На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
Исследование полиморфных вариантов гена ангиотензин-превращающего фермента (АСЕ) При исследовании общих выборок больных и контроля не обнаружено статистически значимых различий в распределении частот аллелей и генотипов исследуемого локуса. Частота аллеля *I и гетерозиготного генотипа *I*D преобладала в обеих исследованных группах. Для обнаружения закономерностей распределения частот аллелей и генотипов исследуемого полиморфизма, выборки больных и контроля были разделены на отдельные группы. При этом не обнаружено достоверных различий в распределении частот аллелей по полу, как между больными, так и соответствующей контрольной группой. Среди исследуемых нами больных с аневризмами частота артериальной гипертензии составила 60,8%. В этой группе больных частота генотипа *D*D оказалась выше, чем в группе контроля, отобранного по критерию отсутствия у них гипертензии, составляя 0,257 и 0,183, соответственно, демонстрируя тенденцию к увеличению частоты рискового генотипа, но различия не достигают достоверных значений. Однако при разделении больных с гипертензией и соответствующего им контроля по полу, обнаружены достоверные различия в распределении частот генотипов у мужчин с артериальной гипертензией и контрольной группой. Генотип *I*D оказался протективным (OШ=0,47, 95%ДИ 0,208-1,072; χ2 =3,86, p=0,049), тогда как генотип *D*D – рисковым (OШ=2,36, 95%ДИ 0,869-6,426; χ2=3,57, p=0,059). Сравнение группы больных с ИА, имеющих в семье родственников с АГ и инсультами, и контрольной группы без семейных случаев АГ и инсультов, не выявило различий в распределении частот аллелей и генотипов исследуемого локуса. Для сравнения данных нашего исследования с изучением АСЕ гена у больных с аневризмами, мы просмотрели все относящиеся публикации, используя систему MEDLINE в Интернете. Одно подобное исследование было проведено японскими авторами Takenaka K. и соавт., которые не выявили ассоциации АГ с генотипами или аллелями АСЕ гена у больных с аневризмами (ссылка скрыта et al., 1998). Другое исследования было проведено в США, где изучался полиморфизм АСЕ гена у больных с ИА, но не сравнивались группы больных с ИА в зависимости от наличия АГ, и ассоциаций АСЕ гена с аневризмами не выявлено (ссылка скрыта et al., 2005). Других таких исследований мы не встретили. Большинство проведенных исследований касалось изучения АСЕ гена у больных с разорвавшимися аневризмами (Keramatipour M. et al., 2000; ссылка скрыта et al., 2004). Мы сопоставили наши результаты с данными других авторов, исследовавших связь АСЕ с гипертензией. Многие исследования продемонстрировали наличие ассоциации между DD генотипом АСЕ гена и гипертензией (ссылка скрыта et al., 1998; ссылка скрыта et al., 2006; ссылка скрыта et al., 1999; ссылка скрыта et al., 2004). Но возникает вопрос, почему в нашем исследовании, несмотря на то, что гипертензия преобладала у женщин, а не у мужчин, DD генотип был ассоциирован с наличием гипертензии у мужчин с аневризмами? В литературе имеется несколько публикаций о наличии половых различий в частоте генотипа DD у больных с гипертензией. Согласно проведенному исследованию "Framingham heart study" (3145 человек), имеется ассоциация I/D полиморфизма гена АСЕ с эсенциальной гипертензией и уровнем диастолического артериального давления у мужчин, но не у женщин (ссылка скрыта, 1998). Данные об ассоциации DD генотипа с гипертензией у мужчин получены также и другими авторами (ссылка скрыта et al., 2002; ссылка скрыта, 2005). С чем это может быть связано? M. Fornage и соавт. показали, что имеется генетическое различие в регионе АСЕ гена, которое значительно влияет на индивидуальные различия в уровне кровяного давления у мужчин, а не у женщин (ссылка скрыта,1998). Кроме того, в другом исследовании, проведенном А.F. Schut и соавт., показано влияние курения на развитие гипертензии у людей-носителей аллели D (ссылка скрыта, 2004). Авторы полагают, что курение и носительство аллели D оказывают непосредственное влияние на развитие гипертонии. Учитывая тот факт, что 83,1% мужчин (69 из 83) в нашем исследовании были курильщиками, можно предположить, что курение в сочетании с DD генотипом АСЕ способствовало развитию артериальной гипертензии у мужчин, а не у женщин, среди которых курильщиками было всего 21,7%. Среди носителей DD генотипа мужчины-курильщики с АГ встречались в 2,2 раза чаще, чем женщины-курильщики с АГ. Это, а также, по-видимому, существующее генетическое различие в регионе АСЕ гена, влияющее на индивидуальные различия в уровне кровяного давления у мужчин, а не у женщин объясняет выявленную в нашем исследовании ассоциацию DD генотипа АСЕ гена с наличием гипертензии у мужчин с аневризмами. Учитывая тот факт, что частота DD генотипа у мужчин с ИА и АГ была более чем в 2 раза выше, чем в контрольной группе, мы считаем, что существует тенденция к увеличению риска развития аневризм у мужчин - носителей DD генотипа с гипертензией. Исследование гена ингибитора протеиназы серина -MLS68 При исследовании общих выборок больных и контроля не обнаружено статистически значимых различий в распределении частот аллелей и генотипов исследуемого локуса. Частота аллеля *D и гомозиготного генотипа *D*D преобладала в обеих исследованных группах. Не обнаружено также достоверных различий в распределении частот аллелей и генотипов в зависимости от пола, как между больными, так и соответствующей контрольной группой. При выделении из общей выборки группы больных с АГ, а также больных с семейным анамнезом АГ, больных с наличием семейного анамнеза инсультов, кровоизлияний и аневризм, при разделении этих выборок по полу и при сравнении с контролем, не имеющим всех вышеперечисленных признаков, мы не обнаружили никаких достоверных отличий. По данным ряда исследований ген ингибитора протеиназы серина (serpina 3) повышает риск аневризматического субарахноидального кровоизлияния (ссылка скрыта et al., 2007; ссылка скрыта et al., 2005). В проведенном нами исследовании ассоциаций гена MLS68 с аневризмами и аневризматическими субарахноидальными кровоизлияниями не выявлено. По-видимому, он не играет роли в их развитии в исследуемой популяции больных и необходимо исследование других генов этого кластера. Исследование гена коллагена 3 типа Мы исследовали инсерционно-делеционный полиморфизм Alu-повторов в 8 интроне и VNTR полиморфизм в 25 интроне, состоящий от 5 до 11 копий повторов из 15 пар оснований в гене Col3A1. Alu-инсерционый полиморфизм гена Col3A1 В общей выборке больных с интракраниальными аневризмами Alu инсерция обнаружена с частотой 0,024, что в 2,2 раза меньше, чем в контрольной группе, однако различия не достигают статистически достоверных значений из-за низкой частоты инсерции (χ2=3,659, р=0,056). В группе больных ни разу не встречался генотип *I*I, а в контрольной выборке обнаружен только один случай гомозиготного генотипа по наличию инсерции (0,005). Обнаружена тенденция снижения частоты гетерозиготного генотипа *I*I и повышения частоты генотипа *D*D у больных с артериальными аневризмами по сравнению с контрольной группой, но различия статистически не достоверны (χ2=2,699, р=0,01; χ2=3,24, р=0,072, соответственно). Для выявления закономерностей распределения частот аллелей и генотипов исследуемые нами выборки больных и контроля были разделены на несколько групп. При сравнительном анализе распределения частот аллелей и генотипов Соl3A1 гена у мужчин и женщин, входящих в группу больных с ИА и контрольную группу, не обнаружил ассоциаций Alu-инсерционного полиморфизма с развитием заболевания (ИА). Отбор больных с ИА по наличию фенотипических признаков дисплазии соединительной ткани (число маркеров не менее трех) и сравнение их с группой контроля без дисплазии соединительной ткани, также не выявил статистически значимых различий в частотах аллелей и генотипов исследуемого локуса гена Col3A1. Таким образом, Alu-инсерционый полиморфизм гена Col3A1 не играет существенную роль в патогенезе аневризм сосудов головного мозга в исследуемой популяции. VNTR полиморфизм в гене Col3A1 В общей группе больных с ИА обнаружено 5 аллельных вариантов, а у контроля – 6, самым частым в обеих исследованных группах оказался аллель *2 с частотой 0,44 и 0,38, соответственно. Результаты согласуются с полученными ранее данными для европейских популяций, где частота аллеля *2 составила 0,42 (Хуснутдинова Э.К. и др., 1999). Обнаружена тенденция увеличения частот аллелей с большим числом повторов, а также более длинных аллельных вариантов в контрольной группе, по сравнению с общей выборкой больных. У больных оказалось меньшее разнообразие генотипов (10), по сравнению с выборкой здоровых доноров (14). Наблюдается бимодальное распределение частот генотипов. Показатель гетерозиготности у больных составил 66,95%, что ниже, чем в контрольной группе, где ожидаемая гетерозиготность достигала 70,48%. В целом, у русских Волго-Уральского региона внутрипопуляционное разнообразие (68,7%) соответствует таковому в ранее изученных европейских популяциях (68,6%) (ссылка скрыта et al., 1996; Watkins W.S. et al., 2001). При подразделении общей выборки больных с ИА и контроля по полу не обнаружено достоверных различий в распределении частот аллелей и генотипов исследуемого локуса гена Col3A1 у мужчин и женщин. При наличии фенотипических признаков дисплазии соединительной ткани (число маркеров не менее трех) у больных с аневризмами сосудов головного мозга наблюдается накопление генотипа *2*4 по сравнению с контрольной выборкой без признаков дисплазии соединительной ткани (χ2=3,49, ρ=0,062), достигая достоверных различий у мужчин с дисплазией по сравнению с соответствующим контролем без дисплазии (χ2=4,18, ρ=0,041). Относительный риск развития заболевания у носителей генотипа *2*4 повышен и составляет 2,4 (95% ДИ=1,02-5,72). В нескольких исследованиях было продемонстрировано, что у больных с интракраниальными аневризмами имеются качественные или количественные нарушения в коллагене 3 типа, который играет важную роль в обеспечении сопротивлений артерий нагрузке (Brega K.E. et al., 1996; Leblanc R. et al., 1989; Majamaa K. et al., 1992, 1993; Neil-Dwyer G. et al., 1983; Ostergaard J.R.et al., 1987; Pope F.M.et al., 1981). Однако исследования, проведенные H. Kuivaniemi исключили мутации в этом гене у больных с аневризмами (ссылка скрыта еt al., 1993). Результаты проведенного нами исследования показали, что имеется ассоциация *2*4 генотипа c наличием дисплазии соединительной ткани у мужчин с аневризмами, что свидетельствует о повышенном риске развития ИА при данной ассоциации. Однако это не объясняет большую часть других случаев дисплазии соединительной ткани у больных с ИА. Поэтому исследованные локусы гена Col3A1 оказались не достаточно информативными для использования их в качестве маркеров повышенного риска развития аневризм сосудов головного мозга. Недавно проведенные исследования показали, что в процесс развития аневризм могут быть вовлечены другие гены коллагена, в частности ген коллагена 1 типа (СOL1A2) (ссылка скрыта еt al., 2003). Исследование генов калликреинов В исследованиях Olson J.M. и соавт. было обнаружено, что два однонуклеотидных полиморфизма (SNP) кластера генов калликреинов ассоциированы с аневризмами в финской популяции (Olson J.M. et al., 2002). Для подтверждения данной ассоциации у русских больных с ИА и для выяснения роли генов калликреинов в генезе ИА было проведено данное исследование. Было выявлено 2 SNPs, rs1722561 и rs1701946, ассоциированные с ИА в финской популяции. Для обнаружения ассоциаций в русской популяции, SNP rs1722561 и rs1701946 были также прогенотипированы у 156 больных с ИА и 186 контроля, принадлежащих к русской популяции. Частоты аллелей и гаплотипов были сходными с таковыми в финской популяции. Частоты распределения обоих SNP в Российской популяции были в соответствии с равновесием Харди-Вайнберга, как у больных, так и в контроле. Был использован регрессионный анализ, чтобы определить, есть ли ассоциация двух SNP с интракраниальным аневризмами в русской популяции, при этом обнаружено, что оба SNPs rs1722561 rs1701946 имеют тенденцию, но не достигают статистически значимой ассоциации (P>0,05). Отсутствие статистически значимой ассоциации этих двух однонуклеотидных полиморфизмов с ИА в русской популяции возможно связано с малым количеством образцов исследуемых ДНК по сравнению с финской популяцией. Дальнейшее исследование с использованием большего количества образцов должно подтвердить ассоциацию одного или обоих однонуклеотидных полиморфизмов с аневризмами в русской популяции. Когда анализируются однонуклеотидные полиморфизмы более чем в одной популяции, могут возникать расхождения из-за наслоения популяций. Наслоение популяций может приводить к ложным ассоциациям, когда частоты аллелей различаются между популяциями. Однако в данном исследовании этого не произошло, поскольку статистически значимых различий в частоте аллелей исследуемого локуса не выявлено в финской и русской популяциях. Поэтому впоследствии они были объединены в комбинированную группу, включающую 524 больных с ИА и 578 лиц контроля. Анализ ассоциации для 2 SNPs в комбинированной группе образцов показал, что rs1722561 (P=0,0005) и rs1701946 (P=0,0011) значимо ассоциированы с аневризмами. Показатели отношения шансов в комбинированной группе образцов для rs1722561 и rs1791946 составили: 1,35 (95% ДИ=1,14-1,60, P<0,0001), и 1,32 (95% ДИ=1,12-1,57, P<0,0001), соответственно. Анализ гаплотипов в объединенной выборке (этап 3) показал, что SNP9-SNP10 гаплотип был значимо ассоциирован с ИА (асимптотическая P=0,006; эмпирическая P=0,008). Частота гаплотипов, оцениваемая для комбинированной группы данных с SNP9-SNP10 гаплотипом, показала, что CC гаплотип может быть возможным гаплотипом, характерным для интракраниальных аневризм (CCаневризмы = 0,4971; CCконтроль = 0,4248). Наше исследование показывает, что локус генов калликреинов является фактором риска как для семейных, так и для спорадических аневризм, поскольку семейный анамнез аневризм был у 62,5% больных с ИА в финской популяции и лишь у 2% больных с ИА в русской популяции. Мы полагаем, что нарушенные функции генов калликреинов, вызванные структурными изменениями в белках калликреина или в его экспрессии, активации или ингибировании, могут приводить к нарушениям в сосудах мозга, которые способствуют развитию и разрыву интракраниальных аневризм. Таким образом, выявлена ассоциация двух однонуклеотидных полиморфизмов rs1722561 и rs1791946 кластера генов калликреинов с интракраниальными аневризмами в комбинированной группе больных с ИА, принадлежащих к финской и русской популяциям. Это свидетельствует о том, что калликреины являются важными генами-кандидатами для развития аневризм сосудов головного мозга. РАЗРАБОТКА СИСТЕМЫ РАННЕЙ СКРИНИНГОВОЙ ДИАГНОСТИКИ ИНТРАКРАНИАЛЬНЫХ АНЕВРИЗМ На основании анализа симптомов до разрыва аневризм, а также изучения факторов риска интракраниальных аневризм в нашем регионе и результатов генетических исследований, мы разработали систему диагностики аневризм до их разрыва. Она включает в себя следующие этапы: 1. Оценка индивидуальных факторов риска развития аневризм и оценка имеющихся симптомов, настораживающих о возможном наличии аневризмы. 2. Оценка индивидуального риска и пользы проведения диагностических процедур для каждого конкретного больного. 3. Принятие решения о целесообразности проведения магнитно-резонансной или компьютерной ангиографии сосудов головного мозга. 4. Рекомендации по динамическому наблюдению и кратности проведения неинвазивных методов диагностики в случае невыявленных аневризм и решение вопроса о дальнейшей тактики ведения больных при обнаружении аневризмы. На основании анализа факторов риска и оценки симптомов до развития аневризм мы выделили наиболее значимые факторы риска и оценили их относительный риск (ОР) у женщин и мужчин с аневризмами в сравнении с контролем (см. табл. 4). Таблица 4 Факторы риска развития аневризм в зависимости от пола
Данные этой таблицы показывают, что у женщин наибольший риск развития аневризм возникает при наличии дисплазии соединительной ткани (при наличии числа внешних маркеров больше три и больше трех), а у мужчин – при наличии мигреней. Артериальная гипертензия и семейный анамнез кровоизлияний как факторы риска имеют наибольшее значение у женщин, а не у мужчин. Мы рассчитали общий относительный риск у мужчин и женщин при сложении всех представленных в таблице ОР факторов риска. Общий риск был почти в 2 раза больше у женщин, чем у мужчин (74,6 и 38,3 соответственно). На основе данных о наличии тех или иных комбинаций факторов риска у каждого больного с аневризмой и знания их ОР, мы суммировали ОР всех индивидуальных факторов риска у каждого больного в зависимости от пола и получили суммированный индивидуальный риск у каждого больного. После чего мы сложили все полученные суммированные индивидуальные риски у мужчин и женщин и разделили соответственно на количество мужчин и женщин в нашем исследовании и получили средний суммированный риск у всех женщин и всех мужчин с аневризмами. Средний суммированный риск в нашем исследовании составил у женщин 45,4 (95% ДИ 41,0 – 49,2), а у мужчин – 12,3 (95% ДИ 9,9 – 14,8). Таким образом, женщины имеют значительно больший риск развития аневризм по сравнению с мужчинами. Для оценки индивидуального риска развития аневризм у мужчин и женщин мы составили специальную шкалу. Эта шкала построена с учетом данных о количестве больных, имеющих наиболее частые комбинации факторов риска и значений ОР при этом, а также знания минимального и максимального значений суммированных индивидуальных рисков у мужчин и женщин, а также их среднего суммированного риска и границ значений 95% интервала при этом. Все выявленные сочетания факторов риска и отдельные факторы риска (при отсутствии комбинаций), значения суммированных ОР, а также количество мужчин и женщин, имеющих такие комбинации факторов риска, представлены в таблице 5. Таблица 5 Комбинации факторов риска у мужчин и женщин
Разработанная шкала включает низкий, средний и высокий риск развития аневризм (см. табл. 6). Таблица 6 Шкала оценки индивидуального риска развития аневризм
На основании этой шкалы можно определить риск развития аневризм. При этом необходимо знать наличие у больного всех вышеперечисленных факторов риска: АГ, дисплазия соединительной ткани, семейный анамнез инсультов, мигрень. Затем необходимо суммировать их и сопоставить с данными таблицы в зависимости от пола пациента. Например, у пациента мужского пола, который имеет семейный анамнез кровоизлияний и АГ, риск развития аневризм, согласно таблице 7, составляет 7,1, т.е. он имеет средний риск развития аневризм. После того, как определен риск развития аневризм (низкий, средний, высокий), необходимо установить, нуждается ли в скрининговом обследовании данный больной. Для тестирования шкалы, мы оценили риск у трех родственников первой степени родства больных с аневризмами и у двух больных с мигренями, у которых были обнаружены аневризмы при проведении МР-АГ. Среди этих РIстР, двое имели средний риск развития аневризм и перенесли САК и один – высокий риск. Все больные с мигренями и выявленными ИА имели высокий риск развития аневризм. Все эти пациенты (РIстР и больные с мигренями) имели семейный анамнез кровоизлияний. На основании данных шкалы оценки риска скрининговое исследование сосудов головного мозга может быть рекомендовано лицам со средним и высоким риском. Кроме того, независимо от данных этой шкалы, показаниями для скринингового исследования сосудов головного мозга являются: 1. Семейный анамнез аневризм или верифицированных аневризматических кровоизлияний (2 случая и более у родственников первой степени родства). 2. Наличие субарахноидального кровоизлияния или аневризмы у одного из идентичных близнецов 3. Наличие у больного наследственного аутосомно-доминантного поликистоза почек Почему показаны исследования в этих случаях? Данные многочисленных исследований доказали, что наибольший риск развития аневризм имеют ближайшие родственники больных с аневризмами, если в семье было 2 и более случаев аневризм или САК (ссылка скрыта еt al., 1997; ссылка скрыта, 2005). У пациентов только с одним пораженным родственником первой степени родства, скрининг не очень эффективен или вообще неэффективен, поскольку по данным G. Rinkel, для предотвращения одного эпизода фатального кровоизлияния, необходимо обследовать при этом 300 человек (ссылка скрыта, 2005). Исключение может быть сделано только для родных братьев или сестер (сибсов) с одним пораженным родственником, который был моложе 40 лет при диагностике аневризмы. Считается, что в этом случае сибсы имеют повышенный риск развития аневризмы. По данным имеющихся в литературе 13 случаев возникновения ИА у идентичных близнецов (ссылка скрыта Et al., 2004) и по данным нашего наблюдения двух сестер - идентичных близнецов с аневризмами (Сакович В.П. и др., 1998), идентичный близнец имеет высокий риск развития аневризмы, если аневризма обнаружена у другого. Во многих случаях аневризмы имеют при этом одинаковую локализацию и разрыв аневризм происходит в пределах одной декады, а иногда в одном и том же возрасте. Интракраниальные аневризмы выявляются у пациентов с наследственным аутосомно-доминантным поликистозом почек в 10% случаев (ссылка скрыта et al., 1998). Кроме того, семейный анамнез аневризм и субарахноидальных кровоизлияний выявляется у родственников первой степени родства таких пациентов в 40% случаев по сравнению с 10% родственников первой степени родства без поликистоза (ссылка скрыта et al., 1995). Поэтому наследственный аутосомно-доминантный поликистоз почек является на сегодняшний день единственным наследственным заболеванием соединительной ткани, при котором показано проведение МР-ангиографии или КТ-ангиографии с целью раннего обнаружения аневризмы. Пациентам с синдромом Элерса-Данлоса IV типа скрининговое исследование не рекомендуется, несмотря на повышенный риск развития аневризм, поскольку существующая хрупкость сосудов значительно повышает риск осложнений во время проведения ангиографии, часто необходимой для подтверждения наличия аневризмы, выявленной при МР-ангиографии. Кроме того, эти пациенты имеют также высокий процент осложнений, связанных с оперативным лечением аневризмы (ссылка скрыта et al., 1995). Поскольку повышенный риск субарахноидального кровоизлияния не подтвержден для пациентов с синдромом Марфана и с нейрофиброматозом, скрининговое исследование сосудов головного мозга таким пациентам не показано (ссылка скрыта et al., 1998). Необходимо отметить, что большинство исследователей, занимающихся вопросами ранней диагностики аневризм не рекомендуют проведение скрининговых исследований у лиц моложе 20 лет поскольку они очень редко встречаются в таком возрасте (ссылка скрыта et al., 1998). Поэтому первое скрининговое исследование нужно проводить в возрасте после 20 лет. Максимальный возраст для скрининга – 65-70 лет (ссылка скрыта, 2005, ссылка скрыта еt al., 1995). Кроме того, при решении вопроса о проведении скрининга нужно учитывать также сопутствующие заболевания, которые могут быть противопоказаниями для хирургического и эндоваскулярного лечения аневризм, в этих случаях скрининг также не показан. Магнитно-резонансная ангиография на сегодняшний день является методом выбора для проведения скринингового исследования в большинстве случаев (ссылка скрыта et al., 1999; ссылка скрыта, 2005; ссылка скрыта еt al., 1995; Wilms G. et al., 2001). Это относительно недорогой метод, неинвазивный, без рентгеновского облучения, без введения контраста, имеющий достаточную чувствительность от 70% до 97% (Aprile I., 1996; Huston J. еt al., 1994). Хотя аневризмы до 5мм плохо визуализируются на МР-АГ, такие аневризмы имеют низкий риск разрыва и обычно не оперируются (ссылка скрыта et al., 2003) за исключением пациентов с семейным анамнезом кровоизлияний и аневризм (ссылка скрыта еt al., 1997; ссылка скрыта et al., 1998). Чувствительность МР-АГ для аневризм более 6 мм составляет более 95% (ссылка скрыта et al., 1997). Магнитно-резонансная ангиография также является предпочтительным методом у больных после внутрисосудистого лечения спиралями, поскольку спирали практически не вызывают артефактов при этой методике. Противопоказанием к проведению МР-АГ является клаустрофобия (боязнь замкнутых пространств) (ссылка скрыта). У пациентов, у которых уже производилось клипирование аневризм и имеется необходимость проведения исследования сосудов мозга с целью исключения новых аневризм, а также у пациентов с имплантированными кардиостимуляторами, необходимо проведение компьютерной ангиографии, поскольку клипсы и другие металлические предметы дают выраженный артефакт при МР-АГ. Противопоказаниями для проведения КТ-АГ являются: аллергические реакции, тяжелые заболевания почек и почечная недостаточность, апластические анемии, лучевая болезнь (Wardlaw J.M., White P.M., 2000). В конечном итоге решение "за" или "против" скрининга остается за пациентом. Врач должен лишь разъяснить ему все возможные последствия. В конце консультации врач должен предоставить право выбора больному: пройти скрининговое исследование, прийти на повторную консультацию еще раз или отказаться от дальнейших консультаций и обследований. В тех случаях, когда аневризма не обнаружена, но имеется высокий риск ее развития, необходимо повторное скрининговое исследование через 5 лет. Это связано с тем, что риск обнаружения аневризмы после первоначально негативного скрининга составляет 7% при повторном проведении его через 5 лет (ссылка скрыта et al., 2003). В семейных случаях (с двумя и более пораженными родственниками первой степени родства), когда у кого-либо из РIстР возникли новые аневризмы в течение 5 лет с момента диагностики первой аневризмы, скрининг можно рекомендовать 1 раз в 2 года, что обусловлено тем, что в семейных случаях аневризмы развиваются быстрее, чем у пациентов, не имеющих семейного анамнеза аневризм (ссылка скрыта, 2005). 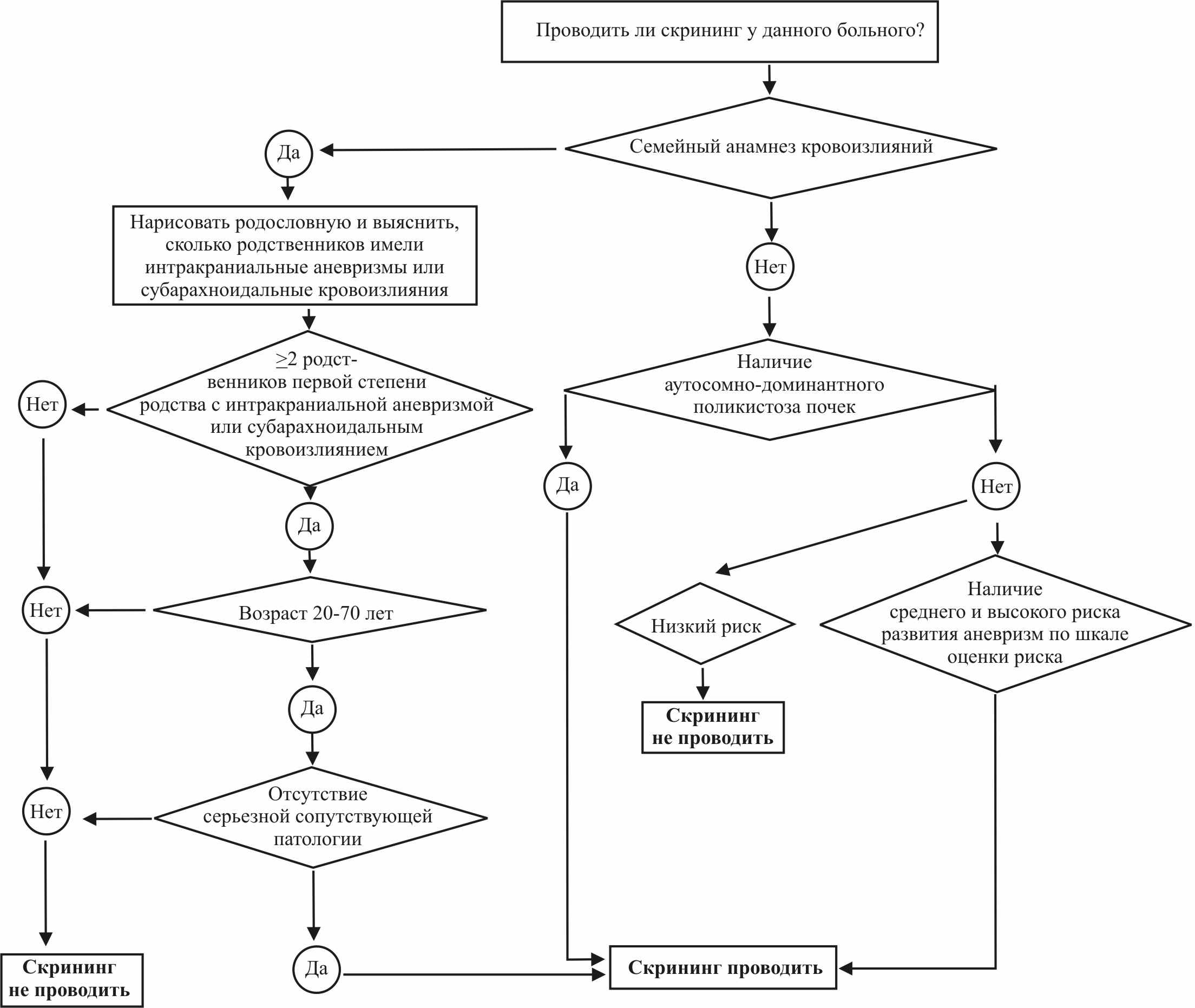 Рисунок 1. Схема ранней диагностики интракраниальных аневризм. Повторный скрининг может быть также рекомендован пациентам, перенесшим хирургическое лечение аневризмы, поскольку они имеют риск развития новых аневризм (ссылка скрыта et al., 2005; ссылка скрыта et al., 2005). По данным многих исследований, ежегодный риск развития новых аневризм составляет у таких больных от 0,4% до 2,2% (ссылка скрыта еt al., 2004; ссылка скрыта et al., 1999; ссылка скрыта et al., 2001; ссылка скрыта et al., 2001). Кроме того, в литературе также представлены случаи увеличения аневризм после клипирования и эндоваскулярного лечения аневризм (ссылка скрыта et al., 1999; ссылка скрыта et al., 2001). Кроме того, многие пациенты могли иметь маленькие аневризмы, которые были не видны при первоначальном проведении исследования после САК. Эти аневризмы в последующем могут увеличиваться в размерах и разрываться (ссылка скрыта et al., 2006). По данным двух исследований с длительным наблюдением за больными, риск повторного САК после клипирования аневризмы составлял 2% за 10 лет и около 9% за 20 лет наблюдения, что в 30-50 раз выше, чем риск в общей популяции (ссылка скрыта et al., 1999; ссылка скрыта et al., 2001). Таким образом, на основании полученных результатов, схема ранней диагностики интракраниальных аневризм может быть представлена следующим образом (см. рис. 1). ВЫВОДЫ
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
|
