Рекомендації, Павленко В. В, учитель хімії зош №28, Рибіна С. Ф., учитель хімії Миколаївської гімназії №2
| Вид материала | Урок |
СодержаниеБазові поняття та терміни. Арзуманова І.Ю. Учні повинні знати Тип уроку Хід уроку 2. «Морський бій» 4. «Квітка – семипелюстка» 6. «Поле чудес» IV. Домашне завдання. Додатки Зразок протоколу |
- Відділ освіти Овруцької райдержадміністрації Овруцька загальноосвітня школа №3 Позакласна, 579.77kb.
- Клас хімії при Розсошенській гімназії, 7.3kb.
- Опис досвіду вчителя хімії зош і–ііі ступенів с. Павлівка Іваничівського району Волинської, 121.4kb.
- Методичні рекомендації щодо вивчення хімії у 2011 2012 навчальному році Олена Бобкова, 178.03kb.
- Горького Кафедра фармацевтичної та токсикологічної хімії методичні вказівки для студентів, 2971.74kb.
- Кафедра фармацевтичної та токсикологічної хімії методичні вказівки для студентів, 2193.23kb.
- Методичні рекомендації до технології розвитку креативного мислення при вивченні хімії, 313.08kb.
- Програма комплексного фахового екзамену з хімії для вступу на навчання для здобуття, 189.84kb.
- V всеукраїнський фестиваль науки Вчені нту «хпі» Міжнародному року хімії, 118.36kb.
- Про організацію навчально-виховного процесу з хімії в загальноосвітніх навчальних закладах, 110.65kb.
Мета. Узагальнити знання учнів про властивості води;
продовжити формувати вміння учнів складати формули складних речовин та рівнянь реакцій, що характеризують хімічні властивості води, вміння розв’язувати розрахункові задачі;
формувати вміння самооцінки та взаємооцінки.
Обладнання. Періодична система хімічних елементів Д.І. Менделєєва;
таблиця розчинності кислот, основ, солей;
електрохімічний ряд напруги металів.
Базові поняття та терміни. Кислота, основа, оксид, сіль; Кислотний оксид, основний оксид, амфотерний оксид, несолетвірний оксид
Структура уроку
- Організація класу.
- Перевірка домашнього завдання.
- Мотивація та актуалізація опорних знань.
- Узагальнююче повторення ( виконання тренувальних вправ )
- Підведення підсумків уроку.
- Домашнє завдання.
Хід уроку
- Організація класу.
- Перевірка домашнього завдання.
- Мотивація та актуалізація опорних знань і “мозковий штурм”
- оксиди та їх класифікація;
- вода та її хімічні властивості.
- оксиди та їх класифікація;
- Узагальнююче повторення.
( 2 учні біля дошки)
1. Класифікуйте оксиди:
P2O5, K2O, MgO, NO, SO3, CO, CaO, AL2O3, N2O, ZnO, N2O5, SiO2
(3 бали)
2. Які із оксидів реагують з водою? Складіть рівняння реакцій.
(кожне правильне 0,6 бали, що не реагує (-0,1 бал))
3. Луги, добуті в завданні (2), одержіть взаємодією Ме з водою ( 3 бали)
(кожне - 1 бал)
4. Обчисліть масу ортофосфатної кислоти, що утворилась при взаємодії 71 г фосфор (V) оксиду з водою. (98г)
5* Здійсніть перетворення:
а) P P2O5 H3PO4
б) Na Na2O NaOH
- Підведення підсумків уроку.
- Домашнє завдання.
1) Класифікуйте оксиди:
BeO, Na2O, SO2, Cr2O3, H2O, NO, BaO, CO2, CuO
2) Які оксиди взаємодіють з водою? Складіть рівняння реакцій.
3) Яка маса натрій гідроксиду утворилась при взаємодії натрій оксиду масою 15, 5г з водою?
Арзуманова І.Ю.
учитель хімії Миколаївського муніципального колегіуму
Тема: Узагальнення й систематизація знань з теми «Початкові хімічні поняття»
Цілі: - узагальнити й систематизувати знання про початкові хімічні поняття, хімічні формули, хімічні реакції, хімічні рівняння;
- розвивати логічне мислення на основі порівняння різних об’єктів;
- виховувати пізнавальний інтерес до хімії, сприяти розвитку творчого мислення на уроках хімії.
Учні повинні знати: початкові хімічні поняття і закони хімії, хімічну символіку, номенклатуру, термінологію.
Учні повинні вміти: узагальнювати вивчений матеріал, складати хімічні формули, хімічні рівняння.
Тип уроку: урок узагальнення й систематизації знань.
Методи і методичні прийоми: словесний, наочний, репродуктивний.
Форми роботи на уроці: фронтальна бесіда, групова робота, робота в парах, гра
Хід уроку
I. Організація класу, мотивація навчальної діяльності учнів.
Діти, сьогоднішній наш урок незвичайний, переконана, що ви продемонструєте міцні знання з теми «Початкові хімічні поняття».
Урок сьогодні узагальнювальний, і я хотіла почути, як ви вважаєте, що на сьогодні ми повинні знати і вміти.
(Відповіді учнів)
Дякую, мені хотілося, щоб цей урок пройшов під гаслом:
«Просто знати – це не все. Знання потрібно правильно використовувати»
Ми побудуємо наш урок таким чином.
Розподілимось на три команди – «Нейтрон», «Протон», «Електрон».
На дошці написані назви етапів уроку і кількість балів, які може одержати команда за кожен конкурс.
Кожна команда заздалегідь одержує кілька по три аркуша формату А4, аркуші для самостійної роботи, набор із символами хімічних елементів, набор стикерів з формулами оксидів, періодичну систему хімічних елементів.
Отже, готові? Команди до бою!
II. Гра
1.Розминка «Вірю – не вірю».
На екрані з’являються питання.
Команди повинні по черзі відповісти «вірю» або «не вірю» і пояснити свій вибір. Якщо команда дає неправильну відповідь, право відповіді переходить до наступної команди( кожній команді по 4 запитання)
- Одержання цукрової пудри з рафінованого цукру – це хімічне явище.
- Прокисання молока – це хімічне явище.
- Іржавіння заліза – це фізичне явище.
- Плавлення алюмінію – це фізичне явище.
- Випаровування спирту – це хімічне явище.
- Танення льоду – це хімічне явище.
- Горіння свічки – це фізичне явище.
- Фотосинтез – це фізичне явище.
- Речовини, які вступають в хімічну реакцію, називають продуктами.
- До ознак хімічних реакцій належать: випадання осаду,зміна забарвлення, змішування речовин, нагрівання речовин, виділення тепла.
- До фізичних властивостей належать: колір, запах, твердість, горючість.
- Складною речовиною називають речовину, молекули якої містять атоми тільки одного елемента.
Підбиваємо підсумки конкурсу, максимальна оцінка – 1 бал за правильну відповідь. Записуємо результати до протоколу на дошці.
2. «Морський бій»
На екрані ігрове поле, на якому формули простих і складних речовин.
| № з/п | А | Б | В | Г | Д |
| 1 | КОН | С | ZnО | О2 | SО3 |
| 2 | СuО | Са3Р2 | Н2СО3 | Fe | N2O |
| 3 | LiH | N2 | S | H2O | Сu |
| 4 | Cr2 О3 | Na2O | MgBr2 | H2 | AlCl3 |
| 5 | HNO3 | Cr2 О3 | Cl2 | Ag Cl | Si |
Першій команді координати задає вчитель: учень, який відповідає, повинен прочитати формулу і сказати, проста це речовина чи складна. Ця формула викреслюється, і учень називає нові координати учневі другої команди.
Правильна відповідь – 1 бал, неправильна – хід переходить до іншої команди, поки все поле не буде закреслено. Підбиваємо підсумки й заносимо бали до протоколу.
3. «Сортувальник»
Кожна команда одержує коробку стикерів з формулами оксидів. Завдання однакові в кожній групі. Члени команд повинні наклеїти на аркуш А2 стикери з формулами відповідно до їх валентності.
Na2O, NO2, СuО, ZnО, Cr2О3, MgО, Сu2О, РbО2, V2O5
B2О3, Li2О, SО3, МnО2, Al2О3, СО2, N2O5, CrО3, Р2O5
Виконані завдання команди наклеюють на дошці, порівнюють, виправляють помилки.
Підбиваємо підсумки за конкурс: 0,5 бала за правильно визначене значення валентності елемента у формулі.
Разом правильна відповідь – максимально 9 балів.
Поки одна група готує завдання, друга група учнів проводить «фізкультхвилинку» - «Хто швидше».
Необхідно скласти правильно хімічну формулу, користуючись картками, на яких записані символи хімічних елементів.
Учні повинні стати так, щоб одержати хімічні формули речовин.
Завдання 1: речовина складається з двох атомів Фосфору та п’яті атомів Оксигену.(P2O5)
Завдання 2: речовина складається з одного атома Калію та одного атома Хлору.(K Cl)
Завдання 3: речовина складається з двох атомів Гідрогену та двох атомів Оксигену.(H2O2)
Завдання 4: речовина складається з двох атомів Натрію, двох атомів Сульфуру та семи атомів Оксигену.(Na2S2O7)
Завдання 5: речовина складається з двох атомів Алюмінію та трьох атомів Оксигену.( Al2О3)
Завдання 6: речовина складається з трьох атомів Кальцію та двох атомів Нітрогену.( Са3N2 )
4. «Квітка – семипелюстка»
К
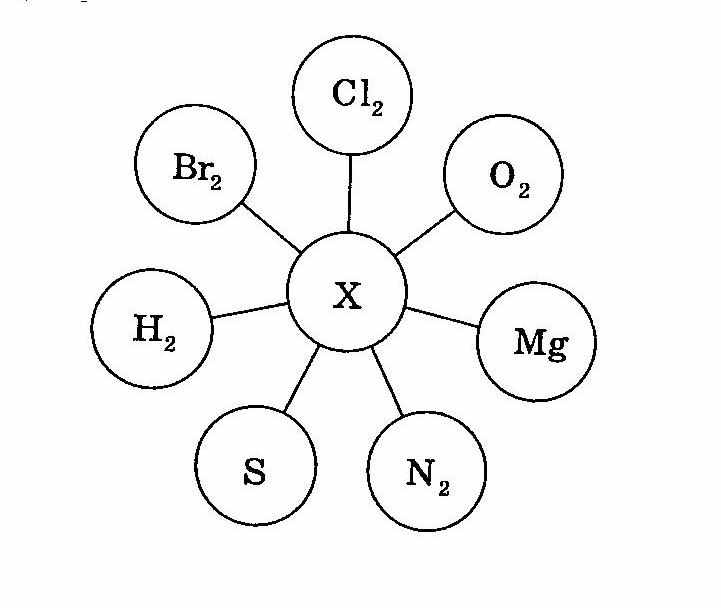
ожна команда одержує завдання.
«Протон»: X – Ca
«Електрон»: X – Mg
«Нейтрон»: X – Zn
На аркуші формату А2 команди записують формули продуктів реакції за валентністю, записують рівняння реакції та розставляють коефіцієнти. Потім аркуші наклеюють на дошку, перевіряють з учителем, згадують про валентність, сталу та зміну, що номер групи у головній підгрупі показує найвищу валентність елемента ( з кожного ряду по два рівняння)
Кожне правильне рівняння – 2 бали. Разом – 14 балів за конкурс.
5. «Рахувалочка»
Кожна команда одержує номер від 1 до 6 відповідно до підсумків трьох конкурсів.
За відведений час команда повинна підрахувати сумарну відносну молекулярну масу всіх оксидів на одному рядку в завданні 3.
Na2O, NO2, СuО, ZnО, Cr2О3, MgО, Сu2О, РbО2, V2O5
B2О3, Li2О, SО3, МnО2, Al2О3, СО2, N2O5, CrО3, Р2O5
Учитель перевіряє суму. Оцінка за правильну відповідь – 3 бали.
Підбиваємо підсумки четвертого і п’ятого конкурсів, заносимо до протоколу.
6. «Поле чудес»
Команда одержують аркуші з хімічними рівняннями, в які необхідно вписати пропущені формули так, щоб вийшло рівняння хімічної реакції, і розставити коефіціенти, визначіть тип хімічної реакції.
Кожне рівняння – 3 бали.
Ag + ? → Ag2S
H2 + Cl2 → ?
HgO → ? + O2
? → H2 + O2
Порівнюємо результати команд з рівняннями на екрані, знаходимо помилки, кожен сам оцінює свою роботу і передає аркуш., заносимо результати до протоколу, і поки учень-контролер підбиває підсумки, учитель аналізує результати уроку.
Повідомляємо переможця, виставляємо оцінки, відзначаємо активних учнів.
Протягом гри доцільно вести особистий залік, видаючи учням за правильні відповіді фішки. За сумою таких фішок можна оцінити роботу кожного з учнів.
IV. Домашне завдання.
Підготуватися до контрольної роботи з теми «Початкові хімічні поняття»., повторити параграфи 9-16.
Творче завдання. Намалювати «Квітку – семипелюстку»: у центрі – проста речовина кисень, а на пелюстках – продукти її взаємодії з іншими простими речовинами.
Додатки
Зразок протоколу
| Назва випробування | Протон | Електрон | Нейтрон |
| 1. Розминка прав. від – 1б | | | |
| 2. «Морський бій» прав.від – 1 б | | | |
| 3. «Сортувальник» прав.від – 0,5 б мах – 9 б | | | |
| 4. «Цветик - семицвітик» прав.від – 2 б, мах - 14 | | | |
| 5. «Рахувалочка» прав.від – 3 б | | | |
| 6. «Поле чудес» прав.від – 3 б, мах - 12 | | | |
Конкурс 4
«Квітка – семипелюстка»
Конкурс 5
«Рахувалочка»
Конкурс 3
«Сортувальник»
| I | II | III | IV | V | VI |
| | | | | | |
ЛІТЕРАТУРА
- Рибак, О. Розвиток психофізіологічної культури педагога: програма занять для педагогів / О. Рибак // Психолог (Шкільний світ). – 2008. - №5. - с.16-24.
- Підласий, І.П. Зміцнюємо теоретичні знання / І.П. Підласий // Управління школою (Основа). – 2009. - №11. – с. 2-20.
- Стасюк, Л. Фізіолого-гігієнічні основи організації навчання та виховання дітей різного віку / Л. Стасюк, р. Бевз // Практика управлінням закладу освіти. – 2010. - №4. – с. 49-55.
- Бугрій, О. Формування уміння навчатися / О. Бугрій // Рідна школа. – 2009. - №4. – с. 17-21.
Психофізіологічні особливості процесу навчання: бібліографічний список літератури
Бехтерева, Н. Новое в изучении мозга человека / Н. Бехтерева // Свободная мысль. – 2009. - №9. – С. 113-120.
Бугрій, О. Формування уміння навчатися / О. Бугрій // Рідна школа. – 2009. - №4. – С. 17-21.
Волошко, Н. Психофізіологічні особливості учнів у навчанні / Н. Волошко // Післядипломна освіта в Україні. – 2009. - №2. – С. 37-44. (Бібліографія с. 44).
Гнетковская, М.Г. Концепция психолого-педагогического сопровождения образовательного процесса / М.Г. Гнетковская // Завуч. – 2007. - №3. – С. 33-39.
Диагностика природных особенностей человека: методики диагностики природных психофизиологических особенностей человека // Психологическая диагностика. – 2007. - №4. – С. 7-88.
Дикая, Л.А. Психофизиологические и психологические характеристики учащихся со специальной одаренностью / Л.А. Дикая, Е.Б. Кац // Одаренный ребенок. – 2008. - №3. – С. 39-46.
Кнодель, Л. Різноманіття рішення проблем навчання / Л. Кнодель // Директор школи. Україна. – 2007. - №6. – С. 20-26.
Кочерга, О. Психофізіологічні особливості діяльності дівчаток і хлопчиків: (Чому дівчатка і хлопчики сприймають світ по-різному) / О. Кочерга // Початкова школа. – 2006. – №12. – С. 8-12.
Кочерга, О. Психофізіологічні особливості діяльності мозку дитини: розподіл функцій між лівою та правою півкулями головного мозку / О. Кочерга // Початкова школа. – 2005. – №5. – С. 6-8; №6. – С. 10-14.
Кочерга, О. Психофізіологічні особливості сприймання навчальної інформації / О. Кочерга // Початкова школа. – 2010. - №4. – С. 58-60.
Кочерга, О. Психофізіологія раннього дитинства: методологічний матеріал / О. Кочерга. – К.: Вид. дім «Шкільний світ». – 2006. – 120 с.
Макарова, В.М. Обучаем с учетом психофизиологических особенностей учащихся / В.М. Макарова // Профессиональное образование. – 2006. – №5. – С. 26-27.
Никифорова, О.А. Психофизиологические особенности леворуких учащихся / О.А. Никифорова, В.И. Навалихина // Завуч. – 2006. - №1. – С. 125-128.
Підласий, І.П. Зміцнюємо теоретичні знання / І.П. Підласий // Управління школою (Основа). – 2009. - №11. – С. 2-20.
Процес навчання – фізіологічні процеси
Рибак, О. Розвиток психофізіологічної культури педагога: програма занять для педагогів / О. Рибак // Психолог (Шкільний світ). – 2008. - №5. – С. 16-24.
Сиротюк, А.Л. Обучение детей с учетом психофизиологии: практическое руководство для учителей и родителей / А.Л. Сиротюк. – М.: ТЦ «Сфера», 2000. – 128 с.
Стасюк, Л. Фізіолого-гігієнічні основи організації навчання та виховання дітей різного віку / Л. Стасюк, Р. Бевз // Практика управління закладом освіти. – 2010. - №4. – С. 49-55.
Цокур, О. Психофізіологічні особливості учнів / О. Цокур, І. Іванова // Підручник ля директора. – 2007. - №11. – С. 47-50.
