 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Разработка и совершенствование биотехнологических процессов при промышленном производстве биопрепаратов
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
Исследование процессов ультрафильтрации. Для очистки солевого раствора альбумина и аего эффективного концентрирования использовали мембраны Владипор УАМ-300 и УАМ-200 (с селективностью по белку 98-99%), которые обеспечивали процесс ультрафильтраци с минимальными потерямиа белка. По сульфату аммония селективность этих мембран составила 0-2% и 5-10% соответственно. Процесс осуществляли на ячейке ФМ-02, тонкоканальной ультрафильтрационной установке ФТО-01 и рабочем макете аппарата УФ-5. На установке ФТО-01 концентрировали раствор альбумина до содержания белка 40-45%, а ана аппарате УФ-5 - до 15%. В условиях производства Ставропольской биофабрики на установке ФТО-01 осуществляли обессоливание раствора альбумина диафильтрацией. Содержание соли в полученном растворе альбумина составляло 0,2% и белка 10%, что соответствовало требованиям инструкции по приготовлению питательной среды для культивирования патогенных лептоспир. Установка ФТО-01 рекомендована для очистки и концентрирования альбумина объемом до 6 л, а УФ-5 для больших объемов (6-10 л). Использование установки ФТО-01 в 4 раза сокращало время обессоливания альбумина, УФ-5 - в 6 раз по сравнению с простым диализом.
Очистку, концентрирование растворов белков, ферментов, вирусных,а бактериальных суспензий осуществляли на ультрафильтрационных аппаратах на полых волокнах с целью снижения концентрационнойа поляризации на мембранах за счет прохождения потока жидкости. На рис. 3 представлен процесс обессоливания и концентрирование раствора трипсина (0,25%) при диафильтрации на ультрафильтрационных аппаратах разных марок.
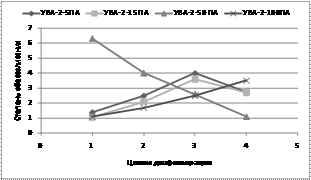
Рис. 3. Обессоливание и концентрирование раствора трипсина при диафильтрации на ультрафильтрационных аппаратах разных марок.
0,25% раствор трипсина обессоливали на аппарате УВА-2-50 в 6 раз за 1-2 цикла диафильтрацииии через полые волокна ВПУ-50ПА приа одновременном концентрировании. Разделительный модуль УВА-2-100 с полыми волокнами ВПУ-100ПА концентрировал фермент на всех циклах диафильтрации при постепенном удалении солей из раствора. Степень концентрирования фермента возрастала с 5 на первом цикле до 7 на четвертом цикле диафильтрации.
Замена системы подачи жидкости центробежным насосом марки ЦНГ-0,5/10 вместо перистальтического позволила эффективно использовать разделительные модули фирмы Мем-Текс типа АР-2 с площадью фильтрации 2 м2 различных марок УВА-2-5ПА, УВА-2-15ПА, УВА-2-50, УВА-2-100 ПА, с полыми волокнами типа ВПУ-5ПА, ВПУ-15, ВПУ-50, ВПУ-100 из полиамида с пределом задержания по белку 5, 15, 50, 100 кДа при очистке ферментных и других биологических растворов.
Метод ультрафильтрации использовали для концентрирования суспензии. вируса чумы плотоядных животных. С помощью ультрафильтрации концентрировали 12 л исходной суспензии в 40 раз за 2 часа, а 6 л вирусной суспензии концентрировали до 100 мл за 4 часа (в 60 раз). Метод ультрафильтрации способствовал концентрированию суспензии в 40-60 раз.
Таким образом, исследование процесса микрофильтрации позволило применить отечественные и импортные мембраны на основе ацетата целлюлозы, регенерированной целлюлозы, нейлона (капрона) и других полимеров, а также использовать оборудование для очистки и стерилизации питательных сред и растворов в производстве биопрепаратов. Усовершенствование метода ультрафильтрации за счет применения тонкоканального и плоскопараллельного аппаратов снизило концентрационную поляризацию на поверхности мембран в процессе очистки альбумина и вирусной суспензии. Ультрафильтрационные аппараты с полупроницаемыми полыми волокнами ускорили процессы фракционного разделения, обессоливания и концентрирования абиологических жидкостей.а
Разработка технологии очисткиа и концентрирования биологических растворов в настоящее время реализуется согласно требованиям ГОСТ Р 52249-2009 Правила производства и контроля качества лекарственных средств аас применением валидированных методов и оборудования.
а2.2.5.3. Применение электродиализа для очистки альбумина
от солей сульфата аммония
При сотрудничестве с Краснодарским государственным ауниверситетом (КГУ) и Ставропольской биофабрикой, нами исследована возможность применения электродиализа для обессоливания альбумина. Процесс электродиализа представляет собой направленный массоперенос ионов солей под действием электрического тока.
Работу на технологической электродиализной установке осуществляли в автоматическом циркуляционном режиме при параллельном включении рабочих камер электродиализатора типа ЭК-04-74 (КГУ) и напряжении 75-85В, температуре не выше 35оС. Содержание солей аммония в растворе альбумина после электродиализа не превышало 0,2%, что соответствовало требованиям инструкции на питательную среду для культивирования патогенных лептоспир. Максимальная производительность аппарата по целевому продукту составляла 4,5 л/час, по исходному продукту 8,1 л/час. Электродиализ сократил в 7,2 разаа время обессоливания раствора альбумина по сравнению с ранее проводимым диализом.
3. ВЫВОДЫ
1. Усовершенствована технология промышленного производства трипсина с использованием центрифугирования для разделения суспензии после экстрагирования и высаливания фермента; и крупномасштабного способа высушивания методом распыления для больших объемов раствора фермента и сублимационного для небольших партий фермента.
Разработаннаяа промышленная технологическая линия производства трипсина испытана в опытно-промышленных условиях, а полученные партии фермента рекомендованы для использования в производстве противовирусных вакцин.
2. Применение трипсина позволило получить первичные культуры клеток (ФЭК, ФЭП, ПЭК, ТБ, ПК, ПКШ, ПЩ) и перевиваемые линии клеток (MDBK, MDCK, СПЭВ), которые обладали равноценной чувствительностью к вирусам и обеспечивали максимальное их накопление в производстве вакцин против болезни Марека, инфекционного ринотрахеита и парагриппа-3 крупного рогатого скота и парвовирусного энтерита собак. Подтверждена пригодность трипсина при производственном получении культур клеток ФЭП и выращивании штамма ФС-126 вируса герпеса индеек и штамма ЭПМ вируса чумы плотоядных.
3. Разработан способ иммобилизации протеолитического фермента трипсина на полимерном носителе (сополимере винилиденфторида и гексафторпропилена, а также винилиденфторида и перфторметилвинилового эфира). Протеолитическая активность и диспергирующая способность фермента при этом не снижались; клетки ФЭП и ФЭК, полученные с его применением, обладали жизнеспособностью на уровне контроля, а выход клеток превышал значение контрольного опыта.
4. Получены теплостойкие полимерные материалы на основе фторкаучуков (СКФ-26 и СКФ-260Д), совмещенные композиции с фторсиликоновой смесью и фторсодержащим пластификатором, обладающие повышенной теплостойкостью к температуре 200оС, стойкостью к различным химическим средам (кислотам, щелочам и маслам) и деформационным воздействиям при сжатии.
Разработан способ оценки токсичностиа полимерных материалов с помощью микроорганизмов (пастерелл)а и на культуре клеток (ПТ-80), исключающие использование животных, уменьшающие трудозатраты и время проведения опытов.
5. аа Усовершенствована технология псевдосуспензионного и суспензионного культивирования первичных и перевиваемых клеток в биореакторах (объемом - 0,005; 0,025; 0,100; 0,250 м3) с системой технологической обвязки.
Разработана технология суспензионного культивирования клеток ПТ-80 и ВНК-21/13 в биореакторах. Максимальный индекс пролиферацииа клеток ВНК-21/13 - 7,4 получен при использовании питательной среды на основе мышечного гидролизата.
6. Усовершенствована технология глубинного культивирования золотистого стафилококка St. aureus в биореакторе АК-210 объемома 0,01м3; определены условия получения культуры, используемой для выделения биологически активного протеина А: при температуре культивирования 37 оС, скорости перемешивания 100 об/мин, рН 7,2 и аэрации воздухом со скоростью 1,4 л/мин, посевной дозе культуры 50 млн.кл/мл и конечной концентрации St. aureusа - 1,9 млрд/мл.
7. Усовершенствована предварительная, тонкая и стерилизующая фильтрация питательных сред, сыворотки крови, ферментных солевых растворов с помощью фильтр-пластин на безасбестовой основе ФП, ФТ, ФС, ФД, а также картона КФБЖ и КФМП. Отработана технология микрофильтрации питательных сред, сывороток, растворов трипсина, защитных сред, концентрата разбавителя вакцины при производстве вакцины против болезни Марека.
8. Усовершенствована система очистки и концентрирования раствора альбумина с помощью ультрафильтрации на мембранной тонкоканальной и Уфильтр-прессеФ аа установках. Для получения высокоочищенных и концентрированных растворов трипсина, вирусных суспензий аи биологических жидкостей применены аппараты с полупроницаемыми мембранами ав виде полых волокон типа ВПУ-5ПА, ВПУ-15ПА, ВПУ-50ПА, ВПУ-100ПА из полиамида с пределом задержания по белку 5, 15, 50, 100 кДа. Полые волокна ВПУ-50ПА за 1-2 цикла диафильтрации ва 6 раз снижали содержание солей и обеспечивали концентрирование раствора трипсина. Полупроницаемые полые волокна ВПУ-100ПА эффективно концентрировали фермент в 7 раз при постепенном удалении солей из раствора. Метод ультрафильтрации на полыха волокнах позволил концентрировать в 40-60 раз по объему вирусную суспензию чумы плотоядных.
9. Разработана технология глубокого обессоливания раствора альбумина методом электродиализа (до минимального содержания солей 0,2 %) в производстве вакцины против лептоспироза, обеспечивающим сокращение времени диализа в 7,2 раза.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА