 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Разработка и совершенствование биотехнологических процессов при промышленном производстве биопрепаратов
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
2.2.2.3. Определение токсичности полимерных материалов с использованием микроорганизмов и на культуре клеток
Разработка и применение конструкций и материалов, обеспечивающих стерильные условия культивирования клеток и микроорганизмов, являются важной задачей биотехнологии. Используемые при этом полимерные материалы должны быть неа только прочными, устойчивыми к моющим средствам, химическим реагентам, температурным воздействиям, но и быть инертными. В связи с этим определение токсичности материалов необходимо для их оценки при конструировании технологического оборудования.а
Определение токсичности с использованием микроорганизмов. Нами предложен метод определения токсичности полимерных материалов с использованием микроорганизмов. Испытания проводились в лаборатории микробиологии (Анисимова Л.В., Сапегина Е.П., Никитина Р.А, 1984) на культуре Pasteurella multocida, 2 авирулентный (пастеровский) штамм. Установлено, что резина на основе силиконового каучука, совмещенная композиция фторкаучука и фторсиликоновой смеси и резина на основе фторкаучука не оказывали ингибирующего действия на рост микроорганизмов Pasteurella multocida и могут быть использованы в конструкционных узлах технологического оборудования при производстве противобактерийных препаратов.
Определение токсичности на культуре клеток.Наряду с вышеуказанным методом проводили испытание токсичности полимеров на культуре клеток. Для оценки токсичности резиновых изделий использовали культуру клеток ПТ-80. Исследования проводили совместно с сотрудниками лаборатории культур клеток (Гвозденко Н.И., Пухова Н.М., Соловьев Б.В., 1990). Высокий прирост клеток был получен при испытании резин на основе силиконового каучука, совмещенной композиции фторкаучука и фторсиликоновой смеси и резины на основе фторкаучука. Клетки не прикреплялись к стеклу или формировали редкие очаги роста в случае использования токсичных материалов. Метод определения токсичности полимеров исключает использование животных, уменьшает трудозатраты и время проведения опытов.
2.2.3. Усовершенствование способов культивирования клеток при культивировании вирусов
В практике существуют несколько способов получения культур клеток для противовирусных препаратов, среди них: стационарный, динамичный, суспензионный и псевдосуспензионный на микроносителях. Использование роллерных аппаратов при монослойном культивировании клеток, особенно для первичных культур, позволяет экономить потребление питательной среды по сравнению со стационарным способом.
Для совершенствования монослойного культивирования клеток проведены испытания многотрубчатого культиватора V=0,006 м3 с использованием технологической обвязки биореактора. Технологическая обвязка к аппарату включала линии подачи, очистки, стерилизации газовой смеси и отвода отработанных газов; подачи пара; термостатирования и поддержания температурного режима в биореакторе; подачи компонентов (питательной среды, засевной культуральной жидкости) и обеспечивала контролируемый и управляемый процесс культивирования клеток в отличие от роллерной технологии. Первичные клетки куриных и перепелиных эмбрионов росли не только на внутренней, но и на внешней поверхности стеклянных трубок аппарата.
Увеличение площади ростовой поверхности клеток обеспечивалось также с помощью микроносителей, суспензируемых в питательной среде (псевдосуспензии), что способствовало регулированию и поддержанию параметров культивирования, получению однородной культуры и осуществлению контроля качества культуры и выхода клеточной биомассы. При культивировании клеток на микроносителях (МН) в биореакторе объемом 0,005 м3 установлено влияние режимов перемешивания на адсорбцию клеток к поверхности микроносителя, определен тип мешалки. Перемешивание микроносителя (акрилекса) проводили трехлопастной мешалкой с углом поворота лопастей 90о и 45о, а также шестилопастной турбинной мешалкой. Равномерному распределению микроносителя способствовало использование трехлопастной мешалки с углом поворота лопастей ?=90о при скорости перемешивания от 40 до 60 об/мин. При 80 об/мин распределение МН такое же, как при 40 об/мин. Клетки, снятые с микроносителя, являлись посевным материалом для 0,025 м3 реактора. Установлена оптимальная посевная концентрация клеток ПТ-80 на микроносителях (8-12 кл/МН). Равномерное распределение клеток после 3 час адсорбции наблюдали при концентрации 10-12 кл/МН, что позволило достичь 95% прикрепления клеток к микроносителю. Полученные результаты были взяты за основу при разработке культивирования клеток ФЭП и ФЭК псевдосуспензионным способом.
Концентрация клеток ПТ-80 в суспензии при скорости перемешивания 40 об/мина и 60 об/мин трехлопастной мешалкой с углом поворота ?=90 о изменялась незначительно и увеличивалась при 80 об/мин, процент мертвых клеток ПТ-80 при этом снижался на 12 - 15%.
Для осуществления суспензионного культивирования клеток в реакторах (объемом 0,005; 0,025; 0,1; 0,25 м3) разработана технологическая обвязка. Конструкция биореакторов имела вводы для датчиков контроля параметров процесса (рН, еН, рО2, tоC). При культивировании в биореакторе объемом 0,005м3 температурный режим культивирования обеспечивали системой термостатирования, а снабжение СО2 и воздухом осуществляли с помощью аппарата управляемой подачи газовой фазы (УПГФ).
Суспензионное культивирование клеток ВНК-21/13 в биореакторе (0,005м3) проводили в питательной среде Игла + 199 (1:1) с добавлением сыворотки крови крупного рогатого скота (10%) при посевной концентрации клеток 100000 кл/мл. Перемешивание суспензии осуществляли с помощью трехлопастной мешалки с углом поворота ?=90о со скоростью 220 об/мин.а В результате получено максимальное накопление клеток после 67 час культивирования, процент мертвых клеток при этом составил 2%, а индекс пролиферации - 4,5.
Применение отъемно - доливного способа позволило продлить процесс деления клеток в суспензии. В процессе суспензионного культивирования ВНК-21/13 первый цикл длился 72 час, затем добавляли свежую порцию средыа с сывороткой крови крупного арогатого скота (КРС) 10% в фазе логарифмического ростаа культуры. Второй цикл длился 71 час, а третий цикл после замены среды с сывороткой (10%) - 40 час. Индекс пролиферации в первом цикле составил 4,5; во втором - 4,2 и в третьем - 1,6.
Наряду с использованием среды Игла и 199 (1:1) применяли также питательную среду на основе мышечного гидролизата (рис. 1).
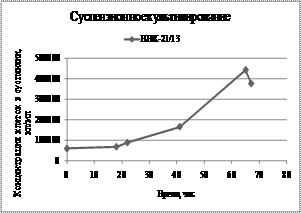
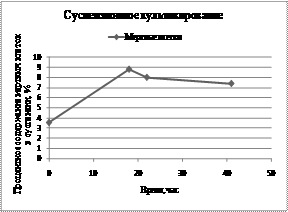
а) б)
Рис. 1.а Суспензионное культивирование клеток ВНК-21/13 при использовании мышечного гидролизата:
а) - концентрация живых клеток в мл суспензии;
б) - процентное содержание мертвых клеток в мл суспензии.а
Суспензионное культивирование клеток ВНК-21/13 в питательной среде мышечного гидролизата повысило индекс пролиферации до 7,4. После 67 час культивирования добавляли свежую питательную среду в объеме 1 л, и продолжали процесс культивирования до получения индекса пролиферации аклеток 7,4.а Процесс культивирования клеток проводили при поддержании постоянной температуры (37+0,1)Со; рН 7,0-7,2+ 0,1; концентрации рО2 9-17% (32-96 мм.рт.ст.), при регулировании объемной долиа СО2а 5-7 % во входящем газе и еН (+75 до +10мв), осуществляли контроль питательной среды и отобранных проб на МПБ, МПА, агаре Сабуро.
При культивировании в биореакторах использовали фильтры в виде фильтроэлементов из фторопласта и титана с диаметром пор 12-20 мкм и 2-6 мкм. Испытание разработанных фильтров показало, что срок службы титановых фильтроэлементов, обладающих устойчивостью к деформациям, был в 1,5-2 раза больше, чем фторопластовых. Для обеспечения стерильности процессов культивирования клеток использовали полимерные теплостойкие материалы в качестве уплотнительных изделий в реакторах и технологической обвязке.
В технологической обвязке биореакторов объемом 0,025; 0,1 и 0,25 м3 применена малогабаритная запорная арматура: вентили МВСП и МВСУ и запорные клапаны с электромагнитным приводом, которые позволили уменьшить в 2 раза габариты и в 8-10 раз вес арматуры по сравнению с серийными вентилями. Технологическая обвязка, состоящая из системы очистки поступающих и отходящих газов, термостатирования, подачи необходимых компонентов (питательной среды, засевного инокулята, титрантов), позволила осуществить культивирование клеток в биореакторах суспензионным и псевдосуспензионным способами при управлении процессом.
Полученные клеток ПТ-80 использовали при разработке биореакторной технологии получения вирусов ИРТ и ПГ-3 в псевдосуспензииаа (на микроносителях) и конструировании инактивированных вакцин и диагностических препаратов (Иванов В.С., Пухова Н.М., Васько В.Е.). Применение клеток ВНК-21/13а привело к повышению инфекционности вируса ИРТ в 10 раз, а иммуногенности в 3-4 раза, но репродуцированный вирус в монослое клеток ПТ-80 обладала большей активностью, чем вирус, аполученный в клетках ВНК-21/13. Суспензионное культивирование клеток ВНК-21/13 было использовано при производстве инактивированной вакцины против бешенства из штаммаа Щелково-51 (Иванов В.С.).
Разработана технологическая схема культивирования клеток и вирусов, включающая технологические модули с аппаратами для культивирования клеток (объемом 0,005 м3; 0,025; 0,100; 0,250 м3) и вирусов (0,630 м3), а также технологический модуль с аппаратом для приготовления питательной среды (0,250м3), емкости для приготовления моющего раствора (1000м3) и емкости для обезвреживания отработанных жидкостей (1000м3).
Таким образом, нами впервые в производстве ветеринарных препаратов осуществлено культивирование клеток ПТ-80 и ВНК-21/13 в суспензии и псевдосуспензии на микроносителях при культивировании вирусов ИРТ и ПГ-3 с использованием специальных биореакторов, разработанных ВНИТИБП и ИркутскНИИхиммашем. В конструкции реакторов были предусмотрены вводы в средуа культивирования датчиков контроля параметров процесса (рН, еН, рО2, tоC). Аппараты оснащены рубашкой для термостатирования и стерилизации, трубой передавливания и перемешивающим устройством с приводом мешалки через магнитнуюа муфту, обеспечивающей герметичность узла в зоне привода. Для осуществления процесса культивирования в реакторах разработана технологическая обвязка. Использование малогабаритной запорной и регулирующей арматуры, а также фильтров из пористого титана для очистки и стерилизации воздуха, применение уплотнительных изделий из теплостойких материалов, выдерживающих воздействие различных химических сред, позволили обеспечить процесс культивирования клеток и вирусов в стерильных условиях.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА