 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Разработка и совершенствование биотехнологических процессов при промышленном производстве биопрепаратов
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
ааПроведенные исследования послужили основой для разработки технологического регламента УКультивирование клеток и вирусов с использованием экспериментальных образцов оборудованияФ и технологической схемы процесса. Использование специализированного оборудования, средств механизации и автоматизации способствовало увеличению выхода продукции при производстве биопрепаратов.
В настоящее время разрабатываемые технологии согласуются с учетом требований международных стандартов ИСО серии 9000:2008 и Правил производства и контроля качества лекарственных средств GMP (ГОСТ Р 52249-2009) с применением аттестованных (валидированных) методов и оборудования.
2.2.4. Усовершенствование способа глубинного культивирования золотистого стафилококка St. aureus для получения протеина А
Глубинное культивирование в реакторе проводили также при получении бактерийной массы, используемой для выделения белка А.
При конструировании иммуносорбентов, диагностических препаратов особый интерес представляет иммобилизация биолиганда через спейсор - протеин А, который встречается у 99% штаммов золотистого стафилококка и составляет 1,7 % сухого веса клетки и 6,7 % веса клеточной стенки (Матвеева И.Н., 2008). В связи с этим осуществляли усовершенствование способа глубинного культивирования золотистого стафилококка St. aureus для получения протеина А.
Культивирование золотистого стафилококка St. aureus проводили в питательной среде на основе бульона Хоттингера и мясопептонного бульона (МПБ) в биореакторе АК-210 объемома 0,01м3. Длительность фазы приспособления культуры золотистого стафилококка St. aureus составила - 0,5-1,5 час, а фазы логарифмического роста - 3,2 - 4,6 час. Максимальная биологическая активностьа протеина А получена из культуры при сроке культивирования 8 час и посевной дозе 50 млн.кл/мл, скорости перемешивания 100 об/мин, при температуреа 37оС, при поддержания рН 7,2 и конечной концентрации St. aureusа - 1,9 млрд/мл. Процесс культивирования осуществляли в стерильных условиях, при использовании титановых фильтров для воздуха, системы автоматического контроля и регулирования параметров.
Бактерийную массу золотистого стафилококка инактивировали формалином (10%) или прогреванием при 60оС, 70оС, 80оС в течение 30 мин; и использовали для выделения протеина А после хроматографической очистки. Инактивированная прогреванием клеточная суспензия при ультразвуковой дезинтеграции в течение 10 секунд импульсивно 6 раз, позволила получить биологически активный белок А в количестве - 20 мг. аДезинтеграция же клеточной суспензии, инактивированной формалином, приводила к потере биологической активности белка А. Белок А из клеточной суспензии, инактивированной формалином, извлекали методом солевой экстракции, при этом получали активный препарат, но в небольших количествах (10 мкг).
Использование аффинного сорбента IgG КРС на BrCN-Сефарозе 4B при одноступенчатой обработке дезинтегрированной ультразвуком клеточной суспензии стафилококка, инактивированной прогреванием при 60оС в течение 30 мин, культуральной среды позволило получить протеин А. Анализ чистоты выделенного протеина А показал наличие единственной белковой полосыа с ММ 42 кД. Хроматографически чистый протеин А конъюгировали с ферментом пероксидазы и использовали в биотехнологии компонентов диагностических тест-систем.
Таким образом, в результате проведенных исследований усовершенствован способ глубинного культивирования золотистого стафилококка St. aureus в реакторе АК-210 и получен, биологически активный протеин А. Определены, условия культивирования, при этом максимальная концентрация бактериальной массы составила 1,9 млрд. кл/мл. Отработаны методы инактивации культуральной суспензии и дезинтеграции клеток. Установлено, что инактивация клеточной суспензии формалином приводила к потере биологической активности белка А после дезинтеграции ее ультразвуком. Из инактивированной формалином клеточной суспензии протеин А выделяли методом солевой экстракции, но в малых количествах. Активный препарат получали при температурной инактивации клеточной суспензии, ультразвуковая дезинтеграция которой имела минимальные потери, и количество выделенного активного белка А в 20000 раз больше, чем в случае инактивированной формалином клеточной массы. Протеин А использовали для конструирования иммуносорбентов и получения диагностических препаратов.
2.2.5. Усовершенствование технологии различных методов очистки биологических растворов
Применение различных методов очистки при получении питательных сред и растворов для бактерийных и вирусных препаратов необходимо для осуществления культивирования в стерильной среде и повышения качества вакцин. В этой связи проводились исследования по использованию глубинных, мембранных фильтров, оборудования и выбору методов микрофильтрации, ультрафильтрации и электродиализа.
2.2.5.1. Применение материалов на безасбестовой основе для предварительной, тонкой и стерилизующей фильтрации
биологических растворов
При очистке растворов медико-биологического назначения к фильтрующим материалам предъявляются такие требования, как исключение подвижности матрикса, вымывание различных компонентов, в особенности канцерогенных веществ, таких как асбест, что характерно для асбестовых фильтр-пластин. Совместно с сотрудниками ВНИИ ЦБП проведены работы по созданию безасбестовых фильтровальных пластин и картона для фильтрации биологических растворов.
Установлено, что фильтрационные свойства пластин зависели от их состава. Так при увеличении содержания диатомита до 60% в фильтр-пластинах ФП-1 для предварительной очистки по сравнению с композицией (ФП), содержащей 50% этого сорбента, понижало в 4 раза удельную скорость фильтрации воды. Замена в стерилизующих пластинах (ФС) окиси алюминия на диатомит (ФС-1) незначительно снижала скорость прохождения воды, и повышала скорость прохождения сыворотки КРС. Картон марки КФБЖ, КФМП использовали для предварительной фильтрации и в качестве префильтра перед мембранами при очистке желудочного сока, при фильтровании питательных сред, растворов трипсина. Опытные образцы безасбестовыха фильтр-пластин размером 200х200 мм, 300х300 мм, 400х400 мм, диаметром 293 мм испытывали по воде, биологическим, солевым и ферментным растворам, питательным средам.
Полученные результаты позволили рекомендовать фильтр-пластины ФП, ФТ, ФС, ФД и картон КФБЖ и КФМП для фильтрования, очистки, стерилизации биологических растворов разного назначения. Фильтровальные виды бумаги и картона освоены на бумажной фабрике (г. Косино, Московской обл.), Красногорском ЭЦБЗ и промышленном производстве ВНИИ ЦБП.
2.2.5.2.а Применение микрофильтрации и ультрафильтрации
для очистки биологических растворов
Исследование процессов микрофильтрации.Для получения стерильных питательных сред, растворов трипсина, защитных сред, разбавителей использовали микропористые мембраны отечественного и импортного производства. Максимальную скорость процесса фильтрации наблюдали у комплекта капроновых мембран фирмы Pall. Двухслойные мембраны обладали устойчивостью к стерилизации в автоклаве. На рис. 2 представлена скорость стерилизующей фильтрации различных сред и растворов для вирусных препаратов через микрофильтрационные мембраны в сочетании с префильтрами на безасбестовой основе.
Использование микрофильтрационных мембран в сочетании с префильтрами обеспечило получение стерильных растворов: 3% глютамина, концентрата лактальбумина, защитных сред (СФГА и СФГЖ), концентрата разбавителя и 0,25% раствора трипсина, используемых при культивировании вирусов. Префильтры повышали производительность мембран (с размером пор 0,2 мкм) в 5 раз в процессе фильтрования глютамина 3% и концентрата лактальбумина. При фильтрации защитной среды СФГА производительность мембран возрасталаа в 4 раза при использовании одного слоя картона КФБЖ и в 7 раз при использовании двух слоев картона между слоями микрофильтрационных мембран. Для объемов до 5 л рекомендуется использовать комбинации КФБЖа и мембраны 0,2 мкм; для больших объемов сочетание КФБЖ + 0,2 мкм + КФБЖ + 0,2 мкм. В качестве префильтра перед стерилизующей мембраной 0,2 мкм при фильтровании защитной среды с желатином использовали микрофильтрационные мембраны большего диаметра пор (0,8 мкм), которые в сравнении с глубинными фильтрами повышали скорость фильтрования. Использование префильтра перед мембраной или между мембранами повышало удельную производительность при микрофильтрации концентрата разбавителя.
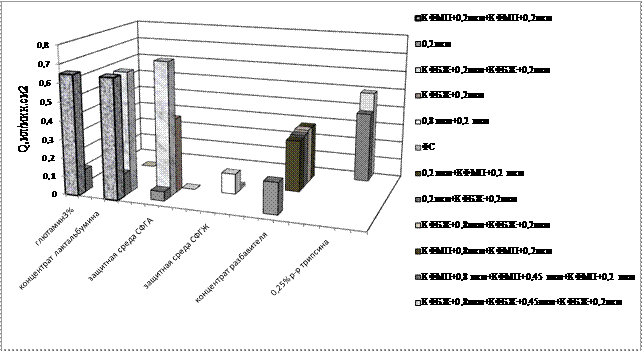
Рис. 2. Результаты стерилизующей фильтрации различных сред и растворов через микрофильтрационные мембраны в сочетании с префильтрами на безасбестовой основе:
глютамин 3%, концентрат лактальбумина; защитные среды - СФГА, СФГЖ; концентрат разбавителя; 0,25% раствор трипсина.
При стерилизации растворов трипсина использовалиа префильтры КФБЖ или КФМП между мембранами 0,8 мкм - 0,45 мкм - 0,2 мкм. Сыворотку крови фильтровали через мембраны с размером пор 0,45 мкм и 0,22 мкм после предварительной фильтрации через глубинные фильтры.
Технология микрофильтрации питательных сред, сывороток, растворов трипсина, в виде защитных сред, концентрата разбавителя вакцины отработана при производстве вакцины против болезни Марека и инфекционной бурсальной болезни птиц. При этом использовали комплект лабораторного стерилизующего фильтрационного оборудования ЛКСФ-1 с набором фильтродержателей диаметром 12, 25, 47, 90, 142, 293 мм и промышленные установки УСФ-293 и УСФ-0,28/7, которые испытывали на инертность и безвредность. После технических доработок,а отечественные образцы были рекомендованы для использования при стерилизации питательных сред, сывороток крови, растворов трипсина.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА