Cols=2 gutter=24> 2006/№2 Засновники
| Вид материала | Диплом |
- Cols=2 gutter=24> 2006/№4 Засновники, 2613.23kb.
- Cols=2 gutter=24> 2004/№2 Засновники, 2407.74kb.
- Cols=2 gutter=24> 2005/№2 Засновники, 2193.94kb.
- Cols=2 gutter=24> 2005/№4 Засновники, 2823.78kb.
- Cols=2 gutter=24> 2007/№3 Засновники, 2007.95kb.
- Cols=2 gutter=24> 2004/№3 Засновники, 3012.42kb.
- Cols=2 gutter=24> 2007/№2 Засновники, 1975.25kb.
- Cols=2 gutter=24> 2004/№4 Засновники, 2183.65kb.
- Cols=2 gutter=47> пбоюл кошмак, 159.62kb.
- Cols=3 gutter=38> Список улиц г. Пскова, 135.43kb.
У структурі такої опорної схеми вико-ристано фунуціональну знаково-символьну наочність, а саме формули речовин, що дозво-ляють учневі дати назву речовини, визначити її якісний та кількісний склад, масові спів-відношення елементів, обчислити відносну молекулярну, молярну маси, скласти графічні формули тощо; рівняння реакцій, що характе-ризують властивості того чи іншого класу або окремої з речовин; модель загальної формули оксидів; причинно-наслідкову, яка відобра-жається схемою класифікації оксидів на оснóвні, кислотні та амфотерні.
Такого типу опори стали однією з рубрик робочих зошитів учня з друкованою основою для 8-11 класів [4, 5].
Під час узагальнення знань про типи хімічних реакцій у 8 класі пропонується така схема класифікації рис. 1:
Р
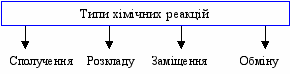 ис. 1. Схема класифікації хімічних реакцій
ис. 1. Схема класифікації хімічних реакційЦя схема дає загальні уявлення про класифікацію реакцій за ознакою речовин, що вступають в реакцію та речовин, що утворю-ються внаслідок її проходження. Для того, щоб учень міг уявити, як відбуваються ці реакції на рівні перебудови структури речо-вин, подаємо додатково рисунки-схеми [4]. Щоб довести, що основи, кислоти і амфотерні гідроксиди є сполуками оксидів з водою і всі подібні за будовою, їх склад виражаємо графічними формулами:
 О – Н Н – О
О – Н Н – ОК – О – Н; Аl – О – Н Н – О – Р = О
О – Н Н – О
Підкреслюємо, що в усіх трьох речовин наявна група атомів – ОН, а отже, їх власти-вості як лугу, амфотерного гідроксиду та кислоти залежать від сили зв’язків між центральним атомом та атомами Оксигену та Оксигену з Гідрогеном.
У 9 класі порівняльну характеристику підгрупи лужних металів учні вивчають за опорною таблицею 2 [5].
Таблиця 2
Порівняльна характеричтика підгрупи лужних металів
| Символ | Протонне число | Схеми будови атомів | Електронні формули | Формули оксидів | Формули гідроксидів | Зміна забарвлен-ня полум’я пальника |
| Li | +3 | ) ) 2 1 | 1s22s1 | Li2O | LiOH | Малиновий |
| Na | +11 | ) ) ) 2 8 1 | 1s22s22p63s1 | Na2O | NaOH | Жовтий |
| K | +19 | ) ) ) ) 2 8 8 1 | 1s22s22p63s2 3s2 3p64s1 | K2O | KOH | Оранжево- фіолетовий |
| Rb | +37 | ) ) ) ) ) 2 8 18 8 1 | 1s22s22p63s2 3s2 3p64s24d105s1 | Rb2O | RbOH | Червоний |
| Cs | +55 | ) ) ) ) ) ) 2 8 18 18 8 1 | 1s22s22p63s23s23p64s24d105s25s65p106s1 | Cs 2O | Cs OH | Фіолетовий |
| Подібність | Один електрон на зовнішньому енергетичному рівні | Зовнішній енергетичний рівень має подібну структуру, один s-електрон | Е2О | ЕОН | | |
| Відмінність | Радіуси атомів зростають із зростанням за-ряду їхніх ядер | Кожний наступний атом легше віддає електрон зовнішнього енергетичного рівня | | | Різне забарвлен-ня полум’я | |
Таблиця узагальнює інформацію про будову атомів лужних металів, про їхню по-дібність та відмінність. На основі цієї інфор-мації вчитель має можливість підвести учнів до розуміння причинно-наслідкових зв’язків та сформувати в них вміння встановлювати їх.
Наприклад. На основі поданої опорної таблиці можна встановити цілий ланцюг при-чинно-наслідкових зв’язків. Зокрема, наяв-ність одного s-електрона на зовнішньому енергетичному рівні в усіх лужних металів (причина) зумовлює їх одновалентність у спо-луках (наслідок); зростання зарядів атомів ядер елементів і атомних радіусів (причина) посилює їхню хімічну активність (наслідок); здатність віддавати один електрон із зов-нішнього енергетичного рівня (причина) по-силює їхню хімічну активність (наслідок); одновалентність (причина) зумовлює подіб-ний склад оксидів та гідроксидів, загальні формули яких Е2О, ЕОН (наслідок); подіб-ність у будові атомів (причина) – подібність властивостей (наслідок) і т.д.
У 9 класі для характеристики хімічних властивостей лужних металів використовуємо загальну схему. Наприклад таблиця 3.
Таблиця 3
Хімічні властивості лужних металів
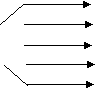 +Cl2 2MeCl +Cl2 2MeCl+S Me2S 2Me +2H2O 2MeOH +2HCl 2MeCl + + H2 2MeH З киснем! Тільки Літій утворює оксид H2 складу Li2O. Усі інші утворюють пероксиди – Me2O2 Ме+ – О- – О- – Me+ |
| Лужні метали – сильні відновники |
Робота з такою схемою дозво-ляє учням самостійно опрацювати навчальний матеріал і закріпити його на конкретному прикладі, поданому в самостійній роботі. Наприклад, завдання самостійної роботи: Напишіть рів-няння рекцій, що лежать в основі даної схеми. Де можливо, складіть йонні рівняння.
+ Н2 +Br2
 +S +O2
+S +O22К +Н2О 2Li +H2O
+НВr + H2
+Сl2 +HCl
Під час виконання самостійної роботи учням дозволяється користуватися опорною схемою. Повторення організовують взаємо-опитуванням. Тоді вчитель пропонує відтво-рити загальну схему, або, що складніше, скласти її самостійно на основі іншого луж-ного металу (наприклад, натрію), написати рівняння реакцій та перевірити один одного.
Розкриття причинно-наслідкових зв’яз-ків за допомогою опорних схем дозволяє про-гнозувати властивості будь-якого з лужних металів. Таким чином робота з опорними схе-мами (таблицями) переростає в технологію формування функціональних компетентно-стей школярів. У наведеному вище прикладі конкретизовано один із способів формування ланцюжка причинно-наслідкових зв’язків.
Ми зазначали, що окремі схеми можуть виступати основою для висунення гіпотез та пошуку шляхів їх розв’язання. Наприклад, під час характеристики Феруму як представника побічних підгруп, учні дізнаються, що цей елемент утворює сполуки, в яких проявляє ступені окиснення +2 і +3. Учитель це показує на схемі:
Fe+2
F
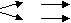 e
eFe+3
Пропонує учням завдання: продовжити схему до утворення гідроксидів і довести експериментально, що ферум (ІІ) гідроксид – основа.
Для виконання цього завдання вчителю слід навчити учнів планувати порядок дій: а) проаналізувати дане завдання; б) сфор-мулювати гіпотезу; в) скласти план доведення гіпотези; г) встановити наслідки та переві-рити їх на практиці; ґ) сформулювати виснов-ки про правильність чи хибність гіпотези.
Виконувати це завдання можна індиві-дуально, в групах або фронтально. Друга і третя форма організації дозволяє залучити до роботи усіх учнів класу, підвищує інтерес до її виконання. Сам експеримент виступає засо-бом доведення гіпотези, тому доцільно його теоретично обґрунтувати і провести дослід-ницьким методом.
Під час вивчення органічної хімії зро-зуміти суть будови окремих класів сполук та побачити взаємоз’язки між ними дає змогу використання моделей як аналогів реальних структур цих сполук. Просторове розташу-вання атомів у молекулі органічних речовин відбивають кулестержневі та масштабні мо-делі, електронні та структурні формули, що є у робочому зошиті учня для 10-11 класів.
Використання опорних схем стало однією з поширених технологій індивідуалі-зації навчання [2,3,4,7,9]. У методичній літе-ратурі [8] відзначається, що опорні схеми (таблиці) не мають строго визначених вимог щодо форми подачі матеріалу, а отже, тут відкривається широке поле для творчої діяль-ності і педагогів, і учнів. Багато вчителів, прихильників використання опорних схем, пропонують учням самостійно скласти їх за текстом підручника чи іншого навчального посібника. У праці [8] йдеться про те, що одні педагоги схиляються до думки, що в опорних схемах мають фігурувати лише формули і терміни, інші вважають, що мають бути певні несподіванки, які загострюватимуть увагу школяра на важливому для нього об’єкті, розширюватимуть уяву про мікросвіт.
Шкільна практика доводить, що, пра-цюючи з опорними схемами, вчителі набу-вають величезного досвіду з управління самостійною роботою учнів на уроках та під час виконання домашніх завдань.
Учні, які засвоїли технологію роботи з опорними схемами відзначаються вміннями:
- висловлювати свої думки стисло, влучно і конкретно;
- аналізувати, класифікувати, узагальнювати, систематизувати навчальний матеріал, тоб-то володіють загальнонауковими методами навчальної діяльності;
- виділити у навчальному тексті найголовні-ше і відмежуватися від другорядного;
- використовувати такі прийоми навчальної діяльності, як групування, складання плану, самостійне створення змістових опор тощо.
Отже, використання опорних схем при вивченні хімії є одним з ефективних засобів організації самостійної навчальної діяльності учнів.
Література
1. Калмыкова З.И. Продуктивное мышление как основа обучаемости. – М.: Педагогтка, 1981. – 200 с.
2. Савчин М.М. Гуманізація процесу навчання на уро-ках хімії / Конференція Соросівських Учителів. – К.: Міжнародний фонд “Віджродження”, 1995. – 376 с.
3. Савчин М.М. Застосування опорних схем на уроках хімії та їх результативність у впровадженні процесу гуманізації навчання // Конспект. Науково-методичний журнал. ЛОІППО, 1996 – №2. – С. 36-56.
4. Савчин М.М. Робочий зошит з хімії. 8 клас.– 2-е вид., виправлене і перероблене. – Львів: ВНТЛ-Класика, 2003. – 120 с.
5. Савчин М.М. Робочий зошит з хімії. 9 клас. – 2-е вид., виправлене і перероблене. – Львів: ВНТЛ-Класика, 2002. – 112 с.
6. Столярчук Д.С. Знаково-символическая наглядность как средство обучения и систематизации знаний уча-щихся по физике в средней школе. Автореферат дис. ... канд. пед. наук: 13.00. 02. – 1987. – 24 с.
7. Супотницкая И.И., Гоголевская Н.И. Важнейшие классы неоганических соединений. Опорные схемы-таблицы по химии. – М.: Школа-Прес, 1997.
8. Чернобельская Г.М. Методика обучения химии в средней школе: Учеб. для студ. висш. учеб. заведений. – М.: Гуманит. изд. Центр ВЛАДОС, 2000. – 336 с.
9. Шаталов В.Ф. Учить всех, учить каждого // Педагогический поиск / сост. М.Н. Боженова. – М.: Педагогика, 1987. – С. 141-204.




Шаромова Віра
