Мусієнко М. М., Панюта О. О. Біотехнологія рослин. Навчальний посібник
| Вид материала | Документы |
- Ослин навчальний посібник до лабораторних занять з фізіології рослин для студентів, 2678.12kb.
- Удк 581. 8 (075. 8) Брайон О. В., Панюта О. О., Паршикова Т. В., Славний, 518.84kb.
- Практикум з педагогіки вищої школи: Навчальний посібник за модульно-рейтинговою системою, 411.72kb.
- Дмитриченко М. Ф., Навчальний посібник, 2529.95kb.
- Дмитриченко М. Ф., Навчальний посібник, 2842.03kb.
- Наталя Чабан навчальний посібник з історії української культури мвс україни, 9171.9kb.
- Програма вступних фахових випробувань за спеціальністю «фізіологія рослин» освітньо-кваліфікаційний, 164.35kb.
- Рекомендовано Міністерством освіти України як навчальний посібник для студентів архітектурних, 1979.84kb.
- Т. Г. Сабірзянов Печі ливарних цехів. Гриф «Навчальний посібник», 375.04kb.
- Н. М. Борівська Навчальний посібник містить цікавий матеріал стосовно урок, 283.61kb.
КУЛЬТУРА КЛІТИННИХ СУСПЕНЗІЙ
Культура клітинних суспензій або суспензійна культура – вирощування окремих або невеликих агрегатів у завислому (суспендованому) стані в рідкому середовищі при використанні апаратури, яка забезпечує їх аерацію і перемішування.
Суспензійна культура використовується для вивчення фізіологічних закономірностей росту, диференціації, метаболізму соматичних клітин вищих рослин. Особливе значення має використання біосинтетичного потенціалу рослинних клітин для промислового отримання при великомасштабному культивуванні ряду економічно цінних речовин – алкалоїдів, стероїдних сполук, глюкозидів, ефірних олій, ферментів тощо.
Клітинну суспензію отримують з шматочка калюсу в рідкому середовищі, яке перемішується. Для ініціації суспензійної культури необхідно 2-3 г свіжої калюсної маси на 60-100 мл рідкого живильного середовища. Первинну суспензію отримують на коловому шейкері зі швидкістю перемішування 100-120 об/хв.
Суспензійну культуру можна отримати також із фрагмента органа рослини (листок, стебло, корінь). Спочатку на поверхні експлантата утворюється первинний калюс, а потім від нього відділяються клітини і клітинні агрегати, які дають початок клітинній суспензії.
Для отримання високо диспергованої суспензійної культури велике значення має тип вихідної калюсної тканини. Оптимальною є калюсна тканина пухкого типу, яка легко розсипається при внесенні в рідке середовище, що перемішується. Для цього калюс вирощують на середовищі з високою концентрацією ауксинів і зменшеною концентрацією або без цитокінінів і без іонів Са2+. Додавання в середовище фермента пектинази, який руйнує пектат кальцію, що склеює окремі клітини, полегшує отримання суспензії.
Необхідною умовою культивування клітинних суспензій є постійне перемішування середовища. Якщо клітинна суспензія перебуває в нерухомому стані, то ділення суспензійних клітин призводить до утворення калюсної тканини.
Первинну суспензійну культуру перед субкультивуванням фільтрують через 1-2 шари марлі, нейлонові або металічні сита, щоб позбутися від великих і щільних шматків калюсної тканини і крупних агрегатів.
Для глибинного культивування рослинних клітин користуються способами вирощування, які розроблені в мікробіології. Використовують закриті або відкриті системи в періодичному або протоковому режимах.
У закритій системі при періодичному режимі вирощування клітинна маса поміщається в певний об’єм середовища. До закінчення вирощування система залишається закритою за всіма параметрами окрім газів.
У закритій безперервній культурі у систему періодично подається свіже живильне середовище, а старе видаляється у тому ж об’ємі. Клітини залишаються в системі протягом всього періоду вирощування.
У відкриті протокові культури періодично поступає свіже середовище, однак відбирається не лише старе середовище, а й частина клітинної маси. Регуляція цього процесу може здійснюватися за принципом турбідостата або хемостата. У турбідостаті подача свіжого середовища і відбір суспензії відбуваються після досягнення клітинною суспензією певної заданої густини. Сигнал на включення поступає від реле, яке зв’язане з оптичною системою, що визначає густину суспензії. В хемостаті швидкість протоку задається експериментатором і від неї залежить швидкість росту клітинної маси. Режим хемостата дозволяє за допомогою фіксованої швидкості розбавлення підтримувати постійну швидкість поділу і густину клітин у популяції. Найпоширенішим режимом культивування клітинних суспензій є закрита періодична система. У цьому випадку для аерації і перемішування суспензії використовують різну апаратуру: ролери, шейкери (як правило колові), ферментери з механічними і магнітними змішувачами або ферментери барботажного типу, в яких аерація і перемішування здійснюється повітряним потоком.
Для роботи з суспензіями необхідно знати їхні характеристики: життєздатність, щільність клітин в суспензійній культурі, ступінь агрегованості, швидкість росту.
Життєздатність клітин визначають за їхнім забарвленням барвником (метиленова синь або синь Еванса). Живі клітини не фарбуються барвником так, як клітинні мембрани непроникні для нього. В мертві клітини фарба легко проникає, і вони забарвлюються у синій колір.
Одним із основних показників, які характеризують стан клітинної суспензії, є щільність клітинної популяції. Кількість клітин визначають в лічильній камері Фукс-Розенталя під мікроскопом після мацерації хромовою кислотою (10-20 %).
Звичайно пасаж культивування клітинної суспензії становить 14-16 днів. За цей час щільність зростає від 5·104 до 5·106 кл/мл.
Якість суспензії залежить від ступеня агрегованості її клітин. Агрегати не повинні містити більше 10-12 клітин. Для видалення крупних агрегатів суспензії фільтрують через марлеві, нейлонові або металеві фільтри. Водночас це дозволяє позбутися від залишків експлантата або щільних шматків калюсної тканини.
^ Культивування ізольованих клітин
Для генетичних і фізіологічних досліджень, а також для практичного використання в клітинній селекції використовують ізольовані клітини. Отримання клону-потомства одиночної клітини допомагає з’ясувати причини генетичної неоднорідності калюсних клітин, оскільки спостереження в цьому випадку проводяться на тканині, яку отримали не з гетерогенного експлантата, а з однієї клітини. Ізольовані клітини також використовують як модель для вивчення взаємовідношень між клітиною і оточуючим середовищем, клітинами рослини-хазяїна і різними патогенними мікроорганізмами тощо.
Отримання одноклітинних клонів рослин складається з двох етапів:
1. виділення одиночних життєздатних клітин;
2. створення сприятливих умов для їх поділу і росту.
Для виділення життєздатних культур використовують такі методи:
1. вирощування калюсної маси і отримання із неї суспензії;
2. слабо агреговані суспензії;
3. виділення окремих клітин із тканин цілої рослини.
Отримання клітин із суспензійних культур пов’язане з меншим ризиком пошкодження порівняно з виділенням безпосередньо із органів рослини. Для отримання одноклітинної фракції суспензійної культури іноді достатньо простого відстоювання у колбі протягом 15-30 хв. При цьому крупні агрегати осідають на дно колби, а надосадова фракція містить тільки одинокі клітини або дрібні агрегати. Якщо при відстоюванні не вдається отримати одноклітинну фракцію, то застосовують ферменти для мацерації, центрифугування в градієнті сахарози або фільтрування через сита (нейлонові або металеві).
Труднощі культивування одиночних клітин пов’язані з тим, що окрема клітина не ділиться в тих умовах, в яких добре росте калюсна тканина. Для того, щоб змусити одиночні клітини ділитися, розроблені спеціальні методи:
1. метод культури “няньки”;
2. метод мікрокультури або висячих крапель;
3. метод плейтінга.
Сюди можна віднести і культуру ізольованих протопластів, яку буде розглянуто далі.
Метод культури “няньки” запропонував Джонсон у 1960 році. Функцію “няньки”, яка стимулює поділ одиночної клітини, виконують шматочки калюсної тканини, відокремлені від неї фільтрувальним папером. У присутності “няньки” одиночна клітина ділиться і дає індивідуальну колонію клітин – клон (Рис. 2).
Метод мікрокультури базується на використанні дуже малих об’ємів багатого живильного середовища і являє собою культивування одиночних клітин в мікрокраплі в чашці Купрака об’ємом 20 мл. Метод запропонував
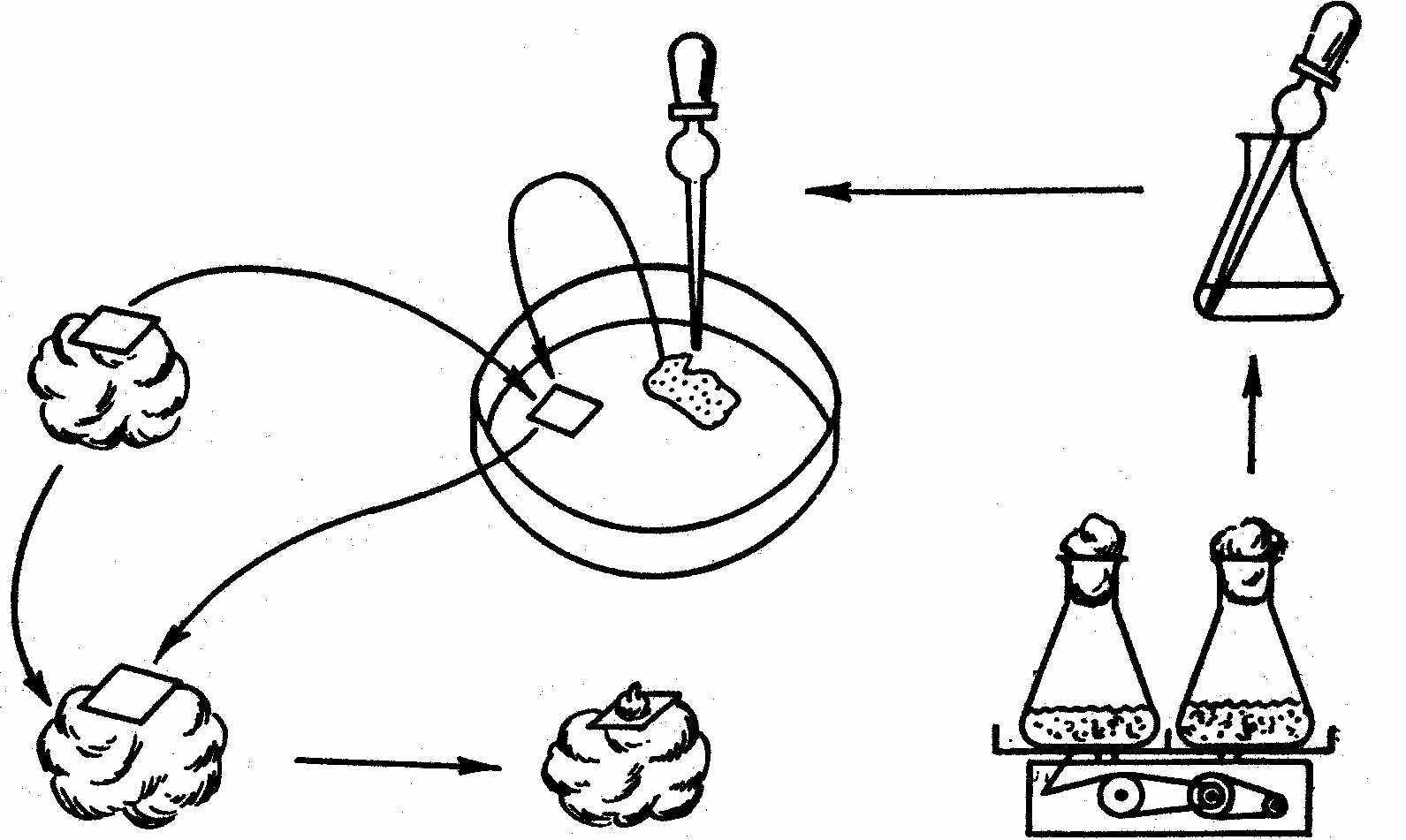
Рис.2. Метод культури “няньки” для вирощування культури із одиночної клітини.
академік Глєба Ю.Ю. У мікрокраплях зручно спостерігати за отриманням і діленням клітин при соматичній гібридизації.
Метод плейтінга передбачає змішування клітин суспензії з розплавленим та охолодженим до 35°–40° С середовищем і розлив тонким шаром (1 мм) у чашки Петрі. Цей метод був розроблений Бергманом у 1960 році. Цей метод використовують для отримання одноклітинних клонів та оцінки життєздатності клітин.
Використання культури “няньки”, мінімального об’єму середовища, в якому культивується окрема клітина, пов’язані з феноменом, який називають
“дія фактора кондиціонування”. Незважаючи на численні спроби визначити хімічну природу речовин (або речовини), які індукують ділення одиночної клітини, і механізм дії фактора кондиціонування, ця проблема залишається не вирішеною. Дослідження показали, що цей фактор хімічної природи і включає низькомолекулярні речовини (~700 Д).
^ Методи оцінки результатів
Для характеристики росту культур in vitro в першу чергу визначають збільшення сирої маси (Wt–Wo). Результати можуть бути виражені відносно вихідної маси
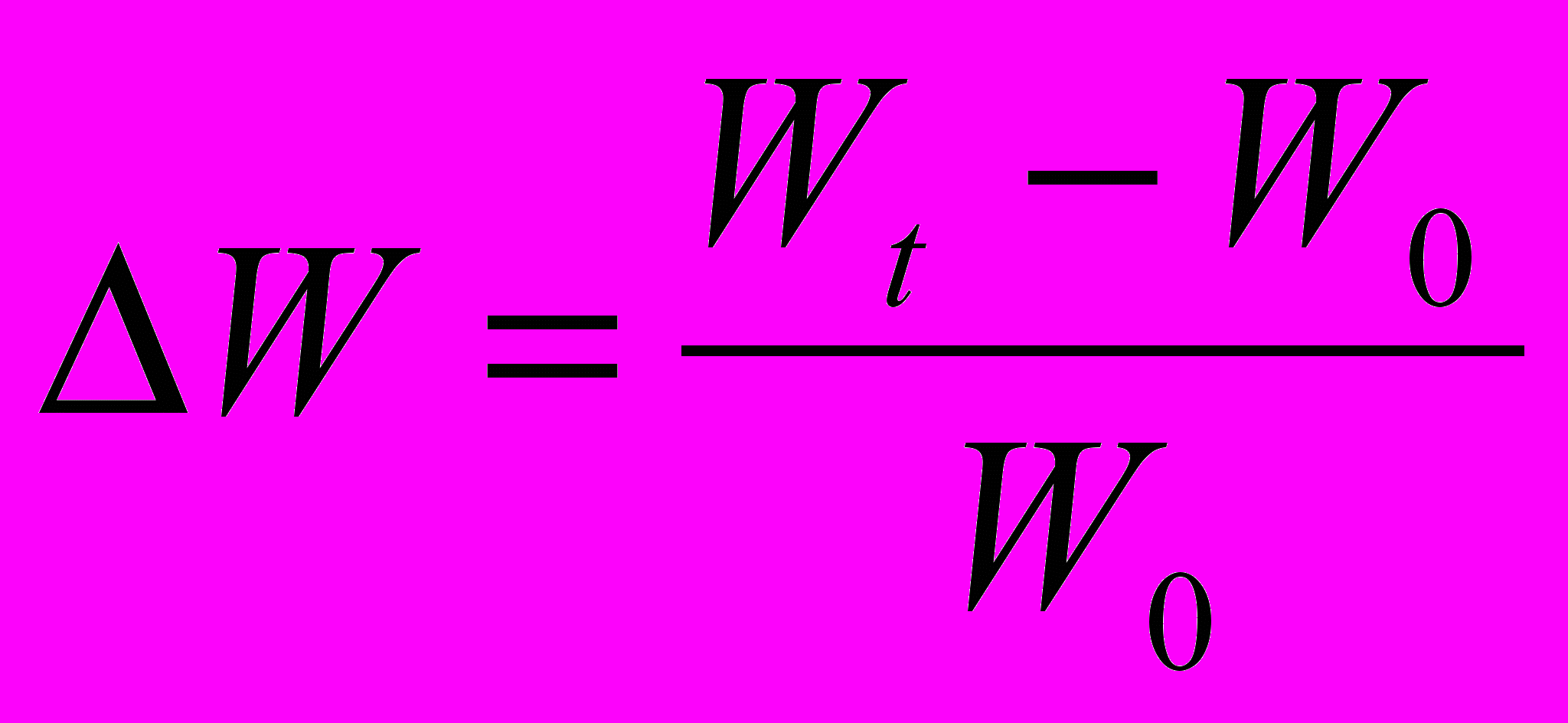 . Це дозволяє встановити у скільки разів збільшилася маса протягом досліду. Величину приросту маси можна виразити у відсотках
. Це дозволяє встановити у скільки разів збільшилася маса протягом досліду. Величину приросту маси можна виразити у відсотках 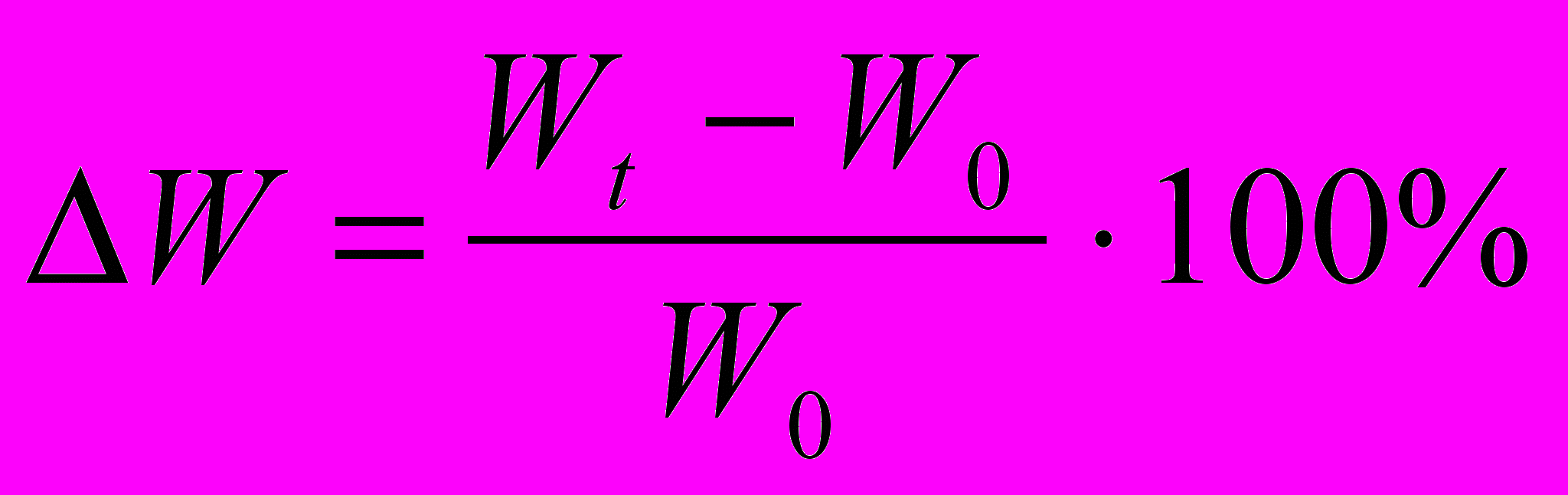 . Якщо тривалість росту в окремих випадках неоднакова, необхідно ввести у формулу фактор часу
. Якщо тривалість росту в окремих випадках неоднакова, необхідно ввести у формулу фактор часу 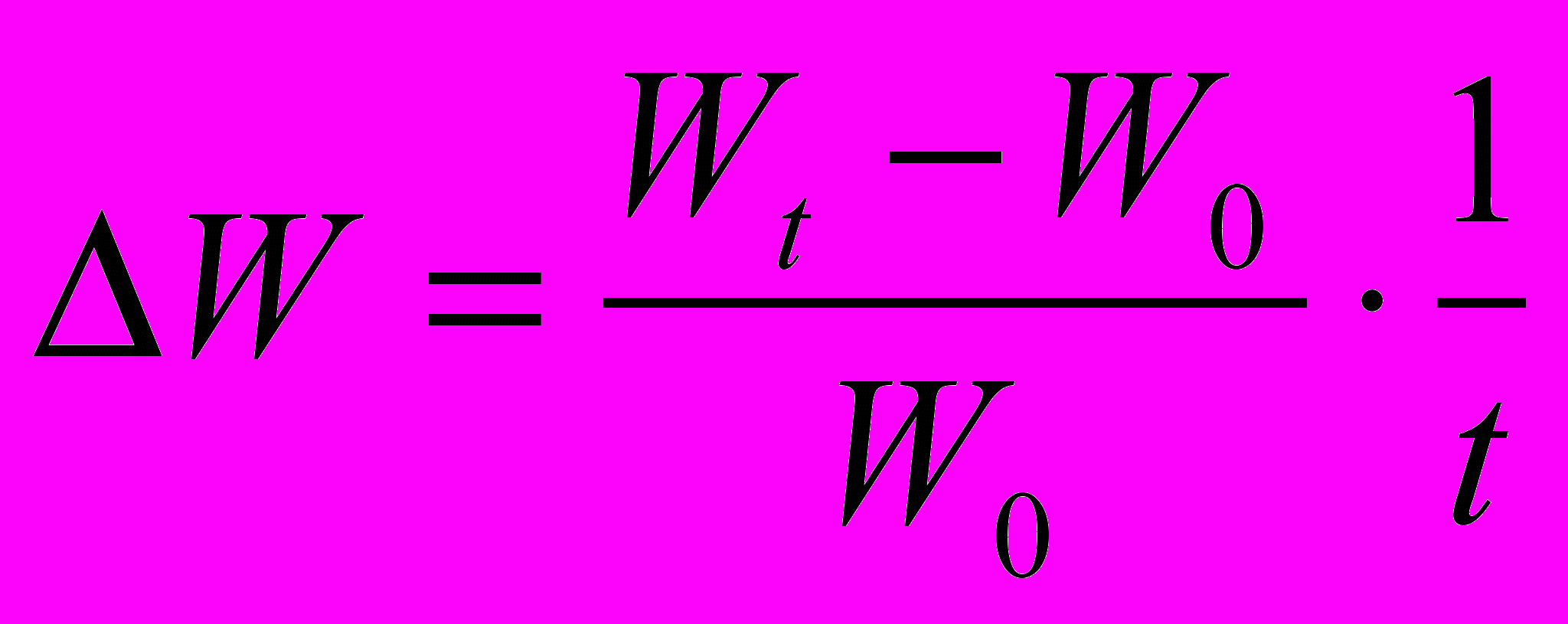 .
.Таким же чином можна проводити облік результатів за масою сухої речовини.
Більше інформації про характер росту культури отримують при визначенні числа клітин на одиницю маси тканини. Підрахунок клітин дозволяє визначити збільшення маси тканини відбувається за рахунок поділу клітин чи їх росту. Це дає можливість розрахувати і середню вагу клітини. Кількість клітин визначають за методом розробленим Брауном, який полягає у мацерації і послідуючому підрахунку краплі суспензії клітин у лічильній камері під мікроскопом. Використовують кілька методів мацерації. Більшість з них базується на обробці тканин сильними кислотами, які гідролізують серединні пластинки, що з’єднують клітини.
Для суспензійних культур визначають об’єм ущільнених клітин. Для цього в градуйовані центрифужні пробірки переносять певний об’єм суспензії (15 – 30 мл) і центрифугують при 1500g 10 хв або суспензію поміщають в градуйований циліндр і відстоюють впродовж доби. Об’єм ущільнених клітин виражають в мл клітинного осаду на мл культури.
Розмір клітин визначають вимірюючи їхню довжину та ширину під мікроскопом за допомогою шкали окуляр-мікрометра та об’єкт мікрометра.
Контрольні запитання і завдання
1. Що таке калюс?
2. Які зміни відбуваються у спеціалізований клітині при переході до дедиференціації?
3. Із яких органів рослини можна отримати калюсну тканину?
4. Яка основна особливість середовища для калюсогенезу у злаків?
5. Назвіть типи калюсної тканини.
6. Яке практичне використання пухких калюсів?
7. Який тип калюсної тканини Ви б використали для отримання рослин-регенерантів?
8. Наведіть приклади можливого використання калюсної тканини.
9. Що таке клітинна суспензія та яке її практичне значення?
10. Калюсній тканині якого типу надається перевага для отримання клітинної суспензії?
11. Назвіть методи культивування одиночних клітин.
12. Які показники визначають для оцінки росту суспензійної культури?
^ МІКРОКЛОНАЛЬНЕ РОЗМНОЖЕННЯ РОСЛИН
Біотехнологія рослин найширше використовується у агротехніці для прискореного розмноження і оздоровлення цінних сортів сільськогосподарських культур. На основі цієї технології створена ціла індустрія мікроклонального розмноження рослин.
Мікроклональне розмноження - це безстатеве вегетативне розмноження в культурі in vitro , при якому отримують рослини генетично ідентичні вихідній батьківській формі, що сприяє збереженню генетично однорідного посадкового матеріалу. Цим методом можна розмножувати у короткі строки види, які важко розмножуються і рослини, які є в одному екземплярі, а також і стерильні генотипи. Особливої актуальності сьогодні набули дослідження по розробці методів мікроклонального розмноження рідкісних та зникаючих рослин. Багаточисельність, швидкість і високий коефіцієнт розмноження (1:1 000 000 ) дозволяє у 2–3 рази скоротити термін відбору і отримання нових рослин у селекційних дослідженнях.
Мікроклональне розмноження має цілий ряд переваг над традиційними методами розмноження рослин:
1) економія вихідного матеріалу;
2) отримання великого числа копій із мінімальної кількості рослинного матеріалу;
3) отримання генетично однорідного матеріалу;
4) можливість відбирати in vitro рослинний матеріал з бажаними ознаками;
5) можливість отримання безвірусного матеріалу;
6) можливість проводити розмноження рослин протягом цілого року, адже їх ріст і розвиток in vitro практично не залежать від сезону;
7) можливість отримувати у великих кількостях вегетативне потомство видів рослин, що важко розмножуються у звичайних умовах;
8) економія площі;
9) можливість тривалого збереження пробірочних рослин при понижених температурах, що дає змогу створити банк цінних форм рослин.
Теорією і принципом розробки технології мікроклонального розмноження є положення про можливість індукції диференціації і органогенезу, виникнення біологічної форми із однієї рослинної клітини, її здатності утворювати цілу рослину. Клітина in vivo у складі тканини з певною диференціацією виконує вузьку специфічну функцію. Реалізація її тотипотентності in vivo послаблюється факторами і умовами, які мають місце на материнській рослині. Якщо ж клітина вилучається із рослини і поміщається у штучні контрольовані умови in vitro, то реалізується потенційна можливість відновлення рослини із клітини або групи клітин, тобто реалізується властива клітині тотипотентність. Прояв цієї властивості поки що виявлено у клітин, які називаються меристемоїдами.
Меристемоїди – це морфогенетично компетентні клітини, які відповідають на індуктори диференціації і склад середовищ формуванням пагонів, коренів, зародка. Морфологічно їх виявляють у калюсних культурах у компактних осередках клітин, що діляться, у вигляді дрібних, ізодіаметричних, тонкостінних клітин з великим ядром, густою цитоплазмою і практично без вакуолей. Саме з таких клітин складаються апікальні меристеми і клітини зародка. У тканинах, які отримали з цих органів найлегше індукувати органогенез.
У зв’язку з цим регенерація із будь-яких клітин рослин можлива, якщо вдасться перевести ці клітини у меристемоїди, створивши відповідні умови.
Навіть у рослин з високим ступенем регенерації, наприклад у тютюну, клітин-меристемоїдів не так багато: у первинному калюсі на 1000 – 10000 клітин може бути один меристемоїд. Розподіл меристимоїдів по органах рослин нерівномірний, і різні види відрізняються за вмістом меристемоїдів у тканинах окремих органів. У зв’язку з цим першочерговим завданням є вибір частини рослини, яку можна використати як первинний експлантат. Найвищий ступінь регенерації виявлений у зародків, сім’ядолей, гіпокотилів, коренів, стебла, листка, бульб, суцвіття і пиляків.
Встановлено, що у багаторічних рослин, як і у однорічних, прояв тотипотентності клітин у тканинах і органах поточного року знижується на пізніших етапах. Це може свідчити про зниження у рослині концентрації меристемоїдів з віком або про поступове зниження їх компетентності. Так, регенерація рослин кукурудзи або кофе можлива із калюсу, який отримують із незрілих зародків, які виділені задовго до дозрівання насіння. Загальновідомо, що культури тканин, які отримали із молодих листків або стебел краще здатні до регенерації рослинок. Крім цього, розвиток рослини супроводжується зниженням здатності тканин до ембріогенезу або органогенезу. Культури тканин, які отримали із дорослих рослин, звичайно не здатні до регенерації, а тому первинні експлантати деревних необхідно відбирати на ювенільних фазах розвитку.
Кількість меристемоїдів можна збільшити їх відбором. Крім того, для подальшого розвитку меристемоїдів їх необхідно відділити від немеристемоїдних клітин, так як остані пригнічують ембріогенез у цих клітин, можливо, виділяючи інгібітори. Необхідність відбору меристемоїдів обумовлена і тим, що при тривалому культивуванні тканин зменшується здатність до регенерації.
Кількість меристемоїдів і реалізація тотипотентності у значній мірі залежать від умов, у які поміщають клітину перед або під час індукції регенерації. Серед них найважливішими є: освітлення, температура і склад середовища.
Сезонні зміни поведінки ізольованих тканин звичайно пов’язані із змінами фотоперіоду і температури. Відмічено, що вміст меристемоїдних клітин і найвищий ступінь регенерації спостерігаються в разі вирощування донорних рослин при оптимальних для даного виду фотоперіоді і температурі. Експлантати, відібрані від рослин, які росли при несприятливому фотоперіоді, утворюють мало або зовсім не утворюють регенерантів, навіть якщо фотоперіод при культивуванні буде оптимальним. У більшості лабораторій стандартом є 16–годинний фотоперіод, оптимальна інтенсивність освітлення 1000 Лк. Соматичний ембріогенез, як правило, відбувається в темряві – на світлі зародки передчасно проростають. Однак відомі випадки коли соматичний ембріогенез у калюсу Nicotiana стимулювало освітлення 10000 – 15000 Лк. Значення має і спектральний склад світла: утворення адвентивних пагонів у Nicotiana tabacum найкраще відбувається при освітленні калюсу ультрафіолетовою частиною спектра (371 нм), голубою (419 – 467 нм) або пурпурною (504 – 550 нм). У іншого виду Lactuca sativa утворення пагонів стимулювало освітлення червоним світлом (660 нм) і індукція знімалась при освітленні дальнім червоним (750 нм).
Для отримання великої кількості меристемоїдних клітин і прискорення органогенезу у різних видів рослин є температурні оптимуми. З метою індукції прискорення органогенезу застосовують обробку тканин листків або стебел субоптимальними температурами (15–18° С), що покращує регенерацію при подальшому культивуванні при 21–25° С. Для деяких рослин більш ефективною є короткочасна обробка нижчою температурою (4° С).
Важливу роль у регулюванні реалізації тотипотентності рослинною клітиною відіграють біологічно активні речовини фітогормональної дії, що входять до складу середовища, а саме, ІОК і цитокініни.
Отже, для успішної реалізації рослинною клітиною властивої їй тотипотентності необхідно враховувати такі моменти:
1) вибір первинного експлантата;
2) сезонність, вік первинного експлантата;
3) умови культивування експлантатів.
^ Методи мікроклонального розмноження рослин
На сьогодні розроблено ряд різних способів біотехнології мікроклонального розмноження. В їх основі лежать чотири принципових підходи:
1) активація розвитку рослинних меристем (апекс пагона, пазушні і сплячі бруньки пагона);
2) утворення адвентивних бруньок із тканин експлантата;
3) індукція соматичного ембріогенезу;
4) диференціація адвентивних бруньок в первинній і перевивній калюсній тканині.
Іноді, як окрему модель виділяють культуру пиляків.
Основним методом мікроклонального розмноження рослин є активація пазушних меристем. Цей метод вже став промисловим при виробництві посадкового матеріалу деяких культур. Ця модель є найбільш надійною стосовно плодових і ягідних рослин. Вперше ця модель була розроблена на суниці на початку 70-х років минулого століття. Цей метод базується на знятті апікального домінування, чого можна досягти двома шляхами:
1. Отриманням пагонів нормальних пропорцій з послідуючим їх поділом на „однобрунькові мікроживці”, які використовують як вторинні експлантати для повторення циклу розмноження. Теоретична можливість такого способу розмноження складає приблизно 10 000 – 1 000 000 пагонів на рік.
2. Введенням в живильне середовище речовин з цитокініновою активністю, що приводить до формування пагонів з відносно вкороченими міжвузлями, а пазушні бруньки дають початок новим пагонам. Експлантати на таких середовищах набувають вигляду пучків маленьких пагонів, кожний із яких можна рекультивувати. Теоретично, можливість цього методу може становити до 15 000 000 000 бруньок або пагонів в рік від одного експлантата. Вважають, що цей метод має мінімальний ступінь ризику стосовно отримання неоднорідного потомства і частота появи мутантних рослин не перевищує частоти появи таких при звичайному розмноженні. Метод відносно універсальний і має гарну відтворюваність у межах виду і навіть роду рослин.
Другий метод – це індукція утворення адвентивних бруньок безпосередньо тканинами експлантата. Він базується на здатності ізольованих частин рослин за сприятливих умов живильного середовища відновлювати недостаючі органи і регенерувати цілі рослини (виключення становить кореневий органогенез). Майже всі органи і тканини рослин можуть утворювати адвентивні бруньки. Цей процес, як правило, відбувається на живильних середовищах, які містять лише цитокінін або в сполученні з ауксином у співвідношенні 10:1 або 100:1. З ауксинів у цьому випадку найчастіше використовують ІОК або НОК.
Цим шляхом можна розмножувати нарциси, лілії, гладіолуси, часник, цибулю, цвітну капусту, суницю, малину, яблуню, грушу та інші.
Однак, деякі дослідники вважають, що при розмноженні таким способом не виключена можливість отримання неоднорідного потомства. Справа в тому, що у тканинах експлантатів можуть бути клітини з порушеною плоїдністю. Перш за все це стосується тканин, які складаються з клітин, що швидко відмирають, наприклад, клітини кореневого чохлика. І хоча ймовірність регенерації рослин із таких клітин відносно низька, нею не можна нехтувати, так як in vitro ці клітини можуть отримати перевагу у розвитку.
В певних випадках ефективним способом розмноження рослин in vitro може бути соматичний ембріогенез – це формування зародкоподібних структур (ембріоїдів) із соматичних клітин в умовах in vitro, які при перенесенні на відповідне живильне середовище здатні розвиватися у цілу рослину. Соматичний ембріогенез наочно демонструє тотипотентність рослинних клітин.
Основна відмінність утворення зародків in vitro від in vivo полягає в тому, що соматичні зародки розвиваються асексуально поза зародковим мішком і за своїм зовнішнім виглядом нагадують біполярні структури, у яких одночасно спостерігається розвиток апікальних меристем стебла і кореня.
Соматичний ембріогенез включає фази розвитку, аналогічні фазам зиготичного ембріогенезу: глобули, серця, торпеди, молодого проростка (рис. 3).
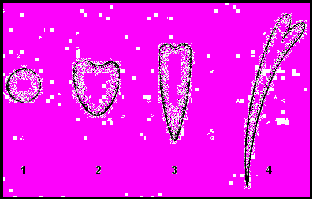
Рис.3. Стадії ембріогенезу: 1 – глобула; 2 – серце; 3 – торпеда; 4 – молодий проросток.
У деяких випадках ембріоїди утворюються безпосередньо із клітин тканини, яка культивується in vitro, - це так званий прямий ембріогенез. В інших випадках спочатку формується калюс, а вже з нього розвиваються зародки – це непрямий ембріогенез.
Ембріоїди утворюються з поодиноких клітин, розташованих в основному на поверхні калюсу. Вони відрізняються щільнішою цитоплазмою, відносно великим ядром із збільшеним ядерцем, містять дрібні вакуолі. Це метаболічно активні клітини, багаті білками і РНК. Оточуючі вакуолізовані клітини виконують функцію “тканини-няньки”.
Формування ембріоїдів у культурі тканин проходить у два етапи. На першому етапі клітини експлантата дедиференціюються за рахунок додавання в живильне середовище ауксинів, як правило, 2,4-Д і перетворюються на ембріональні. На наступному етапі з цих клітин розвиваються ембріоїди. Відбувається це при зменшенні концентрації ауксину або взагалі повного його виключення із складу живильного середовища.
Ембріогенез легше відбувається у молодих культурах. В міру подовження строку культивування ембріогенна активність клітин послаблюється. Так у моркви ембріоїди починають утворюватися через 4-6 тижнів після отримання калюсу, оптимальний вік культури для індукції соматичного ембріогенезу – 15-20 тижнів; 30-40-тижнева культура часто втрачає ембріогенний потенціал.
Четвертий метод мікроклонального розмноження - диференціація адвентивних бруньок в первинній і перевивній калюсній тканині. Цей метод мало використовується для отримання посадкового метеріалу in vitro. Це пов’язане з тим, що при тривалому культивуванні калюсу спостерігаються зміни плоїдності клітин, структурні перебудови хромосом, накопичення генних мутацій і зменшення або і втрата морфогенного потенціалу. Тому цей метод мікроклоноального розмноження доцільно використовувати лише для тих рослин, для яких притаманна генетична стабільність калюсної тканини, а варіабельність між рослинами-регенерантами не перевищує рівня природної мінливості. До таких рослин можна віднести томати, спаржу, деякі деревні породи. Через калюсну культуру були також розмножені цукровий буряк, кукурудза, рис, пшениця, соняшник, льон, картопля, огірок.
^ Етапи мікроклонального розмноження рослин
Процес мікроклонального розмноження складається із ряду послідовних операцій, кожна з яких має свою специфіку.
Першою операцією або етапом є вибір експлантатів і введення їх в культуру. Вихідним матеріалом для мікроклонального розмноження можуть бути верхівкові і пазушні меристеми стебла, молоді листки, елементи суцвіття і квітки, цибулин і бульбоцибулин. Ідеальним матеріалом для отримання чисельних пагонів є апікальні і пазушні бруньки здорових і активноростучих рослин.
На цій стадії визначальну роль відіграє стерилізація рослинного матеріалу, бо живильні середовища є чудовим субстратом для розвитку грибної і бактеріальної мікрофлори. Деякі дослідники використовують так званий „тест на інфікованість експлантатів сапрофітною мікрофлорою”, при якому експлантати спочатку поміщають на середовища без дефіцитних і дорогих складових. Протягом 7 – 10 днів відбувається вибраковування інфікованих експлантатів, а „чисті” поміщаються на середовище певного складу для подальшого культивування. У більшості випадків для мікроклонального розмноження рослин in vitro використовують різні модифікації середовища Мурасиге і Скуга.
Другим етапом є процес мікророзмноження, який відбувається за однією з приведених моделей. На цьому етапі важливу роль можуть відігравати такі фактори, як сортові і видові особливості, будова і розмір експлантата, його походження, склад живильного середовища і фізичні умови культивування.
Відомо, що здатність рослини до розмноження, як і будь-яка інша ознака генетично детермінована, чим пояснюється різна поведінка рослин різних видів у культурі ізольованих тканин і органів. І на сьогодні не завжди вдається створити для будь-якого генотипу умови, які індукують процеси регенерації або проліферації пагонів. Наприклад, суниця може розмножуватися за будь-якою моделлю мікроклонування, а ефективного розмноження обліпихи не вдалося досягти жодним із шляхів, хоча при традиційних методах розмноження вона прекрасно живцюється. У різних сортів у межах виду рослин здатність до розмноження теж варіює.
Для успішного проведення робіт з регенерації рослин суттєве значення має вибір експлантата. Краще всього використовувати матеріал, вилучений із здорових, сильних рослин. Вибір експлантата залежить від виду, стану рослини-донора (фази її розвитку), сезону року. Значення має навіть положення експлантата на рослині. Так, верхівки пагонів, взяті з верхніх гілок дерева, мають більшу швидкість розмноження, ніж верхівки з нижніх. Більшість експлантатів добре вводяться в культуру у фазу активного росту донорської рослини, але є рослини, експлантати з яких утворюють пагони лише в стані спокою. Незрілі, молоді органи мають кращі морфогенні потенції, ніж зрілі, старіючі тканини і органи.
Розмір експлантата є важливим фактором прояву регенераційної здатності. У цілому відмічено, що використання експлантатів більшого розміру, які містять меристематичні зони, швидше приводить до успішного результату, ніж використання меристематичних верхівок. Проте взяття експлантата великого розміру спряжене з посиленою небезпекою інфікування.
У середовище для культивування експлантатів доцільно додавати антиоксиданти (цистин, меркаптоетанол, глутатіон тощо), які пригнічують активність деяких ферментів і запобігають загибелі експлантатів.
Внесення у середовище активованого вугілля забезпечує зв’язування і виведення низки токсичних речовин, які є у середовищі, серед них і деякі фенольні сполуки, які утворюються у процесі вирощування.
На перших етапах вирощування експлантата важливим є успішне проходження процесів дедиференціації і вступу клітин у ембріональний стан, початок активних клітинних поділів, утворення калюсу, гісто- та органогенез. В цей час особливу увагу слід приділити оптимізації умов живлення. Для цього до складу живильного середовища додають крім мінеральних солей і вуглеводів амінокислоти, вітаміни, ауксини, цитокініни, гібереліни. У подальшому, для індукції росту стебла і формування кореня, склад живильного середовища спрощується. Із фітогормонів додають лише ауксин.
^ Третім етапом мікроклонування є індукція коренеутворення у пагонів, що досягається додаванням у живильне середовище ауксинів. Але наявність ауксинових аналогів у середовищі бажана лише на початкових етапах формування кореневих зачатків. Для подальшого росту закладених коренів наявність у живильному середовищі ауксинів навіть шкідлива. Тому часто для стимуляції ризогенезу використовують обробку пагонів стерильними розчинами препаратів. Цей метод набув широкого поширення для деревних і чагарникових рослин.
^ Останній етап процесу мікроклонального розмноження – адаптація пробірочних рослин до нестерильних умов є найбільш відповідальним і його недооцінка може загубити всю проведену, кропітку роботу.
Розроблена ціла система адаптацій пробірочних рослин до звичайних умов. Спочатку укорінені пробірочні рослини пересаджують на рідке розбавлене живильне середовище. Потім, приблизно через тиждень, такі рослини пересаджують у проавтоклавований ґрунт, а для підтримки високої вологості накривають скляними посудинами. Через 7 – 10 днів накриття знімають, витримують ще приблизно тиждень у спеціалізованих боксах і тільки після цього висаджують у теплицю.
Щоб ефективність мікроклонального розмноження була високою, необхідно на всіх етапах цього процесу підтримувати оптимальні умови вирощування: освітлення, температуру, відносну вологість повітря. У зв’язку з цим для кожної культури розробляють конкретну методику мікроклонального розмноження.
Хоча вартість рослин, одержаних методом культури ізольованих тканин і органів, поки-що більша, ніж рослин, що розмножуються традиційними способами, мікроклональне розмноження вважається перспективним способом вегетативного розмноження, бо дозволяє отримувати оздоровлений посадковий матеріал, скорочувати селекційний процес і проводити роботи впродовж цілого року, економлячи площі для вирощування рослин.
