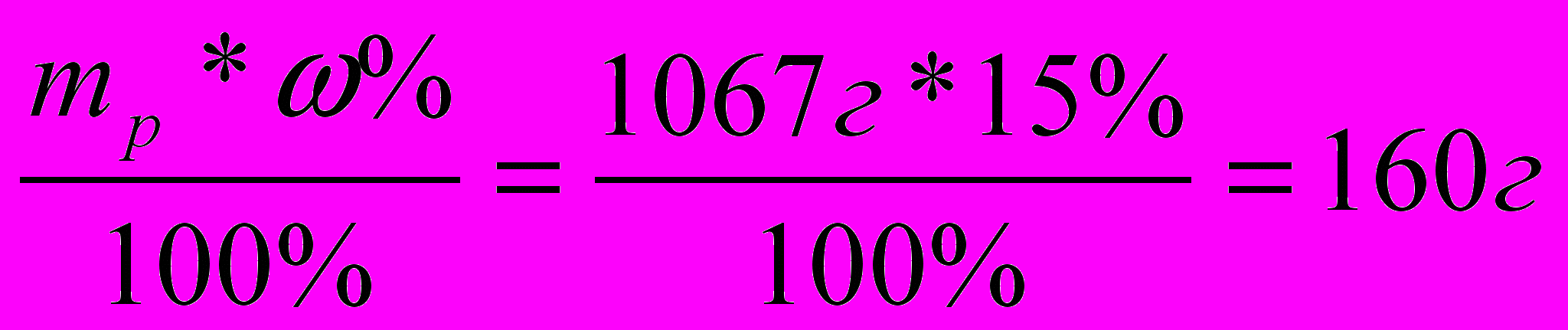План лекции. Значение растворов в жизни и практической деятельности человека Характеристика растворов
| Вид материала | Лекции |
- План. Понятие о кислотности растворов. Исследование растворов (лабораторная работа), 81.88kb.
- «Изучение электропроводности растворов», 130.92kb.
- Физико-химический анализ растворов liAsF 6 в некоторых апротонных растворителях 02., 281.37kb.
- Бизнес-план по организации завода инфузионных растворов, 36.83kb.
- Лекция 6 г идрогеохимия коллоидная миграция и сорбция химических элементов в природных, 87.8kb.
- Свод правил по проектированию и строительству сп 82-101-98 "Приготовление и применение, 1109.85kb.
- Общая характеристика работы, 279.52kb.
- Тематический план лекций по общей химии (осенний семестр), 28.8kb.
- Тематический план лабораторных занятий по дисциплине «общая химия, биоорганическая, 46.73kb.
- Спецкурс «Физикохимия полимеров фазовые равновесия и термодинамика полимерных растворов,, 18.13kb.
МУНИЦИПАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СЯСЬСТРОЙСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №2»
ВОЛХОВСКОГО МУНИЦИПАЛЬНОГО РАЙОНА
ЛЕНИНГРАДСКОЙ ОБЛАСТИ
Лекции для учащихся 9 классов
по теме «Растворы»
Подготовил:
учитель химии
высшей категории
Бочкова И.А.
г.Сясьстрой
2010г.
I Цели и задачи лекции:
Образовательные:
Сформировать у учащихся умение решать задачи на растворы 6
составлением математического уравнения;
используя диагональную схему («правило креста»).
Развивающие:
Продолжить работу над формированием у учащихся:
умения решать задачи с использованием формул массовой доли;
умения производить математические вычисления;
умения работать в должном темпе.
II. План лекции.
- Значение растворов в жизни и практической деятельности человека
- Характеристика растворов
- Массовая доля вещества в растворах
- Определение массовой доли разными способами
- Определение массовой доли при:
а) добавлении растворителя;
б) выпаривании растворителя;
в) добавлении растворённого вещества;
г) смешивании растворов;
д) растворении кристаллогидратов.
Растворы имеют важное значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Раствором называется твёрдая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах. Наиболее важный вид растворов – жидкие растворы.
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Состав раствора может выражаться разными способами. В 8 классе вы познакомились с массовой долей вещества в растворе, которая показывает отношение (обычно в процентах) массы растворённого вещества к массе раствора. Например, 15% водный раствор хлорида натрия – это такой раствор, в 100 единицах массы которого содержится 15 единиц массы NaCl и 85 единиц массы воды.
Для вычисления массовой доли вещества в растворе можно пользоваться изученными ранее формулами, но в некоторых случаях решения бывают длинными и не совсем удобными. Существуют другие способы вычисления массовой доли, например, составлением математического уравнения или использование диагональной схемы («правила креста»). Эти способы особенно удобно использовать для решения задач на добавление растворителя, вещества или на смешивание растворов.
Приготовление растворов определённой концентрации требует произвести необходимые расчёты. Этим пользуются фармацевты, лаборанты химических лабораторий и люди других специальностей. Да и в быту мы зачастую сталкиваемся с этой проблемой.
Растворы.
0%<ω%<100%
ω%=
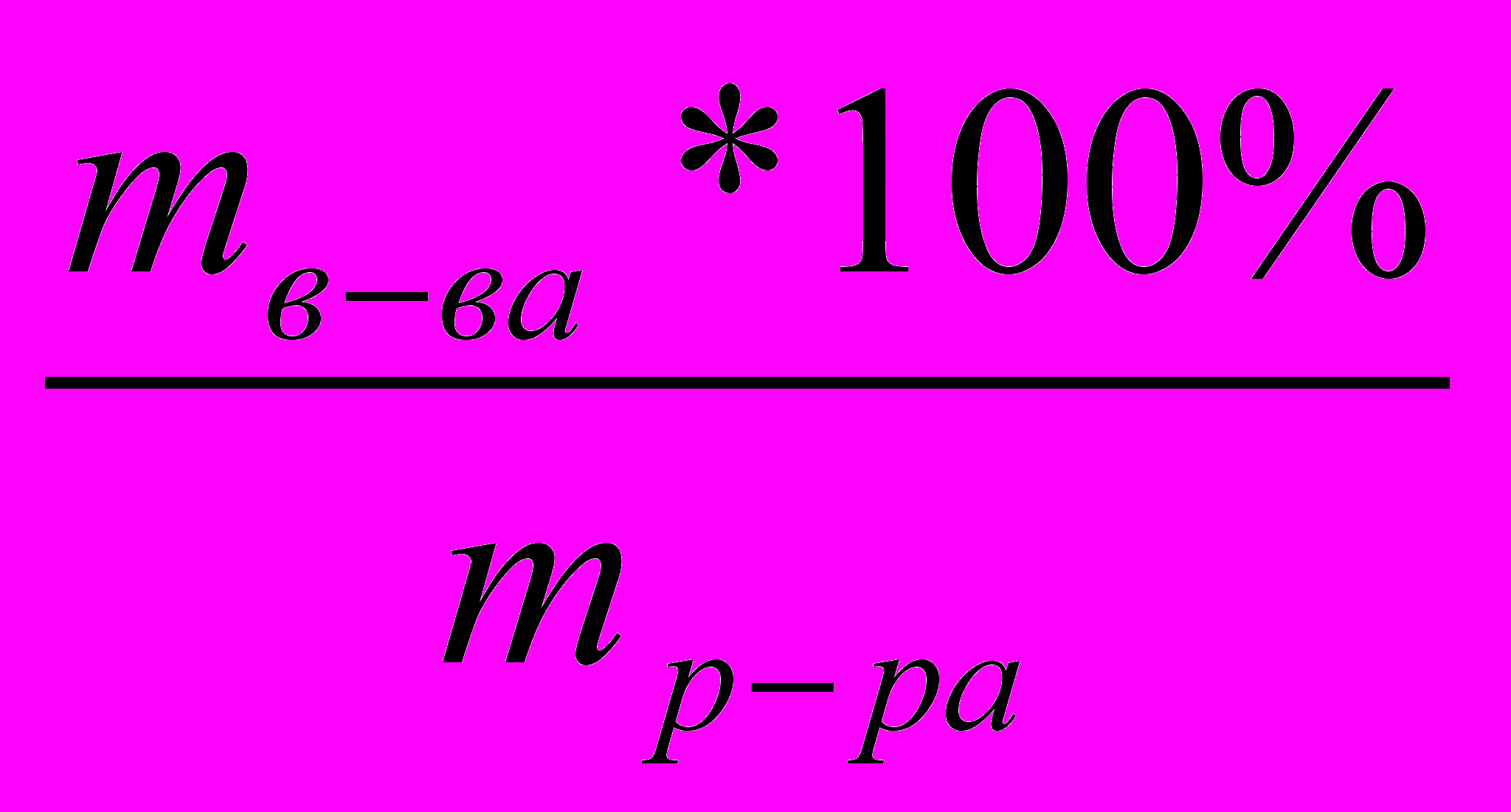 ; mв-ва=
; mв-ва=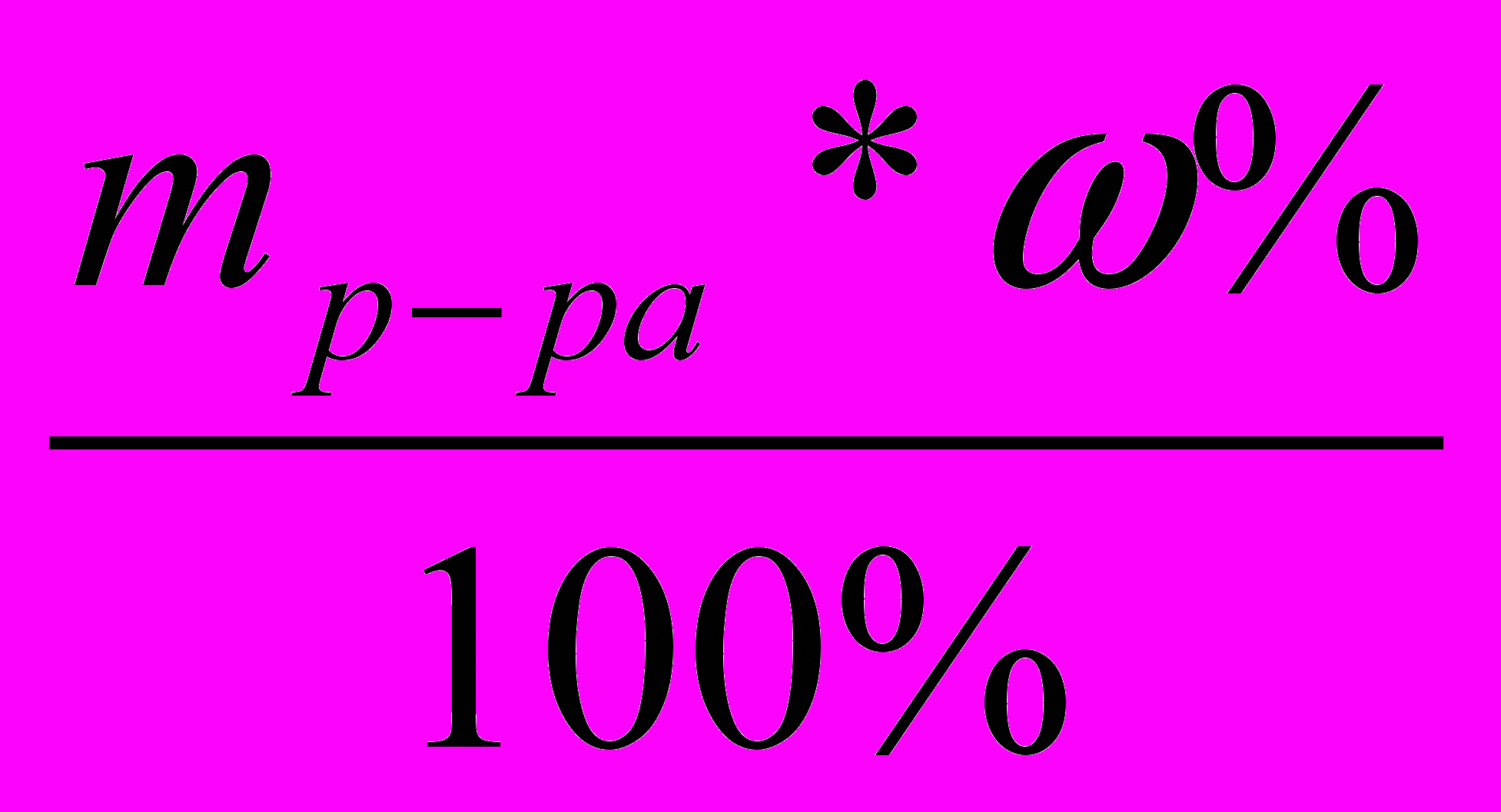 ; mр-ра=
; mр-ра=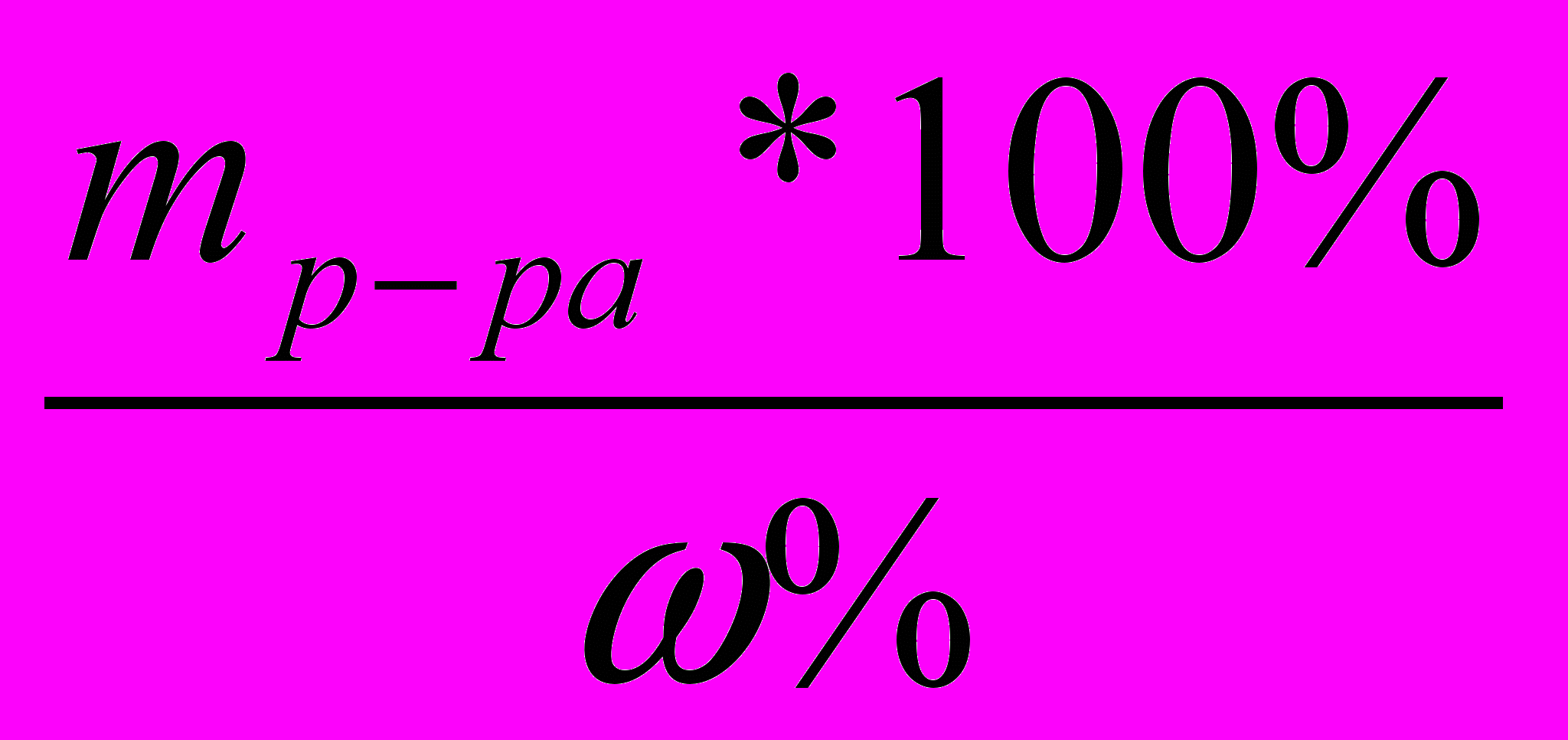 ;
; ω%(в-ва в чистой воде)=0%; ω%(ч.в)=100%.
Задача 1.
К 300г 15% р-ра КОН прибавили 250 г воды. Определить процентную концентрацию полученного раствора.
| Д  ано: ано:mр-ра1=300 г ω%1= 15% m(Н2О)доп=250г  ω%2=? | 1 способ. mв-ва= 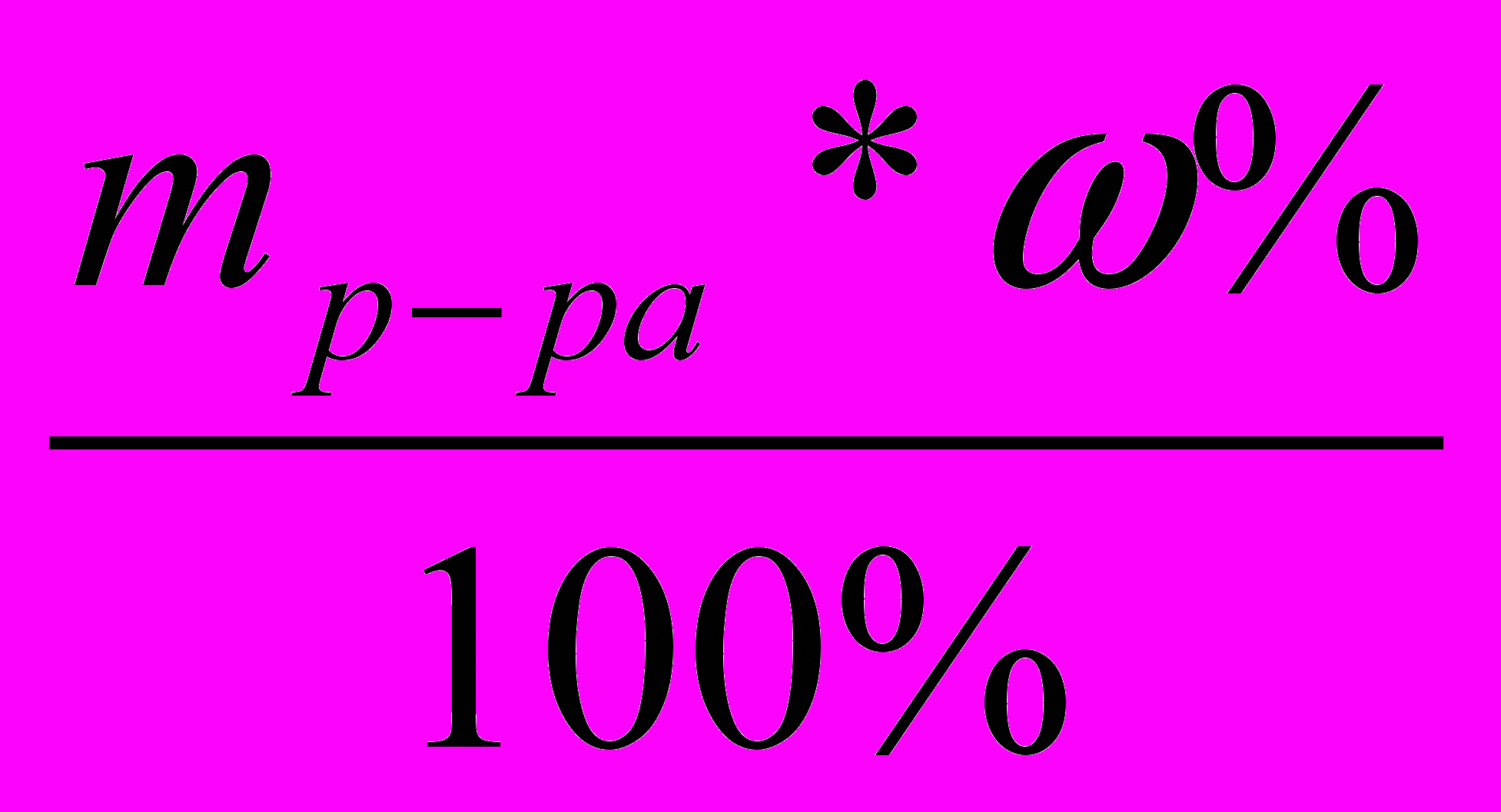 = =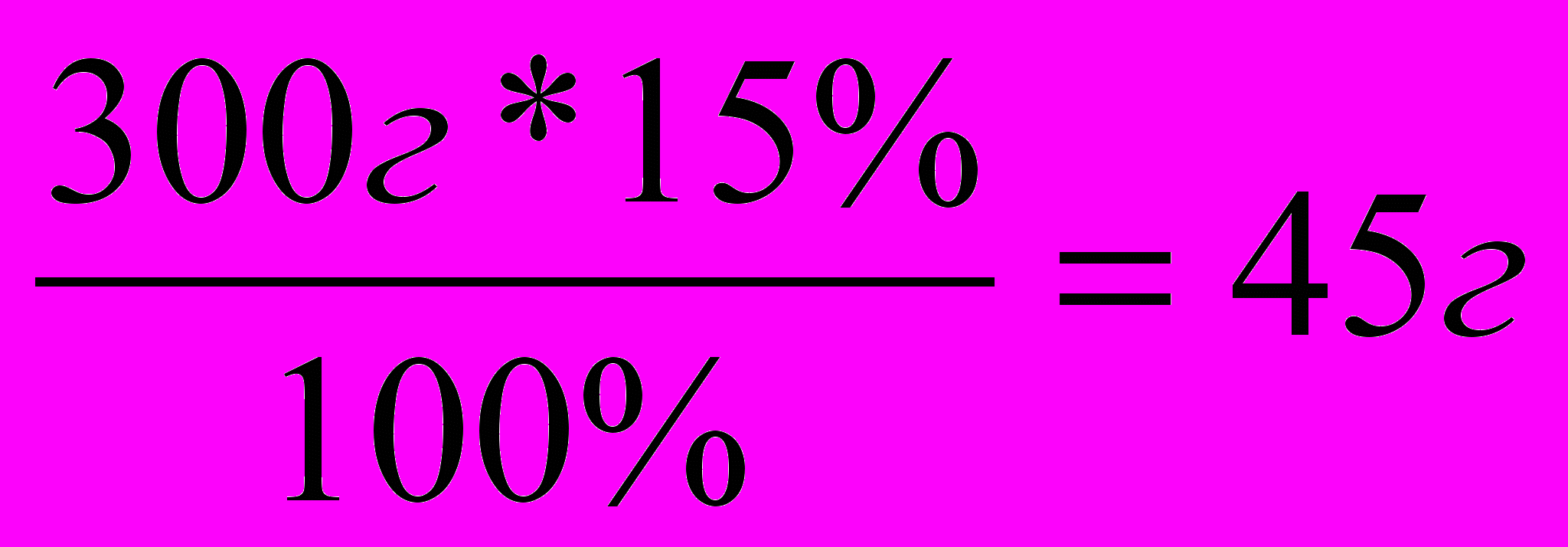 mр-ра2=mр-ра1+m(Н2О)= 300+250=550г ω%=  = =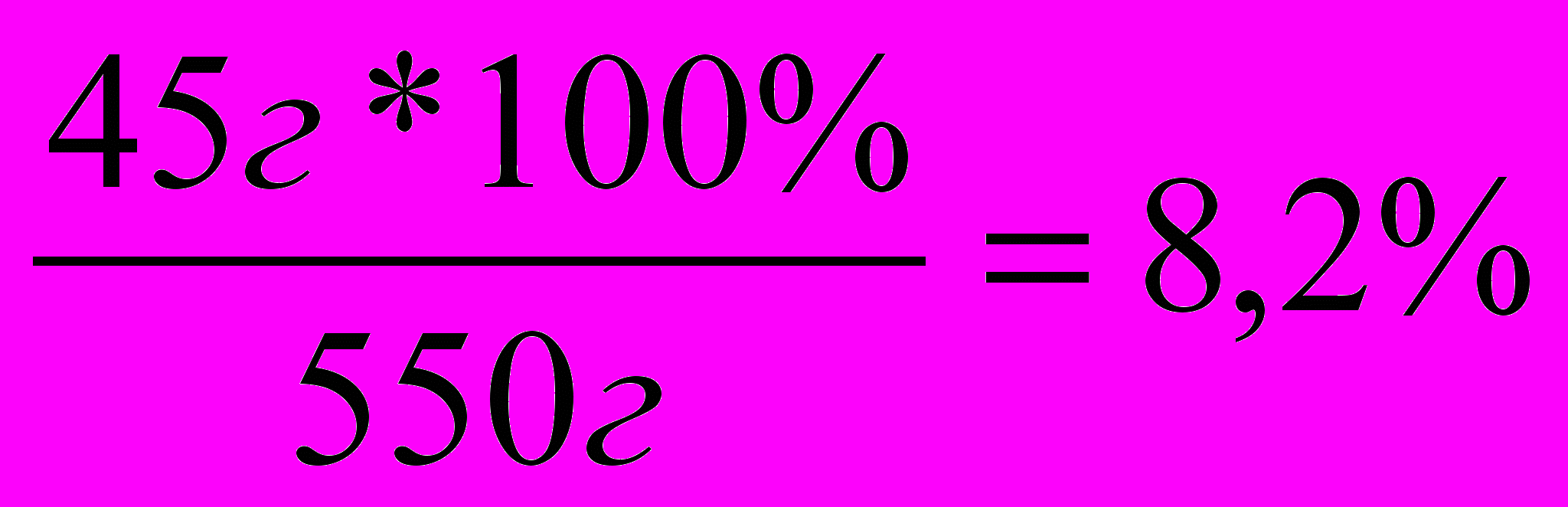 2 способ. 15% 0% х% 300г +250г =550г 300*15 + 250*0 = 550х 4500=550х х=8,18% Ответ: ω%2=8,2% |
Задача 2.
Сколько Н2О необходимо прибавить к 200 мл 20% р-ра Н2SO4 (ρ=1,14), чтобы получить 5% р-р?
| Д  ано: ано:Vр (Н2SO4)=200мл ρ=1,14г/мл ω1=20% ω2=5%  m(Н2О)=? | 1 способ. mр1(Н2SO4)= V*ρ=200*1,14=228(г) mв-ва= 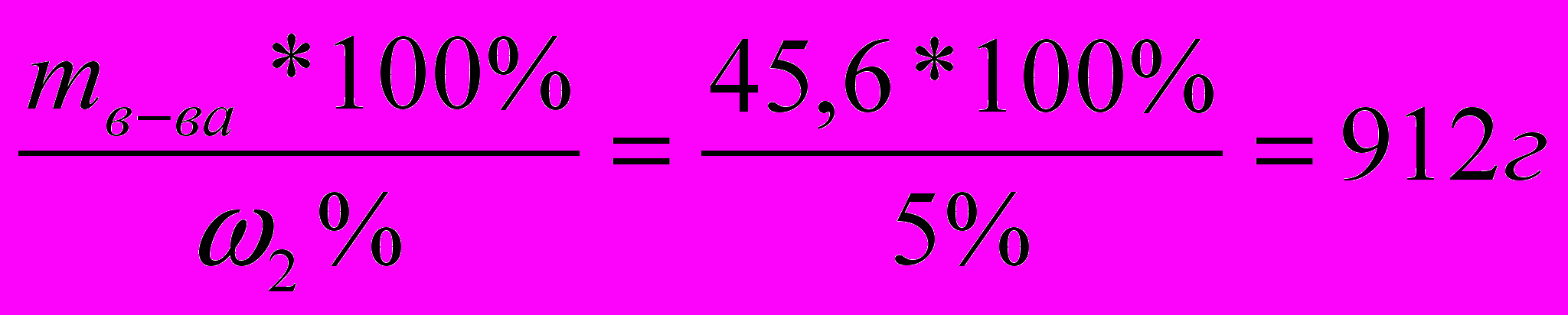 m(Н2О)доп= mр-ра2 – mр-ра1=912 – 288=684г. 2 способ. 20% 0% 5% 228 + х = 228 + х 228*20 + х*0 = (228 + х)*5 4560 = 1140 + 5х 5х =3420 х = 684 3 способ. Диагональная схема («правило креста») В точке пересечения двух прямых обозначают концентрацию смеси, у концов этих прямых по левую сторону от точки пересечения указывают концентрации составных частей смеси, а по другую – разности концентраций смеси и её составных частей. 2  0% 5частей – это 228 г 0% 5частей – это 228 г5% 0% 15частей – это х г m(Н2О)=228:5*15=684г Ответ: масса воды 684 г. |
Задача 3.
Сколько гр. КСl следует, добавить к 450 г 8% р-ра той же соли для получения 12% р-ра?
| Д  ано: ано:mр-ра1=450г ω%1=8% ω%2=12%  m (КСl)доп=? | 1 способ. 8% 100% 12% 450г + хг = 450 + х 450*8+ 100х = (450 + х)*12 3600 + 100х = 5400 + 12х 88х =1800 х=20,45 2 способ. 8  % 88ч. – это 450г % 88ч. – это 450г12% 100% 4ч. – это хг m(КСl)=450:88*4=20,45 (г) Ответ: надо добавить 20,45 г соли |
Задача 4.
Сколько литров 2,5% раствора NaOH (ρ=1,03) можно приготовить из 80 мл 35% раствора (ρ=1,38)?
| Д  ано: ано:Vр-ра1(NaOH)=80 мл ρ1=1,38 ω%1=35% ω%2=2,5% ρ2=1,03  Vр-ра2=? | mр-ра1= V* ρ=80*1,38=110,4 (г) 1 способ. 35% 0% 2,5% 110,4г +хг = 110,4 +х(г) 110,4*35 +х*0 = (110,4 +х)*2,5 3864 = 276 + 2,5х 2,5х = 3588 х=1435,2 (г) - m(Н2О) mр-ра=mр-ра1 + m(Н2О)доб= 110,4 + 1435,2=1545,6 (г) Vр-ра2= 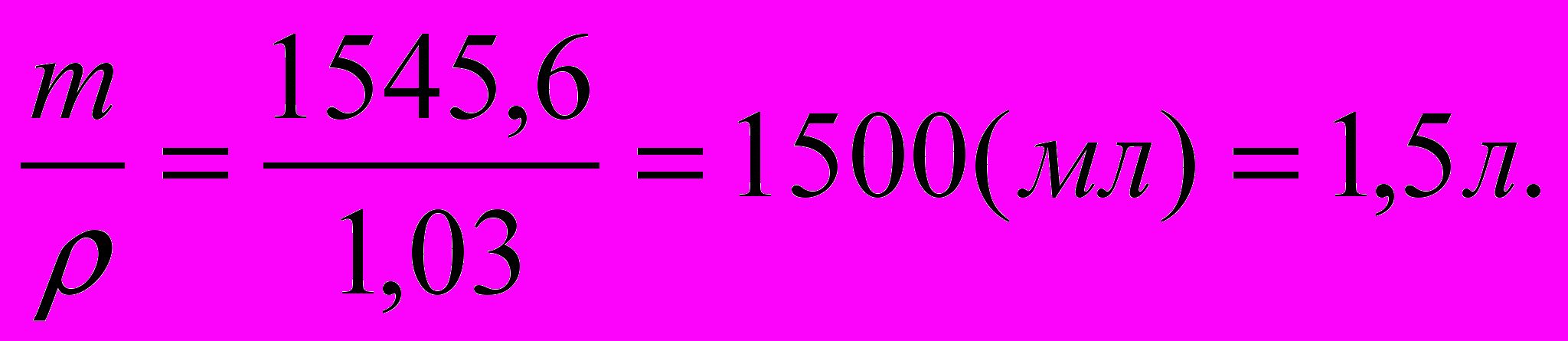 2 способ. 3  5% 2,5част. – 110,4г 5% 2,5част. – 110,4г2,5% 0% 32,5част. – хг m(Н2О)доб=110,4:2,5*32,5=1435,2 (г) mр-ра2=1545,6 (г); Vр-ра2=1500(мл)=1,5 (л) Ответ: можно получить 1,5 л 2,5% р-ра |
Задача 5.
Сколько граммов 30% раствора гидроксида К надо прибавить к 200 г 90% р-ра, чтобы получить 50% раствор?
| Д  ано: ано:mр-ра1=200г ω%1=90% ω%2=30% ω%3=50%  mр-ра2=? | 1 способ 90% 30% 50% 200г +хг = 200 + х(г) 200*90 +30х = (200 + х)*50 30х + 18000=10000 +50х 20х=8000 х=400 2 способ. 9  0% 20 част. – 200г 0% 20 част. – 200г50% 30% 40 част. – х г mр-ра2=200:20*40=400(г) Ответ: 400г 30% р-ра |
Задача 6.
Сколько граммов 20% и 50% растворов одного вещества потребуется для приготовление 1 кг 30% раствора.
| Д  ано: ано:ω%1=20% ω%2=50% ω%3=30% mр-ра3=1000г  mр-ра1=? mр-ра2=? | 1 способ. 20% 50% 30% хг + 1000 – х =1000 20х + (1000 – х)*50 =1000*30 20х +50000 – 50х=30000 30х=20000 х=667(г) m1(20% р-ра) mр-ра2=1000 – 667=333 (г) 2  способ. способ.2  0% 20 част. – хг 0% 20 част. – хг30% 50% 10 част. – уг 30 част. – 1000г. mр-ра1=1000:30*20=667(г) mр-ра2=1000:30*10=333(г) Ответ: 667г, 333г. |
Задача 7.
К 250 г 10% раствора кислоты добавили 500 г р-ра этой же кислоты неизвестной концентрации и получили 25% раствор. Определить концентрацию добавленного р-ра.
| Д  ано: ано:mр-ра1= 250г ω%1=10% mр-ра2= 500г ω%3=25%  ω%2=? | 10% х% 25% 250г + 500г = 750г 250*10 + 500х = 750*25 2500 + 500х = 18750 500х = 162500 х = 32,5 Ответ: 32,5% |
Задача 8.
Смешали 2л 60% H2SO4 (ρ=1,5 г/моль) и 3л 14% раствора (ρ=1,1 г/моль). Найти процентное содержание H2SO4 в полученном растворе.
| Д  ано: ано:V1=2л ω%1=60% ρ1=1,5 г/мл V2=3л ω%2=14% ρ2=1,1 г/мл ω  %3=? %3=? | mр-ра1= V1* ρ1= 2000мл *1,5 г/моль=3000г=3кг mр-ра2= V2* ρ2=3000мл*1,1г/моль=3300г=3,3кг 60% 14% х% 3кг + 3,3кг = 6,3кг 3*60 + 3,3*14 = 6,3х 180 + 46,2 = 6,3х 6,3кг = 226,2 х = 35,9% Ответ: 35,9% |
Задача 9.
Сколько граммов 3% раствора MgSO4 можно приготовить из 100г MgSO4·7Н2О? (горькая соль)
| Д  ано: ано:m(MgSO4*7Н2О)=100г ω%=3%  mр-ра(MgSO4)=? |
М(MgSO4) = 120г/моль М(MgSO4*7Н2О) = 246г/моль Берем образец кристаллогидрата количеством вещества 1 моль → m(MgSO4) = 120г/моль; m(MgSO4*7Н2О) = 246г/моль Находим массу MgSO4 в 100г кристаллогидрата в 246г – 120г MgSO4 в 100г – хг MgSO4 m(MgSO4) = 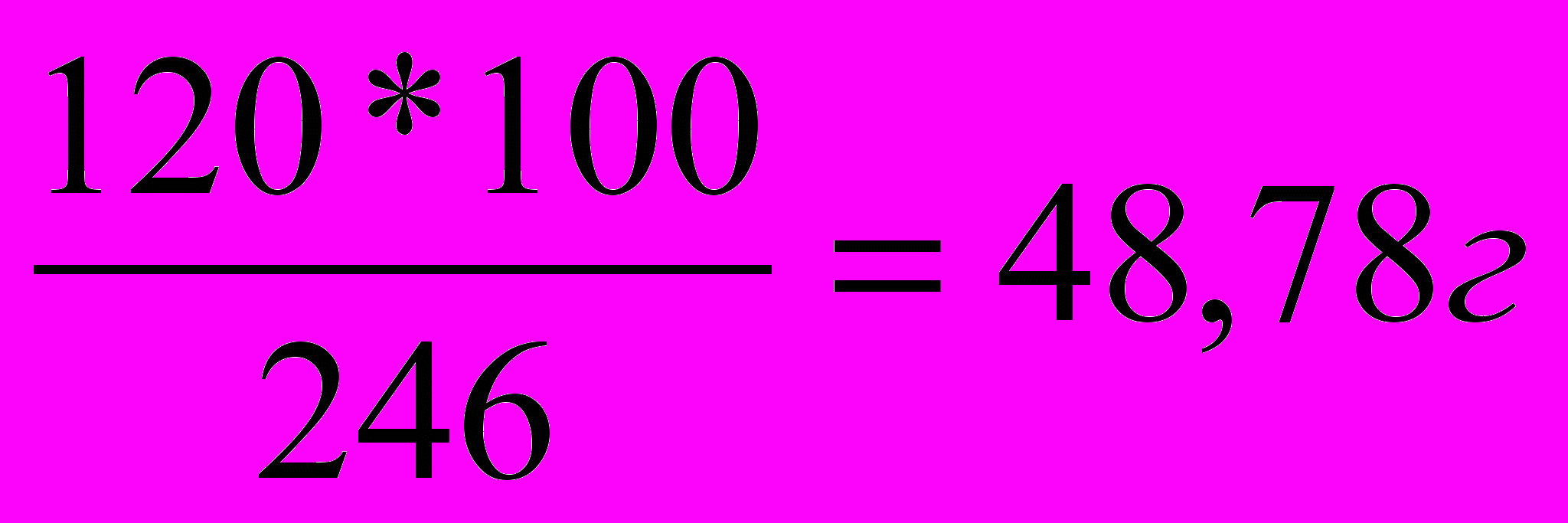 ω%( MgSO4)= 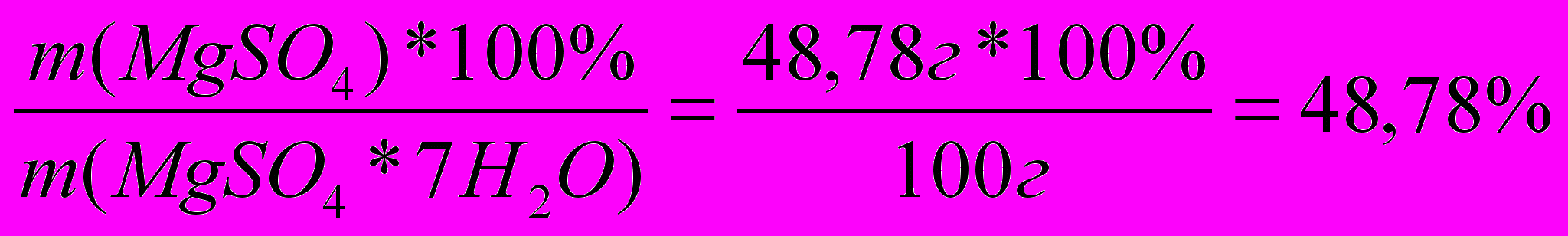 2. 1 способ. 48,78% 0% 3% 100г + (х -100) = х 100*48,78 + (х -100)*0 = 3х 3х = 48,78 х = 16,26г 2 способ. 4  8,78% 3 части – 100г 8,78% 3 части – 100г3% 0% 45,78 част. – хг m(Н2О) = 100:3*45,78 = 1526(г) mр-ра= m(Н2О) + mв-ва=1526 + 100 = 1626 (г) Ответ: масса 3% р-ра 1626г. |
Задача 10.
820г 40% раствора NaOH упарили. При этом испарили 150г Н2О. Найти ω% полученного р-ра.
| Д  ано: ано:mр-ра1=820г ω%1=40% mвып(Н2О)=150г ω  %2=? %2=? | 40% 0% х% 820г - 150г =670г 820*40 – 150*0 =670х 670х = 32800 х = 48,9 Ответ: ω%2=48,9% |
Задача 11.
Сколько граммов Na2SO4*10H2O следует растворить в 250 г Н2О для получения раствора, содержащего 5% безводной соли (глауберова соль).
| Д  ано: ано:m(Н2О)=250г ω%=5%  m(глауб.соли)=? | Образец ν=1моль М(Na2SO4)=142г/моль М(Na2SO4*10H2O)=322г/моль m(Na2SO4)=142г; m(Na2SO4*10H2O)=322г. ω%( Na2SO4)= 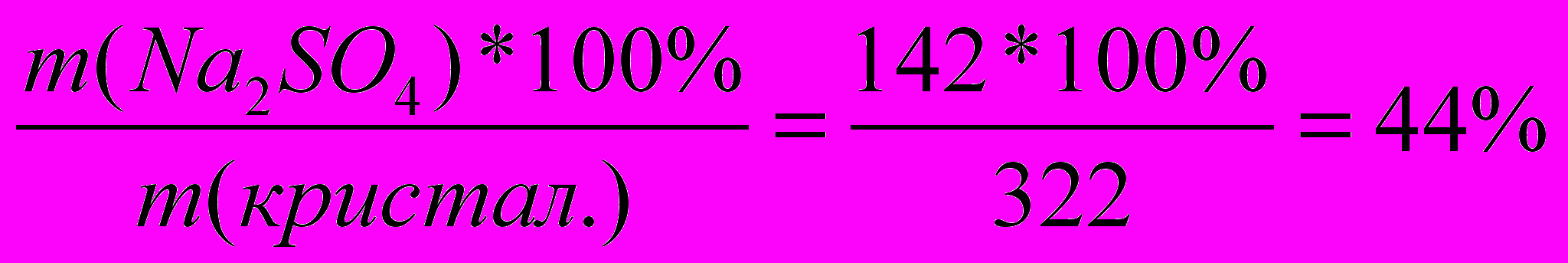 1 способ. 44% 0% 5% хг +250г = (250 + х)г 44х +250*0 = (250 + х)*5 44х = 1250 + 5х 39х = 1250 х=32 2 способ.  44% 5част. – хг 44% 5част. – хг5% 0% 39част. – 250г. m(глауб.соли)=250:39*5=32г Ответ: масса глауб.соли 32г. |
Задача 12.
Какое количество буры (Na2B4O7*10H2O) и воды надо взять для приготовления 3 кг раствора, содержащего 4% безводной соли.
| Д  ано: ано:mр-ра=3 кг ω%=4%  m(буры); m(Н2О)=? | Образец ν=1моль М(Na2B4O7)=202г/моль М(Na2B4O7*10H2O)=382г/моль m(Na2B4O7)=202г; m(Na2B4O7*10H2O)=382г. ω%( Na2B4O7*10H2O )= 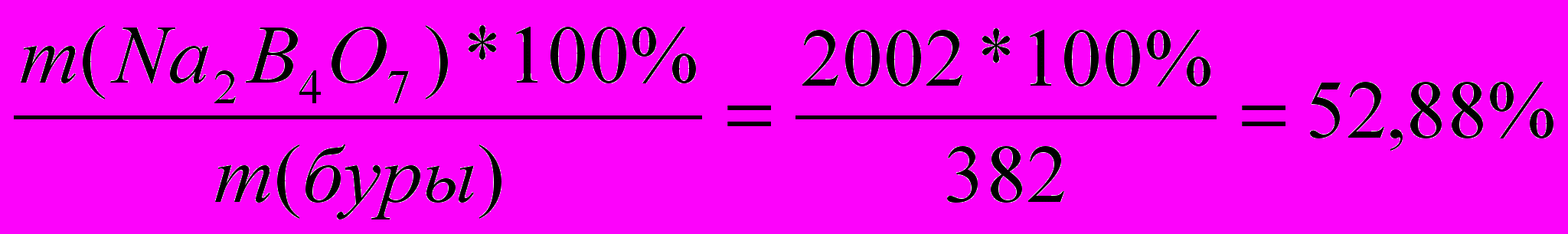 1 способ. 52,88% 0% 4% хг + (3-х) = 3 52,88х + (3-х)*0 = 12 52,88х = 12 х = 0,23 m(буры) = 0,23кг. m (Н2О) = mр-ра – m(буры) = 3 – 0,23 = 2,77 (кг) 2  способ. способ.5  2,88% 4 части – хкг 2,88% 4 части – хкг4% 0% 48,88части – укг 52,88 частей – 3кг. m(буры)=3:52,88*4 = 0,32 (кг) m (Н2О) = 3:53,88*48,88 = 2,77 (кг) Ответ: масса буры 0,23 кг, масса воды 2,77кг. |
Задача 13.
Сколько молей MnSO4*5H2O следует прибавить к 100 молям Н2О для получения раствора, содержащегося 20% безводной соли.
| Д  ано: ано:ν(Н2О)=100моль ω%=20%  ν(MnSO4*5H2O)=? | Образец ν=1моль М(MnSO4)=151г/моль М(MnSO4*5H2O)=241г/моль m(MnSO4)=151г; m(MnSO4*5H2O)= 241г. ω%( MnSO4)= 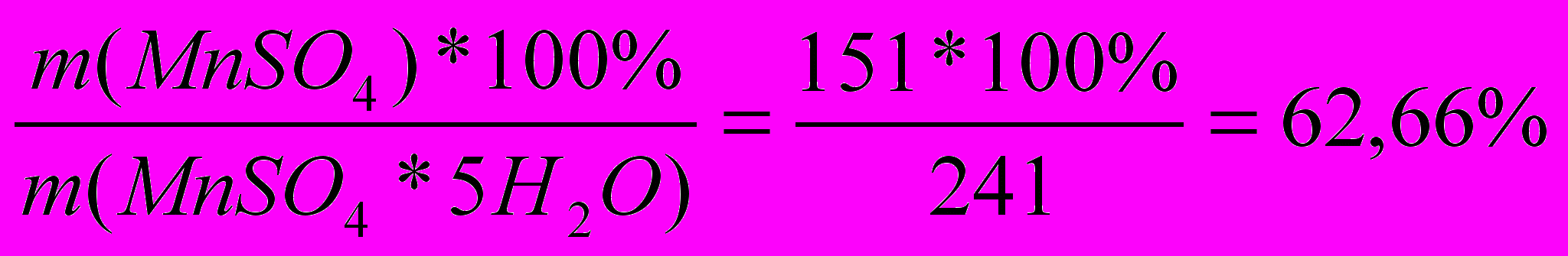 m(Н2О)= ν*М= 100 моль*18г/моль = 1800 (г) 1способ. 62,66% 0% 20% хг – 1800г = (х + 1800)г 62,66х – 1800*0 = (х + 1800)*20 62,66х = 20х + 36000 42,66х = 36000 х = 843,88 ν(кристаллогид.) = 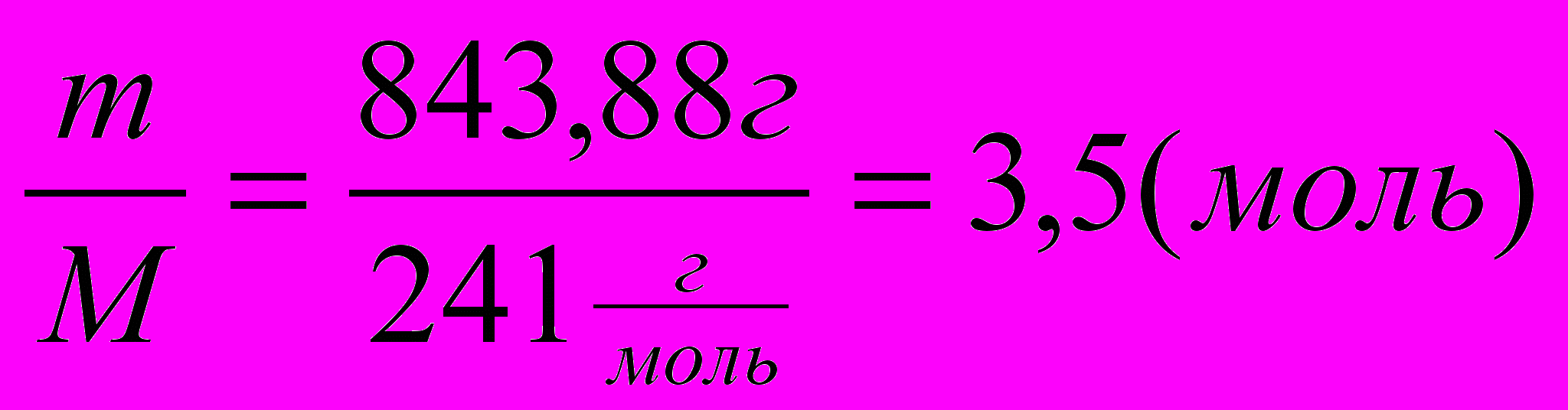 2 способ. 6  2,66% 20 част – хг 2,66% 20 част – хг20% 0% 42,66 част. – 1800г m(кристалл.) = 1800:42,66*20 = 843,88(г) ν(крист.) = 3,5моль Ответ: ν(MnSO4*5H2O)=3,5 моль |
Задача 14.
Сколько граммов железного купороса (FeSO4*7H2O) необходимо для приготовления 500г 7% р-ра безводной соли?
| Д  ано: ано:mр-ра=500г ω%=7%  m(FeSO4*7H2O)=? | Образец ν=1моль М(FeSO4)=152г/моль М(FeSO4*7H2O)=278г/моль m(FeSO4)=152г; m(купороса)=278г. ω%( FeSO4)= 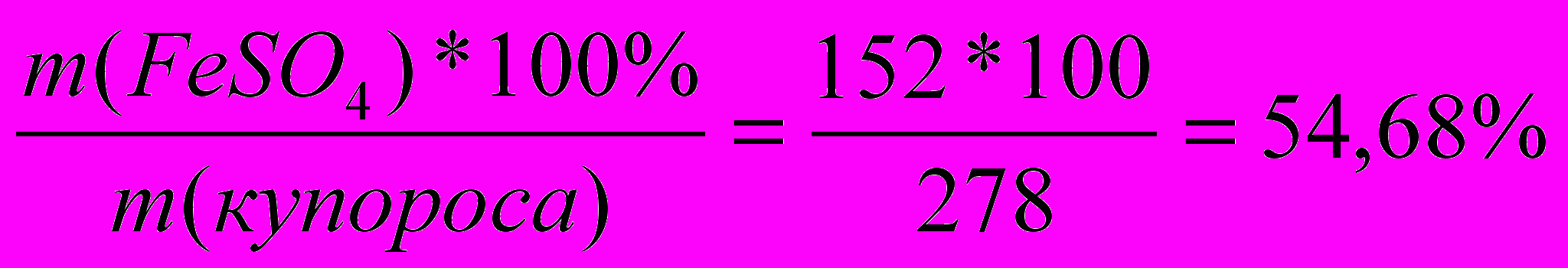 1способ. 54,68% 0% 7% хг + (500 –х)г = 500г 54,68х + (500 –х)*0 = 500*7 54,68х = 3500 х = 64 2  способ способ 5  4,68% 7част – хг 4,68% 7част – хг7% 0% 47,48част 54,68 частей – 500г m(FeSO4*7H2O)=500:54,68*7 = 64(г) Ответ: масса железного купороса 64 г |
Задача15.
При упаривании раствора сульфата натрия соль выделяется в виде кристаллогидрата Na2SO4*10H2O. Какую массу кристаллогидрата можно получить из раствора объемом 200 мл с массовой долей сульфата Na 15% (ρ=1,14 г/моль)?
| Д  ано: ано:Vр-ра=200 мл ρ=1,14 г/мл ω%1=15%  m(глауб.соли)=? | Образец ν=1моль М(Na2SO4)=142г/моль М(Na2SO4*10H2O)=322г/моль m(Na2SO4)=142г; m(Na2SO4*10H2O)=322г. ω%( Na2SO4)= 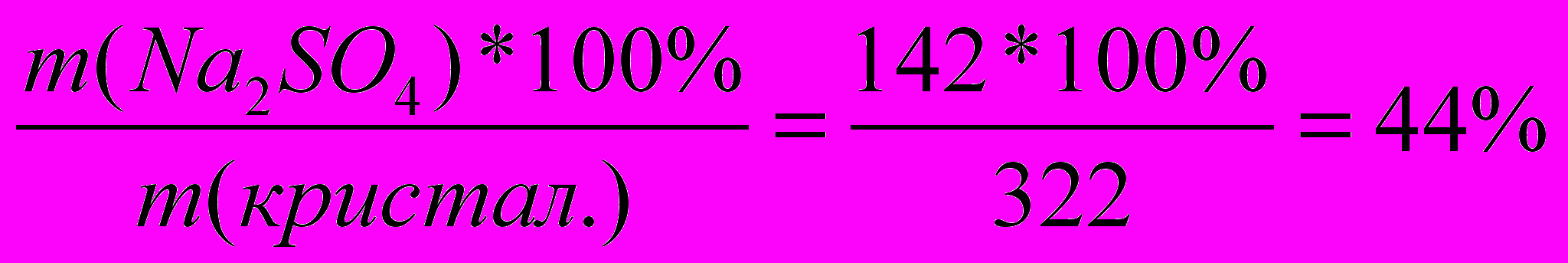 mр-ра=200мл*1,14 г/моль= 228(г) 15% 0% 44% 228г – (228 – х)г = хг 228*15 – (228 – х)*0 = 44х 44х = 3420 х = 77,7г. Ответ: масса глауб.соли 77,7 г. |
Задача 16.
Какую массу медного купороса CuSO4*5H2O и воды надо взять для приготовления р-ра сульфата Cu(II) массой 40кг с массовой долей CuSO4 2%.
| Д  ано: ано:mр-ра=40кг ω%=2%  m(H2O)=? m(купороса)=? | Образец ν=1моль М(CuSO4)=160г/моль М(CuSO4 *5H2O)=250/моль m(CuSO4)=160г; m(Na2SO4*10H2O)=250г. ω%( CuSO4)= 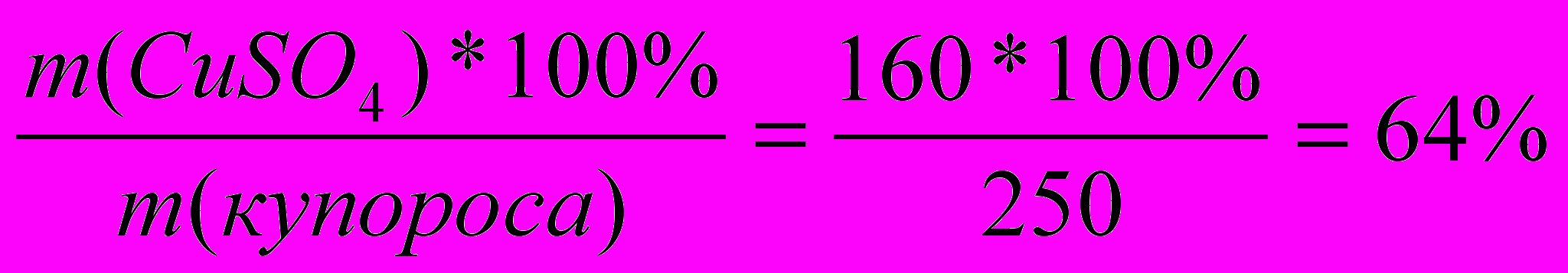 1 способ. 64% 0% 2% хг + (40 – х)кг = 40кг 64х + (40 – х)*0 = 40*2 64х = 80 х = 1,25кг m(купороса) = 1,25 кг m(H2O) = mр-ра – m(купороса) = 40 – 1,25 = 38,75 (кг) 2 способ. 6   4% 2 части - хкг 4% 2 части - хкг2% 0% 62 части – укг 64 части – 40кг. m(CuSO4*5H2O)= 40:64*2 = 1,25 (кг) m(H2O)= 40:64*62 = 38,75 (кг)  Ответ: масса купороса 1,25 кг, масса воды 38,75 кг |
Задача 17.
В воде массой 40г растворили железный купорос FeSO4*7H2O массой 3,5г. Определить массовую долю сульфата Fe(II) в полученном растворе.
| Д  ано: ано:m(H2O) = 40г m(купороса) = 3,5г  ω%( FeSO4)=? | М(FeSO4)=152г/моль М(FeSO4*7H2O)=278г/моль ν(купороса) = 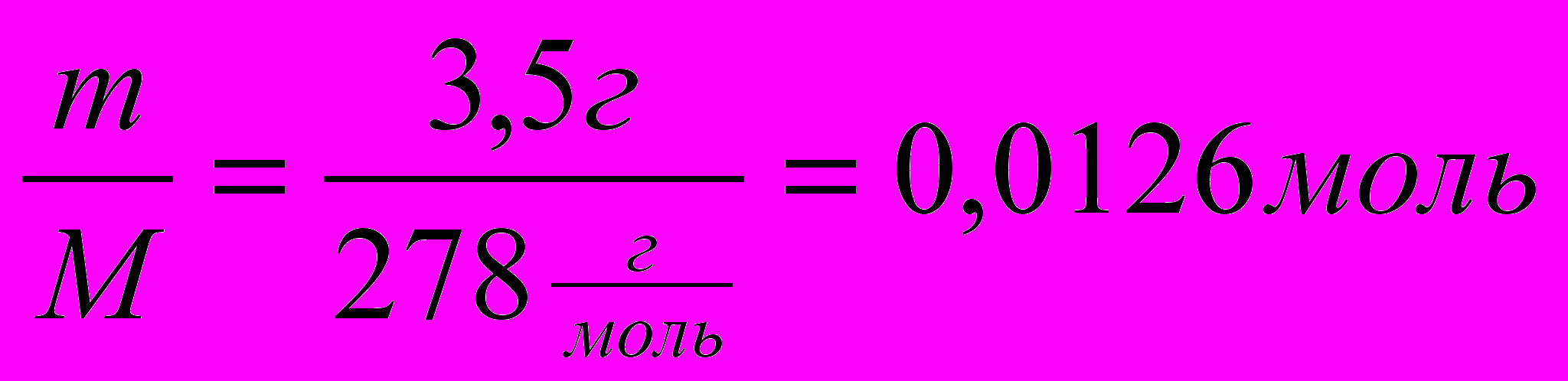 ν(FeSO4) = ν(купороса) =0,0126 моль m(FeSO4) = ν*М = 0,0126 моль*152г/моль=1,9(г) ω%( FeSO4)= 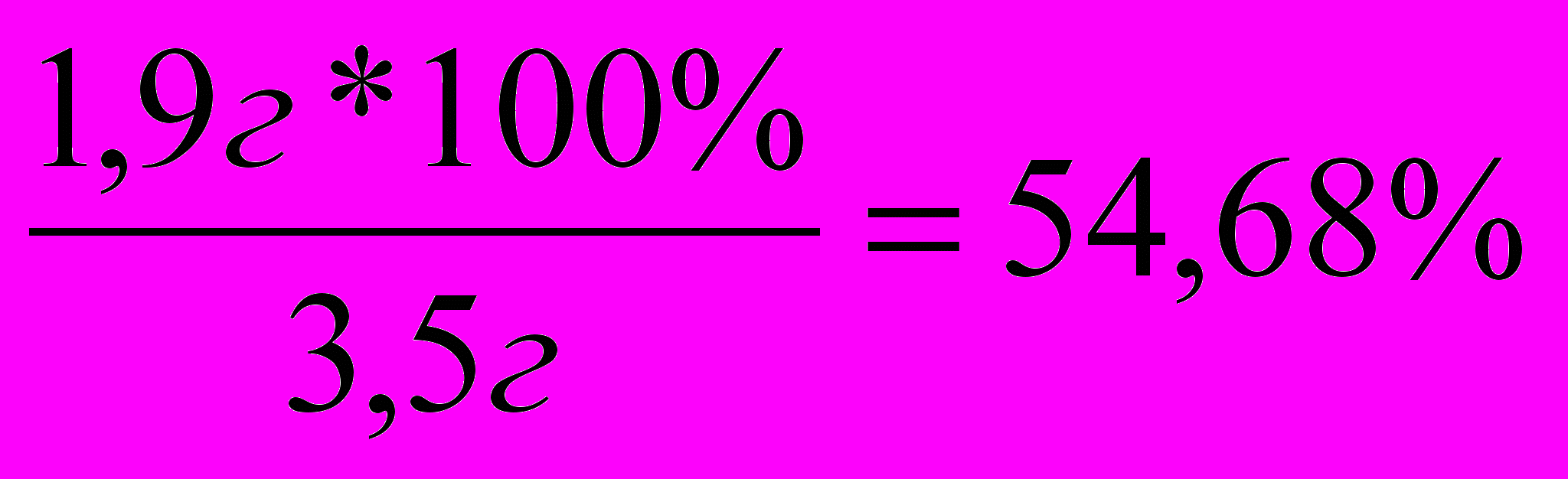 0% 54,68% х% 40г + 3,5г = 43,5г 40*0 + 3,5*54,68 = 43,5х 43,5х = 191,38 х = 4,4% Ответ: массовая доля FeSO4 в растворе 4,4% |
Задача18.
Определить массу раствора с массовой долей карбоната натрия 0,1 и массу кристаллогидрата Na2CO3*10H2O, которые надо взять для приготовления раствора массой 540г с массовой долей Na2CO3 0,15.
| Д  ано: ано:ω%1(Na2CO3)=0,1 ω%2(Na2CO3)=0,15 mр-ра2=540г  mр-ра1=? m(соды)=? | Образец ν=1моль М(Na2CO3)=106г/моль М(Na2CO3*10H2O)=286г/моль m(Na2CO3)=106г; m(соды)=286г. ω%( Na2CO3)= 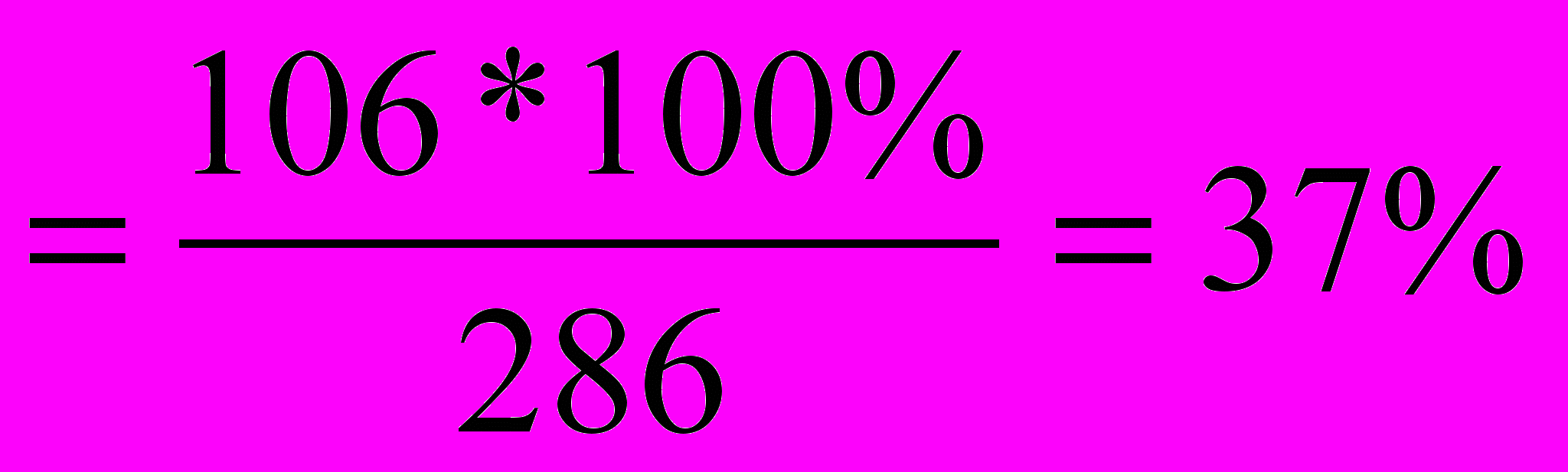 в соде. 1 способ. 10% 37% 15% хг + (540 – х)г = 540г 10х + (540 – х)*37 = 540*15 10х +19980 – 37х = 8100 27х = 11880 х = 440 m(10% р-ра Na2CO3) = 440г m(соды) = mр-ра2 - mр-ра1 = 540 – 440 = 100г 2 способ.   37% 5 частей – хг 37% 5 частей – хг15% 10% 22 частей - уг 27 частей - 540г m(соды) = 540:27*5 = 100(г) mр-ра1 = 540:27*22 = 440(г) Ответ: масса 10% р-ра 440г, масса соды 100г. |
Задача 19.
Определить массу кристаллогидрата Cr2(SO4)3*18H2O и раствора с массовой долей Cr2(SO4)3 0,15, которые надо взять для приготовления раствора с массовой долей сульфата Cr(III) 0,2 массой 795г.

| Дано: ω%1=0,15 ω%2=0,2 m  р-ра2= 795г р-ра2= 795г m(кристаллог.) mр-ра1=? | Образец ν=1моль М(Cr2(SO4)3)=392г/моль М(Cr2(SO4)3*18H2O)=716г/моль m(Cr2(SO4)3)=392г; m(крист.)=716г. ω%( Cr2(SO4)3)= 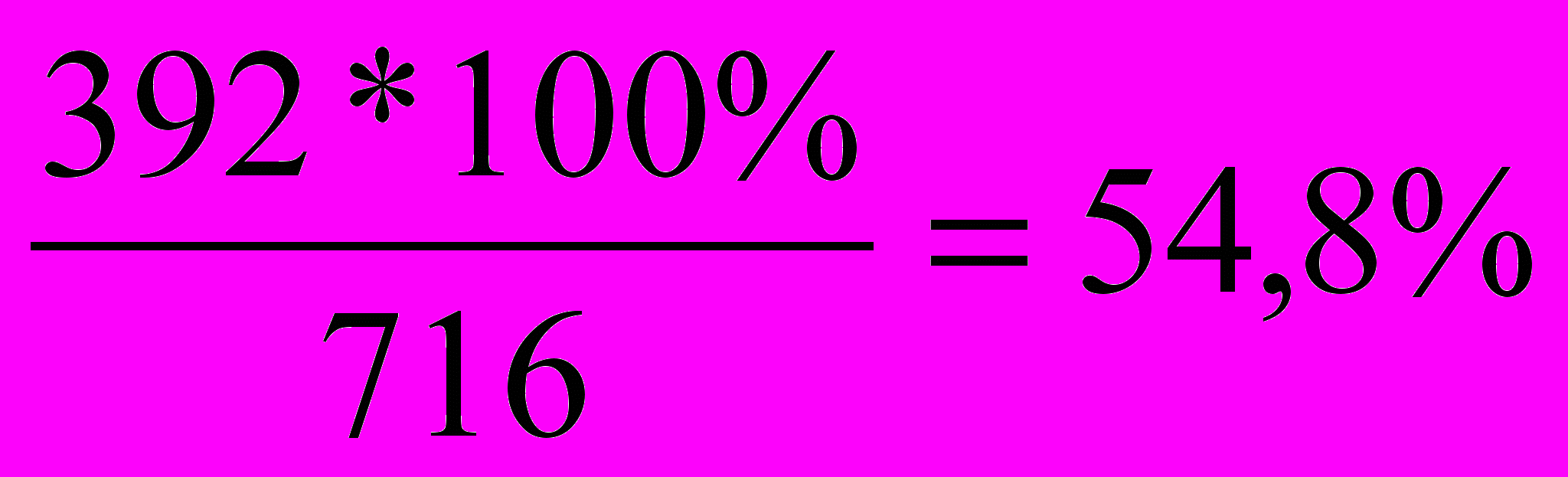 в крист. 1 способ. 54,8% 15% 20% хг + (795 – х)г = 795г 54,8х + (795 – х)*15 = 795*20 54,8х + 11925 – 15х = 15900 39,8х = 99,87≈100г m(крист.)= 100г mр-ра1=795 – 100 = 695 (г) 2 способ.   54,8% 5 част. – хг 54,8% 5 част. – хг20% 15% 34,8 част. – уг. 39,8 част. – 795г m(крист.)= 795:39,8*5 = 100(г) mр-ра1=795:39,8*34,8 = 695 (г) Ответ: масса кристаллогидрата 100г, масса 15% раствора 695г. |
^ Задачи для самостоятельного решения.
1. Определите массовую долю (в%) хлорида Na в растворе, если в 500г H2O растворено 125г соли. (20%)
2. В 1 л воды растворено 2 моль NaOН. Определите ω% NaOН в растворе. (7,4%)
3. Определите ω% NН3 в растворе, полученном при растворении 112л NН3(н.у) в 315 мл H2O. (21,2%)
4. Сколько граммов НNO3 содержится в 200 мл 40% раствора плотностью 1250 кг/м3?
(160г)
5. Определите ω% Cа(NO3)2 в растворе, полученном при смешивании 300г 10% р-ра и 500г 20% р-ра Cа(NO3)2. (16,25%)
6. К 300 мл 40% р-ра НNO3 ((ρ=1250 кг/м3) прилили 125 мл H2O. Определите ω% НNO3 в полученном растворе. (30%)
7. Сколько граммов хлорида К содержится в 750 мл 10% р-ра (ρ=1,063 г/мл)? (79,7г)
8. Сколько граммов йода и спирта надо взять для приготовления 500г 5% йодной настойки?
(25г I2; 475г C2H5OH)
9. Сколько граммов медного купороса нужно взять, чтобы приготовить 5л 8% раствора CuSO4 (ρ=1,084 г/мл)? (678,3г)
10. Сколько граммов 20% едкого натра надо добавить к 0,5 л воды, чтобы получить 5% раствор? (166,7г)
11. Сколько миллилитров H2O надо добавить к 500г 25% р-ра вещества, чтобы получить 10% раствор? (750мл)
12. Какой объем 15% р-ра NaOH (ρ=1,16 г/мл) можно приготовить из 2 л 33% раствора (ρ=1,36 г/мл)? (5,16л)
13. Сколько граммов KCl нужно растворить в 450г 15% раствора KCl, чтобы получить 25% раствор? (60г)
14. Какие объемы 60% Н2SO4 (ρ=1,1 г/мл) второй раствор нужно смешать, чтобы получить 10л 27% раствора (ρ=1,2 г/мл)? (2,25л; 7,75л)
15. Сколько воды необходимо прибавить к 500 мл 20% р-ра NaCl (ρ=1,152 г/мл), чтобы получить 4,5% р-р? (1988г)
16. К 950 г H2O прибавить 50мл 48% раствора Н2SO4 (ρ=1,38 г/мл). вычислите процентное содержание Н2SO4 в полученном растворе. (3,25%)
17. Какой объем р-ра Н2SO4 (ρ=1,8 г/мл) с ω%=88% надо взять для приготовления раствора кислоты объемом 300мл и плотностью 1,3г/мл с массовой долей Н2SO4 40%? (98,5мл)
18. К раствору Н2SO4 объемом 400мл (ρ=1,1г/мл) и ω%=15% добавили воду массой 60г. Определить массовую долю Н2SO4 в полученном растворе. (13,2%)
19. В лаборатории имеется раствор с массовой долей NaOH 30% (ρ=1,33 г/мл). Какой объем этого раствора надо взять для приготовления раствора объемом 250мл с массовой долей NaOH 14% (ρ=1,15 г/мл)? (100,9мл)
20. К раствору массой 250г, массовая доля соли в котором составляет 10%, прили воду объемом 150мл. Определить ω% соли в полученном р-ре. (6,25%)
21. В H2O объемом 200мл растворили образец соли, получив раствор с ω%=20%. К этому р-ру еще добавили H2O объемом 150мл. Определить ω% соли в полученном р-ре. (12,5%)
22. Какую массу раствора карбоната К с ω%=40% надо прибавить к воде массой 500г для получения 15% р-ра К2CO3? (300г)
23. Какую массу 20% раствора NaCl необходимо добавить к воде объемом 40мл для получения 6% раствора NaCl? (17,1)
24. Через 1 л раствора NН3 с массовой долей 10% (ρ=0,96 г/мл), пропустили 10л NН3(н.у). Вычислить ω% NН3 в образовавшемся растворе. (16,6%)
25. В 1000 граммах воды растворили 219г кристаллогидрата CaCl2*6H2O. Определите массовую долю хлорида Са в полученном растворе. (9,1%)
26. Кристаллогидрат CоCl2*6H2O массой 476 растворили в H2O. При этом получился раствор с массовой долей CоCl2 13,15%. Определить массу воды, которая пошла на растворение. (1501г)
27. Сколько кристаллогидрата FeSO4*7H2O необходимо взять, чтобы приготовить 10кг. 5% раствора FeSO4? (914г)
^ МУНИЦИПАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СЯСЬСТРОЙСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №2»
ВОЛХОВСКОГО МУНИЦИПАЛЬНОГО РАЙОНА
ЛЕНИНГРАДСКОЙ ОБЛАСТИ
^
Презентация элективного курса
«Решение расчётных задач по химии»
на ярмарке элективных курсов.
Подготовил: учитель химии
Бочкова
Ирина Анатольевна
г.Сясьстрой
2008г.
I. Цели и задачи:
Заинтересовать учащихся в выборе химико-биологического профиля;
Помочь учащимся подготовиться к выбранному профилю;
Показать необходимость умения решать задачи для успешного усвоения теоретического материала;
Подвести учащихся к ответу на вопросы: «Могу ли я?», «Хочу ли я?», «Нужна ли мне химия?»
II. План лекции:
1. Актуализация темы.
2. Основные типы расчётных задач по уравнению реакции:
а) нахождение массы продукта реакции по известной массе одного из исходных веществ;
б) нахождение массы продукта реакции, если исходное вещество содержит примеси;
в) нахождение массы продукта реакции, если дан объём раствора исходного вещества с определенной массовой долей и плотностью;
г) определение выхода продукта реакции от теоретически возможного выхода;
д) вычисление по уравнению реакции, если одно из исходных веществ
прореагировало полностью.
III. Содержание лекции:
Школьный курс химии включает большой теоретический материал. На расчётные задачи отводится очень мало времени. Умение решать задачи является основным показателем творческого усвоения предмета. Кроме того, решение задач при изучении теории позволяет значительно лучше разобраться в ней и усвоить наиболее сложные вопросы.
Данный курс является первой ступенью для успешного участия в районных и областных олимпиадах юных химиков, для подготовки к сдаче выпускных экзаменов по химии и поступления в высшие учебные заведения химического, фармацевтического и медицинского профиля.
^ Основные типы расчетных задач за курс средней школы:
- Нахождение m продукта реакции по известной m одного из исходных веществ.
Какая масса Cu(OН)2 выпадет в осадок, если в реакцию с CuSO4 вступило 160г NaOH?
| Д  ано: ано:m(NaOH)= 160г  m(Cu(OН)2)=? |
М(NaOH)= 40г/моль 2. 4 моль х моль 2 NaOH+ CuSO4→ Cu(OН)2 ↓+ Na2SO4 2моль 1 моль ν(Cu(OН)2)= 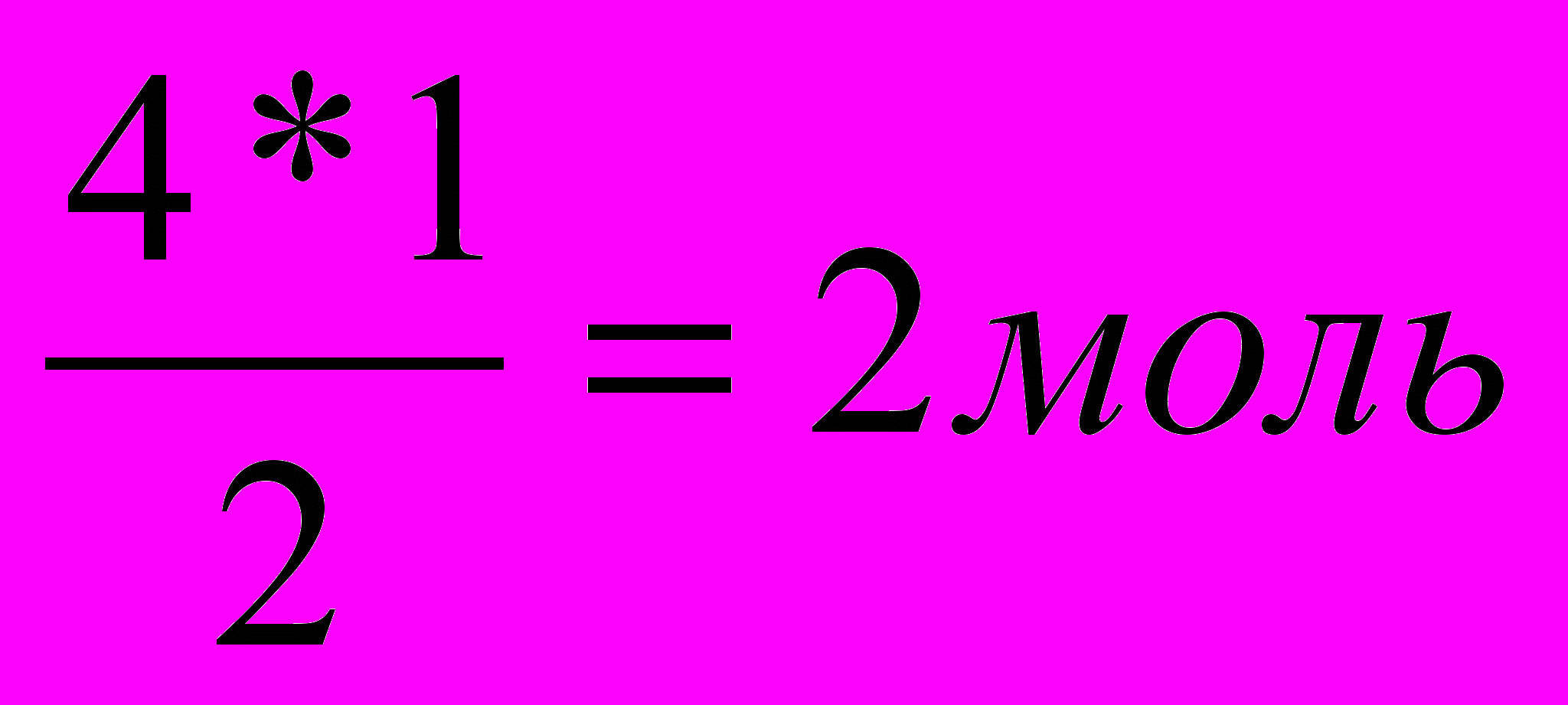 3. m(Cu(OН)2)=М* ν= 98г/моль*2моль = 196г М(Cu(OН)2)=64+32+2=98г/моль Ответ: масса Cu(OН)2 196г. |
- ^ Нахождение массы продукта реакции, если исходное вещество содержит примеси.
Какая масса Cu(OН)2 выпадет в осадок , если в реакцию с CuSO4 вступил р-р NaOH массой 1067г и массовой долей 15%.
| Д  ано: ано:mр-ра(NaOH)=1067г ω%=15%  m(Cu(OН)2)=? | 1.m(NaOH)= 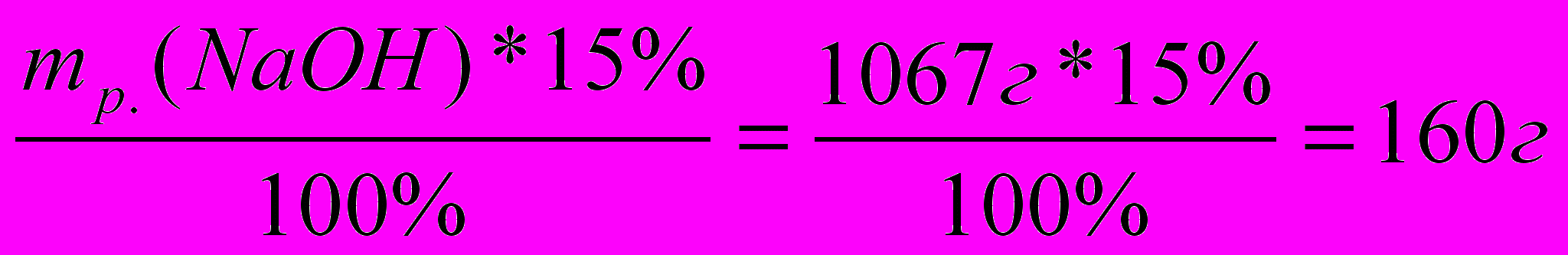 2. |
- Нахождение массы продукта реакции, если дан V раствора исходного вещества с определенной ω% и ρ.
Какая масса Cu(OН)2 выпадает в осадок при взаимодействии 928 мл 15% р-ра NaOH (ρ=1,15 г/мл) с CuSO4?
| Д  ано: ано:Vр-ра(NaOH)=928 мл ρр(NaOH)=1,15г/мл ω%( NaOH)=15%  m(Cu(OН)2)=? |
mр-ра(NaOH)=928мл*1,15г/мл=1067г 2. |
- Определение выхода продукта реакции от теоретически возможного.
Определите выход Cu(OН)2, если при взаимодействии 928мл 15% р-ра NaOH (ρ=1,15 г/мл) с CuSO4, выпал осадок Cu(OН)2 массой 180г.
| Д  ано: ано:Vр-ра(NaOH)=928 мл ρр(NaOH)=1,15г/мл ω%( NaOH)=15% mпр.(Cu(OН)2)=180г   η (Cu(OН)2)=? |
|
- Задачи на недостаток и избыток исходных веществ.
а) Какая масса Cu(OН)2 выделится при взаимодействии 160г NaOH и 160г CuSO4?
| Д  ано: ано:m(NaOH)=160г m(CuSO4)=160г  m(Cu(OН)2)=? |
ν(CuSO4)= 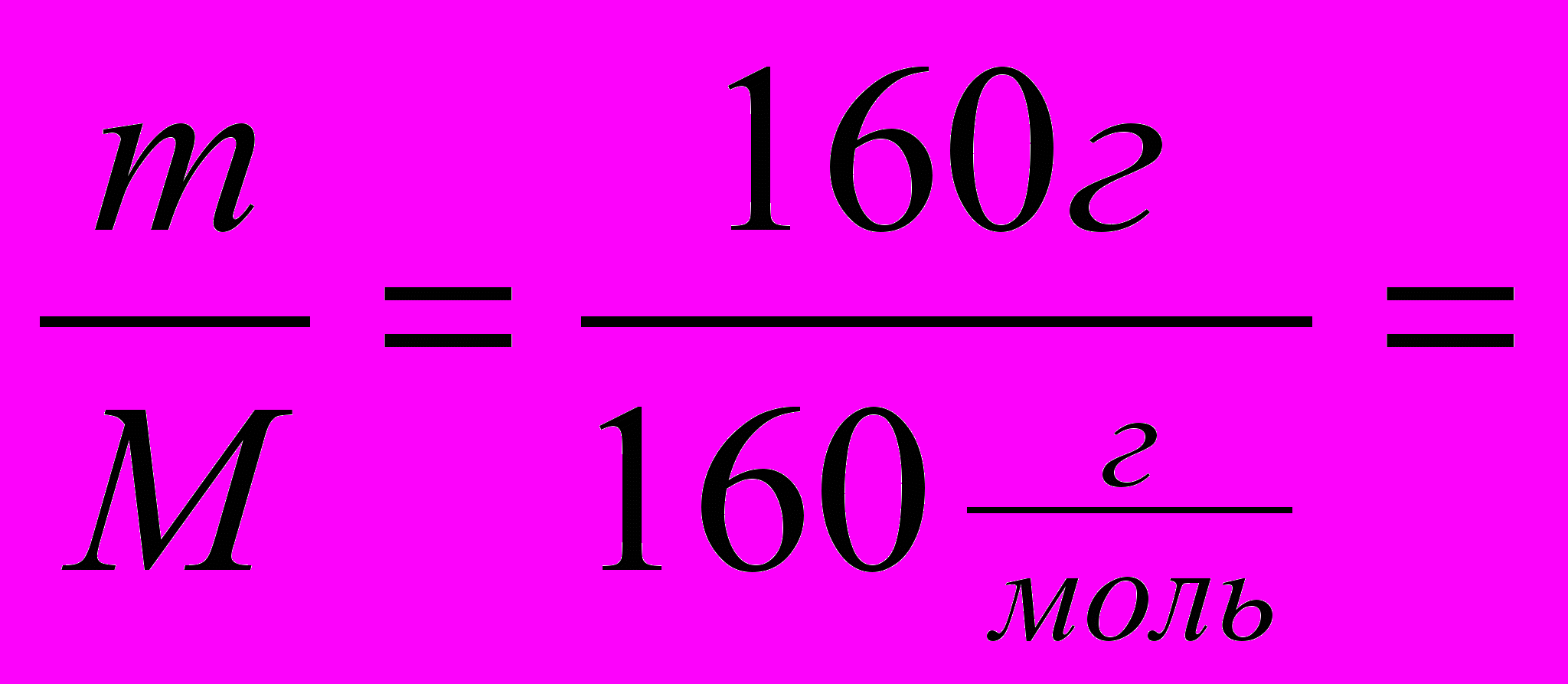 1 моль 1 мольМ(CuSO4)= 64+32+64=160г/моль 2моль 1моль 2) 2NaOH+CuSO4→Cu(OН)2 + Na2SO4 2 1 ν(NaOH)треб. – 2моль; есть – 4 моль; NaOH в избытке, расчет по CuSO4. 1 моль 1моль 3) 2NaOH + CuSO4 = Cu(OН)2 + Na2SO4 1моль 1моль m(Cu(OН)2)=ν*M=98г. Ответ: масса Cu(OН)2 98г. |
б)
| Д  ано: ано:mр.(NaOH)=1067г ω%( NaOH)=15% mр.(CuSO4)=2000г ω%( CuSO4)=8%  m(Cu(OН)2)=? |
m(CuSO4)= 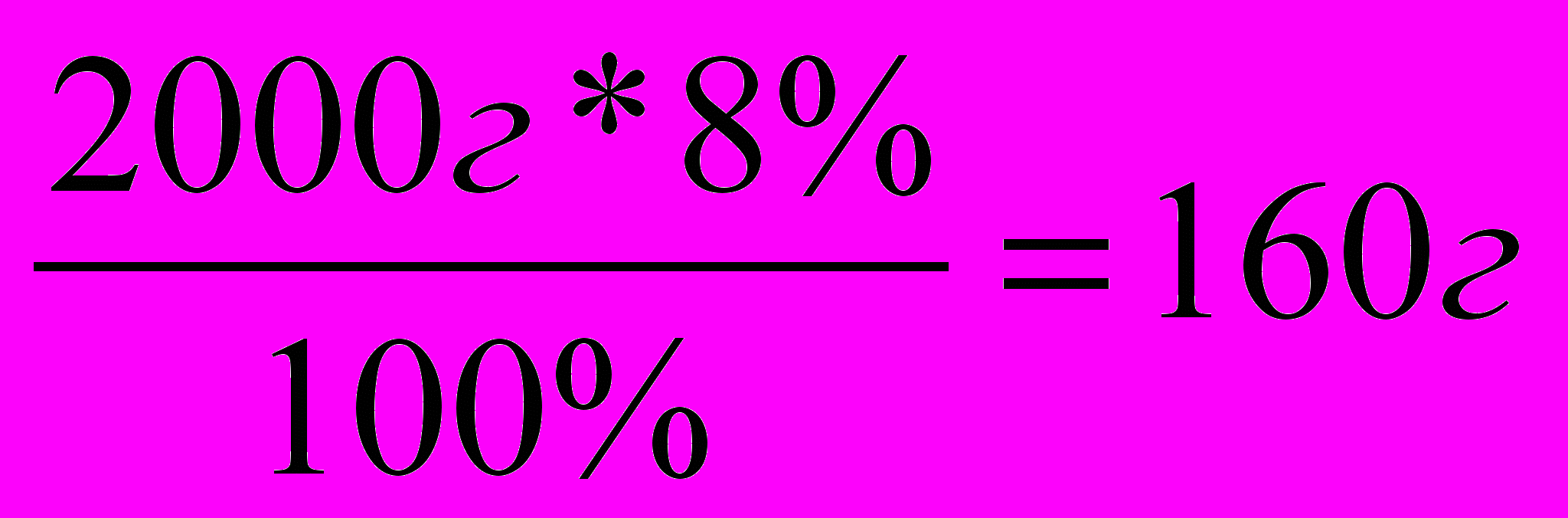 2) |
в)
| Д  ано: ано:Vр-ра(NaOH)=928 мл ρр-ра(NaOH)=1,15г/мл ω%( NaOH)=15% Vр-ра(CuSO4)=1845мл ρр(CuSO4)=1,084г/мл ω%( CuSO4)=8%  mпр(Cu(OН)2)=? |
mр-ра(CuSO4)=2000г 2) |
г)
| Д  ано: ано:Vр-ра(NaOH)=928 мл ρр-ра(NaOH)=1,15г/мл ω  %( NaOH)=15% %( NaOH)=15%Vр-ра(CuSO4)=1845мл ρр(CuSO4)=1,084г/мл ω%( CuSO4)=8% η(CuSO4)=92%  mпр(Cu(OН)2)=? |
mр-ра(CuSO4)=2000г 2) m(NaOH)= 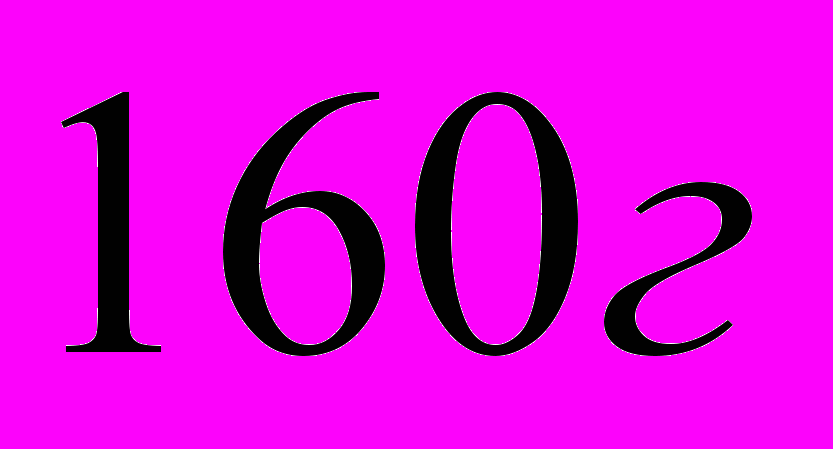 m(CuSO4)= 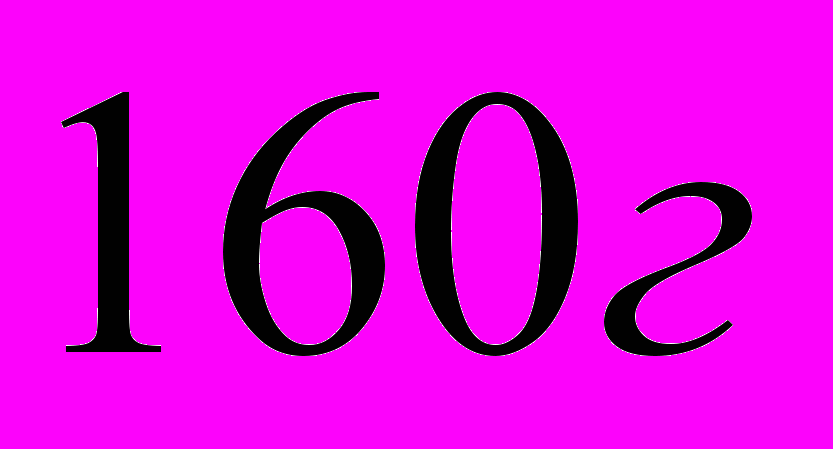 3) расчет по CuSO4 ν(CuSO4)=ν(Cu(OН)2)=1моль 4) mтеор(Cu(OН)2)=ν*M=98г 5) mпр(Cu(OН)2)= 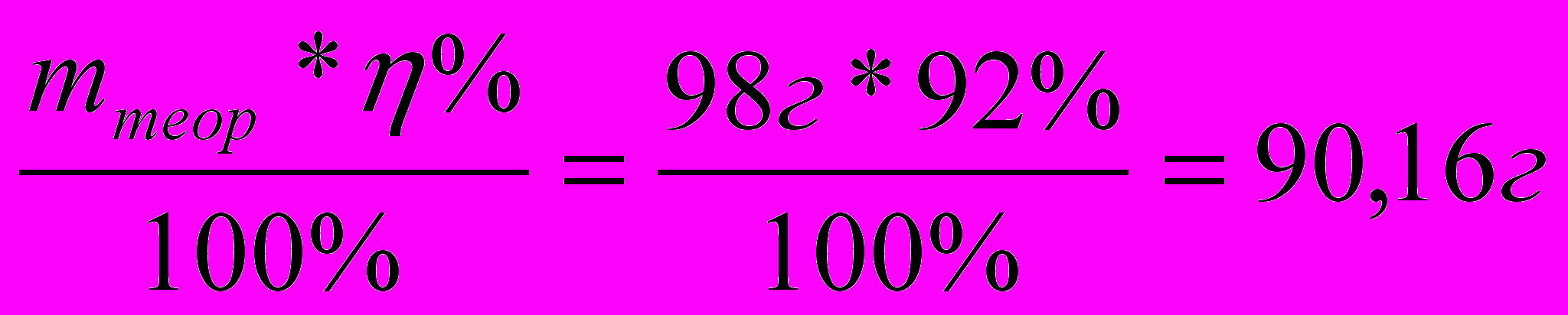 Ответ: масса практическая Cu(OН)2 равна 90,16г |

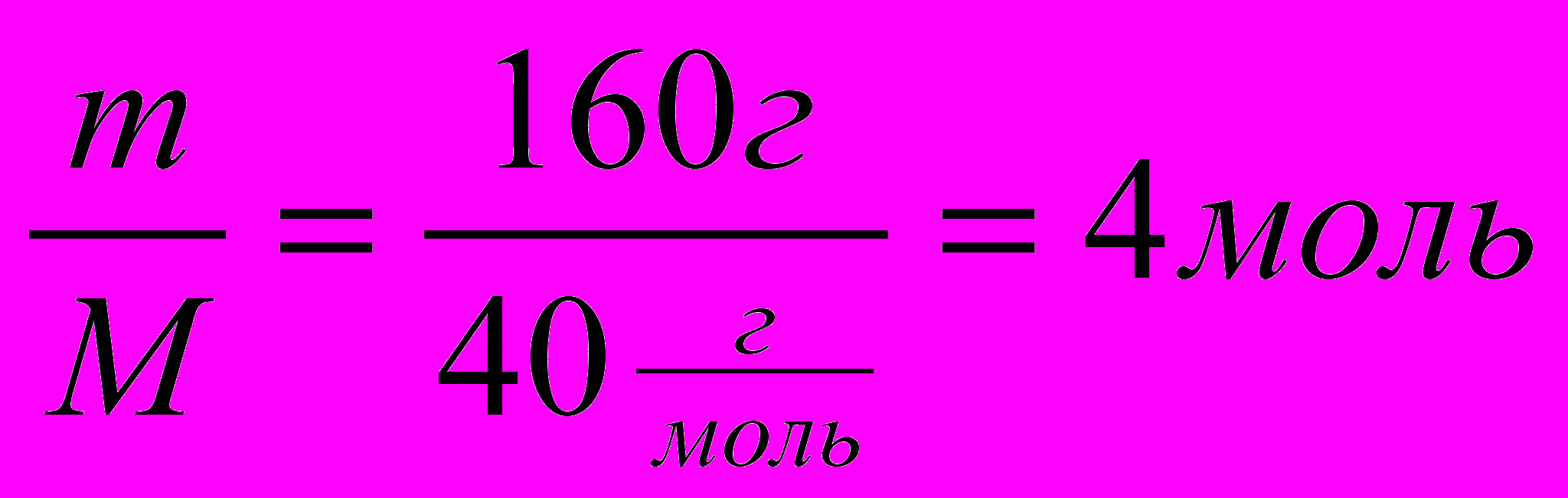
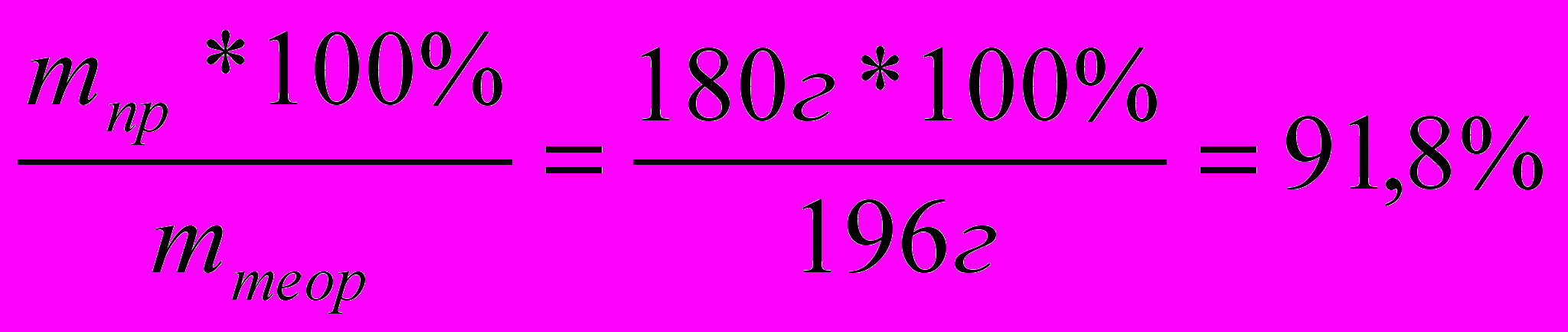
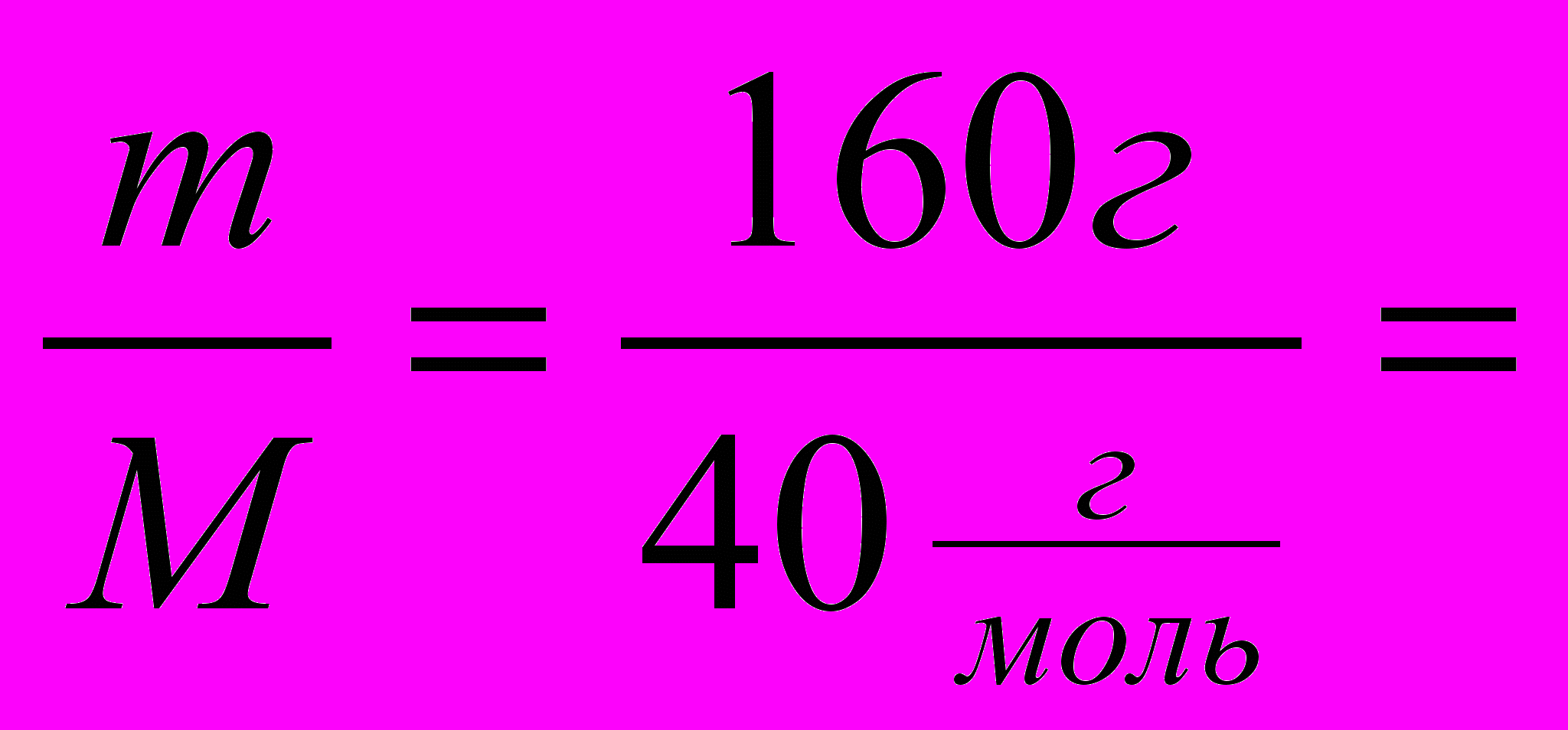 4 моль
4 моль