План. Понятие о кислотности растворов. Исследование растворов (лабораторная работа)
| Вид материала | Исследование |
- План лекции. Значение растворов в жизни и практической деятельности человека Характеристика, 183.37kb.
- «Изучение электропроводности растворов», 130.92kb.
- Физико-химический анализ растворов liAsF 6 в некоторых апротонных растворителях 02., 281.37kb.
- Лекция 6 г идрогеохимия коллоидная миграция и сорбция химических элементов в природных, 87.8kb.
- Экспериментальное исследование структуры и свойств твердых растворов силицидов молибдена, 391.2kb.
- Свод правил по проектированию и строительству сп 82-101-98 "Приготовление и применение, 1109.85kb.
- Тематический план лекций по общей химии (осенний семестр), 28.8kb.
- Курсовая работа по технологии лекарств тема: «Промышленное и серийное производство, 335.05kb.
- Самораспространяющийся высокотемпературный синтез твердых оксидных растворов на основе, 261.16kb.
- Тематический план лабораторных занятий по дисциплине «общая химия, биоорганическая, 46.73kb.


урок химии в 9 классе.
Цели: способствовать формированию у учеников представлений об источниках кислотных осадков, их влиянии на живую и неживую природу, на объекты, созданные трудом человека; показать необходимость охраны окружающей среды.
ХОД УРОКА.
Экология нас учит:
Если кислый дождь из тучи,
То природная среда
Вся в опасности тогда.
УЧИТЕЛЬ. Ребята, мы с вами познакомились с различными веществами - продуктами химической отрасли промышленности. К сожалению, среди них есть и ядовитые вещества. С ними необходимо особое обращение. Однако есть вещества, образующиеся в результате различных природных явлений (грозы, землетрясения, извержения вулканов), которые также влияют на окружающую среду.
Кислотные осадки – экологическая проблема. Что же означает слово «проблема»?
Ученик читает лексическое значение этого слова по словарю ( проблема – это не решенный вопрос; ситуация, требующая разрешения)
УЧИТЕЛЬ. На сегодняшний день проблема кислотных осадков актуальна, т.к. осадки в виде дождя, снега или тумана способны выпадать на огромных географических пространствах.
Мы с вами должны:
изучить особенности кислотности растворов атмосферных осадков и вод природных водоемов;
- исследовать предложенные растворы;
- узнать об их влиянии на окружающую среду;
- предложить способы борьбы с ними.
ПЛАН.
Понятие о кислотности растворов.
- Исследование растворов (лабораторная работа).
- Источники кислотных осадков.
- Химизм образования кислотных осадков (самостоятельная работа).
- Кислотный дождь (демонстрация опыта).
- Влияние кислотных осадков на окружающую среду.
- Меры борьбы с кислотными осадками.
- Домашнее задание – творческая работа.
1.
УЧИТЕЛЬ. Мы с вами сейчас находимся в телестудии Буй-ТВ. Сегодня некоторые наши ученики выступают в необычной роли. Они стали сотрудниками Костромского Государственного Университета. Сформулировать понятие о кислотности растворов я попрошу доцента кафедры коллоидной химии. Внимательно слушайте его рассказ, т.к. после этого мы будем выполнять лабораторную работу. Если у кого-то будут вопросы, вы можете их задать. (кафедра учителя оборудована как телестудия)
УЧЕНИК. Кислотность растворов выражают через молярную концентрацию ионов водорода или гидроксид – ионов. Отрицательный десятичный логарифм концентрации водородный ионов называют водородным показателем pH, а отрицательный десятичный логарифм концентрации гидросид-ионов - гидроксильным показателем pOH.
С помощью pH реакцию растворов характеризуют следующим образом: pH<7 – кислая среда, pH=7 - нейтральная среда, pH>7 - щелочная среда. Значение pH – это показатель степени в которую возведено число 10.
Кислотность природных водоемов различна, ее считают нормальной, если pH>=5,6 (из-за растворенности в воде углекислого газа). В поверхностных водах pH обычно находится в пределах 6,5 – 8,5 (слабощелочная). таким образом кислотные осадки – любые осадки (дождь, снег, туман), кислотность которых больше нормальной.
УЧИТЕЛЬ. Какие вопросы вы хотели бы задать?
УЧЕНИКИ. Как практически узнать кислотность раствора? Если дома нет индикатора, то каким способом определить кислотность?
Отвечает доцент кафедры коллоидной химии.
2.
УЧИТЕЛЬ. Теперь давайте вместе с вами попробуем определить среду некоторых растворов.
Ребята пересаживаются за лабораторные столы, и каждой группе предлагается исследовать растворы разных солей. Важно, чтобы учитель подобрал соли так, чтобы у первой группы раствор имел нейтральную среду, у второй – кислую, у третьей – щелочную; четвертая группа должна исследовать воду из искусственного водоема, которую используют для хозяйственных нужд.
Школьники работают в группах, потом проводят анализ работы. Выступают представители от групп.
УЧЕНИК. Мы исследовали раствор стирального порошка с помощью фенолфталеина. Раствор изменил свою окраску и стал красным; это значит, что среда щелочная и pH>7
3.
УЧИТЕЛЬ. Какой раствор (из четырех) соответствовал обычному – кислотному дождю? Что же служит причиной такого дождя? Слово предоставляется преподавателю университета. Он познакомит вас с источниками кислотных осадков.
Запишите определение кислотного дождя (ЦОР).
Кисло́тный дождь — все виды метеорологических осадков — дождь, снег, град, туман, дождь со снегом, при котором наблюдается понижение pH дождевых осадков из-за загрязнений воздуха кислотными оксидами (обычно — оксидами серы, оксидами азота).
УЧЕНИК. Сернистый газ и оксиды азота - основные загрязнители, вызывающие образование кислотных осадков. Соединения серы попадают в атмосферу как естественным путем, так и в результате деятельности человека (антропогенная деятельность)
Естественные источники.
а) анаэробные бактерии разрушают органические вещества заболоченных зон, приливов и отливов, устьев рек, почв, при том выделяются газообразные соединения серы. Количество серы, образовавшееся биологическим путем превышает 30-40 млн. т в год.
б) при извержении вулканов в атмосферу вместе с диоксидом серы попадают сероводород, сульфаты и сера. Это ок. 2 млн. т
в) образование оксида азота (IV) в атмосфере во время грозовых осадков.
- Антропогенные источники.
а) переработка и сжигание различных видов топлива (каменный и бурый уголь, торф, нефть, древесина). Выбросы предприятий черной и цветной металлургии, заводов по производству синтетических волокон, аммиака, целлюлозы, серной кислоты.
б) жизнедеятельность человека. С ней связана основная часть выбросов оксидов азота: работа автотранспорта (до 38%), теплоэнергетические установки (до 30%), выбросы предприятий по производству минеральных удобрений, красителей, пластмасс, электросварка.
.
4.УЧИТЕЛЬ. Какие же химические процессы происходят с сернистым газом и оксидами азота? Каков химизм образования кислотных осадков? Предлагаю вспомнить основные химические реакции, лежащие в основе этих процессов. в задании нужно вместо точек вставить пропущенные формулы, расставить коэффициенты.
Каждому ученику выдаются карточки с заданиями.
Например:
З а д а н и е 1.
1) N2 + … NO
2) … + O2 NO2
3) … + H2O HNO3 + NO
З а д а н и е 2.
1) FeS2 + … SO2 + Fe2O3
2) … + SO2 SO3
3) H2O + … H2SO4 + Q
По истечении определенного времени работы собираются.
Закрепление (ЦОР).
Уравнения реакций
SO2 + H2O = H2SO3 — образуется сернистая кислота
SO3 + H2O = H2SO4 — образуется серная кислота
2NO2 + H2O = HNO3 + HNO2 — образуются, соответственно, азотная и азотистая кислоты
Эти кислоты и обуславливают понижение pH выпадающих дождей, которые поэтому называют кислотными. кислотный дождь разрушает памятники и города
Основные химические реакции, лежащие в основе образование кислотных,- это окисление сероводорода, сжигание сульфидов и окисление азота.
Получившиеся оксиды взаимодействуют с водой, в результате чего образуются кислоты.
Ознакомьтесь со схемой, отражающей механизм образования
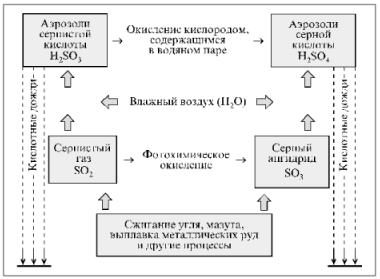
Кислотных осадков(ЦОР).
Наши «технологи», учащиеся вашего класса, изобрели прибор для демонстрации кислотного дождя. Сейчас они вам покажут настоящий кислотный дождь.
5.
ДЕМОНСТРАЦИЯ ОПЫТА.
Берут большую пробирку с отверстием в боковой стенке и газоотводный шланг с краном. Укрепляют пробирку в штативе и соединяют с помощью шланга с сосудом, имеющим два отверстия: первое – для соединения с пробиркой, второе – закрытое пробкой с газоотводной трубкой и краном, к которому подсоединено сито. Этот сосуд укрепляют вверх дном в другом штативе, предварительно заполнив его наполовину водой, подкрашенной синим лакмусом. Перед демонстрацией в пробирку насыпают 1\2 металлической ложки железных опилок (стружки) и приливают разбавленную HNO3 так, чтобы она смочила опилки. Краны на шлангах закрыты. Как только начнет выделяться бурый газ (диоксид азота NO2), нужно открыть первый кран, чтобы газ из пробирки поступил в сосуд с водой, подкрашенной лакмусом. Раствор начинает менять окраску с синей на красную, т.е. образуется кислота.
Если открыть второй кран, чтобы вода поступала на сито, то пойдет «дождь».
6.
УЧИТЕЛЬ. Какое же влияние оказывают кислотные дожди на окружающую среду? Предоставляю слово главному врачу областной больницы.
УЧЕНИЦА. Значение pH водных экосистем чрезвычайно важно, т.к. от него зависит деятельность практически всех ферментов, гормонов и других белков в живых организмах.
Выпадение осадков с повышенной кислотностью ведет к серьезным изменениям и в почве. Когда много сернистого газа без всякого контроля попадает в атмосферный воздух, это грозит большой бедой. Возле крупных теплоэлектростанций и металлургических комбинатов начисто погибает всякая растительность, земля превращается в «мертвую зону». На тех промышленных предприятиях, где пренебрегают очисткой отходящих газов, из фабричных труб порой выходят длинные шлейфы желтого цвета. Это диоксид азота. Несмотря на веселое имя этого дыма – «лисий хвост», - он вовсе не безобиден. При действии влаги из него тут же получается азотная кислота, которая тоже может выпадать в виде осадков и туманов. Известно негативное влияние кислотных осадков на деревья: нарушается восковой покров листьев, деревья становятся более уязвимыми для насекомых и грибков. Особенно страдают хвойные леса. Происходит сброс хвои.
На здоровье людей, особенно с заболеваниями дыхательных путей, серьезное воздействие оказывает сернистый газ.
Кислотные осадки ускоряют разрушение строений, скульптур, памятников.
7.
УЧИТЕЛЬ. Как же можно избежать негативного влияния кислотных осадков?
УЧЕНИКИ. (предлагают меры борьбы с кислотными осадками)
а) можно использовать известкование почв для уменьшения их кислотности;
б) необходимо сокращать выбросы кислотообразующих веществ в окружающую среду; по мнению ученых, сокращение выбросов на 50% приостановило бы «подкисление» окружающей среды;
в) использование в качестве топлива низкосернистых угля, нефти и природного газа тоже способствовало бы уменьшению количества образующихся оксидов;
г) ученые Московского Института Топлива и Энергетики разработали жидкие фильтры: газообразные продукты сгорания топлива пропускают через распыленный водный раствор извести, которая поглощает газы;
д) ТЭЦ можно заменить на более экологически чистые электростанции (солнечные, ветряные, приливные), которые не дают выбросов в атмосферу оксидов серы и азота.
е) водителям необходимо следить за содержанием выхлопных газов.
8.
УЧИТЕЛЬ. Молодцы, вы привели много способов борьбы с осадками. На следующих урокам мы узнаем еще больше. Я предлагаю вам творческое домашнее задание. Одни ученики сочинят сказки, стихи, кроссворды по охране окружающей среды, другие - предоставят материал о различных экологических проблемах, третьи – соберут примеры влияния человека на загрязнение окружающей среды.
