Физико-химический анализ растворов liAsF 6 в некоторых апротонных растворителях 02. 00. 04 физическая химия
| Вид материала | Автореферат |
- Каучук и резина №2 1974 Статьи по каучуку и резине, опубликованные в первом полугодии, 781.99kb.
- «химия», 108.01kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Координационная химия и реакционная способность смешанных ацидопорфириновых комплексов, 804.83kb.
- Програма курса "химия" для студентов специальностей "экология", "природопользование", 157.55kb.
- Рабочая программа дисциплины «Физическая химия» для подготовки бакалавров и магистров, 352.69kb.
- Термохимия растворения ccl 4, бензола и его производных в индивидуальных и смешанных, 298.7kb.
- Физико – химический анализ, 64.24kb.
- Методические указания и контрольные задания по дисциплине Физическая и коллоидная химия, 320.37kb.
- План: Введение; Химия Земли; Химический состав метеоритов; Химический состав звезд, 279.93kb.
На правах рукописи
ЧЕКУНОВА Марина Дмитриевна
ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ РАСТВОРОВ LiAsF6 В НЕКОТОРЫХ АПРОТОННЫХ РАСТВОРИТЕЛЯХ
02.00.04 – физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново – 2003 г.
Работа выполнена в Институте химии растворов Российской Академии наук
Научный руководитель кандидат химических наук,
доцент
Афанасьев Владимир Николаевич
Официальные оппоненты: доктор химических наук, профессор
Максимов Александр Иванович
доктор химических наук, профессор
Базанов Михаил Иванович
Ведущая организация - Ивановский государственный университет
Защита состоится " ... " мая 2003 г. в ___ час. на заседании диссертационного совета Д 002.106.01 в Институте химии растворов РАН по адресу: 153045, г.Иваново, ул.Академическая, 1.
С диссертацией можно ознакомиться в библиотеке ИХР РАН
Автореферат разослан "_____"______________" 2003 г.
Ученый секретарь
диссертационного совета: Ломова Т.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Cоздание литиевых источников тока, обладающих высокой энергоемкостью, широким температурным интервалом работоспособности (- 60 +70 0С), хорошей сохранностью (более 10 лет) позволило подойти к разрешению современных проблем автономного энергоснабжения как для задач стратегического назначения, так и в потребительской сфере. Для направленного поиска электролитных композиций для литиевых и литий-ионных источников электрической энергии необходимо более глубокое понимание строения и физико-химических процессов, происходящих в концентрированных растворах электролитов. Описание концентрированных электролитных систем является одной из наиболее сложных проблем современной химии растворов. Для понимания задачи в целом целесообразен комплексный подход к исследованию с привлечением данных, полученных различными методами. С этой целью были использованы денсиметрический и ультраакустический методы, направленные на исследование сольватационных взаимодействий и структуры растворов электролита, вискозиметрический и кондуктометрический методы, позволяющие оценить особенности процессов переноса, определяющих эксплуатационные характеристики источников тока в широком интервале концентраций и температур. В качестве объектов исследования были выбраны растворы LiAsF6 в апротонных растворителях, обеспечивающие хорошую обратимость литиевого электрода, устойчивые по отношению к литию, обладающие высокой электропроводностью и имеющие важное практическое применение.
Цель работы. Изучениe термодинамических и транспортных свойств электролитных растворов LiAsF6 в пропиленкарбонате (ПК), гаммабутиролактоне (-БЛ) и тетрагидрофуране (ТГФ) при концентрациях электролита, изменяющихся от разбавленных до близких к насыщению, при различных температурах и физико-химический анализ данных растворов.
В задачу исследования входило:
- Получение прецизионных данных по плотности (), скорости распространения ультразвука (u), вязкости () и электропроводности () LiAsF6 в апротонных растворителях с различной диэлектрической проницаемостью (ПК, -БЛ и ТГФ) в широкой области концентраций и температур.
- Изучение объемно-упругих свойств электролитных растворов и особенностей сольватационных взаимодействий LiAsF6 в неводных растворителях на основе метода изоэнтропийного сжатия в интервале температур от 283.15 – 313.15 К.
- Исследование ассоциативных взаимодействий в растворах LiAsF6 в ПК, -БЛ и ТГФ.
- На основе физико-химического анализа исследуемых систем установление закономерностей в изменении электропроводности и вязкости в растворах в области высоких концентрациях.
- Исследование циклического поведения лития в растворах LiAsF6 в пропиленкарбонате и его смесях с малополярными эфирами.
Научная новизна
Получены новые прецизионные значения плотности, скорости ультразвука, вязкости и электропроводности в растворах LiAsF6 в ПК, -БЛ, ТГФ в широком интервале концентраций и температур.
Впервые применен метод изоэнтропийного сжатия к неводным электролитным растворам, определены величины кажущихся молярных объемов и кажущихся молярных сжимаемостей LiAsF6 в ПК, -БЛ, ТГФ. Оценены характеристики сольватных комплексов LiAsF6 в исследуемых растворителях: числа сольватации стехиометрической смеси ионов LiAsF6 и молярная сжимаемость (s,1hV1h) растворителя в сольватной сфере ионов.
Определены значения констант ассоциации и предельных молярных электропроводностей LiAsF6 в -БЛ и ТГФ по модели Ли-Уиттона при 253.15 – 313.15 К.
Впервые показано, что модель ионной квазикристаллической решетки электролита, приводящая к линейной зависимости молярной электропроводности () от кубического корня концентрации, применима с достаточным приближением для описания концентрационной зависимости молярной электропроводности исследуемых неводных растворов LiAsF6 в растворителях со сравнительно высокой диэлектрической проницаемостью вплоть до 1.1 m. Линейная зависимость молярной электропроводности () от кубического корня концентрации (С), также была обнаружена в других апротонных растворителях с высокой диэлектрической проницаемостью и в воде для LiClO4, LiCl, LiBF4, LiBr, LiI в области концентраций до 1.2 М. Выявленная закономерность может быть использована для прогнозирования электропроводности электролитных растворов. Показана линейная зависимость логарифмов электропроводности и вязкости растворов LiAsF6 от (T-T0)-1, что также свидетельствует о существовании псевдокристаллической решетки в неводных растворителях.
Установлена взаимосвязь транспортных свойств на основе метода рациональных параметров. Обнаружены линейные зависимости молярного времени распространения ультразвука от молярной текучести и молярной электропроводности в растворах LiAsF6 в ПК и -БЛ, что позволяет оценивать свойства растворов из экспериментальных данных по другим свойствам.
Практическая значимость работы
Новые прецизионные экспериментальные данные по плотности, скорости распространения ультразвука, электропроводности и вязкости растворов LiAsF6 в пропиленкарбонате, гаммабутиролактоне и тетрагидрофуране, представленные в работе, могут быть использованы при разработке электролитов литиевых источников тока, служить в качестве справочного материала при создания баз данных ХИТ. Выявленные в работе закономерности могут быть использованы для прогнозирования свойств растворов, а также представлять интерес для развития теории концентрированных растворов электролитов.
Апробация работы: Основные результаты докладывались и обсуждались на: VII Международном Фрумкинском симпозиуме «Фундаментальная электрохимия и электрохимическая технология» (Москва, 2000г.); Международной научной конференции студентов, аспирантов и молодых ученых «Молодая наука - 21 веку» (Иваново, 2001г.); II Международном симпозиуме «Приоритетные направления в развитии химических источников тока» (Плес, 2001г.); VIII Международной конференции «Проблемы сольватации и комплексообразования» (Иваново, 2001г.); VII Международной конференции «Фундаментальные проблемы преобразовании энергии в литиевых электрохимических системах» (Саратов, 2002 г.).
Публикации: По материалам диссертации опубликовано 8 печатных работ, в том числе 3 статьи, 5 тезисов докладов на конференциях.
Автор выражает искреннюю благодарность старшему научному сотруднику ИХР РАН, к.т.н. Зятьковой Л. А. за полезные дискуссии, советы, замечания и помощь в процессе выполнения диссертационной работы.
Объем и структура диссертации: Диссертация состоит из введения, обзора литературы, экспериментальной части, результатов и их обсуждения, выводов, библиографии.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Введение.
Во введении обоснована актуальность работы, сформулированы и обоснованы задачи проведенных исследований.
1. Обзор литературы
В обзоре литературы отмечены преимущества литиевых источников тока по сравнению с традиционными преобразователями энергии, рассмотрены характеристики электролитов, применяющиеся в литиевых и литий-ионных источниках тока. Обоснован выбор объектов, являющихся перспективными для разработок новых, в том числе полимерных, электролитных систем, - растворов LiAsF6 в апротонных диполярных растворителях. Рассмотрены процессы сольватации и ассоциации и их влияние на транспортные свойства электролитов. Критически оценены методы определения чисел сольватации в воде и апротонных растворителях, проанализирована их информативность, отмечена несогласованность чисел сольватации, найденными различными методами. Показаны возможности акустического метода изучения сольватации. Большое внимание уделено эмпирическим и полуэмпирическим подходам к описанию свойств концентрированных растворов. Обсуждены принципиальные трудности, связанные с циклированием литиевого электрода в жидкофазных электролитах, а также способы повышения циклируемости литиевого электрода. Дано обоснование выбора методов исследования, среди которых: денсиметрический, акустический, вискозиметрический и кондуктометричекий, а также методы анализа электрохимического поведения лития в жидкофазных системах.
2. Экспериментальная часть.
В экспериментальной части рассмотрены методики очистки и контроля качества растворителей, концентрация остаточной воды в которых определенная методом кулонометрического титрования по К. Фишеру, составляла не более 0.003 %. Плотность и вязкость чистых растворителей находились в разумном согласии с надежными литературными данными. В работе использовался LiAsF6 с содержанием основного вещества 99.5%, полученный на основе методики В.Н. Плахотника, модифицированной постоянным контролем полноты протекания промежуточных реакций синтеза и применением потенциометрического анализа на содержание комплексного аниона, с использованием ионселективного электрода на AsF6-. Приготовление растворов осуществлялось весовым методом с использованием весов «Sartorius» (точность взвешивания 110-5 г) с учетом приведения веса к вакууму. Дано описание прецизионных установок для измерения скорости распространения ультразвука, плотности, вязкости, электропроводности. Проведен анализ погрешностей экспериментальных данных. Методика измерения скорости распространения ультразвука на лазерном интерферометре и плотности на вибрационном денсиметре ДМА – 602 была отработана на водных растворах LiCl, полученные данные показали хорошую согласованность с литературными данными. В этой главе представлены экспериментальные данные для растворов LiAsF6 в ПК, -БЛ и ТГФ по скорости распространения ультразвука, измеренной на специально сконструированном цифровом лазерном ультразвуковом интерферометре на частоте 6 МГц с погрешностью 0.04 м/с, по плотности, определенной на вибрационном плотномере фирмы «A. Paar» с погрешностью измерения 0.02 кг/м3, по вязкости, определенной на вискозиметре с висячим уровнем, снабженным фотоэлектронной системой слежения, с погрешностью определения 0.03%, по электропроводности, измеренной на установке, включающей цифровой мост переменного тока Р-5083 с погрешностью 0.05%. Рассмотрена методика исследования электрохимического поведения литиевого электрода в указанных растворах. Все первичные экспериментальные результаты представлены в диссертации.
3. Результаты исследования и обсуждение.
Растворы LiAsF6 в растворителях с высокой диэлектрической проницаемостью.
Объемные свойства и характеристики сольватации LiAsF6 в ПК и -БЛ.
Исследование кондуктометрических данных в области больших разбавлений показало отсутствие ассоциации LiAsF6 в ПК, а также незначительную ассоциацию гексафторарсената лития в -БЛ, что согласуется с данными метода ядерной спин решеточной релаксации. Вследствие этого можно полагать, что электролит в данных растворах в основном находится в ионной форме.
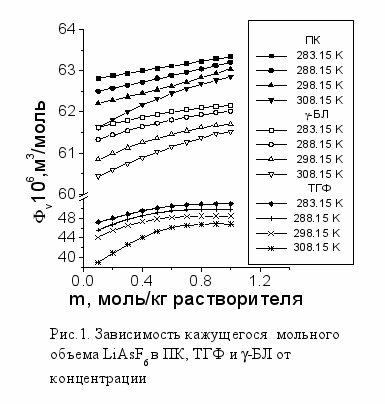
С целью получения информации о взаимодействии растворенного вещества и растворителя были изучены объемные свойства растворов, концентрационные и температурные зависимости кажущихся мольных объемов (v) (рис. 1) и кажущихся мольных сжимаемостей (k,s) LiAsF6 в ПК, -БЛ. В исследуемых растворах наблюдается увеличение кажущихся мольных объемов с ростом концентрации электролита и уменьшение их при повышении температуры. Расчет кажущейся молярной сжимаемости электролита из данных по плотности и изоэнтропийной сжимаемости раствора S=1/(u2) показал, что в растворах ПК и -БЛ кажущиеся молярные сжимаемости увеличиваются с ростом концентрации и понижаются с ростом температуры.
 Интерпретация полученных концентрационных и температурных зависимостей кажущихся параметров LiAsF6 проводилась с привлечением метода рациональных параметров и подхода Онори. Объем раствора рассматривали как состоящий из сольватированных ионов и “свободного” растворителя:
Интерпретация полученных концентрационных и температурных зависимостей кажущихся параметров LiAsF6 проводилась с привлечением метода рациональных параметров и подхода Онори. Объем раствора рассматривали как состоящий из сольватированных ионов и “свободного” растворителя: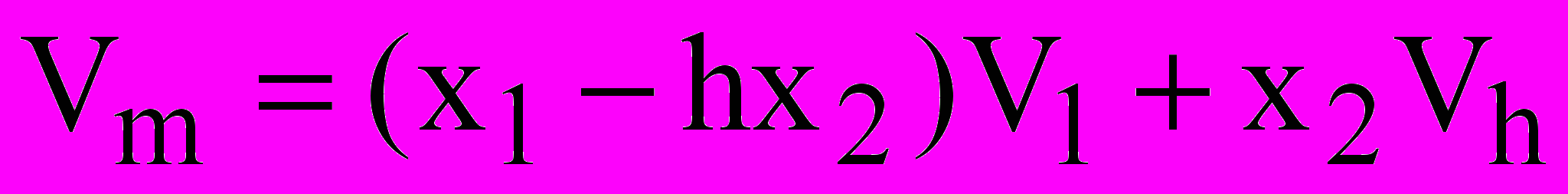 (1)
(1)где h - число сольватации электролита, V1 и Vh - объемы моля свободного растворителя и моля стехиометрической смеси сольватированных ионов соли, x1 и x2 - мольные доли растворителя и растворенного вещества.
Выражение для кажущейся молярной сжимаемости в рамках данного подхода представлялось как:
k,s=s,hVh-hs,1V1 (2)
где s,1V1 и s,hVh - молярные сжимаемости чистого растворителя и сольватного комплекса. Использование молярных величин адиабатической сжимаемости, являющихся рациональными параметрами, позволяет оперировать с постоянным числом частиц в растворе, в отличие от величин адиабатической сжимаемости, относящейся к единице объема раствора и не принимающей во внимание число взаимодействующих частиц.
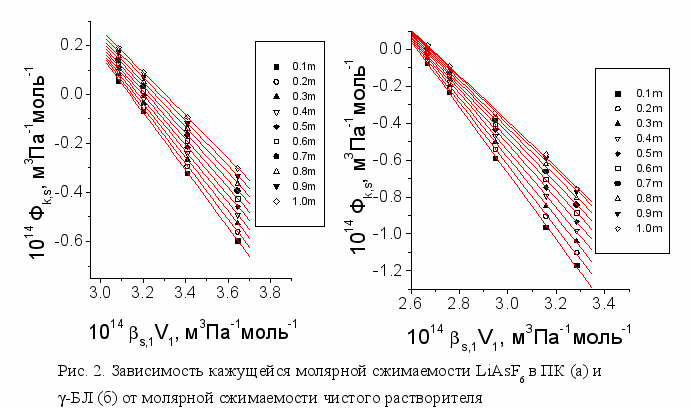
Исследование изоконцентрационных зависимостей кажущихся молярных сжимаемостей LiAsF6 в ПК и в -БЛ от молярной сжимаемости чистых растворителей показало, что они носят линейный характер в соответствии с выражением (2) (рис.2). Это доказывает независимость s,hVh и h от температуры в изученном интервале условий, а также то, что сжимаемость растворителя в сольватных сферах вносит вклад в изменение сжимаемости раствора наряду со сжимаемостью растворителя в объеме. Полученные значения s,hVh и h представлены на рис. 3. Уменьшение кажущихся молярных объемов и кажущихся молярных сжимаемостей LiAsF6 в ПК и -БЛ с ростом температуры связано с увеличением различия между молярным объемом растворителя, сжатым в сольватной оболочке и сохраняющимся неизменным, и молярным объемом чистого растворителя, изменяющимся с температурой. Уменьшение содержания растворителя в сольватной оболочке ионов приводит к повышению кажущихся молярных объемов и кажущихся молярных сжимаемостей LiAsF6. Из обнаруженной линейной зависимости к,s=f(s,1V1) следует, что число сольватации является основной составляющей концентрационной зависимости сольватации, а температура, выраженная через изменение молярной сжимаемости чистого растворителя, влияет на сольватацию через изменение структуры растворителя. Этот вывод согласуется с данными колебательной спектроскопии, которые подтверждают термическую устойчивость сольватной структуры и независимость чисел гидратации от температуры (Волрафен). По данным неупругого рассеяния нейтронов при повышении температуры также обнаруживается нарушение межмолекулярных связей в чистой воде, тогда как полосы, приписываемые гидратам ионов, становятся лишь более отчетливыми (Леунг, Саффорд).
З
начения s,hVh и h уменьшаются с ростом концентрации растворенного вещества, причем для растворов LiAsF6 в ПК и в -БЛ обнаружена линейная зависимость lnh=f(x2), что согласуется с представлением об увеличении перекрывания сольватных сфер ионов при увеличении их содержания в растворе. Перекрывание сольватных сфер приводит к понижению объема сольватированного комплекса и его молярной сжимаемости, что позволяет записать выражение для молярной сжимаемости сольватированного комплекса в виде
s,hVh=s,2hV2h+hs,1hV1h, (3)
где s,2h и s,1h – сжимаемости полости, содержащей стехиометрическую смесь ионов и растворителя в сольватной сфере ионов, соответственно.
Полученные зависимости s,hVh=f(h) в растворах LiAsF6 в ПК и -БЛ линейны (рис. 4), следовательно можно полагать в соответствии с выражением (3), что молярная сжимаемость растворителя в сольватной сфере иона, s,1hV1h, определенная по углу наклона этой зависимости, практически не зависит ни от концентрации электролита, ни от температуры в исследуемом интервале условий. Таким образом, основной вклад в изменение сжимаемости сольватированных комплексов с ростом концентрации электролита вносит понижение чисел сольватации.
И
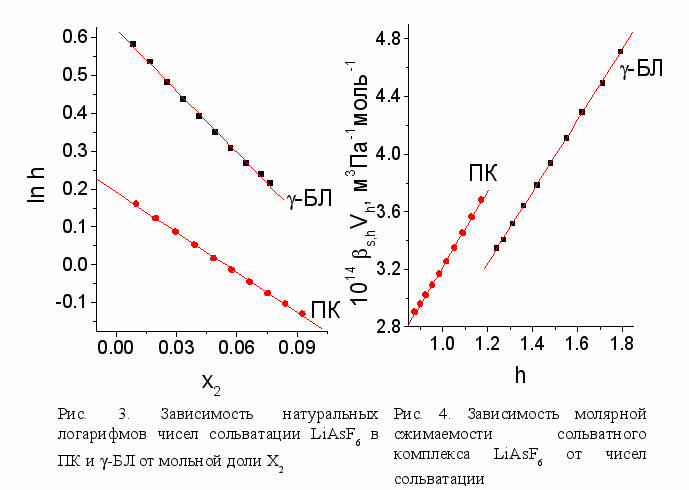
з сопоставления молярных сжимаемостей растворителя в сольватной сфере с молярной сжимаемостью чистого растворителя (табл. 1) можно сделать вывод, что, несмотря на то, что растворитель электрострикционно сжат под действием электростатического поля растворенных ионов, он еще может сжиматься под действием внешнего давления. Вследствие этого некорректно предполагать, как это обычно делается при использовании подхода Дебая-Пасынского для расчета чисел сольватации, что сжимаемость растворителя в сольватной оболочке равна нулю.
Для сравнения чисел сольватации в воде и в неводных растворах были определены числа гидратации LiCl. Значения чисел гидратации в исследуемых растворах хлорида лития изменяются от 17 до 7 при увеличении концентрации растворов от 0.53 до 7.07 m. Данное различие чисел сольватации в воде и в неводных растворах можно объяснить в 4 раза большими размерами молекул неводных растворителей по сравнению с размером молекул воды, а также тем, что в воде могут гидратироваться и анионы, вследствие образований водородных связей.
Таблица 1.
Молярная сжимаемость свободного растворителя и в сольватной сфере LiAsF6
| Растворитель | 1014 s,1V1 м3Па-1моль-1 | 1014 s,1hV1h м3Па-1моль-1 | ||||
| 283.15 | 288.15 | 298.15 | 308.15 | 318.15 | ||
| Пропиленкарбонат | 3.08 | 3.20 | 3.41 | 3.64 | - | 2.84 |
| Гаммабутиролактон | 2.7 | 2.76 | 2.95 | 3.15 | 3.28 | 2.57 |
Процессы переноса в области больших концентраций
Концентрационная зависимость электропроводности растворов LiAsF6 в пропиленкарбонате, гаммабутиролактоне
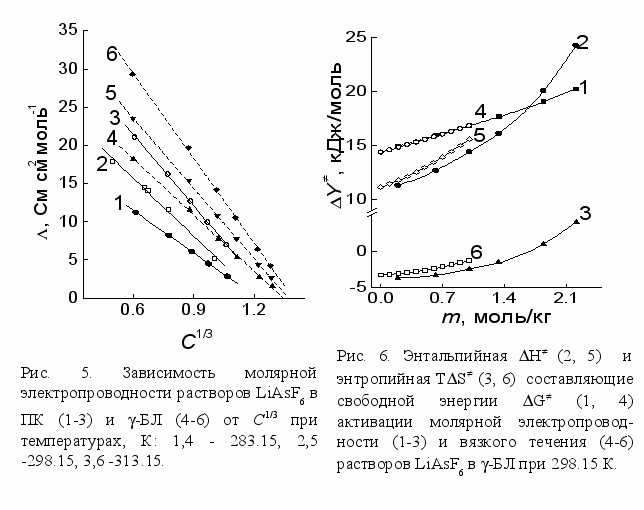
Полученная линейная зависимость =f(C1/3) (рис.5) позволяет предполагать, что растворы LiAsF6 в растворителях с высокой диэлектрической проницаемостью ПК и -БЛ представляют собой системы с квазикристаллическим строением. Это согласно модели Гоша означает, что при растворении ионного кристаллического вещества, ионы могут занимать положения, соответствующие положениям ионов в ионной квазикристаллической решетке раствора, хотя и искаженной в результате взаимодействия ионов с молекулами растворителя. Причем даже при тепловом движении, разрушающем решеточную организацию, около иона существует окружение из нескольких ионов, подобное квазикристаллическому. С учетом проведенных нами акустических исследований можно полагать, что ионы в узлах решетки находятся в сольватированном состоянии. Результаты термодинамического анализа процесса активации вязкого течения и электропроводности показывают (рис.6), что свободная энергия активации вязкого течения и электропроводности растут с увеличением концентрации электролита, как для растворов ПК так и для растворов -БЛ. В пользу образования квазирешетки в этих растворах также свидетельствует снижение отрицательной величины TS при добавлении электролита к ПК и к -БЛ, что показывает увеличение порядка в исходном состоянии по сравнению с переходным при возрастании концентрации. Вследствие усиления электростатического взаимодействия между ионами при их сближении молярная электропроводность уменьшается с ростом концентрации.
Таблица 2.
Коэффициенты уравнения молярной электропроводности (Смсм2/моль) (3)
для растворов литиевых солей.
Растворитель | Соль | Т, К | Интервал Концент- раций, С | 0 | S | , |
| N-метил- пропионамид* | LiClO4 | 348 223 | 0.08-1.46 0.098-1.04 | 41.05 0.418 | 31.6 0.395 | 0.57 0.01 |
| Пиридин* | LiClO4 | 323 | 0.17-0.62 | 35.36 | 25.35 | 0.08 |
| | 243 | 0.18-0.65 | 29.92 | 20.89 | 0.12 | |
| Диметил- сульфоксид* | LiClO4 | 323 | 0.14-2.19 | 58.52 | 41.67 | 0.40 |
| | 298 | 0.14-2.22 | 37.93 | 27.33 | 0.29 | |
| Гамма- бутиролактон** | LiClO4 | 333 278 | 0.1-2 0.1-2 | 59.89 28.54 | 42.24 21.66 | 0.31 0.30 |
| N-метил- пропионамид* | LiBF4 | 348 248 | 0.098-1.30 0.11-1.41 | 34.60 2.10 | 26.33 1.75 | 0.15 0.02 |
| Вода*** | LiClO4 | 298 | 0.07-2.10 | 105.18 | 34.82 | 0.45 |
| LiCl | 298 | 0.59-12 | 124.95 | 51.56 | 0.79 |
Использованы данные:
*Ю.А. Карапетян, В.Н. Эйчис.Физико-химические свойства электролитных неводных растворов. М. Химия, 1989.
** Chagnes A. et al. // J. Electrochimica Acta. 2001, v. 46, p. 1783-1791.
***Справочник по электрохимии под. ред. А. М. Сухотина. Л., «Химия», 1981.
Используемое в рамках ионной квазикристаллической модели выражение
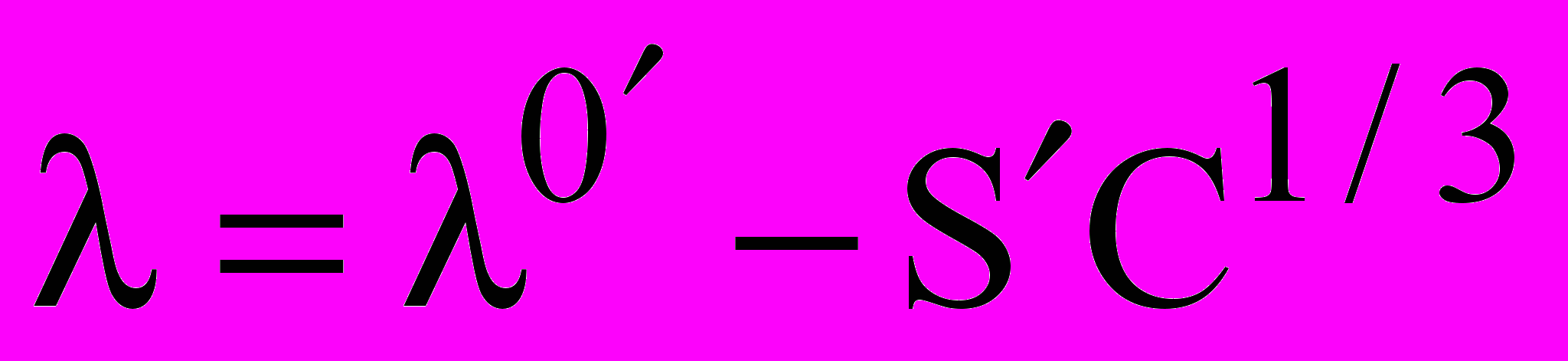 (4)
(4)позволяет определить концентрации, соответствующие положению максимума удельной электропроводности с помощью соотношения
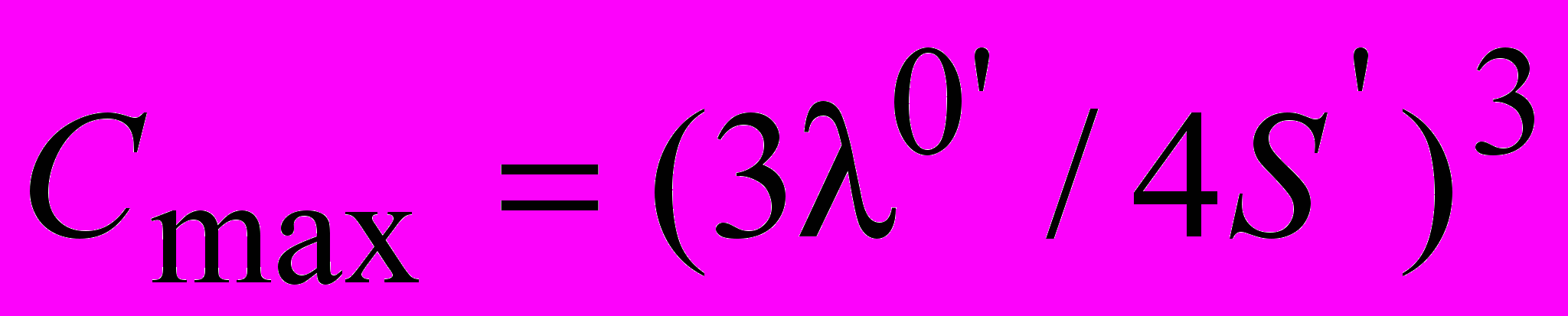 , (5)
, (5)которые оказываются близкими к экспериментальным значениям.
Найденная зависимость может быть использована для прогнозирования электропроводности в электролитных растворах, использующихся в практике. Линейный ход кривых =f(C1/3) был выявлен для литиевых солей в других полярных растворителях (таблица 2), в том числе и для водных растворов, где указанная зависимость соблюдается до очень высоких концентраций (вплоть до С=12 М). В апротонных растворителях при концентрациях больших ~ 1 m, зависимость отклоняется от линейной, видимо, вследствие заметного влияния поляризации ионов при их сближении.
Температурная зависимость транспортных свойств
И
а)
б)
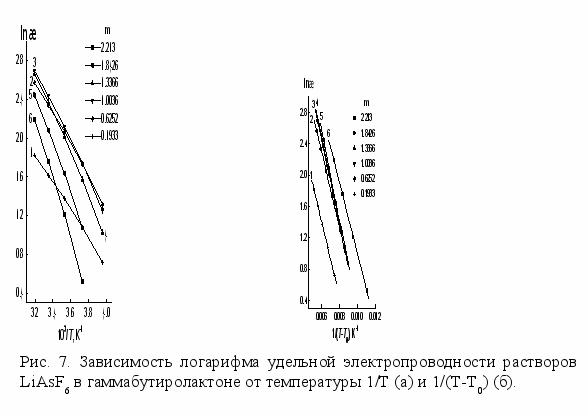
спользование неводных растворителей в литиевых источниках тока в широком интервале температур предопределяет необходимость изучения температурной зависимости транспортных свойств. Широко используемая зависимость Аррениуса в растворах LiAsF6 в ПК и -БЛ линейна далеко не во всем интервале температур (рис. 7а), что свидетельствует об изменении энергии активации процессов переноса в области пониженных температур.
Д
ля описания поведения электропроводности и текучести от температуры в данных системах было использовано уравнение Бартела, основанное на подходе Вогеля-Фульчера-Таммана (ВФТ) (6, 7), справедливое для полимерных и стеклообразных жидкофазных систем:
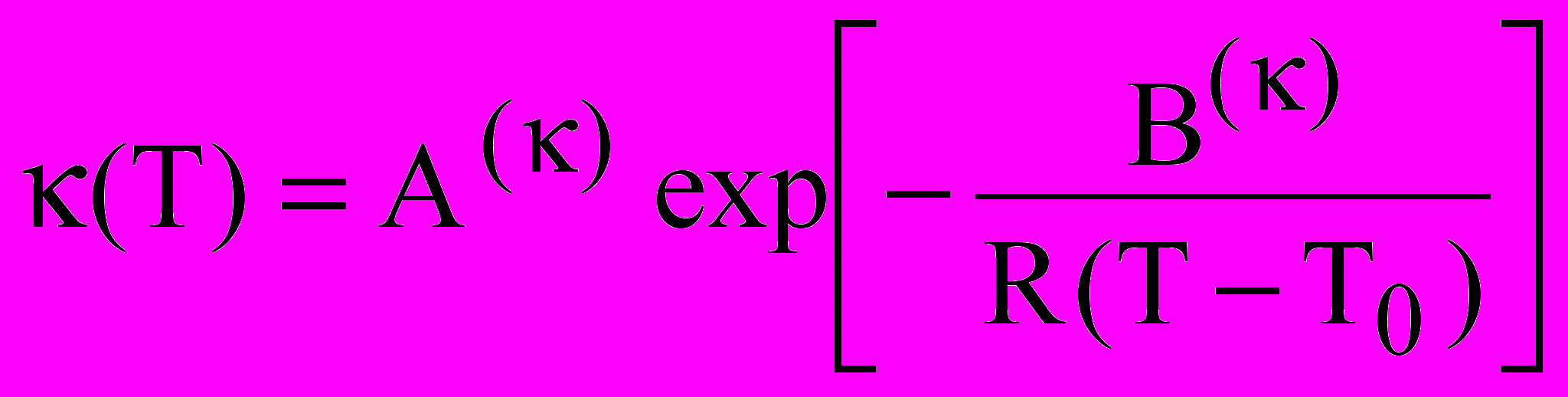 ; (6)
; (6)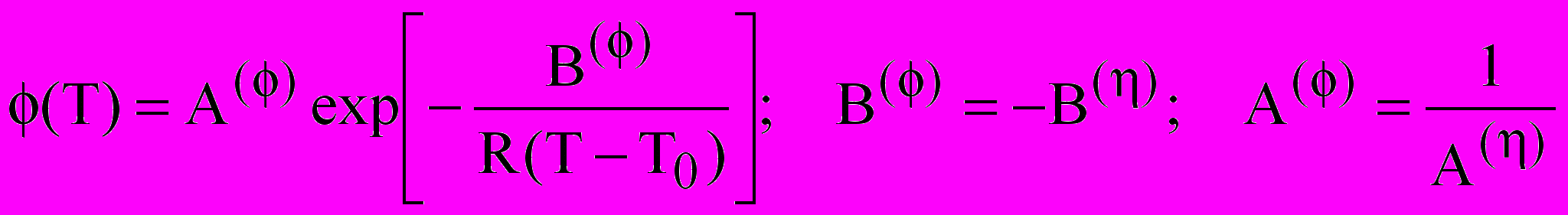 (7)
(7)где, Т0 - температура стеклования, Вm – величина, пропорциональная энергии активации, А - коэффициент, зависящий от концентрации. Зависимости логарифма как электропроводности (рис.7б), так и вязкости от 1/(Т-Т0) становятся линейными во всем интервале температур. Применение подхода (ВФТ) для описания транспортных свойств находится в согласии с моделью квазикристаллического строения электролитного раствора. Усиление квазикристалличности наблюдается с увеличением концентрации и понижением температуры. Температурная зависимость состояния раствора определяется свойствами растворителя, который характеризуется температурой стеклования, т. е. температурой при которой транспортные свойства стремятся к нулю. Важно отметить, что анализ данных электропроводности и вязкости растворов с использованием выражения ВФТ дает близкие значения температуры стеклования при бесконечном разбавлении T0(æ) = 101.32.2, T0() = 104.33.4 K для -БЛ и T0(æ) = 153.32.2, T0() = 151.33.4 K для ПК. Более высокая структурированность растворителя при пониженных температурах затрудняет транспорт ионов. При увеличении температуры кластеры растворителя, определяющие его структурированность разрушаются, что подтверждает изменение параметра
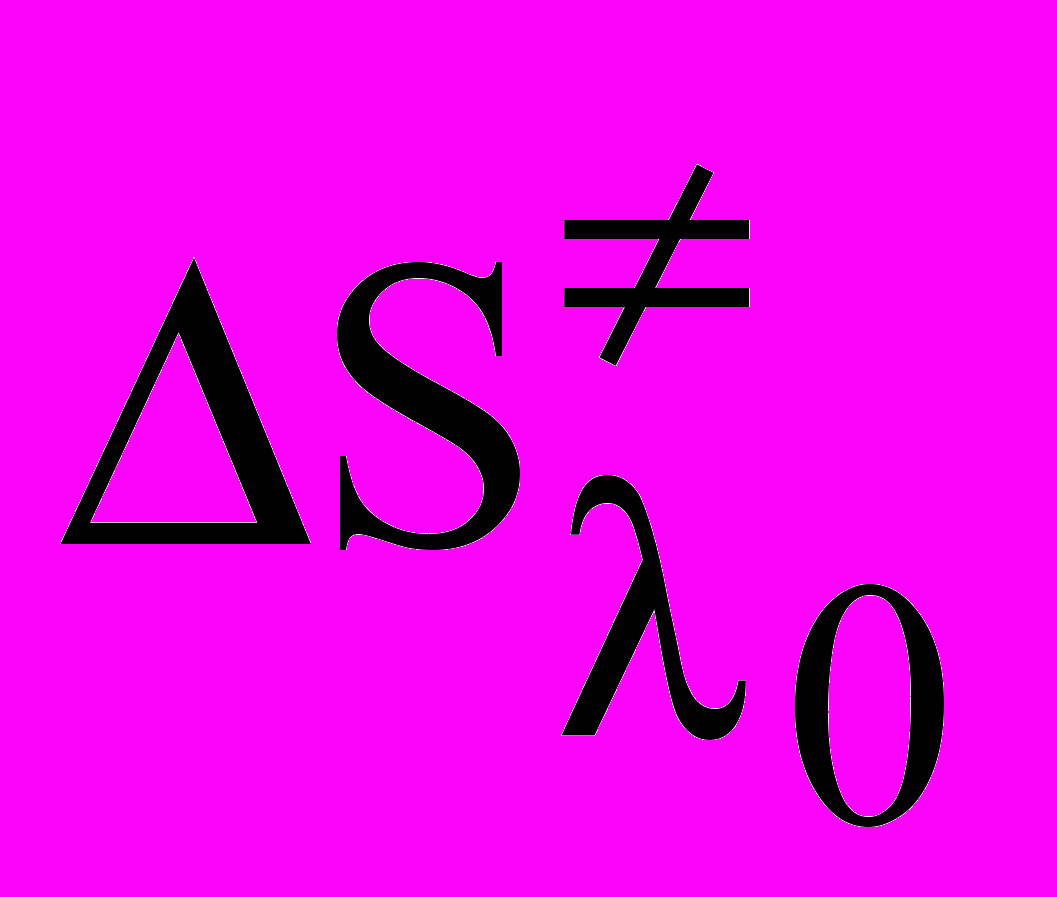 процесса электропроводности при бесконечном разбавлении от –2.3 Дж×моль-1×К-1 до –9.5 Дж×моль-1×К-1 для растворов -БЛ и особенно значительное изменение для ПК от 14.1 Дж×моль-1×К-1 до -13.9 Дж×моль-1×К-1 с ростом температуры от 253.15 К до 313.15 К. С увеличением концентрации электролита и уменьшением доли свободного растворителя, вследствие сольватации, стеклование наблюдается при более высоких температурах.
процесса электропроводности при бесконечном разбавлении от –2.3 Дж×моль-1×К-1 до –9.5 Дж×моль-1×К-1 для растворов -БЛ и особенно значительное изменение для ПК от 14.1 Дж×моль-1×К-1 до -13.9 Дж×моль-1×К-1 с ростом температуры от 253.15 К до 313.15 К. С увеличением концентрации электролита и уменьшением доли свободного растворителя, вследствие сольватации, стеклование наблюдается при более высоких температурах.Взаимосвязь транспортных свойств на основе метода рациональных параметров.
Одной из важных задач физико-химического анализа растворов электролитов является установление количественной взаимосвязи между различными свойствами. В настоящей работе поиск новых закономерностей проведен на основе метода рациональных параметров Афанасьева-Крестова. В качестве исследуемых параметров были выбраны молярное время распространения ультразвука (m), молярная вязкость (m) и молярная электропроводность ().
При рассмотрении исследуемых электролитных растворов в квазикристаллическом приближении и отождествлении их с системой колеблющихся гармонических осцилляторов в вязкой среде, предпринята попытка впервые применить к электролитным растворам соотношение между молярными параметрами m и Fm=mVm2/3, выведенное ранее для индивидуальных растворителей: m=A+BFm, где A, B - константы, m - молярная текучесть. С учетом полученных выше чисел сольватации LiAsF6 в ПК и -БЛ при вычислении молярных параметров m и m, установлено, что в изученных интервалах концентраций и температур для растворов LiAsF6 в неводных растворителях соблюдается линейный характер (R>0.998) зависимости m=f(Fm) (Рис. 8 ).
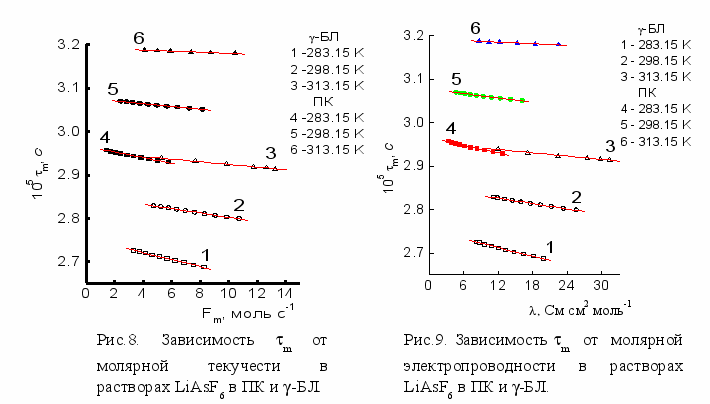
Выявленная линейная зависимость молярной характеристики распространения ультразвуковых колебаний (m) от кубического корня концентрации (C), на основе обобщения зависимостей =f(C1/3) и m=f(C1/3), позволила установить новую взаимосвязь между параметром m и величиной , которая носит линейный характер (R>0.996) в изученном концентрационном интервале при T=const: m=q+g, где q и g - константы (рис. 9).
Полученные результаты свидетельствуют, о наличии общих корреляций между молярными параметрами, что открывает возможности для оценки отдельных свойств растворов из экспериментальных данных других свойств.
Растворы LiAsF6 в тетрагидрофуране.
Наряду с концентрированными растворами LiAsF6 в ТГФ, имеющими практическое значение, нами были проанализированы кондуктометрические данные в области больщих разбавлений с использованием модели Ли – Уиттона, учитывающей диэлектрическое насыщение растворителя при его взаимодействии с электролитом. Предельная молярная электропроводность l0, константа ассоциации Ка и дистанционный параметр R (табл 3) были определены путем минимизации функции:
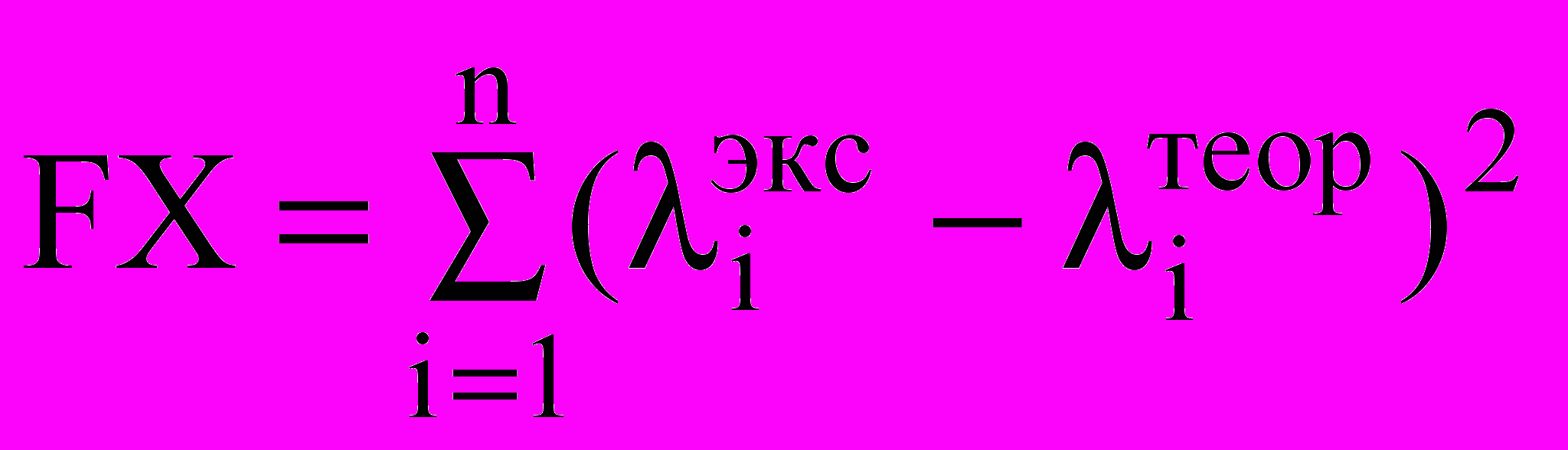
Таблица 3.
Молярные электропроводности, константы ассоциации LiAsF6 в ТГФ.
| Т, К | l0, См см2 моль-1 | Kа, дм3 моль-1 | s(l), См см2 моль-1 |
| 253.15 | 70.24.9 | (5.41.1) 104 | 0.049 |
| 283.15 | 74.54.4 | (9.91.7) 104 | 0.022 |
| 298.15 | 103.713 | (2.80.99) 105 | 0.084 |
Результаты расчета констант ассоциации свидетельствуют о значительных ион-ионных взаимодействиях LiAsF6 в ТГФ, то есть в данной области концентраций большая часть электролита находится в виде ионных ассоциатов. Для расчета были использованы экспериментальные данные при концентрациях, не превышающих, согласно Фуоссу, величину С = 2 3 10-7 M.
В растворах ТГФ константы ассоциации электролита растут с температурой в связи с усилением электростатического взаимодействия при уменьшении диэлектрической проницаемости раствора. Термодинамический анализ показал, что в ТГФ ассоциация LiAsF6 определяется энтропийным вкладом ( при Т=298.15 К Gасс= -33.01, Насс=36.5.4, ТSасс=69.5 кДж/моль), значения энтропии определяются разупорядочением растворителя в процессе десольватации ионов при образовании ионных пар. Большие величины полученных при аппроксимации дистанционных параметров могут свидетельствовать о том, что образующиеся ионные пары являются сольваторазделенными.
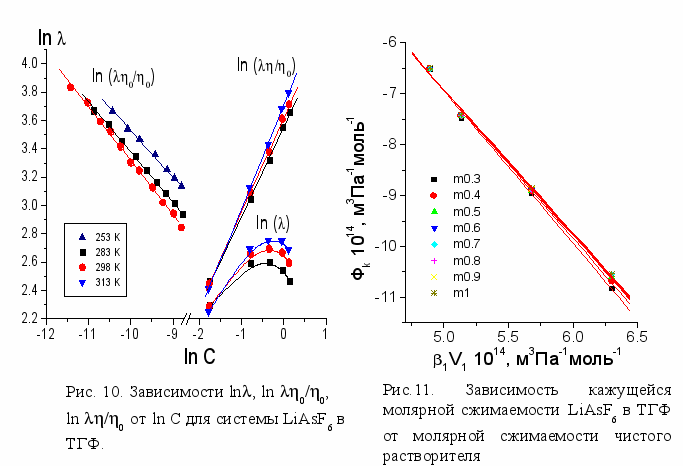
В отличие от растворов LiAsF6 в ПК и -БЛ, в ТГФ в области 0.1-0.8 М наблюдается рост молярной электропроводности при повышении концентрации электролита, известный в литературе как явление аномальной электропроводности. Появление максимума молярной электропроводности в области более высоких концентраций связано с возрастанием вязкости этих растворов. Действительно, на зависимости исправленной молярной электропроводности /0 при высоких концентрациях максимум пропадает (рис. 10).
С целью получения предварительной информации о процессах, происходящих в данной области концентраций, была исследована сольватация LiAsF6 в ТГФ. Зависимости кажущихся молярных объемов (рис. 1) и кажущихся молярных сжимаемостей LiAsF6 в ТГФ имеют вид аналогичный тем же зависимостям в ПК и -БЛ. Вместе с тем обращают на себя внимание значительно более низкие величины к,s и v, что указывает на более существенные, чем в случаях с ПК и -БЛ сольватационные взаимодействия.
Применение метода адиабатического сжатия к данной системе в области концентраций от 0.3 до 1m выявило, что зависимости к,s =f(s,1V1), характеризующие числа сольватации, близки к линейным, как и в случае растворов LiAsF6 в ПК и -БЛ (рис. 10). Полученные значения чисел сольватации в 3 раза превышают соответствующие величины в полярных растворителях, но
м
ало изменяются с ростом концентрации электролита (3.0-2.8). Это свидетельствует о том, что изменения, происходящие при увеличении концентрации в сольватных сферах ионов, не являются существенными. Вместе с тем, электропроводность при этих концентрациях возрастает в несколько раз. По-видимому, добавление электролита в этих условиях уменьшает расстояния между сольваторазделенными ионными парами и приводит к усилению их взаимодействий, вследствие чего ионы постепенно теряют принадлежность к одной паре. При этом состояние ионов начинает приближаться к квазикристаллическому и перенос ионов облегчается.Это достаточно простое умозаключение согласуется с современными представлениями о механизме увеличения молярной электропроводности с концентрацией в средах с низкой диэлектрической проницаемостью. В работах Сухотина А.М показано, что повышение электропроводности идет вследствие увеличения степени диссоциации электролита. Эбелинг У. и Григо М. считают, что этот процесс связан с редиссоциацией ионных пар, вызванной уменьшением коэффициента активности свободных ионов, определенного из принципа среднесферического приближения. В работах Петрукки С. и Эйринга Э. дана количественная трактовка понижения активности ионов и ионных пар, полученная на основе учета многочастичных взамодействий (ион-дипольных, диполь-дипольных, диполь-ионных, ион-ионных). Таким образом, можно придти к заключению о том, что характер концентрационной зависимости тесно связан со смещением равновесия
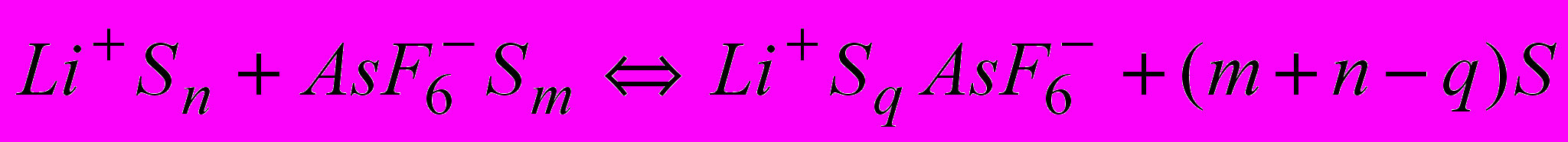 влево при высоких концентрациях электролита.
влево при высоких концентрациях электролита.Практическое использование полученных результатов
Для практического использования в диссертации приведены параметры полуэмпирического соотношения Кастелла-Амиса (8) для концентрационной зависимости удельной электропроводности в интервале концентраций от 0.01 до 1.5 m для растворов LiAsF6 в ПК, -БЛ, ТГФ при температурах 253.15 – 313.15 К.
/max = (m/mmax)аexp[b(m- mmax)2-a mmax -1(m- mmax)] (8)
где a, b - константы, mmax - концентрация раствора, соответствующая максимуму электропроводности (max).
Данные по динамической вязкости исследуемых растворов могут быть получены из представленных в диссертации коэффициентов модифицированного уравнения Анжелла:
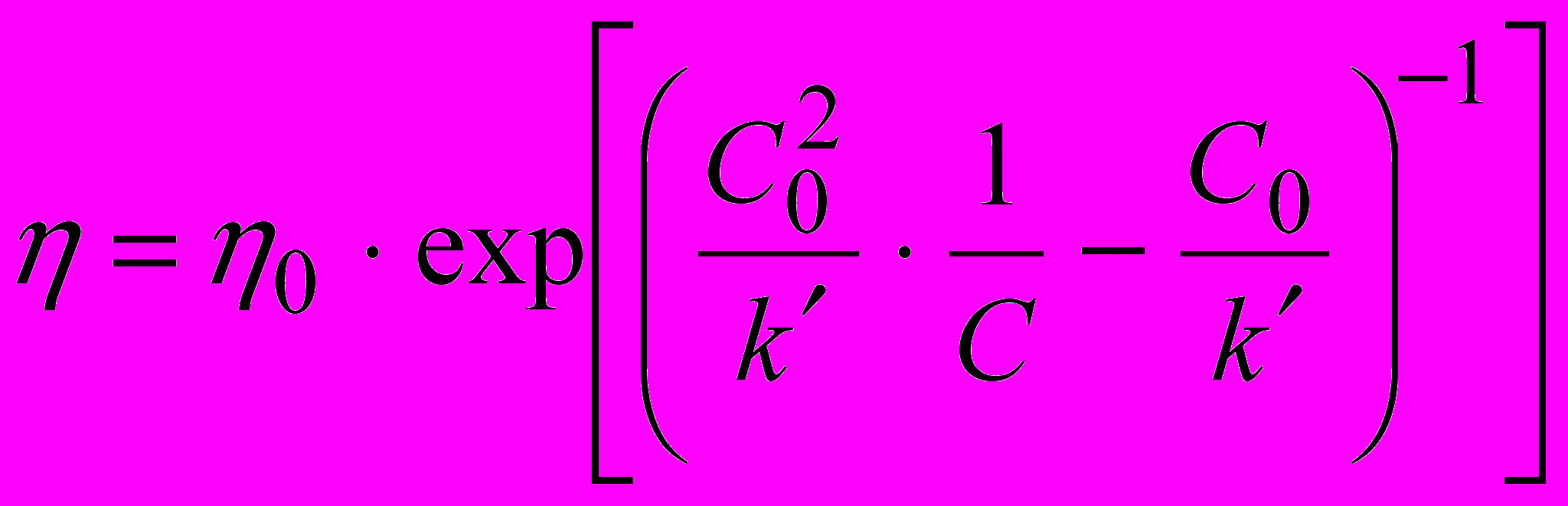 (9)
(9)где k’ - константа, C0 – гипотетическая концентрация, при которой раствор переходит в стеклообразное состояние. Найденные коэффициенты уравнений (8) и (9) могут быть использованы для оптимизации состава электролитных растворов при различных температурах.
В диссертации показано, что использование растворов LiAsF6 бинарного растворителя ПК с небольшими добавками малополярных эфиров (ТГФ, 1,2-ДМЭ) (2.5 – 10 %) существенно улучшает циклические свойства лития, что может быть связано с особенностями поверхностного слоя, образованного продуктами взаимодействия лития с ТГФ и повышением транспортных характеристик электролита. В небольших количествах ТГФ, выполняя роль «предшественника», реагирует с литием быстрее, чем ПК. Скорость коррозии лития, определенная нами, близка к 0.03 мАсм-2 в ТГФ и 0.01мАсм-2 в ПК. Следствием этого является образование пленок с высокой проводимостью по иону Li+, а также улучшение морфологии поверхности лития. При содержании в смеси более 10% ТГФ циклические свойства лития снижаются вследствие ухудшения коррозионной стойкости лития.
ИТОГИ РАБОТЫ
- Получены прецизионные данные по плотности, скорости распространения ультразвука и вязкости при 283-313 К и удельной электропроводности при 253-313 К в системах LiAsF6 в пропиленкарбонате, гаммабутиролактоне и тетрагидрофуране в области разбавленных и концентрированных растворов.
- Кондуктометрическим методом определены константы ассоциации и предельные молярные электропроводности LiAsF6 в -БЛ и ТГФ по модели Ли-Уиттона при разных температурах. Установлено, что в -БЛ электролит мало ассоциирован в изученном интервале температур, а в ТГФ константа ассоциации повышается от 5.4104 до 2.8105 л/моль при изменении температуры от 253 до 298 К.
- Обнаружено, что концентрационная зависимость молярной электропроводности LiAsF6 в ПК и -БЛ линеаризуется в координатах -С1/3. Впервые установлено, что эта зависимость является достаточно общей для растворов литиевых солей в апротонных диполярных растворителях с высокой в области технологически значимых концентраций в широком интервале температур.
- Показано, что температурная зависимость электропроводности и вязкости растворов LiAsF6 в -БЛ, так же как и в ПК, при высоких концентрациях подчиняется уравнению Вогеля-Фульчера-Таммана, применяемого к полимерным и стеклообразным системам.
- Впервые метод изоэнтропийного сжатия применен для исследования сольватации электролитов в неводных растворителях в области концентраций, реально применяемых в литиевых ХИТ. Определены структурные характеристики образуемых сольватных комплексов LiAsF6 в ПК и -БЛ: числа сольватации (h), молярные адиабатические сжимаемости сольватного комплекса (s,hVh) и растворителя в сольватной сфере (s,1hV1h).
- Установлено, что числа сольватации LiAsF6 практически не зависят от температуры при постоянной концентрации электролита. Полученные значения h уменьшаются с концентрацией и существенно меньше по величине чисел гидратации солей лития в воде. Молярная сжимаемость растворителя в сольватных комплексах составляет 80-90% от молярной сжимаемости чистого растворителя (ПК, -БЛ).
- Обнаружено, что LiAsF6 в ТГФ значительно более сольватирован, чем в ПК и -БЛ. Методом адиабатической сжимаемости рассчитаны числа сольватации LiAsF6 в ТГФ, которые близки к 3 и мало изменяются с концентрацией. Показано, что рост молярной электропроводности с концентрацией может быть связан с усилением диссоциации ионных пар.
- Впервые установлены линейные корреляции между молярными параметрами распространения звуковой волны, вязкого течения и проводимости, что расширяет возможности прогнозирования отдельных физико-химических свойств из экспериментального определения других.
- Использование бинарного растворителя ПК-ТГФ с небольшим содержанием ТГФ (2.5- 10%) существенно улучшает циклические свойства лития.
Основное содержание диссертации опубликовано в работах:
- Афанасьев В.Н., Зятькова Л.А., Тюнина Е.Ю., Чекунова М.Д. Сольва тационные взаимодействия в растворах гексафторарсената лития в пропиленкарбонате // Электрохимия, 2001, т. 37, № 1, с. 56-63.
- Афанасьев В.Н., Зятькова Л.А., Чекунова М.Д. Температурная зависимость транспортных свойств и ион-молекулярные формы LiAsF6 в - бутиролактоне // Электрохимия, 2002, т. 38, № 7, с. 876-882.
- Зятькова Л.А., Афанасьев В.Н., Чекунова М.Д. Электрохимическое поведение лития в растворах LiAsF6 на основе пропиленкарбоната и его смесей с малополярными эфирами // Изв. Вузов. Химия и хим. технология. 2002, т. 45, Вып. 6, с. 21-25.
- Афанасьев В.Н., Зятькова Л.А., Чекунова М.Д., Тюнина Е.Ю. Реализация высоких технологических характеристик растворов электролитов на основе изучения термодинамических и транспортных свойств // VII Международный Фрумкинский симпозиум «Фундаментальная электрохимия и электрохимическая технология» Тез. докл. - Москва , 2000, ч. 2, с. 50-51.
- Чекунова М.Д., Афанасьев В.Н., Зятькова Л.А. Эффективность циклирования лития в многокомпонентных эфирных растворителях //Международная научная конференция студентов, аспирантов и молодых ученых «Молодая наука - веку». Тез. докл. - Иваново, 2001, с.107-108.
- Афанасьев В.Н., Зятькова Л.А., Чекунова М.Д. Электролиты для химических источников тока. Термодинамические и транспортные свойства растворов LiAsF6 в пропиленкарбонате и -бутиролактоне // II Международный симпозиум «Приоритетные направления в развитии химических источников тока» .Тез. докл. - Плес, 2001, с. 62-63.
- Афанасьев В.Н., Зятькова Л.А., Чекунова М.Д. Кондуктометрическое исследование гексафторарсената лития в гаммабутиролактоне. // VIII Международная конференция «Проблемы сольватации и комплексообразования в растворах». Тез. докл. - Иваново, 2001. с. 295.
- Афанасьев В.Н., Зятькова Л.А., Чекунова М.Д. Взаимосвязь транспортных и термодинамических свойств LiAsF6 а апротонных растворителях. // VII Международная конференция «Фундаментальные проблемы преобразования энергии в литиевых электрохимических системах» Тез. докл.- Саратов , 2002. с. 62-64.
