Термохимия растворения ccl 4, бензола и его производных в индивидуальных и смешанных растворителях 02. 00. 04 физическая химия
| Вид материала | Автореферат |
- Координационная химия и реакционная способность смешанных ацидопорфириновых комплексов, 804.83kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Физико-химический анализ растворов liAsF 6 в некоторых апротонных растворителях 02., 281.37kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Физико-химические закономерности удерживания производных адамантана в высокоэффективной, 432.05kb.
- Программа дисциплины дпп. Ф. 05 Физическая химия, 267.17kb.
- Тематический план лекций Модуль Физическая химия для студентов 2 курса фармацевтического, 23.81kb.
- Экспериментальное исследование процессов фотодиссоциации гетероароматических азидов, 375.96kb.
На правах рукописи
КАШИНА Юлия Анатольевна
ТЕРМОХИМИЯ РАСТВОРЕНИЯ CCL4, БЕНЗОЛА И ЕГО ПРОИЗВОДНЫХ В ИНДИВИДУАЛЬНЫХ И СМЕШАННЫХ РАСТВОРИТЕЛЯХ
02.00.04 – физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново - 2007
Работа выполнена в Институте химии растворов Российской Академии наук
Научный руководитель
доктор химических наук, профессор Королев Валерий Павлович
Официальные оппоненты:
доктор химических наук,
старший научный сотрудник Агафонов Александр Викторович
Институт химии растворов
Российской Академии наук
доктор химических наук,
старший научный сотрудник Леденков Сергей Федорович
Ивановский государственный
химико-технологический университет
Ведущая организация
Государственное образовательное учреждение высшего профессионального образования Саратовский государственный университет им. Н. Г. Чернышевского
Защита состоится 12 декабря 2007 г. в 10 часов на заседании диссертационного совета Д 002.106.01, Институт химии растворов РАН, 153045 г. Иваново, ул. Академическая, 1
С диссертацией можно ознакомиться в библиотеке Института химии растворов Российской Академии наук
Автореферат разослан 9 ноября 2007 года
Ученый секретарь
диссертационного совета Ломова Т. Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы определяется важностью разработки методов исследования структуры жидкостей с помощью метода молекулярного зонда. Использование молекулярных зондов имеет большое распространение в спектральных методах (сольватохромные индикаторы) и при исследовании структуры материалов. Вместе с тем, актуальной является задача разработки теоретических основ метода молекулярного зондирования на базе исследования энергетических - энтальпийных характеристик сольватации. В качестве молекулярных зондов, как правило, используются молекулы, обладающие высокой симметрией и химической инертностью; альтернативно, могут использоваться образцовые молекулы – доноры или акцепторы электронов – для разработки шкал полярности растворителей или сравнения реакционной способности веществ. Молекулы четыреххлористого углерода (ССl4) и бензола (С6Н6) обладают высокой молекулярной симметрией и часто рассматриваются в качестве инертных при изучении разнообразных химических реакций.
Работа выполнена в соответствии с планом НИР ИХР РАН по теме “Термодинамика, структура и реакционная способность в многокомпонентных жидкофазных системах”. Номер госрегистрации 0120. 0 602029. Работа была частично поддержана Российским фондом фундаментальных исследований (Грант № 06-03-32169).
Цель работы. Изучение закономерностей процесса сольватации ССl4 и ароматических соединений при 298.15 К в индивидуальных и смешанных растворителях на основе данных калориметрического эксперимента.
Для этого требовалось решить следующие задачи:
- калориметрическим методом при 298.15 К определить энтальпии растворения ССl4, бензола, хлорбензола (С6Н5Сl) и анилина (С6Н5NH2) в индивидуальных и смешанных растворителях на основе спиртов, н-алканов и ряда апротонных растворителей;
- выявить преобладающий тип (специфический или неспецифический) межмолекулярных взаимодействий растворитель - растворитель и растворитель - растворенное вещество;
- выявить основные закономерности влияния природы растворителей и растворенных веществ на энтальпийные характеристики;
- в рамках имеющихся в литературе моделей исследовать взаимосвязь между термодинамическими характеристиками двойных и тройных систем.
Научная новизна. Впервые калориметрическим методом при 298.15 К измерены энтальпийные характеристики 40 тройных систем на основе ССl4, бензола, хлорбензола, анилина, спиртов, простых эфиров, амидов, ацетона, воды и алканов. Получены эмпирические уравнения, основанные на формализме Редлиха - Кистера, описывающие избыточные энтальпии растворения неэлектролитов в бинарных растворителях.
Показано, что свойства молекулярного зонда являются важными при изучении энергетики взаимодействия в растворах в связи с возможными специфическими взаимодействиями.
Получено единое уравнение, описывающее энтальпии растворения ССl4 в 7 бинарных системах спирт - спирт и спирт - алкан на основе представлений о концентрации гидроксильных групп в бинарной смеси. Получены зависимости, описывающие энтальпии растворения бензола и его монофункциональных производных в неводных смешанных растворителях н-алкан – 1-алканол + 1-алканол – метанол.
Практическая значимость. Полученные экспериментальные результаты существенно пополняют банк термодинамических данных. Они развивают теоретические представления о структуре и межмолекулярных взаимодействиях в двойных и тройных системах. Предложенное уравнение позволяет рассчитывать величины энтальпий растворения ССl4 в системах спирт - спирт и спирт - алкан.
Апробация работы. Основные положения диссертации докладывались и
обсуждались на: II Международной научно-технической конференции “Актуальные проблемы химии и химической технологии “Химия - 99” (Иваново, 1999); Международной студенческой конференции “Развитие, окружающая среда, химическая инженерия” (Иваново, 2000); Международной научной конференции “Кинетика и механизм кристаллизации” (Иваново, 2000); VIII, Х Международной конференции “Проблемы сольватации и комплексообразования в растворах” (Иваново, 2001; Суздаль, 2007); I Региональной конференции молодых ученых “Теоретическая и экспериментальная химия жидкофазных систем”, Крестовские чтения, (Иваново, 2006). По теме диссертации опубликовано: 4 статьи и тезисы восьми докладов.
Личный вклад автора. Экспериментальное исследование и обработка полученных данных проведены лично соискателем. Планирование эксперимента, анализ результатов исследования, формулирование основных выводов диссертации выполнено совместно с научным руководителем доктором химических наук, профессором Королевым В.П.
Структура и объем диссертации. Работа состоит из введения, литературного обзора, экспериментальной части, обсуждения результатов, выводов, списка цитируемой литературы (260 источников) и приложения. Диссертация содержит 26 таблиц, 40 рисунков.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность работы, ее цель, научная новизна и практическая значимость.
Обзор литературы состоит из трех глав: “Физико-химические свойства, структурные особенности и строение индивидуальных растворителей”, “Характеристики растворенных веществ, свойства и особенности их взаимодействия с индивидуальными и смешанными растворителями” и “Термодинамические характеристики и структура бинарных смесей”. В первой главе рассматриваются особенности структуры и физико-химические свойства 1-алканолов, н-алканов, формамида (ФА) и некоторых апротонных растворителей. Во второй главе описано строение молекул ССl4, бензола, его хлор- и аминопроизводных, физико-химические свойства и применение данных веществ. В третьей главе проведен обзор теоретических и экспериментальных исследований свойств смесей на основе спиртов, алканов, ФА и некоторых апротонных растворителей.
Экспериментальная часть содержит описание калориметрической установки, методики проведения эксперимента и обработки экспериментальных данных, а также оценки погрешностей. Охарактеризованы использованные в работе вещества, способы их очистки и оценка чистоты. Градуировку калориметра проводили в соответствии с рекомендациями IUPAC*. Из табл. 1 видно, что наши и литературные данные хорошо согласуются**.
Таблица 1. Стандартные теплоты растворения веществ в индивидуальных растворителях
| Растворитель | ССl4 | Бензол | Хлорбензол | Анилин |
| Метанол | -0.58; -0.55а | 1.48; 1.55б; 1.51в | 0.71; 0.88б | -2.39; -2.59в |
| 1-Бутанол | -0.08; -0.20а | 2.28; 2.51б | 1.77 | 3.32 |
| 1-Деканол | 1.07 | 3.00 | 1.94 | 4.98 |
| н-Гексан | 1.05 | 3.16 | 2.94 | 14.60 |
| н-Декан | 1.21 | 2.94 | 2.89 | 13.49 |
а - J. Solut. Chem., 1987. V. 16. N 1. P. 39; б- J. Phys. Chem., 1971. V. 75. N 23. P. 3598; в- Can. J. Chem., 1985. V. 63. P. 2540.
В разделе “Обсуждение результатов” проведен анализ полученных данных.
Особенности сольватации веществ в индивидуальных растворителях
Различное поведение зависимостей энтальпий растворения С6Н14 и ССl4*** от числа атомов углерода в молекуле спирта (рис. 1а) указывает на различный характер взаимодействия данных соединений со спиртами. Для выяснения природы взаимодействия спиртов с ССl4 в диссертации рассмотрены параметры их основности (β) и кислотности (α, ЕтN).
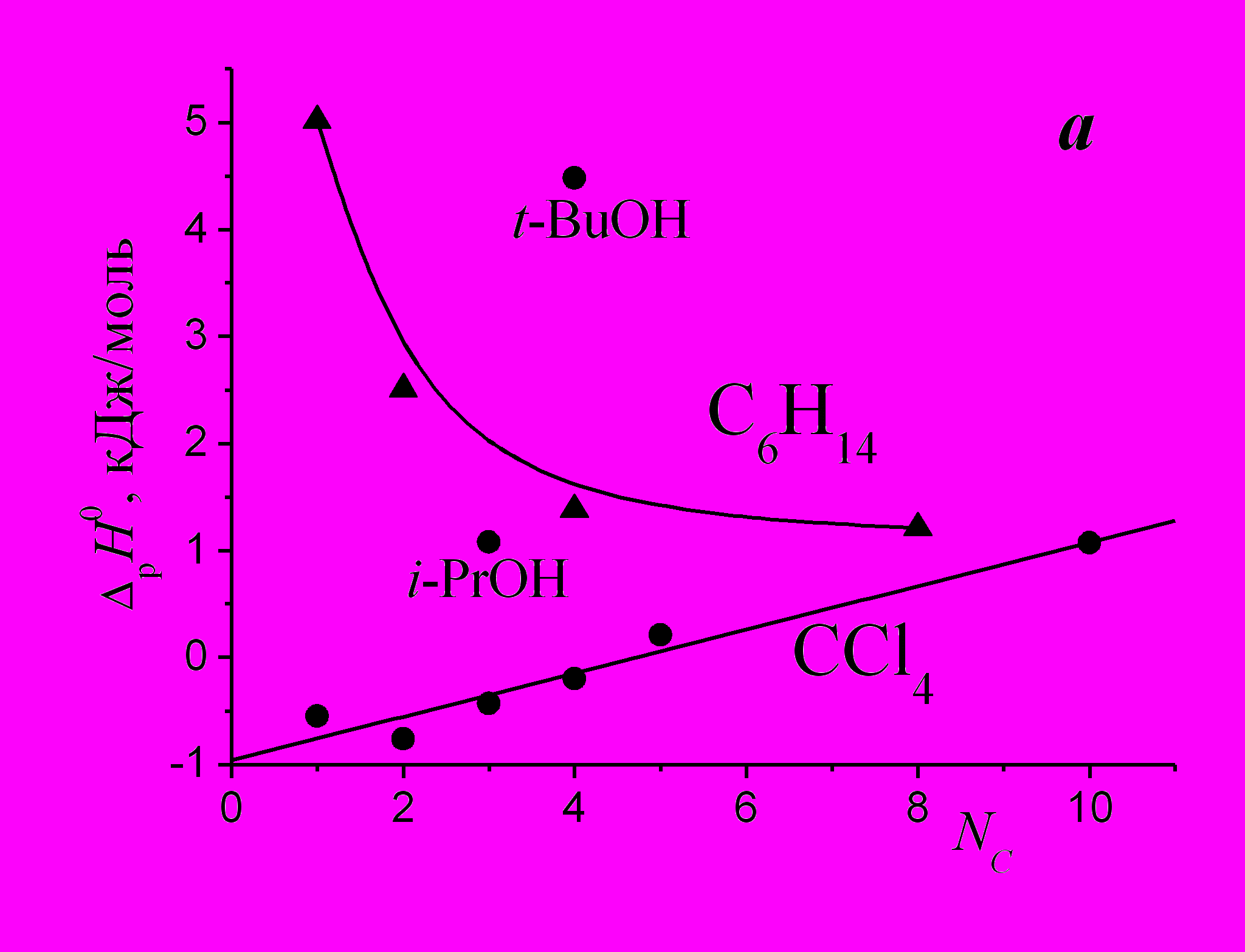 | 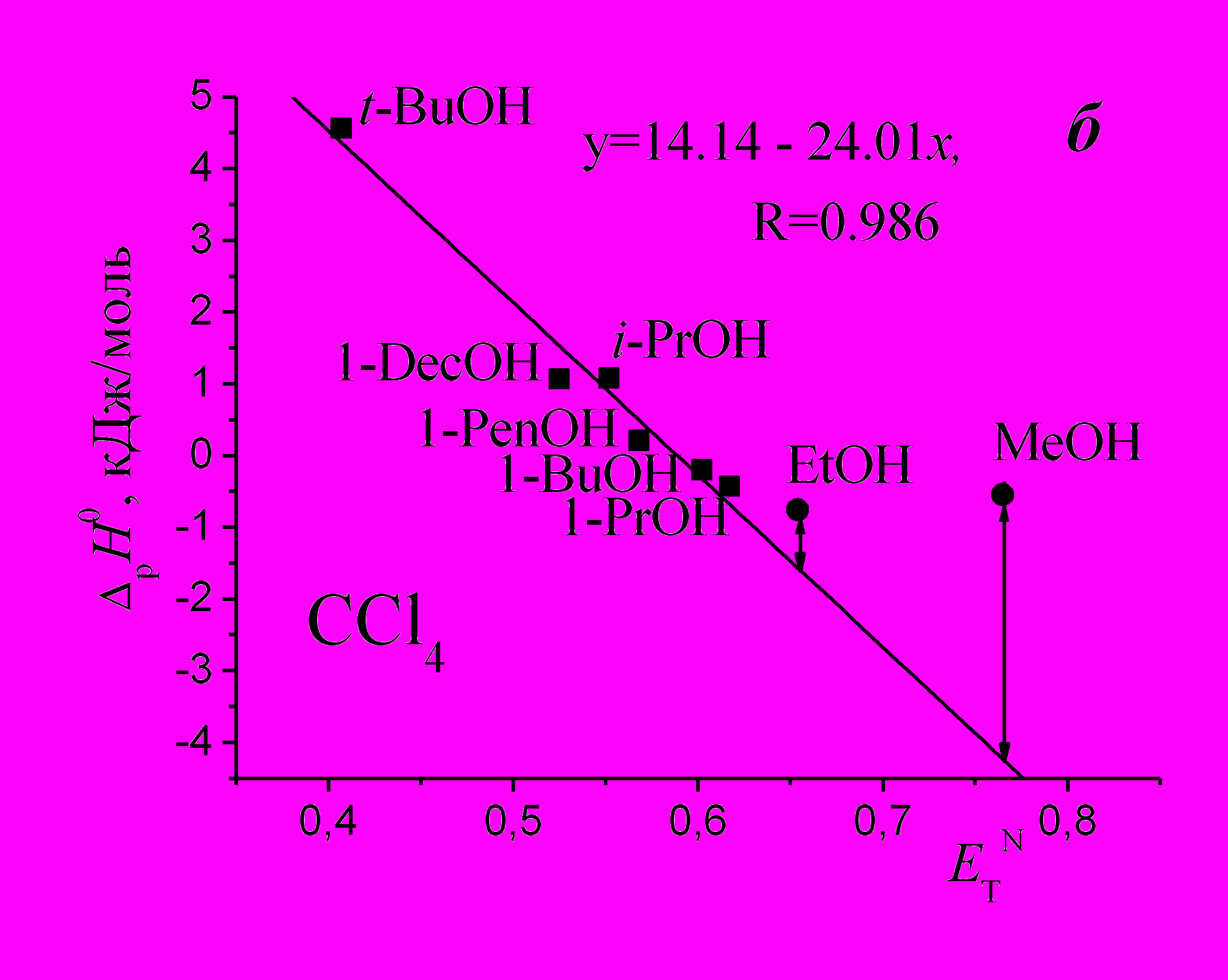 |
| Рис. 1. Зависимости энтальпий растворения веществ в спиртах от числа атомов углерода в молекуле растворителей (а) и параметра Димрота-Рейхардта (б), R – коэффициент корреляции. | |
Однопараметровое приближение ΔрН0 = f(ЕтN) хорошо описывает энтальпию растворения ССl4 в шести спиртах, включая изомеры (рис. 1б). Отклонение метанола и этанола от линейной зависимости можно объяснить дополнительным разрушением части Н-связей в этих наиболее ассоциированных спиртах.
Известно*, что параметр ЕтN отражает кислотность (акцепторную способность) растворителей, а преимуществом ЕтN-шкалы является ее чувствительность. Анализ зависимости на рис. 1б позволяет сделать вывод о проявлении Н-акцепторных свойств ССl4 в спиртах, что является косвенным подтверждением выводов о существовании водородной связи между спиртами и ССl4**, несмотря на то, что донорное число ССl4 (DNSbCl5) равно нулю.
На рис. 2а показана зависимость энтальпий растворения бензола от энтальпий растворения ССl4 в ряду спиртов***. Как видно, только метанол и этанол являются исключениями из линейной зависимости, объединяющей 4 спирта.
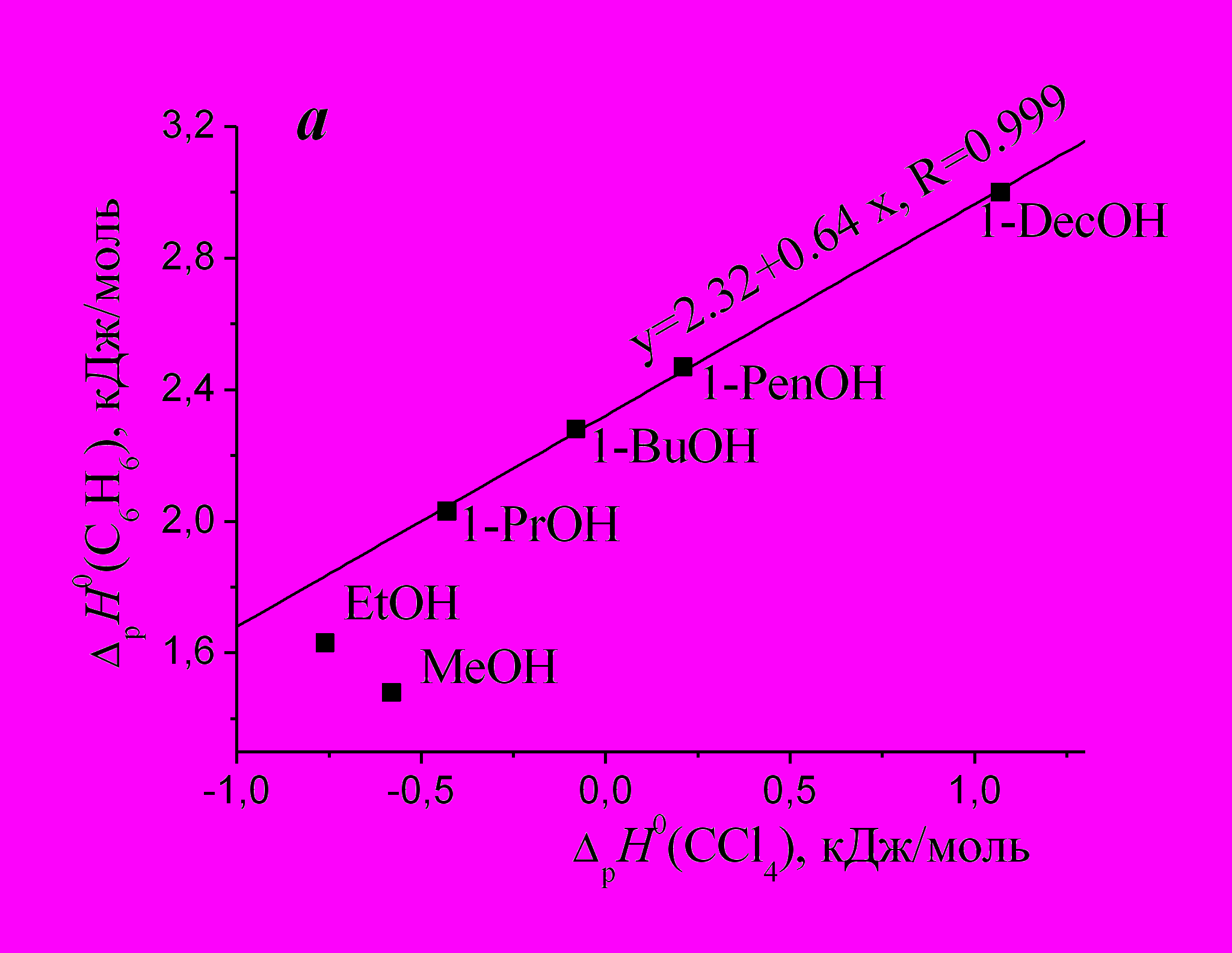 | 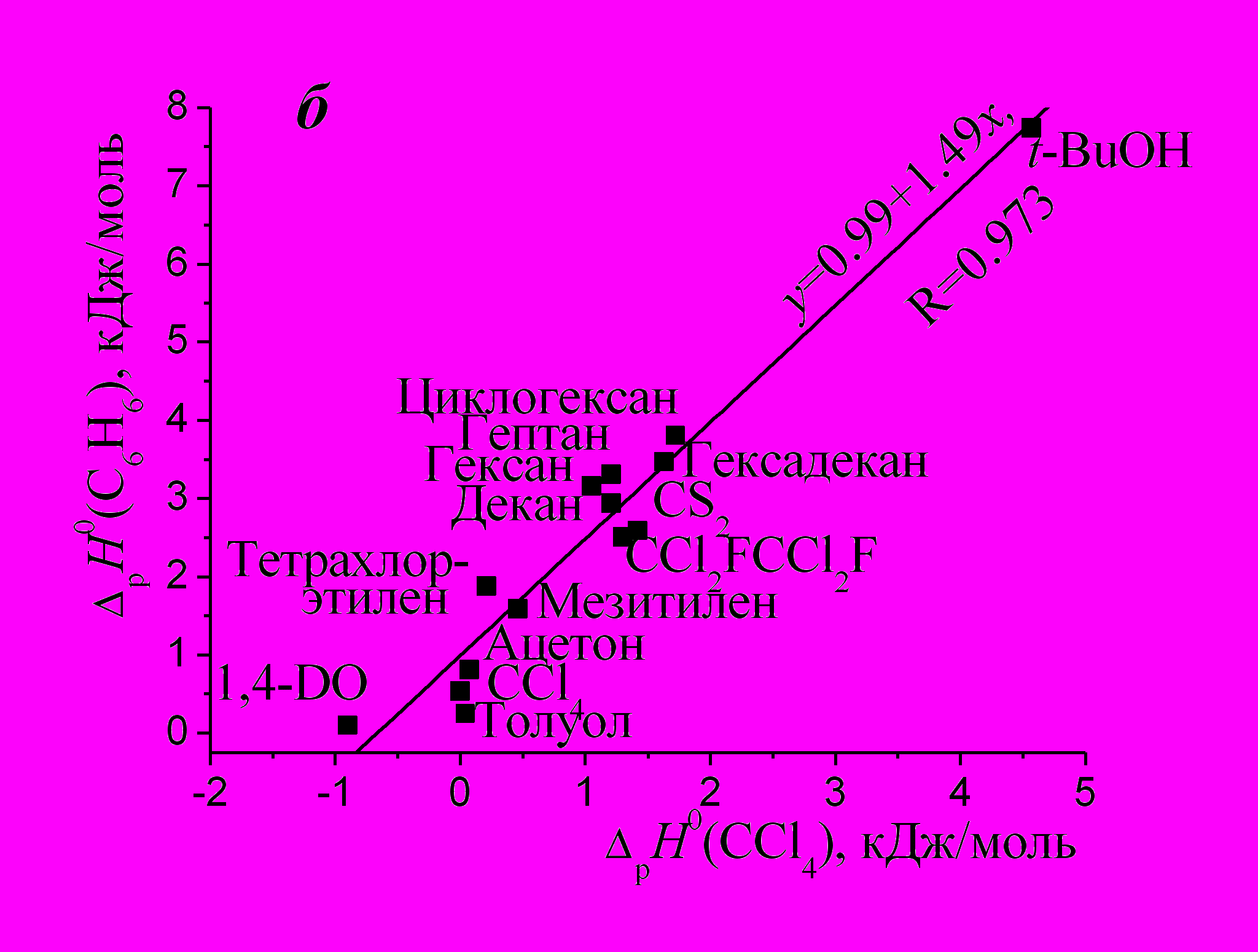 |
| Рис. 2. Взаимосвязи энтальпий растворения бензола и ССl4 в ряду 1-алканолов (a) и апротонных растворителей (б). | |
На рис. 2б представлена линейная зависимость для энтальпий растворения бензола и ССl4 в 14 растворителях*. Можно сделать вывод, что данные вещества проявляют схожие свойства в ряду спиртов и апротонных растворителей, а также, что закономерности сольватационных процессов в индивидуальных растворителях, характерные для ССl4, будут выполняться и для бензола. Следует отметить, что зависимостей ΔрН0 (C6H6)= f (ΔрН0 (алкан)) в ряду спиртов и апротонных растворителей не обнаружено, тогда как для линейных алканов и циклогексана указанные зависимости существуют.
Далее в диссертации рассмотрена проблема расчета вкладов образования полости и взаимодействий растворитель - растворенное вещество в рамках теории Скетчарда - Гильдебранда. Показано, что для 1-алканолов расчет завышает энтальпию сольватации (делает ее менее отрицательной). Для н-алканов, 1-деканола и t-BuOH теория регулярных растворов переоценивает по модулю значения ΔсН0.
Термохимия растворения ССl4, бензола, хлорбензола и анилина в смешанных растворителях
Стандартные значения энтальпий растворения веществ в бинарных растворителях ΔpН0 = f(Х) заданы уравнением (1). Здесь и далее Х – мольная доля компонента, записанного вторым. Для описания избыточных характеристик использовано уравнение Редлиха - Кистера (2), коэффициенты которого для изученных систем представлены в табл. 2 и 3.
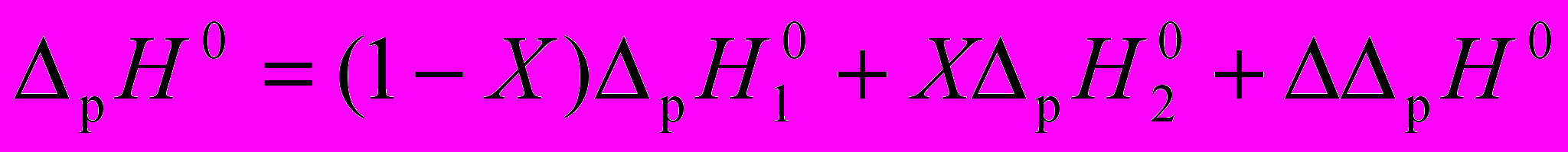 (1)
(1)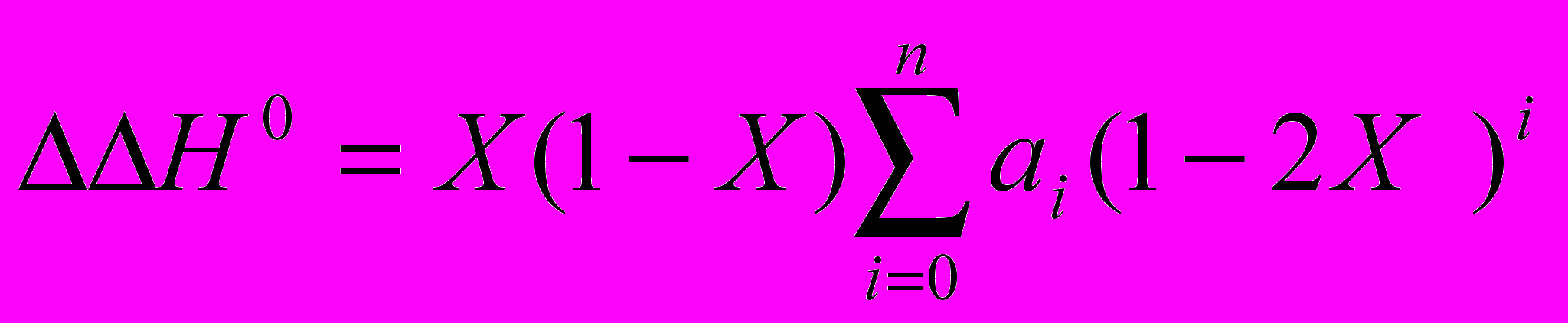 (2)
(2)На рис. 3 показаны энтальпии сольватации ССl4 в бинарном растворителе метанол - 1-бутанол, рассчитанные по соотношению (1) с использованием (2). Для сравнения приведены энтальпии сольватации циклогексана системой метанол - 1-бутанол*. Видно, что по отношению к циклогексану, неспецифически взаимодействующему с растворителем, 1-бутанол обладает большей сольватирующей способностью, чем метанол. По отношению к ССl4 большей сольватирующей способностью обладает метанол, кислотные свойства которого наиболее выражены в ряду одноатомных спиртов. Экзотермичность сольватации циклогексана усиливается во всем интервале составов смеси метанол - 1-бутанол, тогда как экзотермичность сольватации ССl4 сначала несколько усиливается, а затем ослабляется. Это можно объяснить тем, что наряду со специфическим взаимодействием ССl4 (основание) – спирт (кислота) (см. рис. 1б) имеет место взаимодействие ССl4 (кислота) – растворитель (основание), величина которого изменяется с составом смешанного растворителя. Также можно предположить, что добавление к метанолу 1-бутанола разрушает Н-ассоциаты метанола, что приводит к усилению сольватации растворяемых соединений за счет уменьшения эндовклада образования полости и, возможно, за счет усиления неспецифического взаимодействия растворяемого соединения с тем спиртом, который имеет больший углеводородный радикал. Вероятно, совместным действием обоих указанных факторов объясняется усиление сольватации циклогексана во всем интервале составов смеси метанол - 1-бутанол.
Таблица 2. Коэффициенты аi уравнения (2) и их стандартные отклонения
для ССl4
| Растворитель | а1 | а2 | R | sf |
| 1-Бутанол - н-гексан | 2.53±0.06 | | 0.999 | 0.05 |
| 1-Бутанол - н-декан | 2.86±0.14 | | 0.996 | 0.00 |
| 1-Деканол - н-гексан | 0.51±0.01 | 0.19±0.01 | 0.999 | 0.00 |
| 1-Деканол - н-декан | 0.57±0.09 | | 0.934 | 0.03 |
| Метанол - 1-бутанол | -0.61±0.03 | -1.01±0.09 | 0.999 | 0.01 |
| Метанол - 1-деканол | -0.78±0.21 | -2.39±0.55 | 0.991 | 0.09 |
| 1-Бутанол - 1-деканол | 0.51±0.07 | | 0.999 | 0.02 |
| Метанол - диизопропиловый эфир | -0.77±0.02 | 0.49±0.04 | 0.999 | 0.01 |
| 1-Бутанол - диизопропиловый эфир | 0.20±0.02 | 0.33±0.07 | 0.999 | 0.01 |
| 1-Бутанол - диизоамиловый эфир | 0.65±0.05 | 0.58±0.14 | 0.996 | 0.02 |
| 1-Деканол - диизопропиловый эфир | -1.29±0.10 | | 0.999 | 0.04 |
| 1-Деканол - диизоамиловый эфир | -0.62±0.09 | | 0.997 | 0.03 |
Примечание. Х – мольная доля компонента, записанного вторым; sf – погрешность аппроксимации (кДж/моль).
Таблица 3. Коэффициенты аi уравнения (2) для С6Н6, С6Н5Сl, С6Н5NН2
| Растворитель | а0 | а1 | а2 | R | sf | |
| Бензол | ||||||
| МеОН – 1-BuOH | -1.27±0.10 | -0.31±0.25 | | 0.997 | 0.03 | |
| MeOH – 1-DecOH | -1.24±0.18 | -1.46±0.40 | | 0.996 | 0.07 | |
| 1-BuOH - 1-DecOH | 0.99±0.07 | -0.65±0.18 | | 0.998 | 0.02 | |
| 1-BuOH - н-гексан | 4.49±0.21 | 1.28±0.52 | | 0.995 | 0.07 | |
| 1-BuOH – н-декан | 4.04±0.11 | - | 3.79±0.46 | 0.999 | 0.03 | |
| 1-DecOН - н-гексан | 1.19±0.11 | 1.09±0.27 | | 0.977 | 0.04 | |
| 1-DecOH - н-декан | 1.33±0.02 | -1.69±0.03 | 2.00±0.07 | 0.999 | 0.00 | |
| Хлорбензол | ||||||
| МеОН – 1-BuOH | -3.01±0.10 | 1.94±0.29 | | 0.997 | 0.04 | |
| MeOH – 1-DecOH | -1.98±0.38 | -2.00±0.86 | -6.42±2.28 | 0.988 | 0.12 | |
| 1-BuOH – 1-DecOH | -1.84±0.09 | -0.62±0.22 | | 0.994 | 0.03 | |
| 1-BuOH – н-гексан | 3.09±0.26 | -1.65±0.42 | 2.23±0.82 | 0.996 | 0.07 | |
| 1-BuOH – н-декан | 2.29±0.14 | -1.65±0.42 | 2.22±0.82 | 0.996 | 0.07 | |
| 1-DecOН – н-гексан | 0.71±0.20 | -1.53±0.34 | 2.45±0.68 | 0.996 | 0.05 | |
| 1-DecOH – н-декан | 0.76±0.09 | -0.41±0.21 | | 0.998 | 0.03 | |
| Анилин | ||||||
| МеОН - 1-BuOH | -1.22±0.38 | | | 0.999 | 0.12 | |
| MeOH – 1-DecOH | 1.32±0.38 | | | 0.999 | 0.14 | |
| 1-BuOH – 1-DecOH | -2.36±0.17 | 2.82±0.42 | | 0.997 | 0.06 | |
| 1-BuOH – н-гексана | -10.17±0.91 | 14.24±1.55 | -12.76±3.34 | 0.999 | 0.23 | |
| 1-BuOH – н-декан | -6.68±0.31 | 8.65±0.79 | | 0.999 | 0.11 | |
| 1-DecOН – н-гексан | -16.40±1.24 | 11.54±3.08 | | 0.997 | 0.42 | |
| 1-DecOH – н-декан | -10.22±0.51 | 7.20±1.29 | | 0.999 | 0.17 | |
Примечание. а - использованы литературные данные (ЖПХ, 2006. T. 79. C. 215).
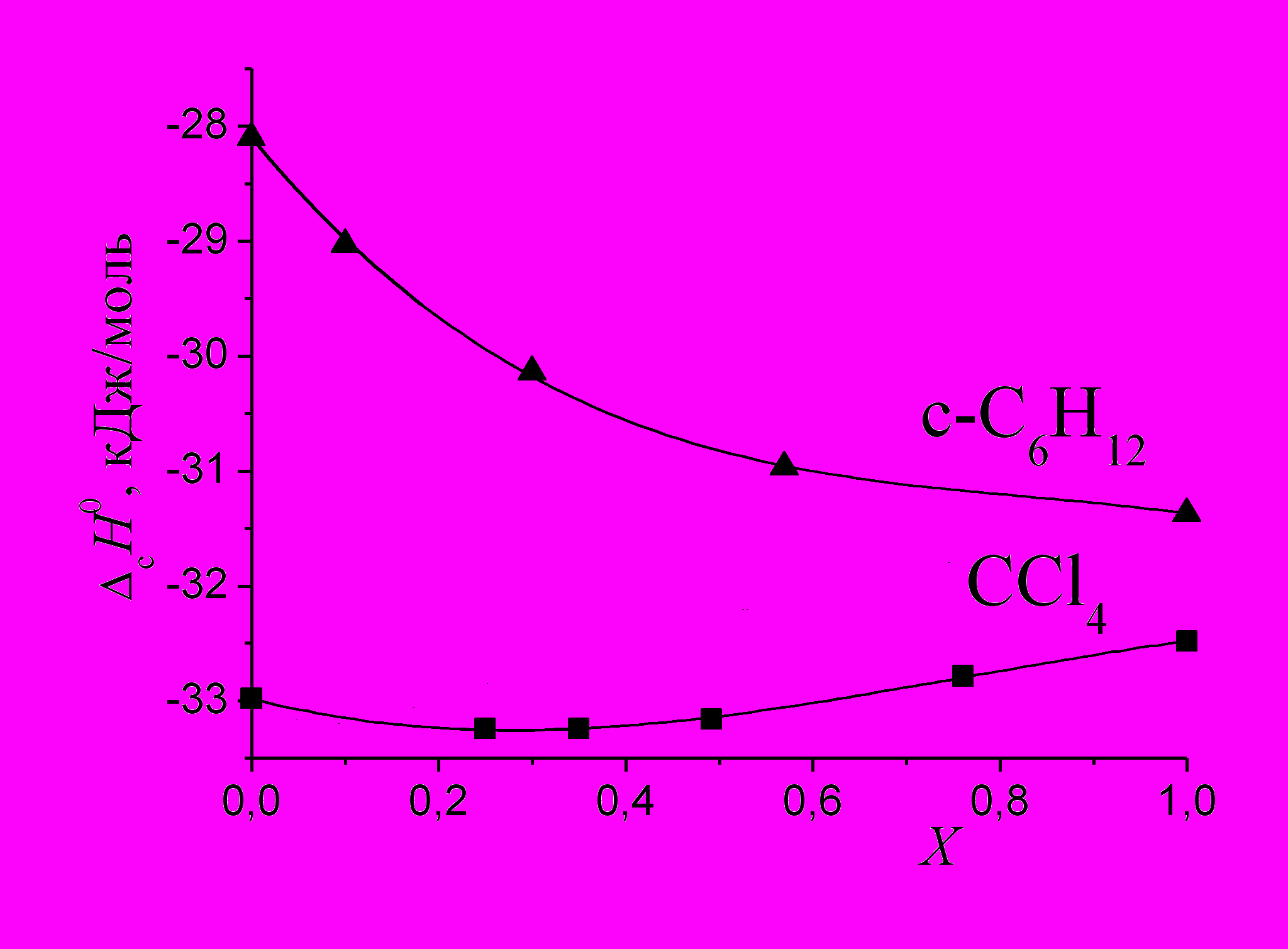 | 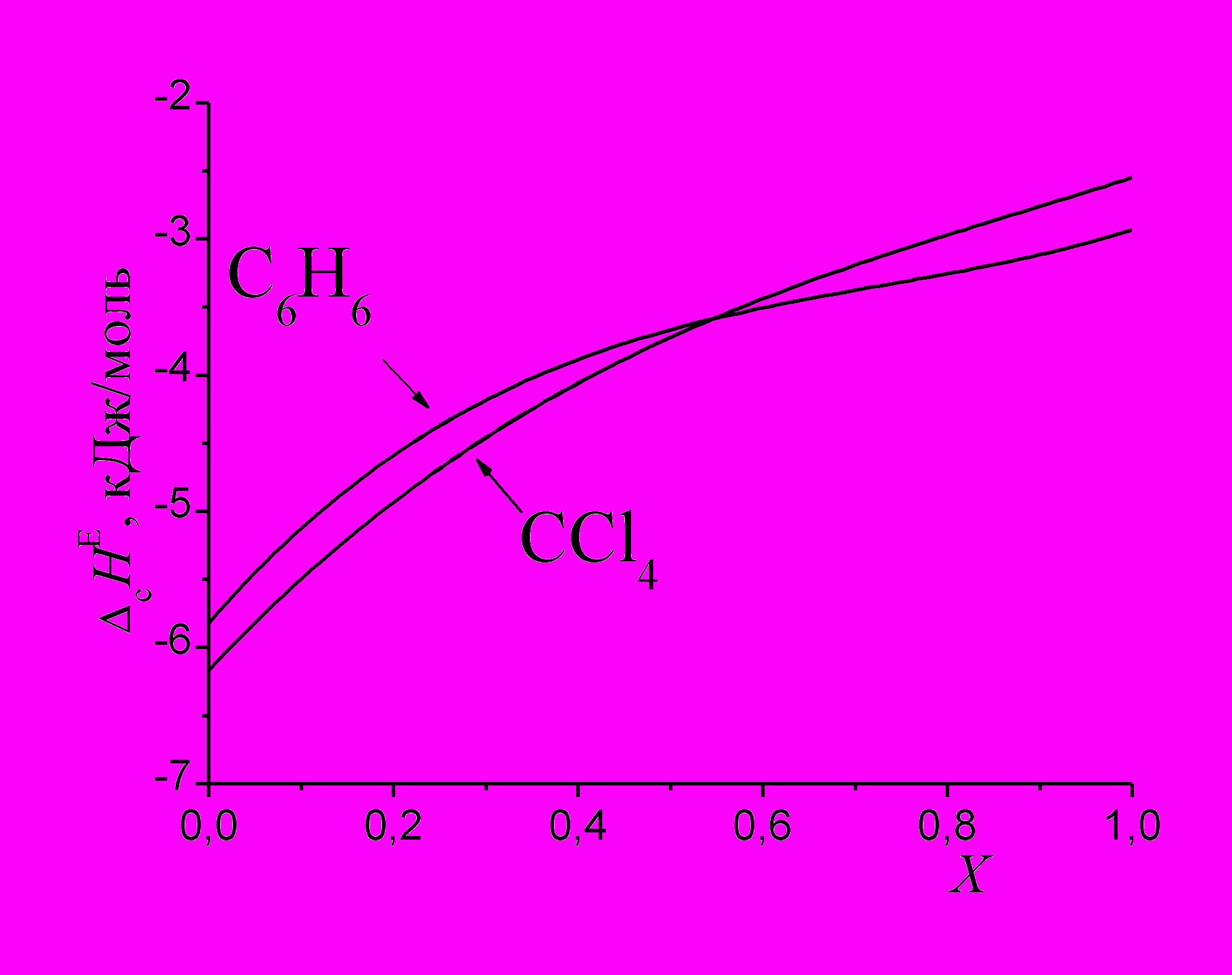 |
| Рис. 3. Энтальпии сольватации ССl4 и циклогексана в системе метанол - 1-бутанол. | Рис. 4. Разности энтальпий сольватации ССl4 и циклогексана, а также бензола и циклогексана в смеси метанол - 1-бутанол. |
На рис. 4 показаны разности энтальпий сольватации ССl4, бензола и циклогексана в смеси метанол - 1-бутанол, рассчитанные с учетом поправки на различия молярной рефракции циклогексана и исследуемых соединений. Видно, что указанные характеристики отрицательны во всей области составов смешанного растворителя, причем в метаноле они более отрицательны, чем в 1-бутаноле, что согласуется с параметрами ЕТN спиртов.
Нами были определены теплоты растворения ССl4 в бинарных смесях метанола с водой (при Хвода<0.68 м. д.), гексаном (при Хгексан<0.15 м. д. и Хгексан>0.80 м. д.), а также ацетоном. Соответствующие аппроксимирующие зависимости приведены в диссертации. Добавки воды к метанолу приводят к резкому росту эндотермичности энтальпии переноса с максимумом при Хвода=0.55 м. д., что, согласно Паттерсону*, свидетельствует о сильном структурировании метанола добавками воды (рис. 5). Добавки гексана, 1-деканола и ацетона к спирту приводят к незначительному увеличению энтальпии переноса ССl4 из метанола в его смеси с данными растворителями. Во всех четырех указанных системах энтальпийный фактор противодействует переносу ССl4 из метанола в бинарные смеси. Энтальпии переноса ССl4 из
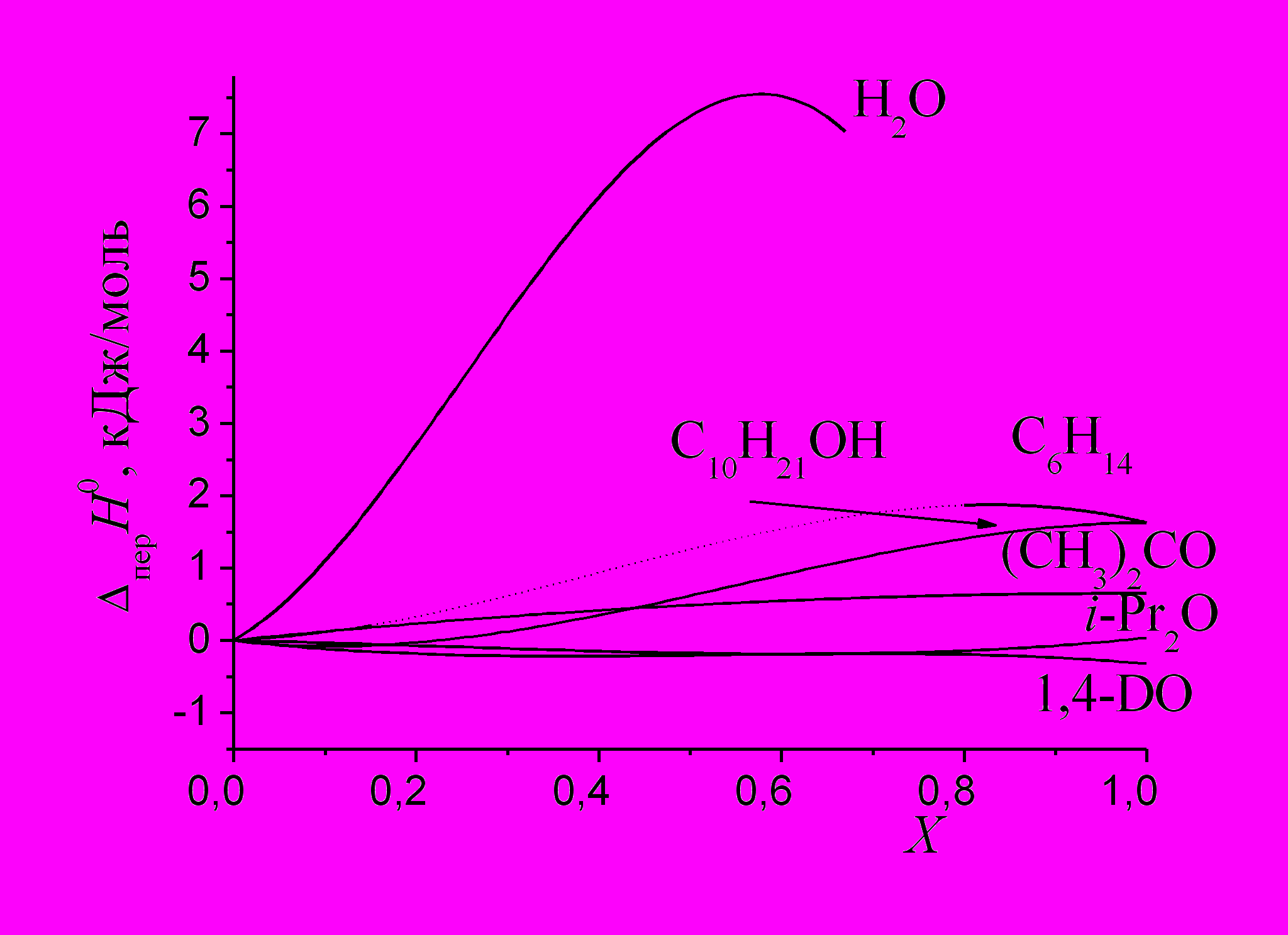 |
| Рис. 5. Зависимости энтальпий переноса ССl4 из метанола в его смеси с различными растворителями. |
На рис. 6 и 7 показаны зависимости энтальпий переноса ССl4 и хлорбензола из 1-бутанола в бинарные смеси. Во всех изученных нами системах спирт-алкан имеет место максимум эндотермичности переноса ССl4 (рис. 6) и хлорбензола (рис. 7). Общей причиной, приводящей к ослаблению сольватации СCl4 при разбавлении 1-бутанола как 1-деканолом, так и алканами, является уменьшение кислотности растворителя. Возникновение максимума эндотермичности переноса ССl4 и хлорбензола в области большого содержания алканов может быть объяснено содержанием максимального количества циклических ассоциатов (например, тетрамеров) в смеси спирт - алкан, которые в отличие от линейных не содержат концевых ОН-групп и не способны быть донором протона без разрыва водородной связи спирт - спирт. Дальнейшее увеличение содержания алкана в смеси спирт - алкан приводит к появлению мономеров спирта и к некоторому усилению сольватации ССl4 и хлорбензола. Смесь 1-бутанола с диизопропиловым эфиром обнаруживает монотонное усиление сольватирующей способности смеси по сравнению с чистым спиртом на всем интервале составов смешанного растворителя, что можно объяснить балансом взаимодействий, в которых ССl4 выступает как основание или как кислота. Кроме того, может уменьшаться энтальпия образования полости в растворителе при сольватации ССl4. Добавление к 1-бутанолу метанола усиливает сольватацию ССl4 и хлорбензола, причем она усиливается в большей степени, чем это следует из условия аддитивности. Энергия слабого специфического взаимодействия, в котором ССl4 является акцептором электронов, а диизоамиловый эфир - донором электронов примерно равна -1.6 кДж/моль (рис. 6). Зависимости энтальпий переноса бензола из 1-бутанола в его смеси со спиртами и алканами имеют схожий вид и обсуждаются в диссертации.
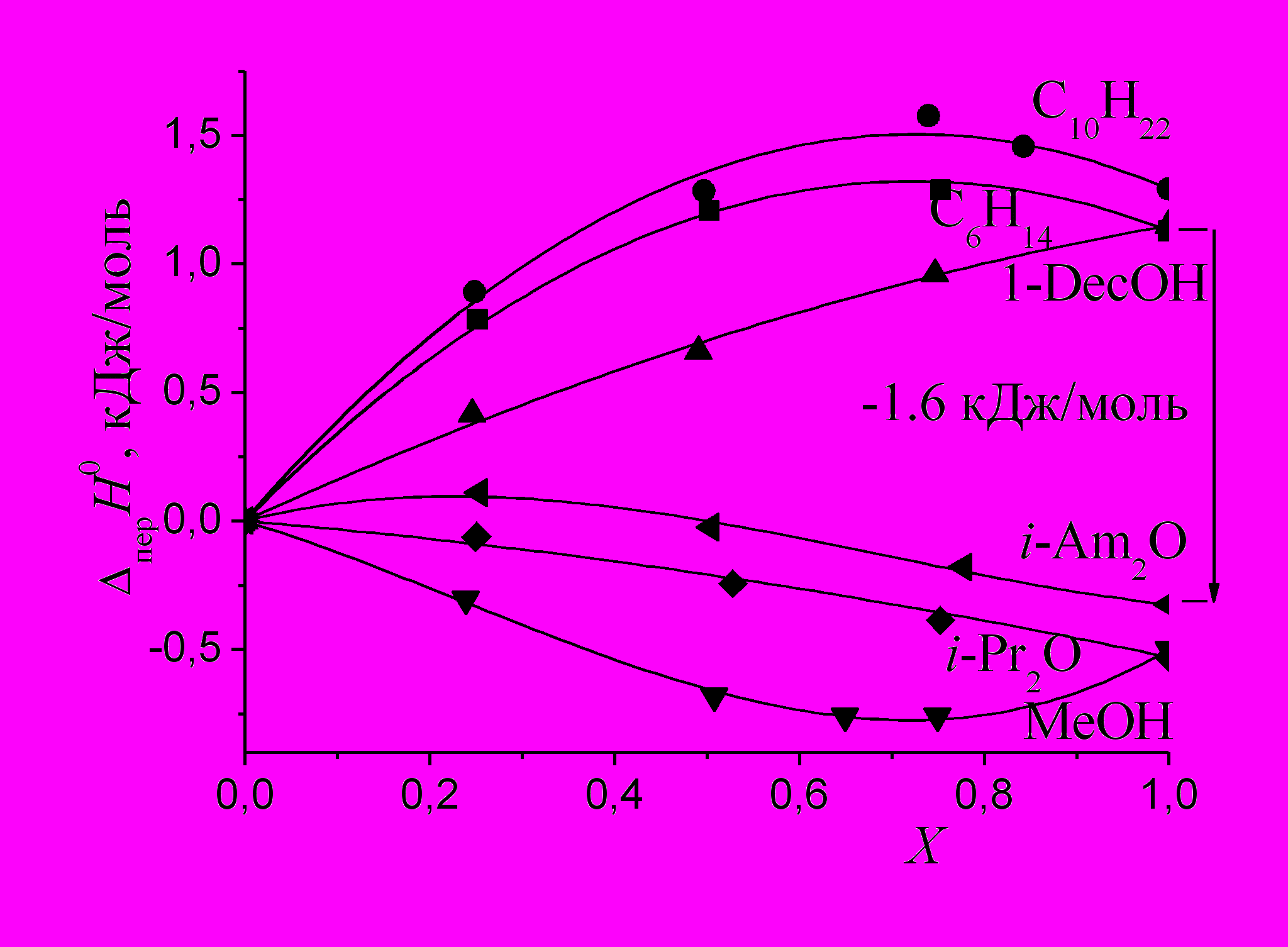 | 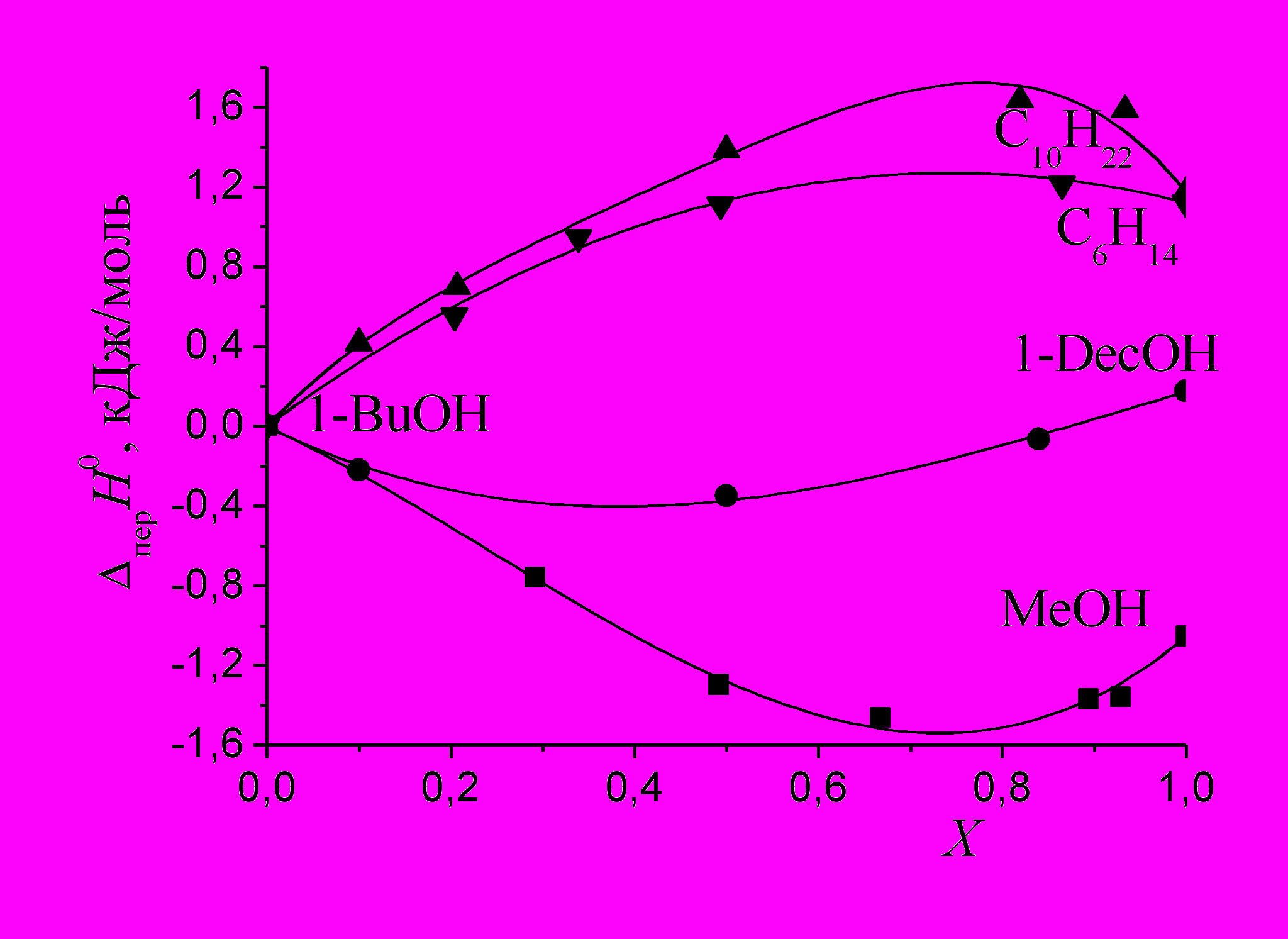 |
| Рис. 6. Энтальпии переноса ССl4 из 1-бутанола в его смеси с алканами, спиртами и эфирами. | Рис. 7. Энтальпии переноса хлорбензола из 1-бутанола в его смеси со спиртами и алканами. |
В диссертации рассмотрена сольватация бензола, хлорбензола и анилина смесью метанол - 1-деканол. Показано, что ΔсН0 = f(Х) становится более экзотермичной в ряду: бензол, хлорбензол, анилин, что согласуется с их донорно - акцепторной способностью. То есть введение -Сl и -NH2 групп в бензольное кольцо приводит к усилению сольватации растворенных веществ смешанным растворителем.
Важной задачей является нахождение взаимосвязи между энтальпийными характеристиками сольватации растворенного вещества и ее избыточными свойствами. С этой целью в главе “Характеристики межмолекулярного взаимодействия в бинарных и тройных системах и подходы к их описанию” применены некоторые предложенные в литературе эмпирические уравнения*. Показано, что предложенные ранее подходы ограниченно применимы для описания избыточных энтальпий ССl4, бензола и алканов в изученных системах.
Описание энтальпий растворения CCl4, бензола, хлорбензола и анилина в объединенных системах спирт - спирт и спирт - алкан
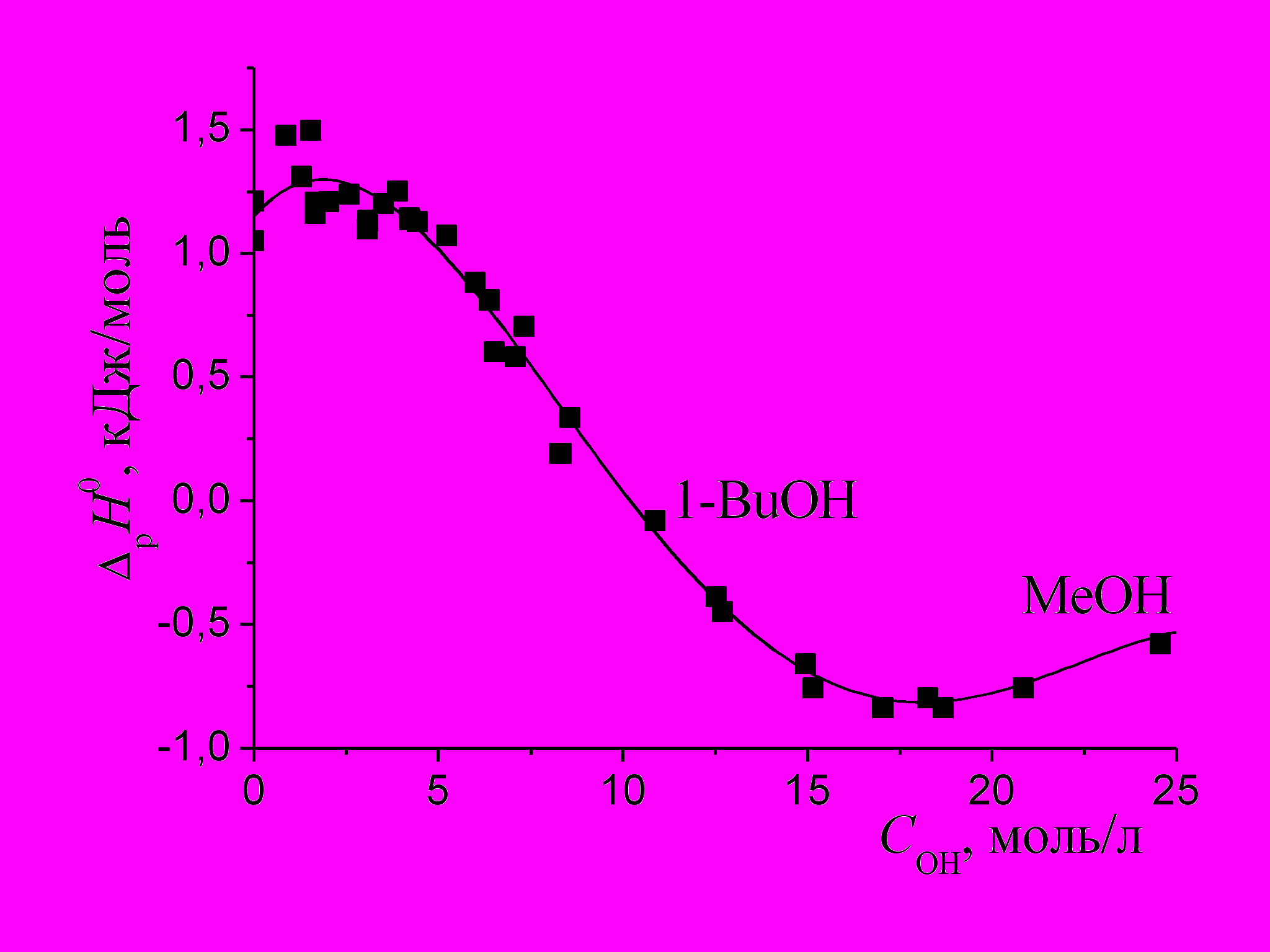 |
| Рис. 8. Зависимость энтальпий растворения ССl4 в системах спирт - спирт и спирт -алкан от молярной концентрации гидроксильных групп в растворе. |
ΔрН0 = (1.150 ± 0.041) + (0.165 ± 0.028) СОН - (0.0515 ± 0.0053) С2ОН +
+(0.00285 ± 0.00036) С3ОН – (50±8)·10-6 С4ОН (3)
R = 0.993, sf = 0.09 кДж/моль, Nточек = 44.
Уравнения (1) и (2) требуют в качестве аргумента долевой шкалы. Чтобы их использовать для объединенных систем сделан переход от СОН к новой независимой переменной – относительной доле гидроксигрупп в растворе (ХОН). Ее рассчитывали как отношение молярной концентрации гидроксильных групп в растворе к молярной концентрации гидроксигрупп в метаноле. Соответствующие коэффициенты уравнения (2) представлены в табл. 4.
Таблица 4. Коэффициенты аi, (кДж/моль) уравнения (2)
| Группы бинарных смесей | Бензол | Хлорбензол | |||||||||
| -а0 | а1 | а2 | а3 | R | sf | -а0 | а1 | а2 | R | sf | |
| (C10H22-C4H9OH) +(C4H9OH-CH3OH) | 0.85 ±0.23 | 7.27 ±0.66 | 8.02 ±1.35 | - | 0.994 | 0.11 | 3.03 ±0.12 | 6.13 ±0.28 | 3.08 ±0.59 | 0.998 | 0.06 |
| (С6Н14-C4H9OH) +(C4H9OH-CH3OH) | 1.08 ±0.16 | 7.11 ±0.44 | 6.98 ±0.90 | - | 0.997 | 0.08 | 2.99 ±0.26 | 8.95 ±0.92 | 7.30 ±2.05 | 0.989 | 0.13 |
| (C10H22-C10H21OH)+ (C10H21OH-CH3OH) | 2.76 ±0.29 | - | 6.91 ±1.22 | 11.39 ±1.24 | 0.994 | 0.10 | 6.59 ±0.36 | 2.72 ±0.78 | 4.94 ±1.47 | 0.993 | 0.14 |
На рис. 9а показаны зависимости ΔрН0 = f(ХОН) для бензола и хлорбензола в системе, включающей две подсистемы растворителей: н-декан (ХОН=0) – 1-бутанол и 1-бутанол - метанол (ХОН=1). Здесь точки при ХОН=0.44 соответствуют 1- бутанолу. Зависимости ΔрН0 = f(ХОН) для бензола и хлорбензола в системах н-гексан - 1-бутанол + 1-бутанол - метанол и н-декан - 1- деканол + 1-деканол - метанол имеют аналогичный характер, с тем, однако, отличием, что в области малых добавок 1-деканола к н-декану максимум отсутствует.
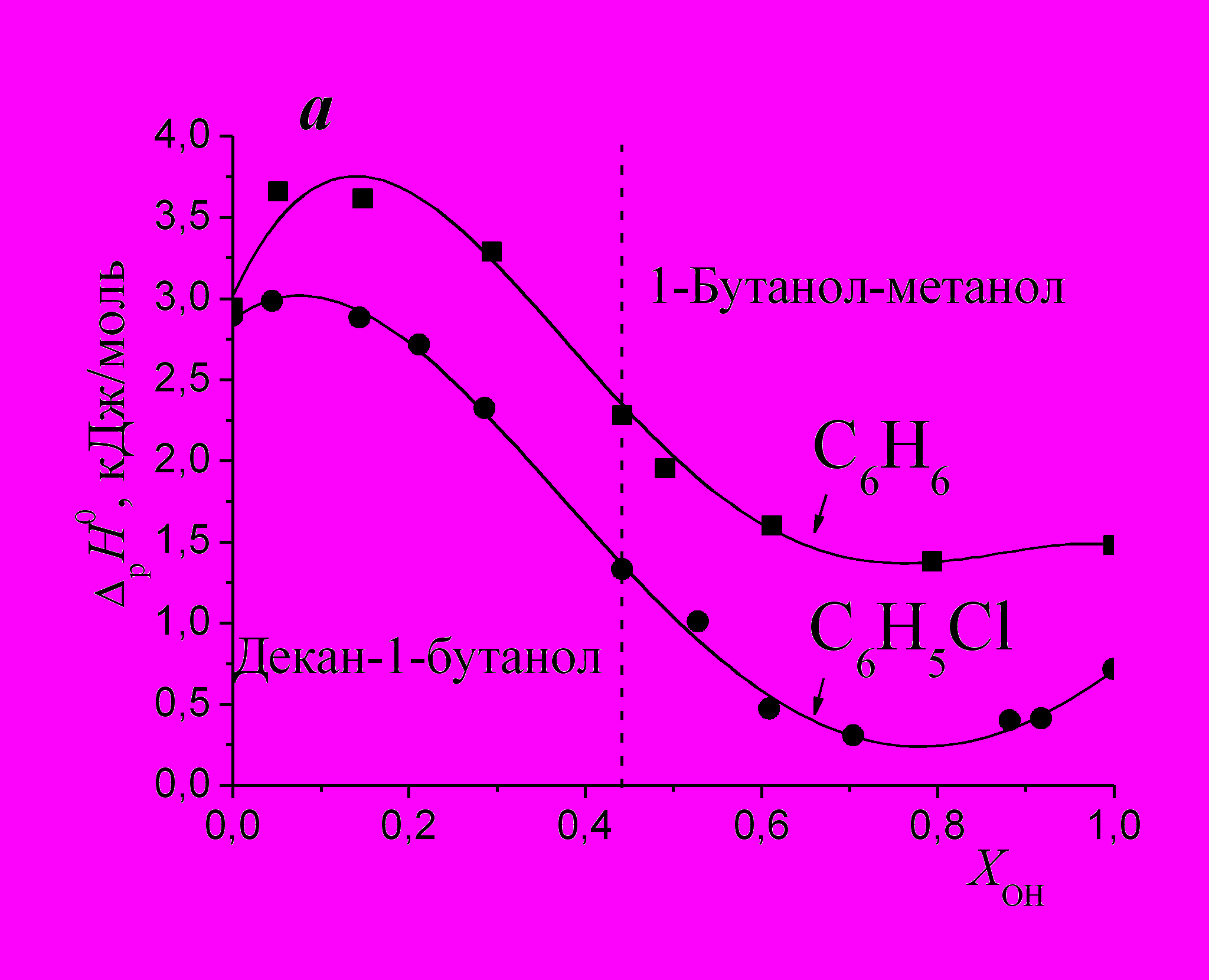 | 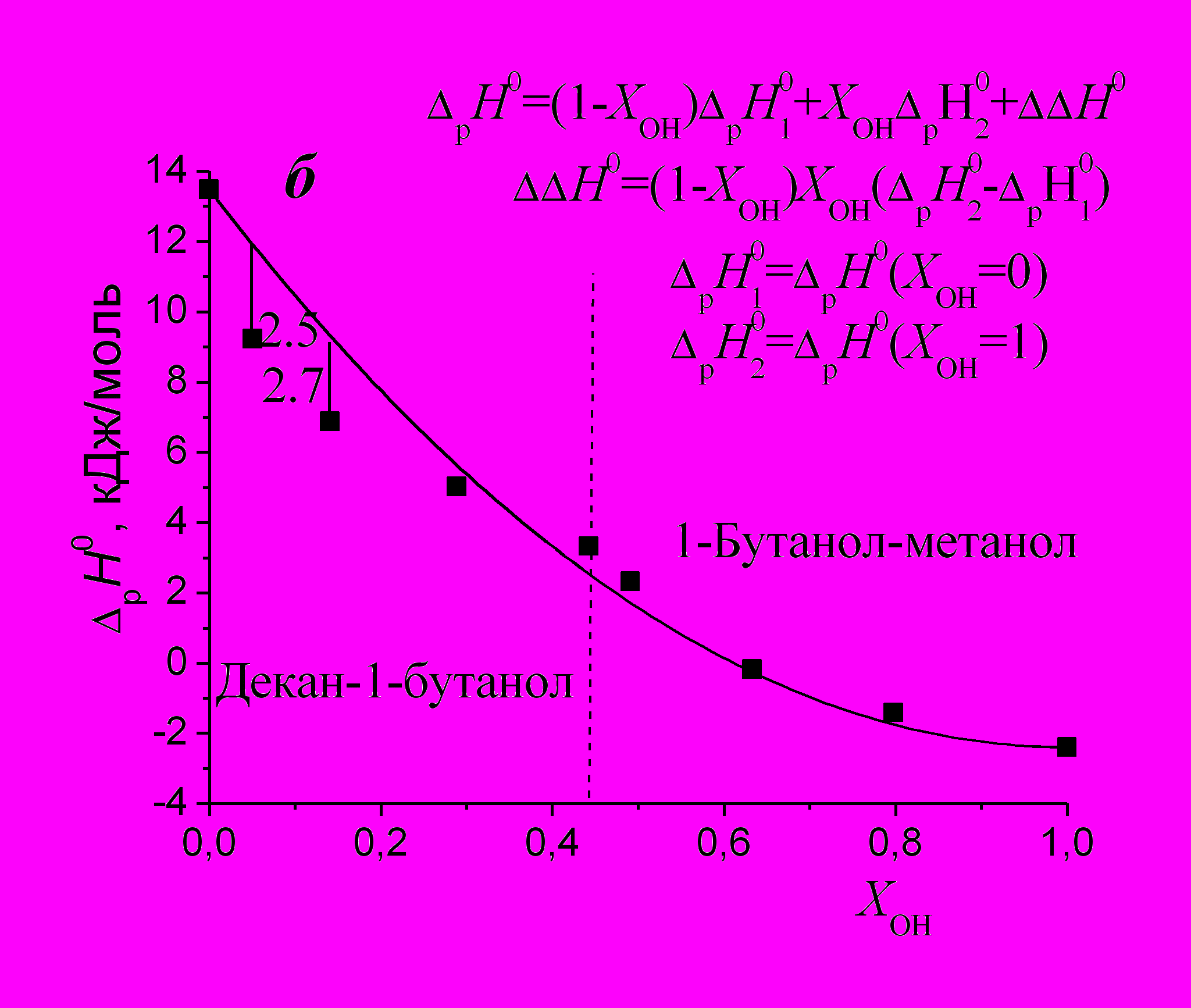 |
| Рис. 9. Энтальпии растворения бензола, хлорбензола (а) и анилина (б) в объединенной системе н-декан - 1-бутанол + 1-бутанол - метанол. | |
Для описания зависимостей энтальпий растворения анилина (р Н0) от относительных долей гидроксигрупп в растворе (рис. 9б) в изученных системах мы использовали уравнение без подгоночных параметров*. Отклонение экспериментальных точек от расчетной линии в области малых добавок спирта к алкану является максимальным (2.7 и 2.5 кДж/моль), что связано со специфическими взаимодействиями растворенного вещества с растворителем. Зависимости ΔрН0 = f(ХОН) анилина в системах н-гексан - 1-бутанол + 1-бутанол - метанол и н-декан - 1-деканол + 1-деканол - метанол имеют аналогичный вид.
На основе избыточных энтальпий растворения (ΔΔН0) рассмотрены межмолекулярные взаимодействия в обсуждаемых системах. На рис. 10 представлены зависимости величин ΔΔН0 бензола и хлорбензола в смеси н-декан - 1-бутанол + 1-бутанол - метанол от относительной доли гидроксигрупп в растворе, которые описаны уравнением (2). Так как основность хлорбензола выше чем бензола, то хлорбензол способен вступать в более сильные специфические взаимодействия с компонентами спиртовых растворов, выступая как акцептор протонов. Это приводит к более отрицательным значениям ΔΔН0 для хлорбензола, чем для бензола.
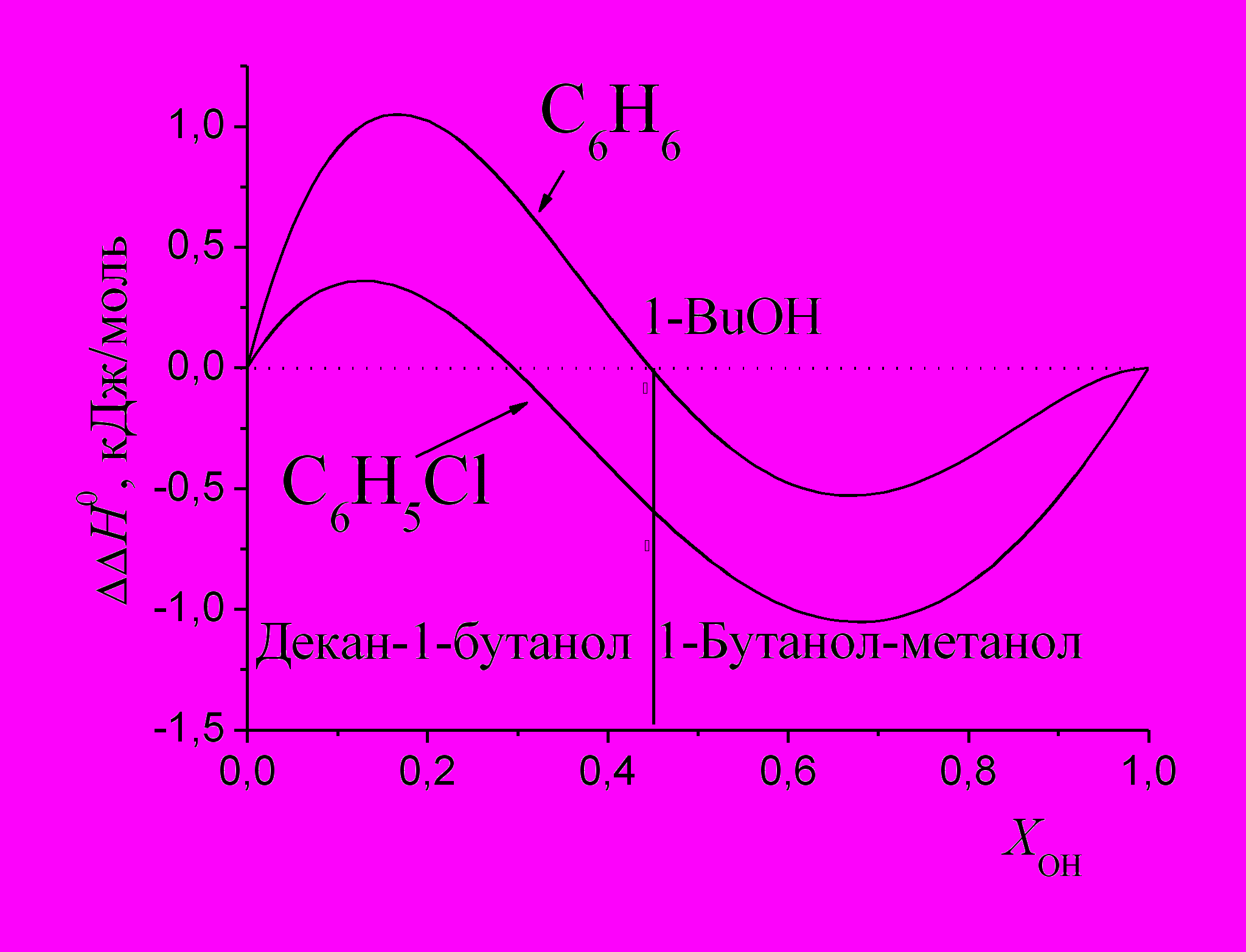 | 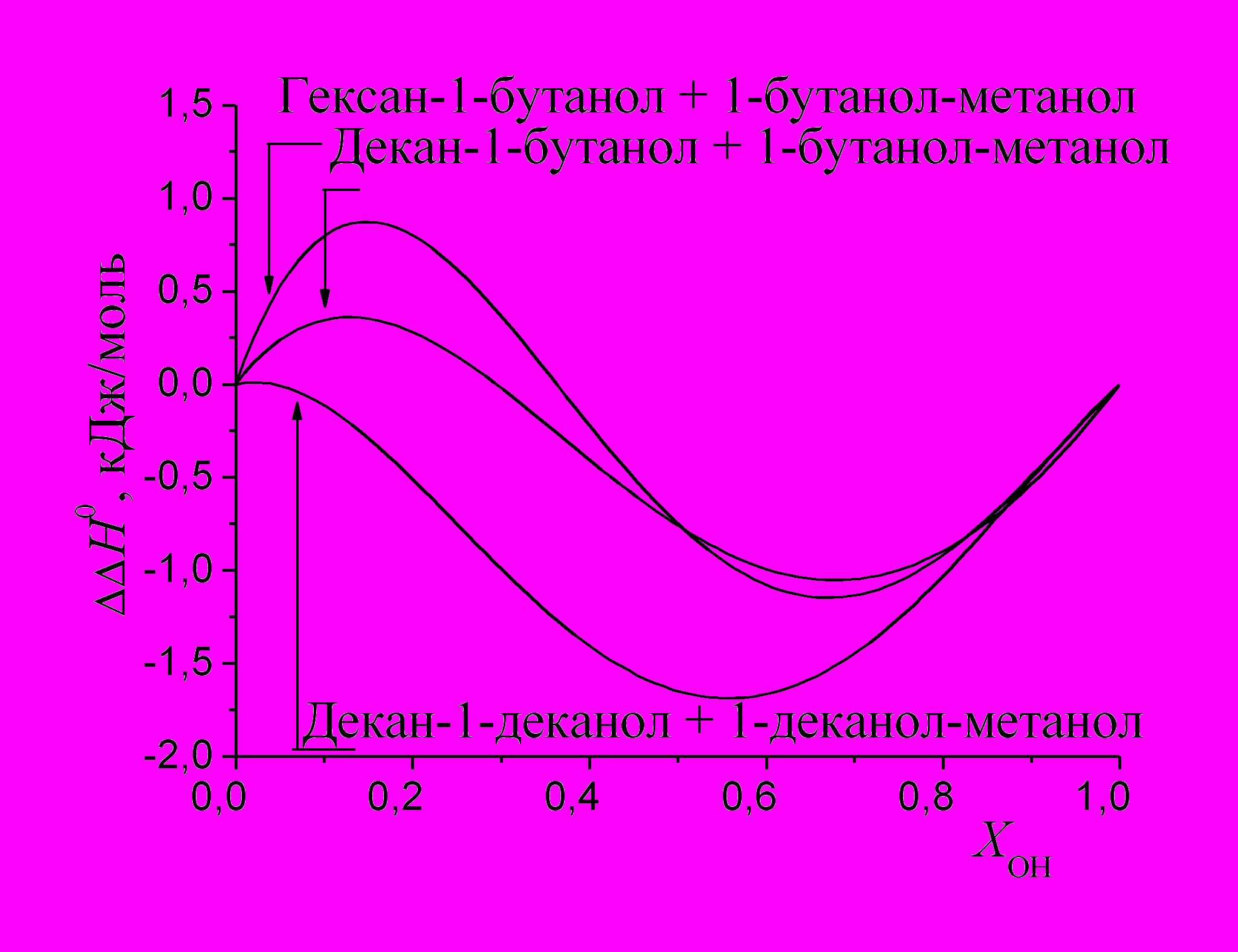 |
| Рис. 10. Избыточные энтальпии растворения бензола и хлорбензола в объединенной системе н-декан-1-бутанол + 1-бутанол-метанол. | Рис. 11. Избыточные энтальпии растворения хлорбензола в объединенных системах н-алкан - спирт. |
На рис. 11 показаны зависимости величин ΔΔН0 = f(ХОН) для хлорбензола в трех объединенных системах. Величины ΔΔН0 для хлорбензола в системе, содержащей 1-деканол имеют более отрицательные значения, что можно объяснить более слабым межмолекулярным взаимодействием метанола с 1-деканолом по сравнению с 1-бутанолом, т.е. вклад образования полости здесь меньше. Представляет интерес область, богатая метанолом (ХОН > 0.85 м. д.), где зависимости ΔΔН0 = f(ХОН) для хлорбензола во всех трех системах практически совпадают. Здесь, вероятно, вклад образования полости при сольватации хлорбензола 1-бутанолом компенсируется специфическими взаимодействиями растворенного вещества с растворителем.
В системах спирт - спирт и спирт - алкан энергетика взаимодействия ССl4, бензола, хлорбензола и анилина определяется концентрацией ОН-групп в растворителе, тогда как при сольватации ССl4 смесями спирт - простой эфир действуют другие факторы.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
1. Калориметрическим методом при 298.15 К впервые измерены энтальпийные характеристики 40 тройных систем на основе ССl4, бензола, хлорбензола, анилина, спиртов, простых эфиров, амидов, ацетона, воды и алканов. Получены эмпирические уравнения, основанные на формализме Редлиха - Кистера, описывающие энтальпии растворения неэлектролитов в бинарных растворителях.
2. Сравнительный анализ энтальпий растворения ССl4, бензола и алканов в индивидуальных растворителях показал наличие специфической составляющей в суммарную энергию взаимодействия ССl4 и бензола со спиртами, в связи с чем использование ССl4 и бензола в качестве молекулярных зондов или инертных растворителей предполагает учет специфической составляющей их сольватации.
3. Изучены закономерности процесса сольватации ССl4, бензола, хлорбензола и анилина в бинарных смесях на основе спиртов и алканов. Установлено, что в системах спирт – спирт и спирт – алкан энергетика взаимодействия указанных веществ определяется аналитической концентрацией ОН-групп в растворителе.
4. На основе представлений о молярной концентрации гидроксильных групп в бинарной смеси впервые предложена единая зависимость, объединяющая 7 исследованных тройных систем спирт – спирт - ССl4 и спирт – н-алкан - ССl4.
5. Переход к относительной доле гидроксильных групп в растворе впервые позволил представить энтальпию растворения бензола и его монофункциональных производных в объединенной системе бинарных растворителей н-алкан - 1-алканол + 1-алканол – метанол в виде суммы аддитивной и избыточной составляющих, что дает предпосылки для прогнозирования энтальпийных характеристик.
Основное содержание диссертации изложено в следующих работах:
- Сиволожская (Кашина) Ю. А., Поткина Н. Л., Королев В. П. Термохимия сольватации ССl4 в системах н-алкан – 1-алканол // ЖОХ, 2001. Т. 70. Вып. 9. С. 1492 - 1498.
- Сиволожская (Кашина) Ю. А., Поткина Н. Л., Королев В. П. Сравнительное исследование сольватации ССl4 в системах спирт-спирт и спирт-алкан // ЖОХ, 2002. Т. 72. Вып. 5. С. 926 - 931.
- Кашина Ю. А., Королев В. П. Термохимия растворения ССl4 в смесях спиртов с н-алканами и простыми эфирами // Известия ВУЗов. Химия и химическая технология, 2007. Т. 50. Вып. 7. С. 41 - 44.
- Королев В. П., Кашина Ю. А., Смирнова Н. Л. Сравнительное исследование сольватации бензола, хлорбензола и анилина смесями спирт-спирт и спирт-алкан // ЖОХ, 2007. Вып. 10. С. 1641 - 1647.
- Сиволожская (Кашина) Ю. А., Поткина Н. Л., Королев В. П. Термохимия растворения ССl4 в смесях н-алканов с н-бутиловым и н-дециловым спиртами // В сб. тез. докл. II Международной научно-технической конференции “Актуальные проблемы химии и химической технологии “Химия -99”. Иваново, 1999. С. 38.
- Сиволожская (Кашина) Ю. А., Королев В. П. Термохимия растворения ССl4 в бинарных спиртовых смесях // В сб. тез. докл. Международной студенческой конференции “Развитие, окружающая среда, химическая инженерия”. Иваново, 2000. С. 198.
- Сиволожская (Кашина) Ю. А., Поткина Н. Л., Королев В. П. Термохимическое исследование сольватации анилина, циклогексана и ССl4 в смесях 1-алканолов с простыми эфирами // В сб. тез. докл. Международной научной конференции “Кинетика и механизм кристаллизации”. Иваново, 2000. С. 93.
- Сиволожская (Кашина) Ю. А., Поткина Н. Л., Литова Н. А., Королев В. П. Сравнительный анализ сольватации четыреххлористого углерода в системах спирт-спирт, спирт-алкан и спирт-простой эфир // В сб. тез. докл. VIII Международной конференции “Проблемы сольватации и комплексообразования в растворах”. Иваново, 2001. С. 263.
- Сиволожская (Кашина) Ю. А., Поткина Н. Л., Литова Н. А., Королев В. П. Особенности взаимодействия алканов со спиртами // Там же. С. 262.
- Кашина Ю. А., Кустов А. В., Смирнова Н. Л., Крестьянинов М. А., Королев В. П. Калориметрическое исследование растворов углеводородов в смесях метанола с формамидом при 25 и 400С // В сб. тез. докл. Х Международной конференции “Проблемы сольватации и комплексообразования в растворах”. Суздаль, 2007. С. 3/S – 317.
- Смирнова Н.Л., Кашина Ю. А., Смирнов В. А., Королев В. П. Термохимия растворения бензола, хлорбензола и анилина в смесях спирт-спирт и спирт-алкан // Там же. С. 5-S – 639.
- Кашина Ю. А., Королев В. П. Теплоты растворения углеводородов в формамиде при 250 С // Там же. С. 5-S – 639.
* Pure Appl. Chem., 2001. V. 73. N 10. P. 1625.
** Все измерения проведены при 298.15 К.
*** J. Phys. Chem., 1971. V. 75. P. 3598; Can. J. Chem., 1985. V. 63. P. 349.
* Бургер К. Сольватация, ионные реакции и комплексообразование в неводных средах. –М.: Мир, 1984. C. 57.
** Шахпаронов М.И. Введение в современную теорию растворов. –М.: Высшая школа, 1976. C. 56; Дуров В.А. в кн. “Концентрированные и насыщенные растворы”. –М.: Наука, 2002. C. 231; J. Phys. Chem., 1969. V. 73. P. 2217.
*** Собственные и данные Беличенко С.Ю. Дис. канд. хим. наук, Иваново, 2001. 157 с
* Саn. J. Chem., 1987. V. 65. P. 2624.
* Изв. РАН. Сер. хим., 1999. N 2. C. 271.
* J. Solut. Chem., 1994. V. 23. N 2. P. 105.
* ЖОХ, 1998. T. 68. C. 196; ЖОХ, 1998. T. 68. C. 188; J. Solut. Chem., 1975. V. 4. P. 205.
* ЖНХ, 2007. T. 52. N 2. C. 147
