Общая характеристика работы
| Вид материала | Документы |
- Содержание лекций Модели местного самоуправления в России Местное самоуправление:, 786.51kb.
- Общая характеристика работы актуальность работы, 336.09kb.
- Общая характеристика работы актуальность работы, 236.99kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Задачи физического воспитания детей дошкольного возраста. Общая характеристика средств, 34.6kb.
- Реферат по курсу: экология на тему: Общая характеристика экосистем, как, 726.64kb.
- Научная работа студентов, 2153.55kb.
- Научная работа студентов, 2114.42kb.
- Общая характеристика работы актуальность работы, 487.01kb.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Одной из наиболее важных задач химии растворов является проблема определения термодинамических характеристик сольватации индивидуальных ионов.
Актуальность данной проблемы определяется широким спектром теоретических и практических задач, при решении которых на первом плане находится информация о свойствах отдельных ионов в растворах. Это: особенности взаимодействий катион-растворитель и анион-растворитель; кинетика и механизм электродных процессов; ионный перенос в гетерогенных (межфазных) процессах; поверхностные свойства растворителей на границе раздела фаз.
Цель работы - определение термодинамических свойств ионов одного вида в воде и смешанных водно-органических растворителях на основе метода вольтовых разностей потенциалов. Достоинство метода в том, что он дает возможность рассчитать поверхностный потенциал раствора, с помощью которого можно перейти от реальных термодинамических характеристик отдельных ионов к химическим.
Научная новизна заключается в том, что впервые: изготовлена и модернизирована установка по определению компенсирующих напряжений вольта-цепей методом Кенрика; получены экспериментальные значения вольтовых разностей потенциалов в растворах иодида и бромида натрия в ряде неводных растворов; с применением концепции реальных термодинамических свойств индивидуальных ионов произведен расчет реальных и химических термодинамических характеристик сольватации ионов брома и иода в смесях воды с органическими растворителями различных классов (этанолом, н-пропанолом, изопропанолом, ацетоном, ацетонитрилом, диметилсульфоксидом, диметилформамидом); выявлены особенности сольватации индивидуальных ионов в зависимости от их природы и структурных особенностей растворителей; определены поверхностные потенциалы исследуемых органических растворителей.
Практическая значимость проведенного исследования и полученных результатов определяется тем, что данные о термодинамических характеристиках сольватации индивидуальных ионов представляют новые сведения для дальнейшего развития теории растворов электролитов. Термодинамические характеристики сольватации индивидуальных ионов представляют интерес для развития различных областей знаний: при разработке химических источников тока, ионообменных равновесий, электролизе, аналитической химии и т.д., то есть там, где необходимо судить о поведении отдельных ионов, а не электролита в целом.
Апробация работы.
Полученные в данной работе экспериментальные и теоретические результаты обсуждались на международных и национальных конференциях:
- VIII Международная конференция "Проблемы сольватации и комплексообразования в растворах" (Иваново, 2001 г.);
- ХIV Международная конференция по химической термодинамике (Санкт-Петербург 2002 г.);
- I, II и III конференции "Химия и применение неводных растворов" (Иваново, 1986 г.; Харьков, 1989 г.; Иваново, 1993 г.);
- XI Конференция по термодинамике органических соединений (Минск, 1990 г.);
- IV и V Всесоюзные совещания "Проблемы сольватации и комплексообразования в растворах" (Иваново, 1989 г., 1991 г.);
- XIII Конференция по химической термодинамике и калориметрии (Красноярск, 1991 г.).
Личный вклад автора состоит в изготовлении модернизированной установки по определению компенсирующих напряжений вольта-цепей (метод Кенрика), в проведении эксперимента, математической обработке экспериментальных данных и анализе полученных результатов.
Публикации: по теме диссертации опубликовано 28 печатных работ, из них 17 статей и 11 тезисов докладов на научных конференциях.
Структура и объем работы.
Диссертация изложена на 118 страницах; состоит из введения, трех глав с обсуждением результатов, итогов работы, списка использованных литературных источников и приложения; содержит 24 таблицы, 17 рисунков и библиографию из 183 наименований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность и новизна исследования, сформулирована постановка задачи.
Первая глава состоит из двух разделов. В первом разделе представлены две группы методов определения термодинамических характеристик сольватации индивидуальных ионов в растворах, их критический анализ и сопоставление:
1) методы теоретического расчета термодинамических характеристик сольватации индивидуальных ионов или их составляющих, характеризующих отдельные стадии процесса сольватации;
2) методы разделения на ионные составляющие экспериментально измеренных суммарных характеристик сольватации стехиометрических смесей ионов.
Во втором разделе описаны методы определения термодинамических характеристик пересольватации ионов.
Вторая глава состоит из трех разделов, в которых: рассматривается современная концепция реальных термодинамических свойств индивидуальных ионов (в основе этой концепции лежит учет межфазных потенциалов); представлена схема возникновения вольта-потенциала между незаряженными конденсированными фазами; приведено представление о реальной энергии пересольватации отдельных ионов.
В третьей главе излагаются результаты экспериментальных исследований сольватации ионов брома и иода в смешанных растворителях методом вольтовых разностей потенциалов. В качестве неводного компонента выбраны растворители различных классов [этиловый (EtOH), н-пропиловый (n-PrOH) и изопропиловый (i-PrOH) спирты; ацетонитрил (MeCN), ацетон (Me2CO), диметилсульфоксид (DMSO) и диметилформамид (DMF)].
В настоящей работе для определения значений компенсирующих напряжений вольта-цепей использовался метод вертикальной струи (метод Кенрика).
Методом Кенрика измерены компенсирующие напряжения (V,В) вольта-цепи:
Ag,AgHalNaHal(m),S(Х)газовая фаза0.05m NaHal, H2OAgHal,Ag (а)
Hal - Br, I; m - моляльность электролита в интервале 2.5·10-3 - 5·10-2 моль / кг растворителя; S - смешанный водно-органический растворитель;
Х - мольная доля неводного компонента в смеси. В качестве раствора сравнения использовался раствор NaHal в воде концентрации 0.05 m.
Метод расчета химических первичных эффектов среды индивидуальных ионов основан на использовании значений реальных первичных эффектов среды индивидуальных ионов
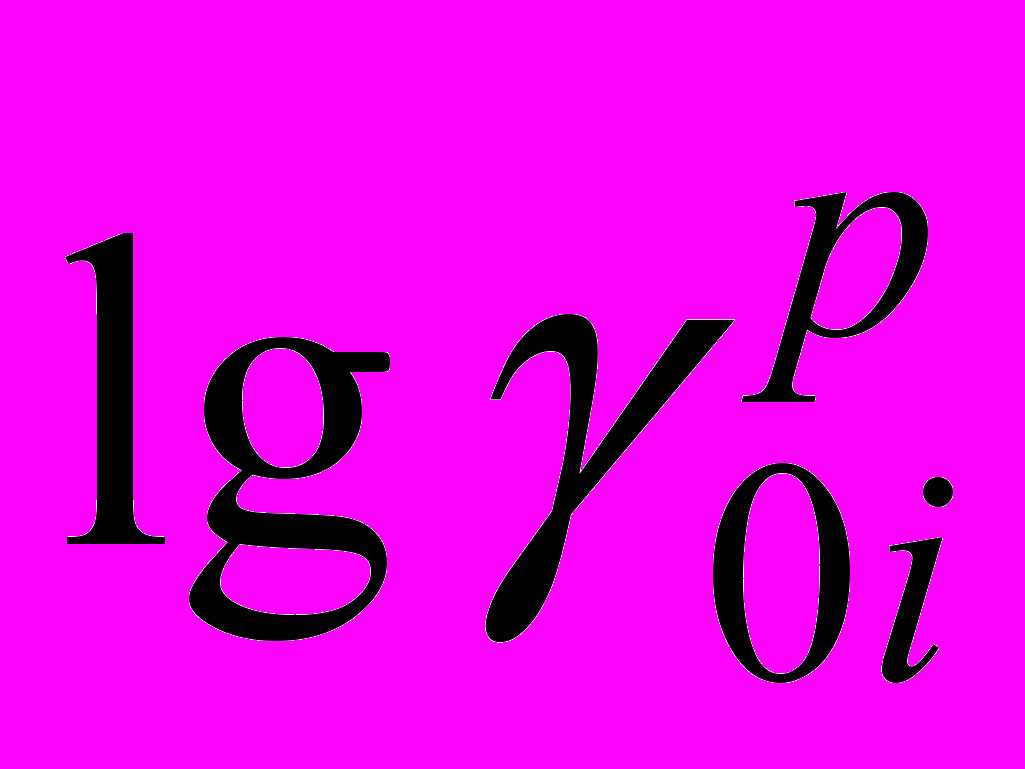 и величины изменения поверхностного потенциала на границе раздела фаз , которые связаны следующим соотношением:
и величины изменения поверхностного потенциала на границе раздела фаз , которые связаны следующим соотношением: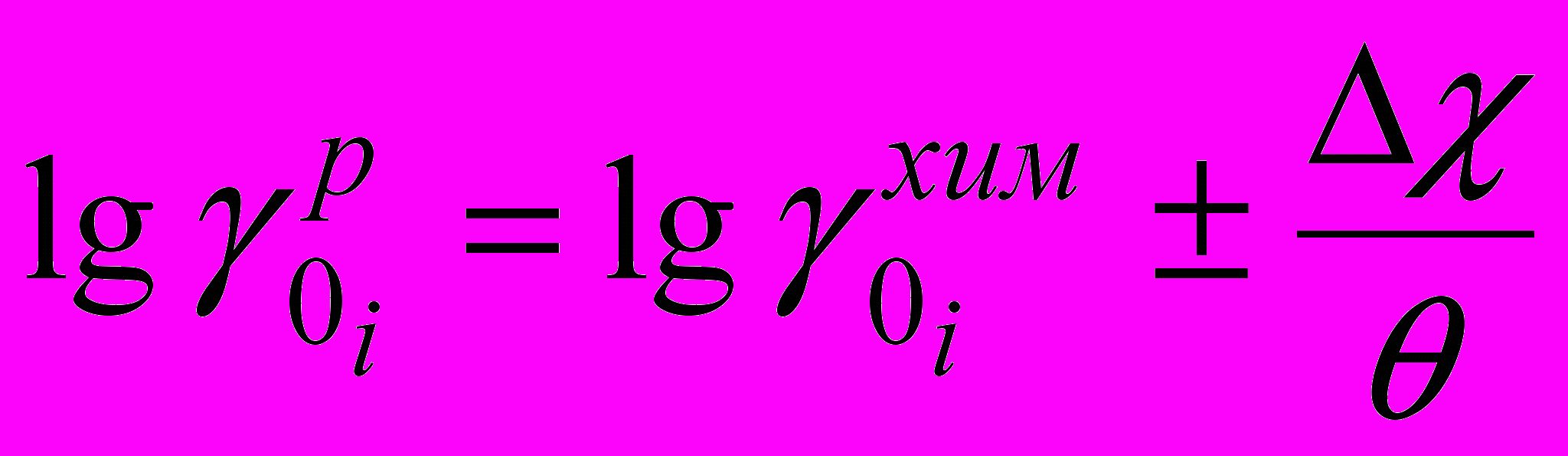 , (1)
, (1)где
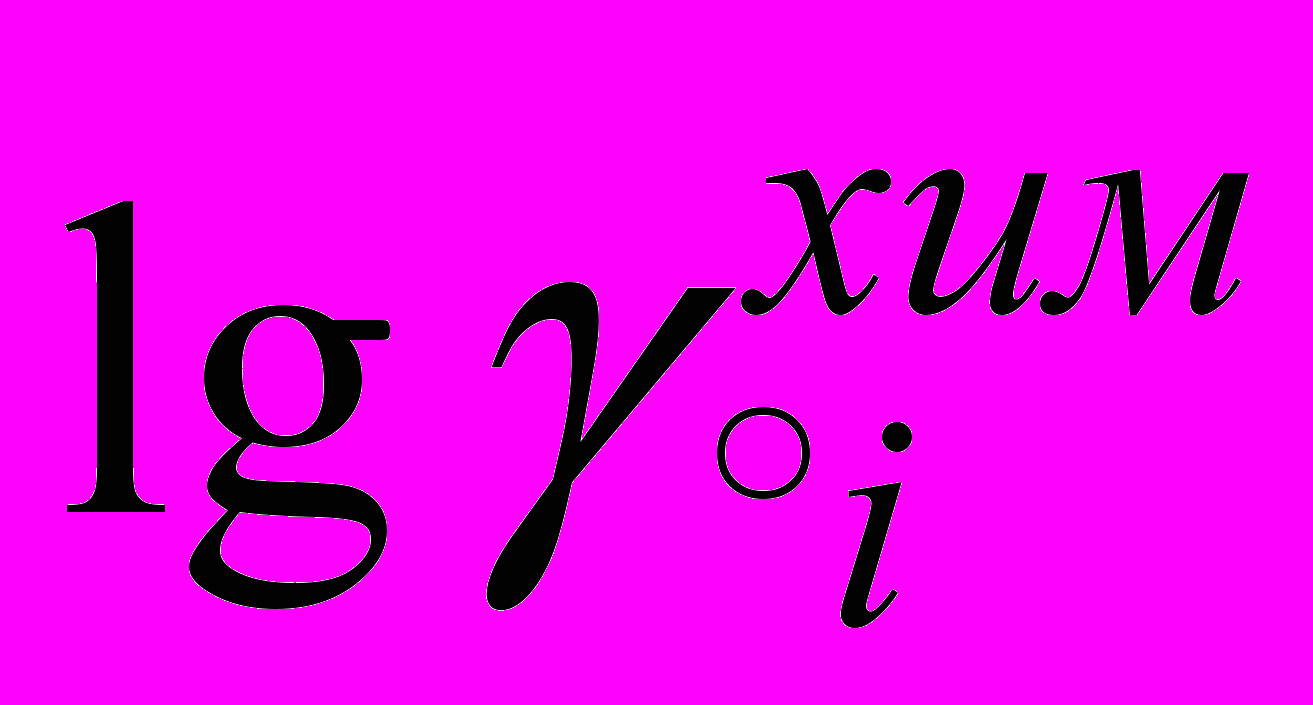 - химический первичный эффект среды индивидуальных ионов. Из данного уравнения можно рассчитать значения
- химический первичный эффект среды индивидуальных ионов. Из данного уравнения можно рассчитать значения 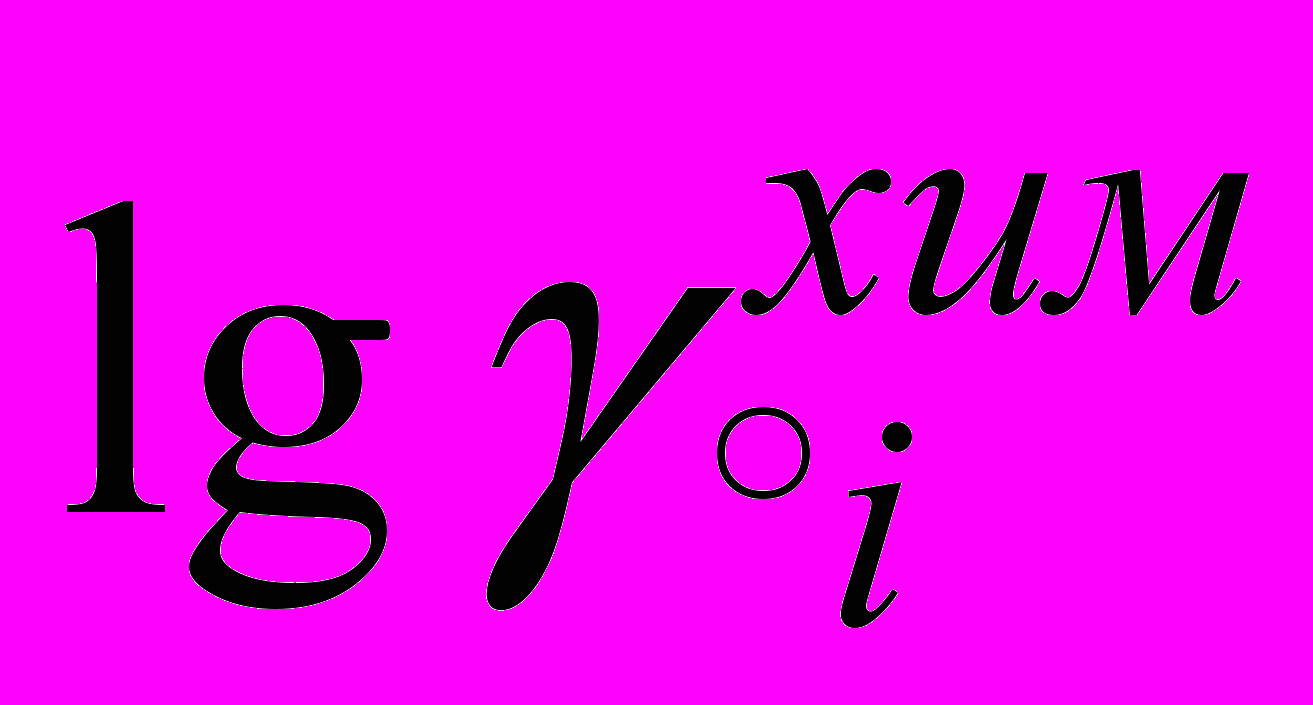 , если известна величина изменения поверхностного потенциала . Эта величина нами определена.
, если известна величина изменения поверхностного потенциала . Эта величина нами определена.В таблицах 1 - 4 представлены вычисленные из экспериментальных данных по V реальные
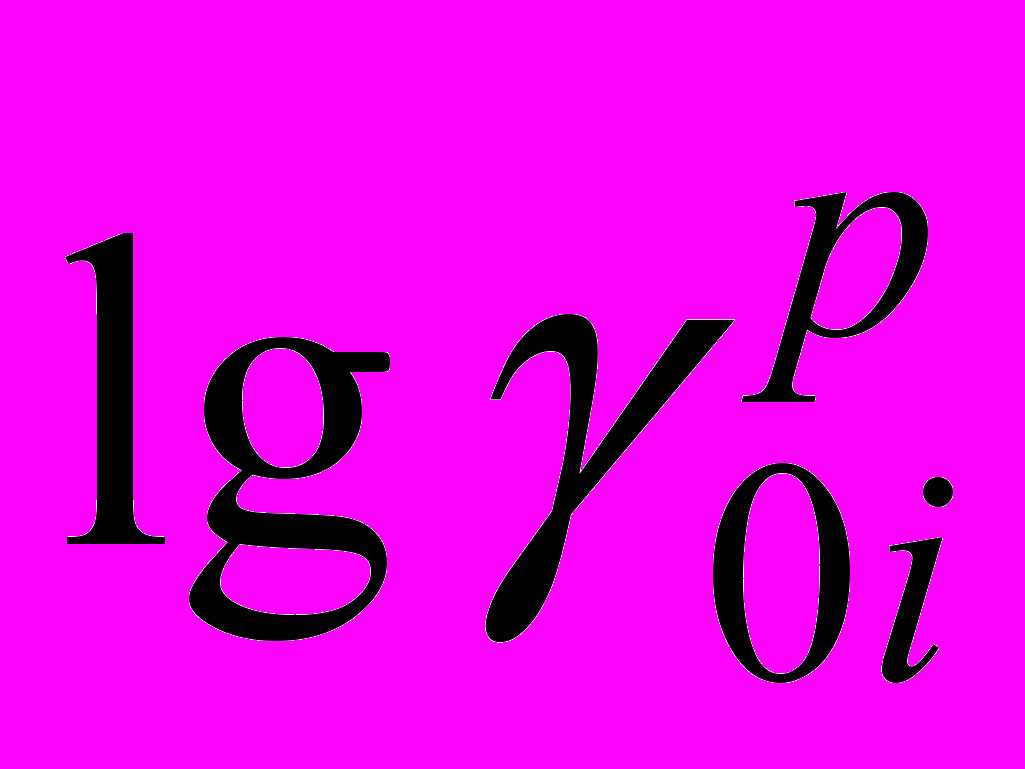 и химические
и химические 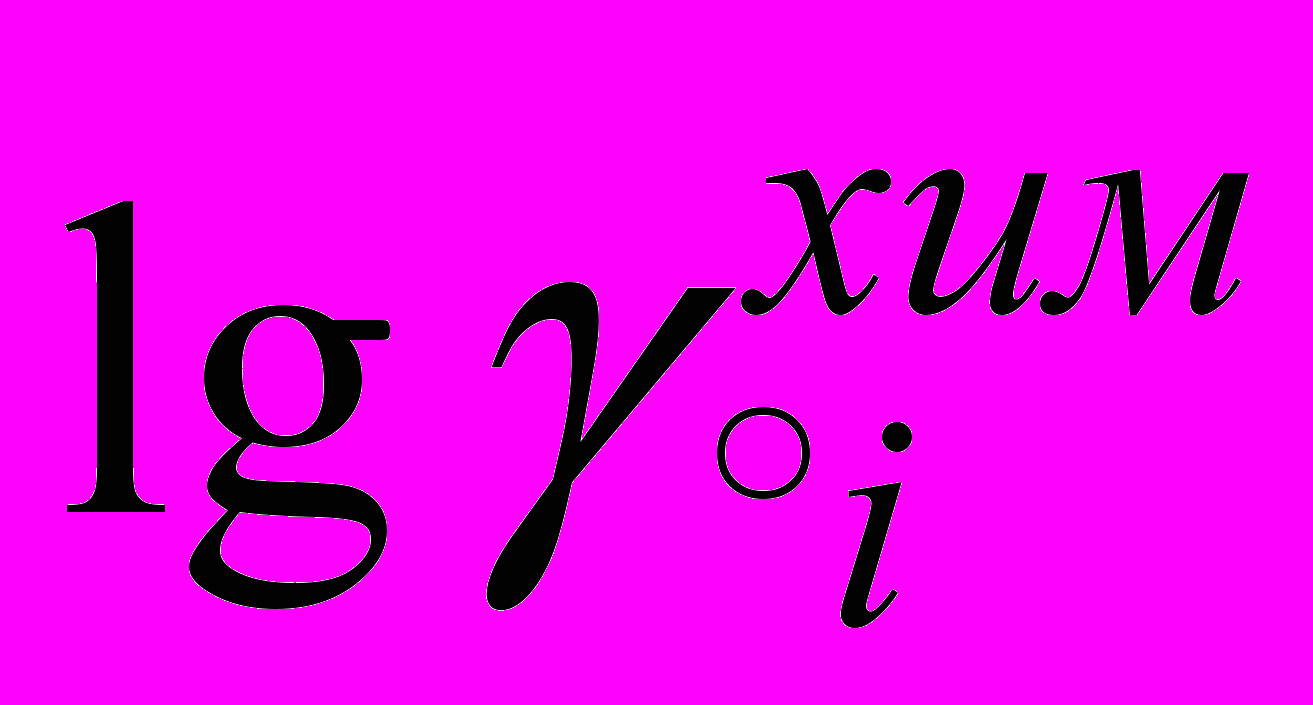 первичные эффекты среды ионов Br- и I- при 298.15 К в изученных смешанных растворителях.
первичные эффекты среды ионов Br- и I- при 298.15 К в изученных смешанных растворителях.Как следует из приведенных в таблицах данных, для всех исследуемых систем величины реальных первичных эффектов среды для анионов брома и иода положительны. В случае анионов наблюдается резкое увеличение в области малых добавок органического растворителя, а затем монотонное его увеличение. Такая зависимость объясняется тем, что изменение
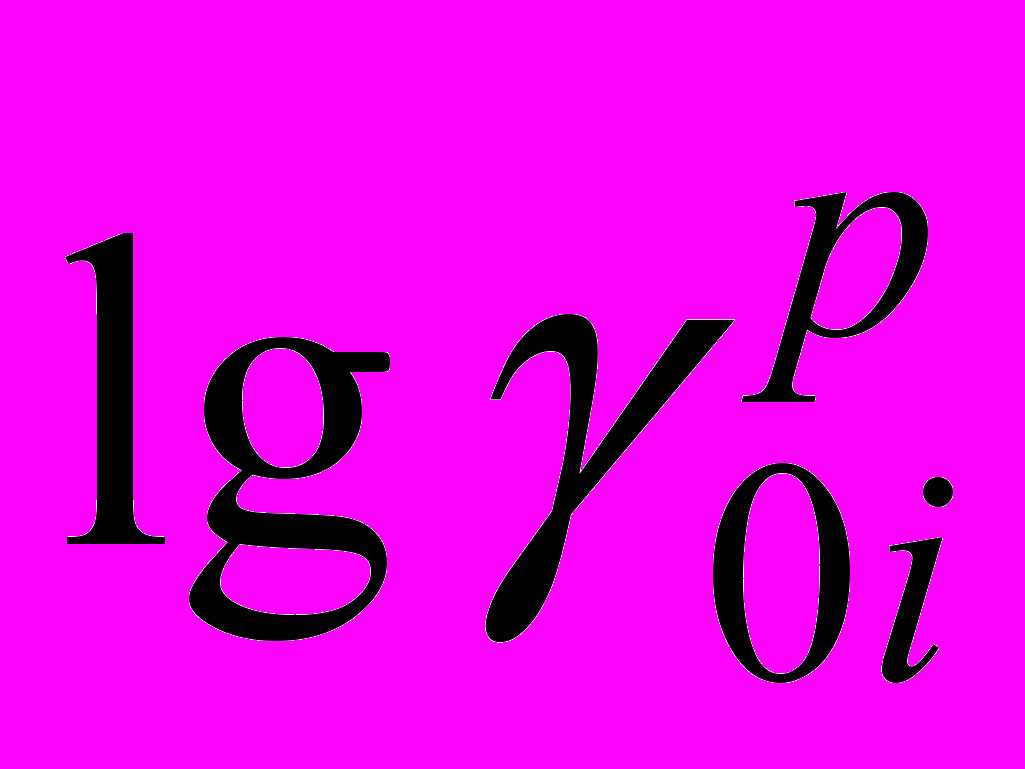 от состава смешанного растворителя зависит от двух факторов: поверхностного и объемного. Поверхностный фактор учитывает работу переноса иона из газовой фазы в объем раствора через границу раздела фаз, объемный - взаимодействие иона с растворителем в объеме раствора (химический эффект среды).
от состава смешанного растворителя зависит от двух факторов: поверхностного и объемного. Поверхностный фактор учитывает работу переноса иона из газовой фазы в объем раствора через границу раздела фаз, объемный - взаимодействие иона с растворителем в объеме раствора (химический эффект среды).При малом содержании неводного растворителя изменение
 происходит, в основном, за счет поверхностного фактора. Наблюдается резкое изменение
происходит, в основном, за счет поверхностного фактора. Наблюдается резкое изменение  . Затем, начиная с определенной (для каждого растворителя своей) концентрации неводного компонента, темп изменения
. Затем, начиная с определенной (для каждого растворителя своей) концентрации неводного компонента, темп изменения  значительно
значительноТаблица 1.
Значения реального первичного эффекта среды
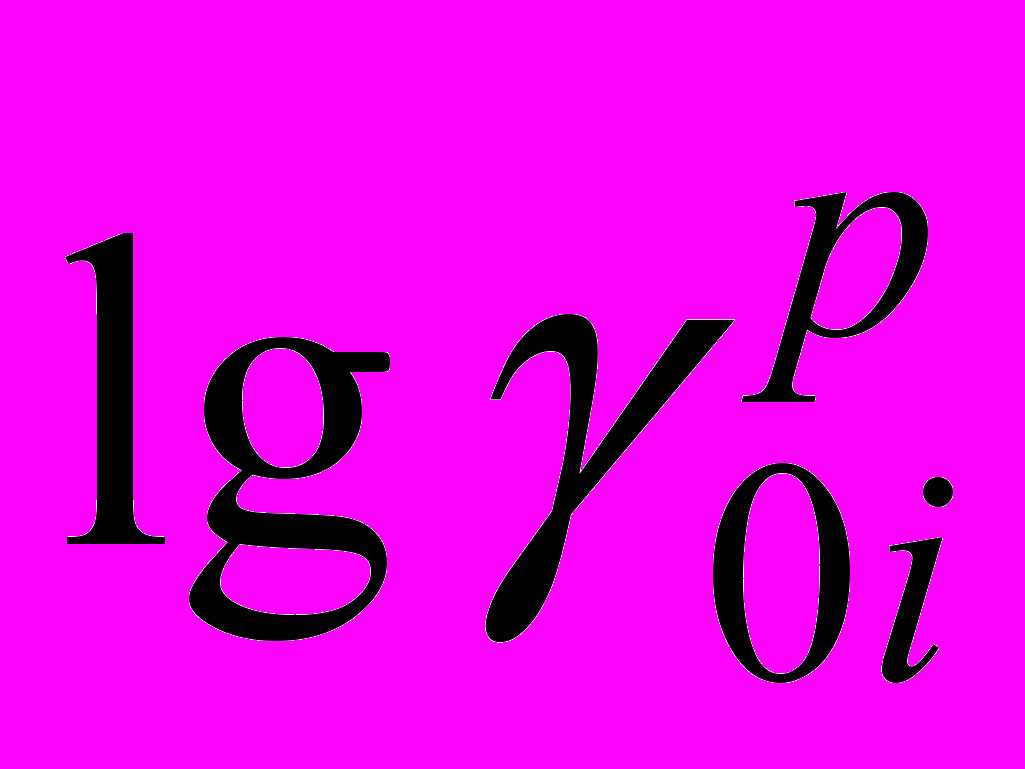 для Br- при 298.15 К
для Br- при 298.15 К| X | EtOH | n-PrOH | i-PrOh | Me2CO | MeCN | DMSO | DMF |
| 0.00 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.08 | - | 6.81 | 7.38 | 8.31 | 4.52 | - | - |
| 0.10 | 6.71 | 6.84 | 7.43 | 8.34 | 4.54 | 6.22 | 9.57 |
| 0.12 | 6.75 | 6.88 | 7.45 | 8.42 | 4.63 | - | - |
| 0.16 | 6.78 | 6.95 | 7.47 | - | 4.71 | - | - |
| 0.18 | - | - | - | 8.74 | - | - | - |
| 0.20 | 6.81 | 6.99 | 7.48 | 9.01 | 4.48 | 6.56 | 9.97 |
| 0.30 | - | - | - | - | 5.05 | 6.97 | 10.20 |
| 0.40 | 7.14 | 7.28 | 7.67 | 9.67 | 5.13 | 7.29 | 10.62 |
| 0.50 | - | - | - | - | - | 7.54 | 10.78 |
| 0.60 | 7.58 | 7.78 | 7.85 | 10.07 | 5.51 | 7.87 | 10.89 |
| 0.70 | - | - | - | - | - | 7.98 | 11.17 |
| 0.80 | - | - | - | - | - | 8.49 | 11.42 |
| 0.90 | 8.21 | - | - | - | - | 8.86 | 11.66 |
Таблица 2.
Значения реального первичного эффекта среды
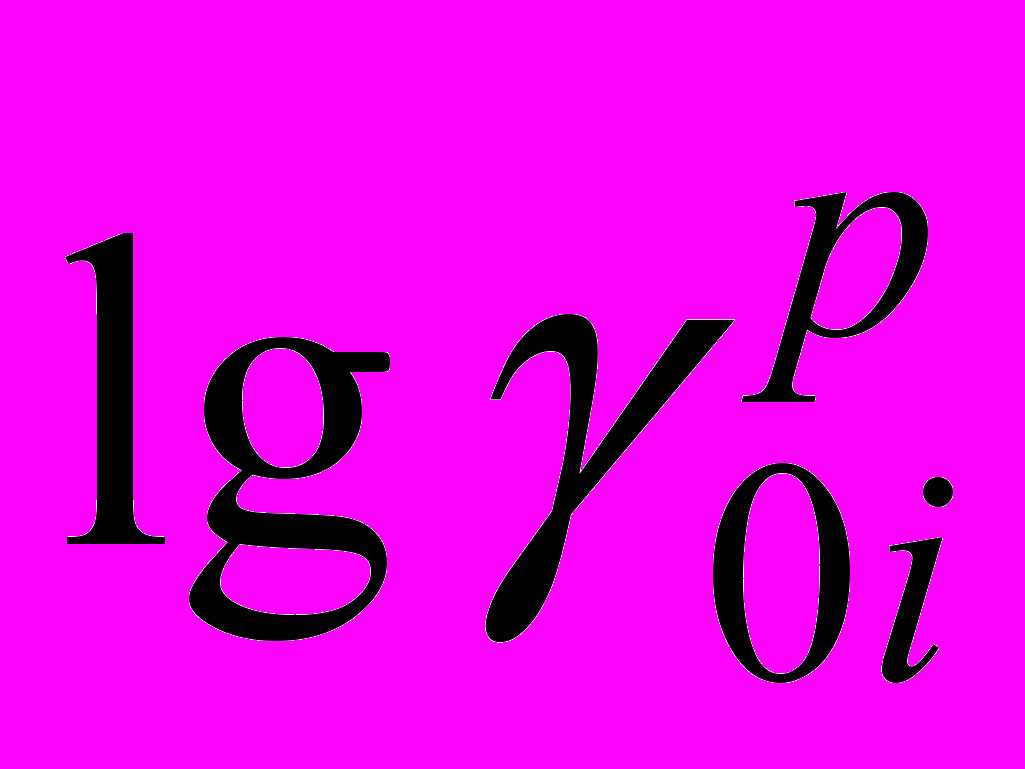 для I- при 298.15 К
для I- при 298.15 К| X | EtOH | n-PrOH | i-PrOh | Me2CO | MeCN | DMSO | DMF |
| 0.00 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.08 | - | 7.39 | 7.61 | 8.85 | 5.08 | - | - |
| 0.10 | 7.59 | 7.45 | 7.80 | 8.93 | 5.14 | 7.17 | 10.27 |
| 0.12 | 7.60 | 7.48 | 7.95 | 9.27 | 5.25 | - | - |
| 0.16 | 7.61 | 7.57 | 8.05 | - | 5.31 | - | - |
| 0.18 | - | - | - | 9.38 | - | - | - |
| 0.20 | 7.62 | 7.53 | 8.16 | 9.51 | 5.35 | 7.37 | 10.47 |
| 0.30 | - | - | - | - | 5.62 | 6.97 | 10.20 |
| 0.40 | 8.04 | 7.66 | 8.82 | 10.25 | 5.70 | 7.75 | 10.80 |
| 0.50 | - | - | - | - | - | 7.95 | 10.98 |
| 0.60 | 8.63 | 7.97 | 9.17 | 11.04 | 6.19 | 8.14 | 11.17 |
| 0.70 | - | - | - | - | - | 8.81 | 11.39 |
| 0.80 | - | - | - | - | - | 9.08 | 11.51 |
| 0.90 | 9.76 | - | - | - | - | 9.34 | 11.69 |
Таблица 3
Значения химического первичного эффекта среды
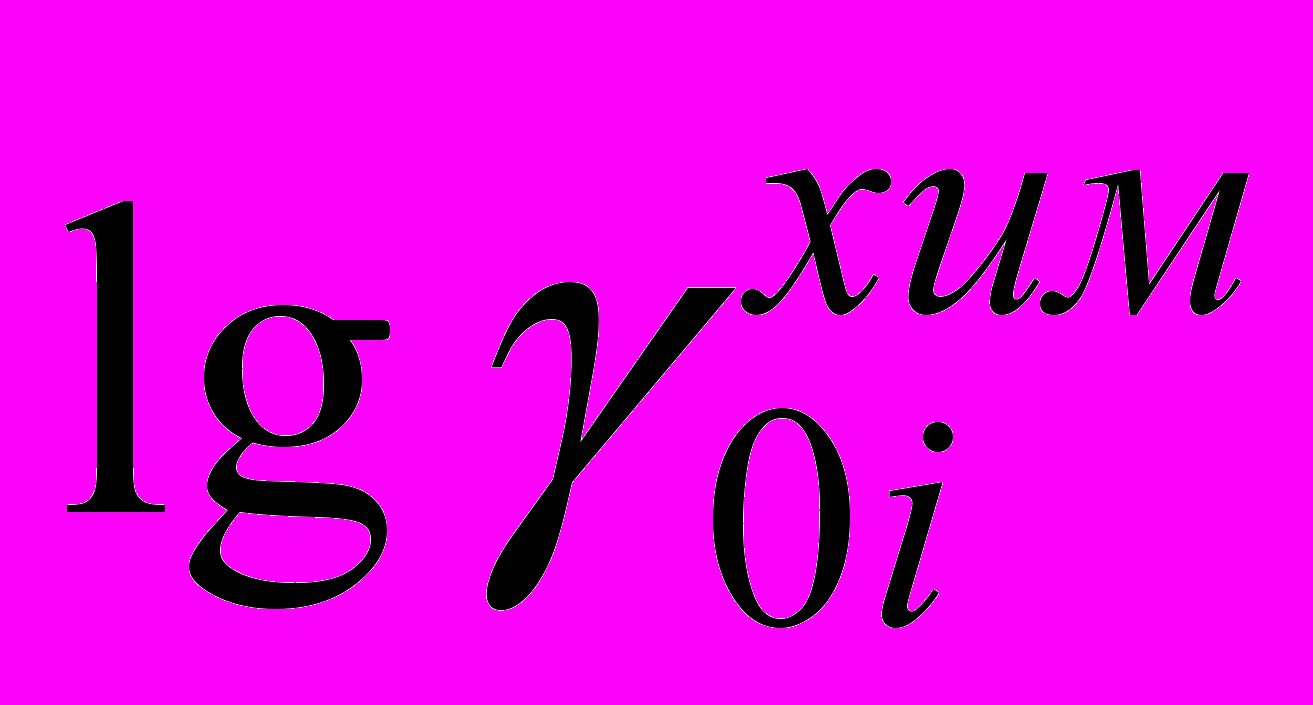 для Br- при 298.15 К
для Br- при 298.15 К| X | EtOH | n-PrOH | i-PrOh | Me2CO | MeCN | DMSO | DMF |
| 0.00 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.08 | - | 0.12 | 0.17 | 0.57 | 0.49 | - | - |
| 0.10 | 0.17 | 0.15 | 0.20 | 0.69 | 0.58 | 0.11 | 0.14 |
| 0.12 | 0.21 | 0.17 | 0.23 | 0.79 | 0.61 | - | |
| 0.16 | 0.24 | 0.22 | 0.25 | - | 0.73 | - | - |
| 0.18 | - | - | - | 1.15 | - | - | - |
| 0.20 | 0.26 | 0.29 | 0.26 | 1.29 | 0.81 | 0.39 | 0.47 |
| 0.30 | - | - | - | - | 0.95 | 0.75 | 0.71 |
| 0.40 | 0.69 | 0.92 | 0.39 | 1.95 | 1.16 | 1.07 | 1.12 |
| 0.50 | - | - | - | - | - | 1.32 | 1.29 |
| 0.60 | 1.04 | 1.09 | 0.64 | 2.24 | 1.43 | 1.65 | 1.40 |
| 0.70 | - | - | - | - | - | 1.76 | 1.68 |
| 0.80 | - | - | - | - | - | 2.27 | 1.93 |
| 0.90 | 1.67 | - | - | - | - | 2.64 | 2.17 |
Таблица 4.
Значения химического первичного эффекта среды
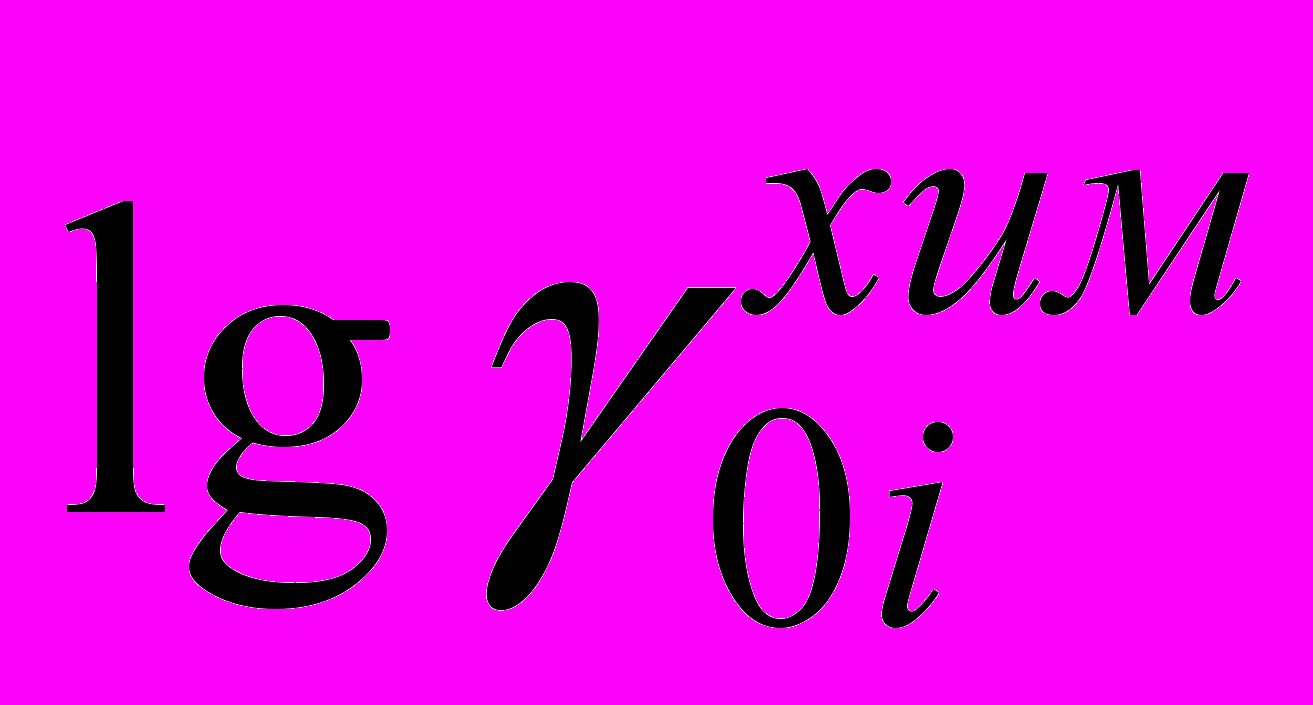 для I- при 298.15 К
для I- при 298.15 К| X | EtOH | n-PrOH | i-PrOh | Me2CO | MeCN | DMSO | DMF |
| 0.00 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.08 | - | 0.16 | 0.32 | 0.85 | 0.55 | - | - |
| 0.10 | 0.32 | 0.19 | 0.34 | 1.61 | 0.58 | 0.37 | 0.19 |
| 0.12 | 0.33 | 0.24 | 0.45 | 1.12 | 0.67 | - | - |
| 0.16 | 0.34 | 0.31 | 0.58 | - | 0.76 | - | - |
| 0.18 | - | - | - | 1.38 | - | - | - |
| 0.20 | 0.35 | 0.36 | 0.72 | 1.68 | 0.82 | 0.51 | 0.55 |
| 0.30 | - | - | - | - | 0.99 | 0.89 | 0.73 |
| 0.40 | 0.80 | 1.04 | 1.36 | 2.42 | 1.16 | 1.15 | 1.18 |
| 0.50 | - | - | - | - | - | 1.45 | 1.36 |
| 0.60 | 1.36 | 1.12 | 1.71 | 3.22 | 1.54 | 1.84 | 1.45 |
| 0.70 | - | - | - | - | - | 2.01 | 1.79 |
| 0.80 | - | - | - | - | - | 2.28 | 2.09 |
| 0.90 | 2.49 | - | - | - | - | 2.74 | 2.27 |
уменьшается. В этой области концентраций изменение поверхностного потенциала раствора на границе растворгазовая фаза становится постоянным и основное изменение реальных первичных эффектов обусловлено объемным фактором.
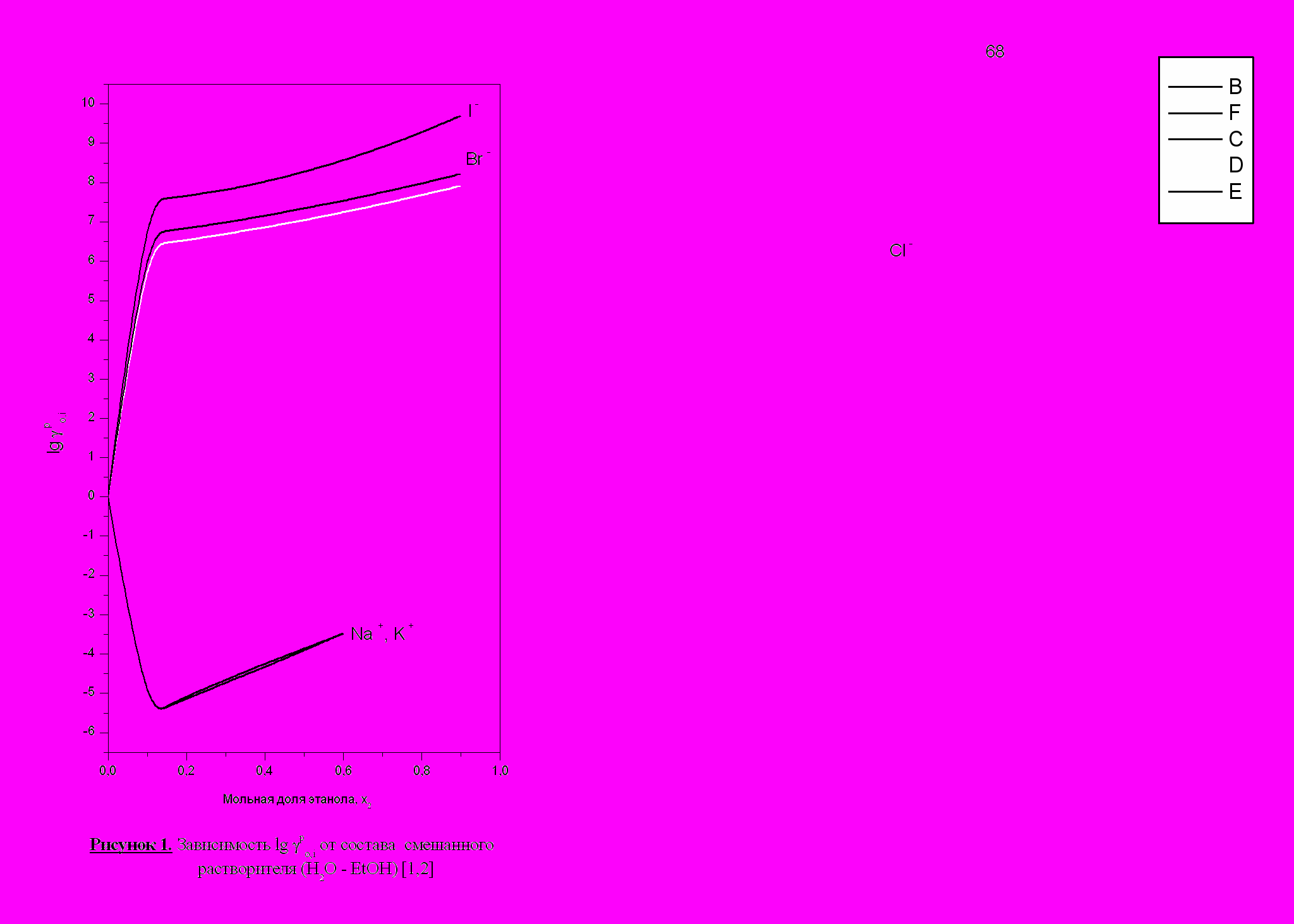
Различие в знаках
 анионов (табл.1,2) и катионов (рис.1) объясняется тем, что при малых добавках неводного растворителя работа выхода анионов (изменение реальной энергии сольватации, взятое с обратным знаком) существенно уменьшается в связи со значительным изменением структуры поверхностного слоя на границе растворгазовая фаза. Поверхностно-активные молекулы органического растворителя, адсорбируясь на поверхности воды, сообщают газовой фазе более отрицательный потенциал. Благодаря этому, образовавшийся двойной слой адсорбированных молекул неводных растворителей препятствует выходу анионов из воды в водно-органический растворитель через границу раздела фаз. Для катионов этот слой способствует выходу этих частиц из раствора.
анионов (табл.1,2) и катионов (рис.1) объясняется тем, что при малых добавках неводного растворителя работа выхода анионов (изменение реальной энергии сольватации, взятое с обратным знаком) существенно уменьшается в связи со значительным изменением структуры поверхностного слоя на границе растворгазовая фаза. Поверхностно-активные молекулы органического растворителя, адсорбируясь на поверхности воды, сообщают газовой фазе более отрицательный потенциал. Благодаря этому, образовавшийся двойной слой адсорбированных молекул неводных растворителей препятствует выходу анионов из воды в водно-органический растворитель через границу раздела фаз. Для катионов этот слой способствует выходу этих частиц из раствора.Химические
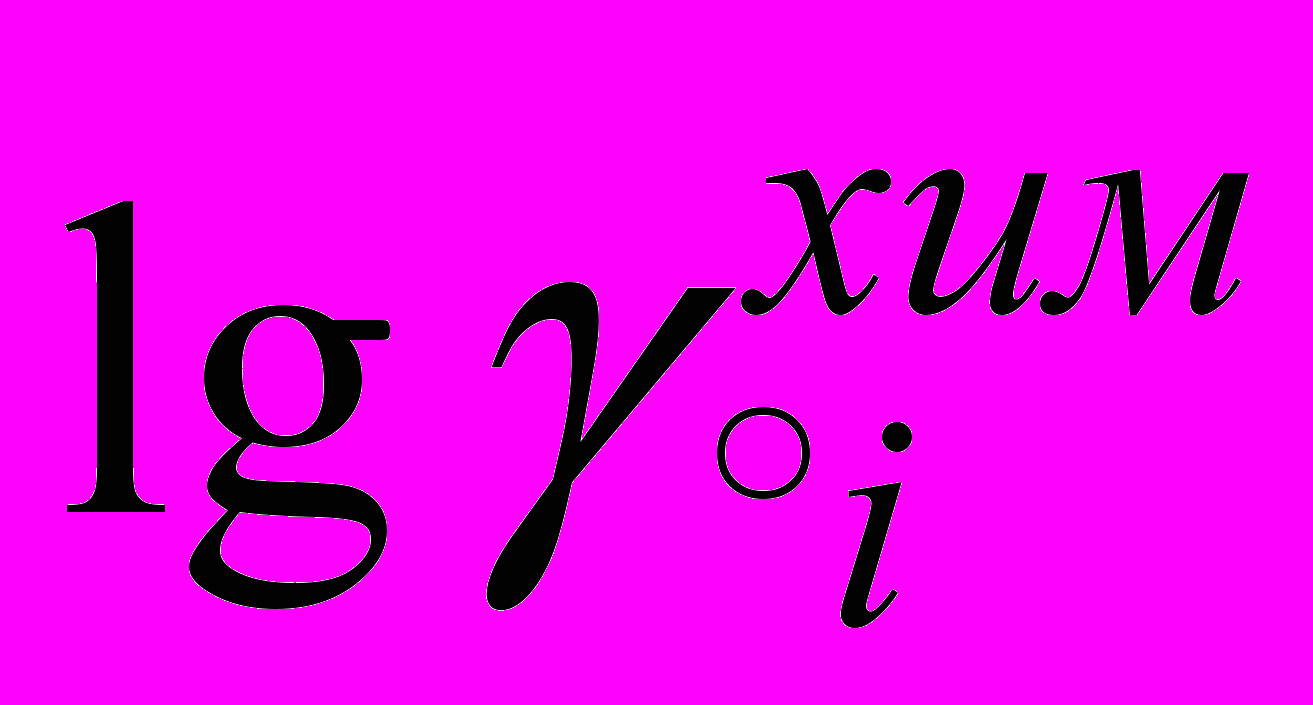 и реальные
и реальные  эффекты среды существенно различаются по физическому смыслу:
эффекты среды существенно различаются по физическому смыслу: 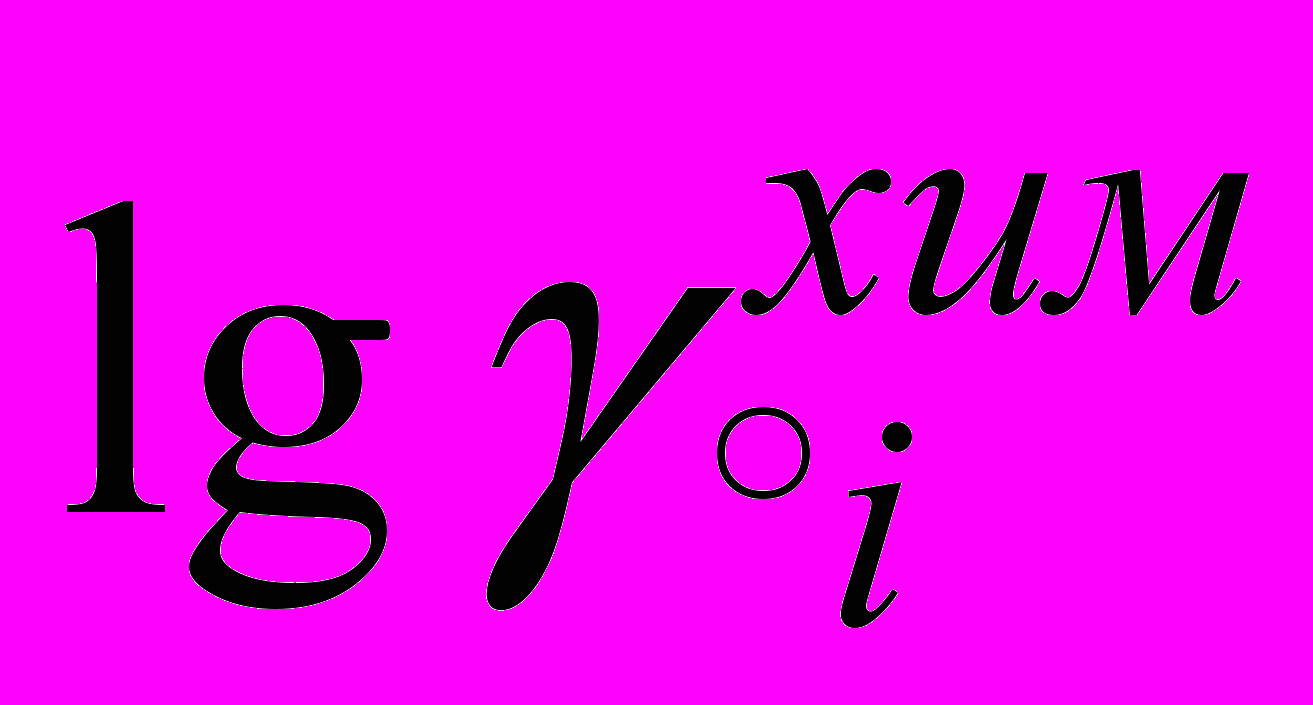 измеряются работой переноса одного моля компонента i из стандартного состояния в растворителе сравнения в стандартное состояние в исследуемом растворителе;
измеряются работой переноса одного моля компонента i из стандартного состояния в растворителе сравнения в стандартное состояние в исследуемом растворителе;  кроме этой работы переноса, включают работу по преодолению двух межфазных границ, отличающихся межфазными потенциалами.
кроме этой работы переноса, включают работу по преодолению двух межфазных границ, отличающихся межфазными потенциалами.Как следует из представленных в таблицах 3,4 данных, для всех изученных систем значения
 положительны и увеличиваются с ростом концентрации неводного компонента. Это говорит о том, что ионы брома и иода лучше сольватированы водой, чем водно-органическим растворителем. Это, отчасти, связано с уменьшением диэлектрической проницаемости водно-органической смеси и, как следствие, уменьшением электростатической составляющей энергии сольватации Гиббса.
положительны и увеличиваются с ростом концентрации неводного компонента. Это говорит о том, что ионы брома и иода лучше сольватированы водой, чем водно-органическим растворителем. Это, отчасти, связано с уменьшением диэлектрической проницаемости водно-органической смеси и, как следствие, уменьшением электростатической составляющей энергии сольватации Гиббса. Погрешности в определении  и
и  составляют 0.02 и 0.06 соответственно.
составляют 0.02 и 0.06 соответственно.
Подробное обсуждение химических эффектов среды целесообразно провести с использованием не
 , а энергий Гиббса переноса (пересольватации) ионов из воды в смешанный растворитель
, а энергий Гиббса переноса (пересольватации) ионов из воды в смешанный растворитель  .
.Термодинамические характеристики пересольватации не дают возможности определенно судить о количественном составе смешанных сольватных оболочек, однако позволяют количественно сравнить сольватирующие свойства растворителей и способность к сольватации различающихся по химической природе ионов.
Изменение реальных
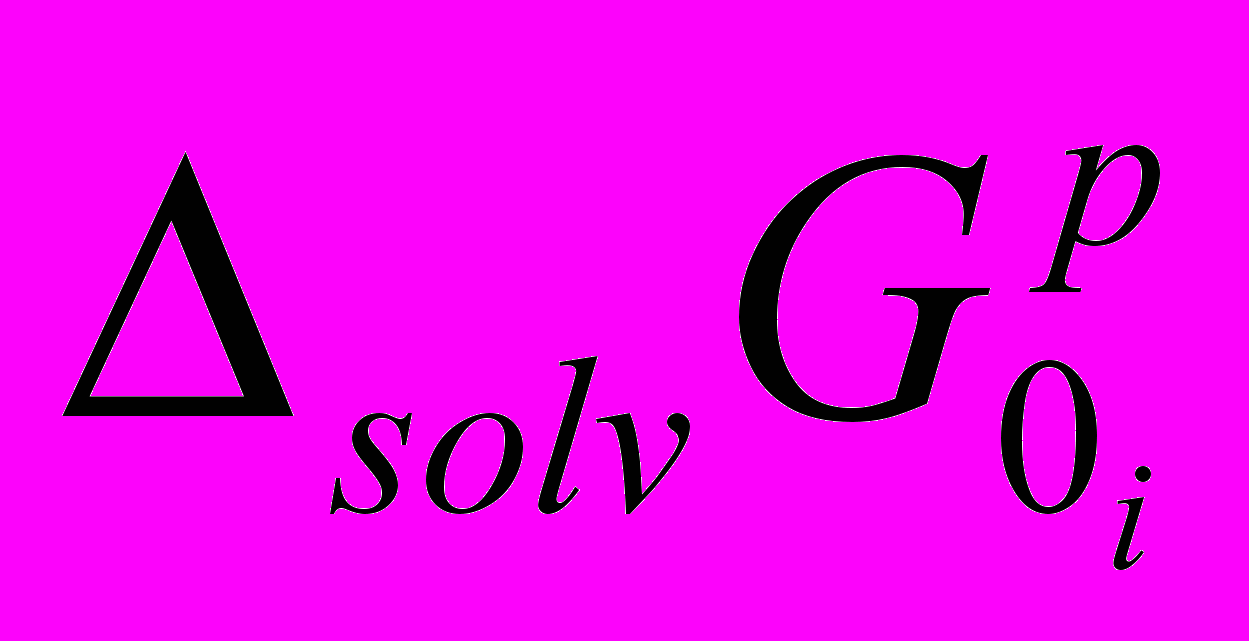 и химических
и химических 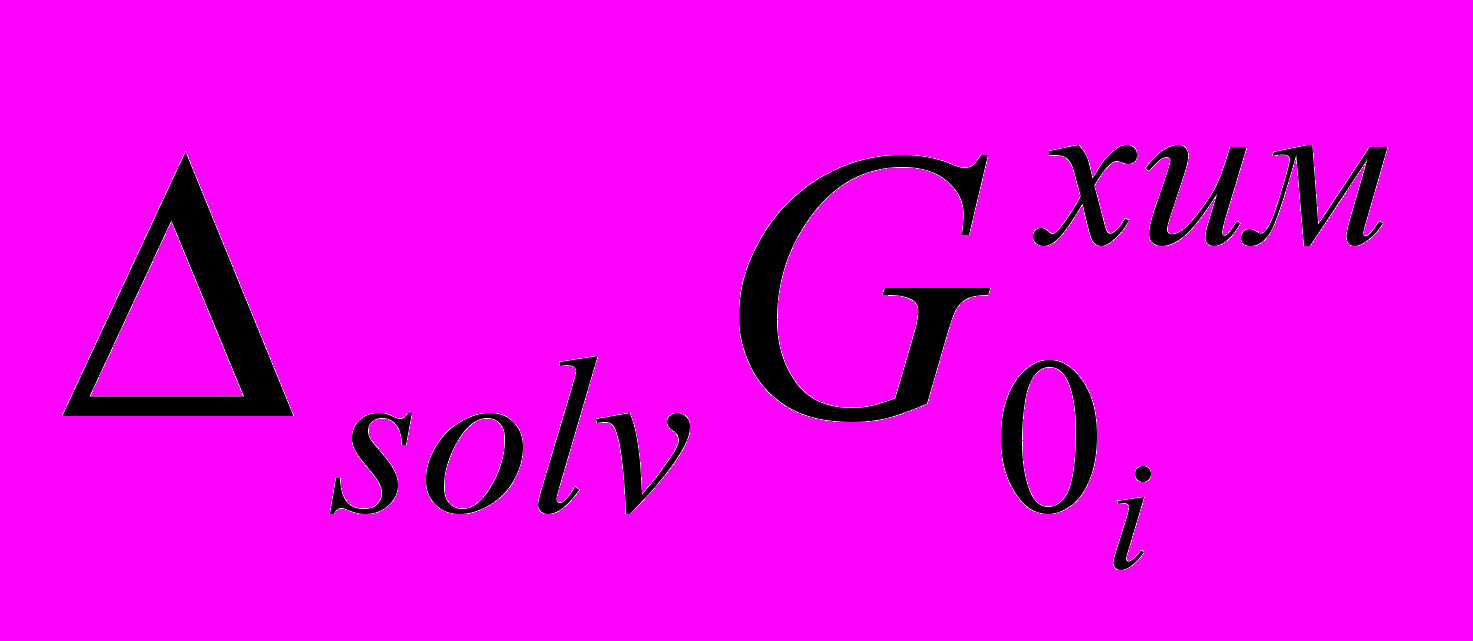 энергий сольватации ионов рассчитывались по следующим уравнениям:
энергий сольватации ионов рассчитывались по следующим уравнениям: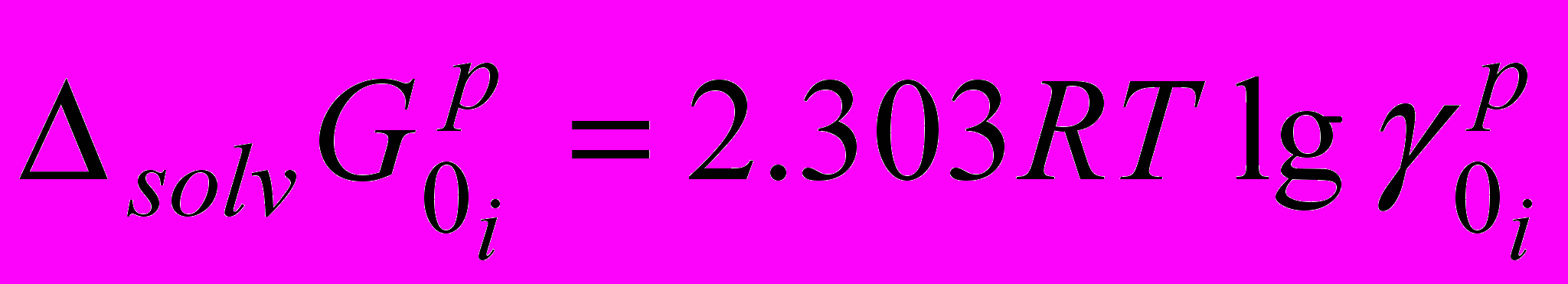 (2)
(2) (3)
(3)Таблица 5.
Химические энергии Гиббса переноса
 при 298.15 K
при 298.15 K| X | EtOH | n-PrOH | i-PrOh | Me2CO | MeCN | DMSO | DMF |
| 0.00 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.08 | - | 0.8 | 0.9 | 3.3 | 3.0 | - | - |
| 0.10 | 1.1 | 0.9 | 1.1 | 3.5 | 3.3 | 0.2 | 0.4 |
| 0.12 | 1.2 | 1.0 | 1.3 | 4.7 | 3.8 | - | - |
| 0.16 | 1.5 | 1.2 | 1.4 | - | 4.1 | - | - |
| 0.18 | - | - | - | 5.5 | - | - | - |
| 0.20 | 1.6 | 1.7 | 1.5 | 7.4 | 4.7 | 2.1 | 2.7 |
| 0.30 | - | - | - | - | 6.5 | 4.3 | 4.0 |
| 0.40 | 3.5 | 5.3 | 2.2 | 11.2 | 6.6 | 6.1 | 6.4 |
| 0.50 | - | - | - | - | - | 7.5 | 7.4 |
| 0.60 | 5.9 | 6.2 | 3.7 | 13.3 | 8.8 | 9.4 | 7.9 |
| 0.70 | - | - | - | - | - | 10.0 | 9.6 |
| 0.80 | - | - | - | - | - | 12.9 | 11.0 |
| 0.90 | 9.5 | - | - | - | - | 15.1 | 12.4 |
Таблица 6.
Химические энергии Гиббса переноса
 при 298.15 K
при 298.15 K| X | EtOH | n-PrOH | i-PrOh | Me2CO | MeCN | DMSO | DMF |
| 0.00 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.08 | - | 1.0 | 1.1 | 5.6 | 3.2 | - | - |
| 0.10 | 1.7 | 1.1 | 1.9 | 6.2 | 3.5 | 2.1 | 0.5 |
| 0.12 | 1.8 | 1.2 | 2.4 | 6.6 | 4.0 | - | - |
| 0.16 | 1.9 | 1.6 | 2.9 | - | 4.4 | - | - |
| 0.18 | - | - | - | 8.2 | - | - | - |
| 0.20 | 2.0 | 2.1 | 4.3 | 9.6 | 4.8 | 2.9 | 3.1 |
| 0.30 | - | - | - | - | 6.6 | 3.9 | 4.2 |
| 0.40 | 4.6 | 5.9 | 7.8 | 13.8 | 6.7 | 5.4 | 6.7 |
| 0.50 | - | - | - | - | - | 6.6 | 7.8 |
| 0.60 | 7.8 | 6.4 | 9.8 | 18.4 | 9.5 | 7.6 | 8.3 |
| 0.70 | - | - | - | - | - | 11.5 | 10.2 |
| 0.80 | - | - | - | - | - | 13.0 | 11.9 |
| 0.90 | 14.2 | - | - | - | - | 14.5 | 12.9 |
В таблицах 5,6 приведены вычисленные из экспериментальных данных химические энергии Гиббса переноса ионов брома и иода из воды в смешанные растворители при 298.15 К.
Величины
 имеют положительные значения и растут при увеличении содержания неводного компонента, что можно объяснить ослаблением сольватации этих ионов в водно-органических смесях по сравнению с водой. Эта общая тенденция имеет в каждом растворителе свои особенности.
имеют положительные значения и растут при увеличении содержания неводного компонента, что можно объяснить ослаблением сольватации этих ионов в водно-органических смесях по сравнению с водой. Эта общая тенденция имеет в каждом растворителе свои особенности.П
 ри этом, что на наш взгляд важно отметить, поведение катионов и анионов в некоторых растворителях существенно различается.
ри этом, что на наш взгляд важно отметить, поведение катионов и анионов в некоторых растворителях существенно различается.В водно-спиртовых растворителях, в богатых водой областях, ионы преимущественно гидратированы, так как спирты обладают меньшей сольватирующей способностью по сравнению с водой. С увеличением содержания спирта в смешанном растворителе происходит процесс пересольватации.
Для водно-спиртовых систем величины
 [2,3,5] при увеличении концентрации спирта до 0.60 м.д. возрастают приблизительно на 16 кДж··моль-1. Для анионов картина иная: величины
[2,3,5] при увеличении концентрации спирта до 0.60 м.д. возрастают приблизительно на 16 кДж··моль-1. Для анионов картина иная: величины 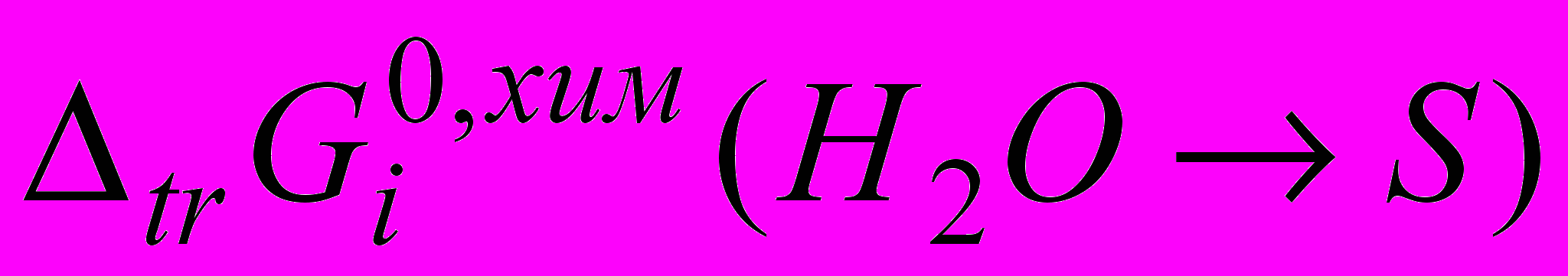 тоже возрастают, но значительно меньше.
тоже возрастают, но значительно меньше.Это позволяет сделать вывод, что при добавлении к воде протонных растворителей основной вклад в общую энергию пересольватации бромида и иодида натрия вносит катион. При этом ослабление сольватации у катионов проявляется в большей, чем у анионов, степени. По-видимому, в изученной области составов в случае анионов вытеснение молекул воды молекулами спирта протекает не так интенсивно, как в случае катионов, и их сольватные оболочки остаются состоящими преимущественно из молекул воды. Вероятно, здесь большую роль играет специфичность гидратации анионов, которая выражается в их способности образовывать с молекулами воды связи по типу водородных.
Сопоставление величин
 для катионов [1,3] и анионов свидетельствует о том, что вклады ионов противоположного знака в общую энергию пересольватации приблизительно одинаковы во всем изученном диапазоне составов. Этот факт может рассматриваться как свидетельство, говорящее в пользу допущения, что состав сольватных оболочек ионов в водно-ацетоновых смесях изменяется примерно пропорционально изменению состава растворителя по всей его массе.
для катионов [1,3] и анионов свидетельствует о том, что вклады ионов противоположного знака в общую энергию пересольватации приблизительно одинаковы во всем изученном диапазоне составов. Этот факт может рассматриваться как свидетельство, говорящее в пользу допущения, что состав сольватных оболочек ионов в водно-ацетоновых смесях изменяется примерно пропорционально изменению состава растворителя по всей его массе. Для смеси вода-ацетонитрил при изменении состава растворителя до X=0.60 м.д. неводного компонента значения
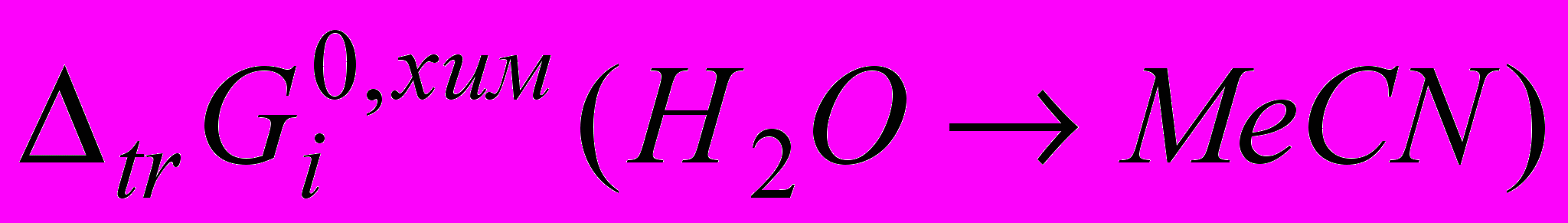 ионов натрия [1] увеличиваются на 4 кДж·моль-1, а для ионов брома и иода на 8-9 кДж·моль-1. Таким образом, в водно-органических смесях, в которых в качестве неводного компонента выступает полярный апротонный растворитель - ацетонитрил, в отличие от тех смесей, где добавками к воде являются протонные растворители - спирты, основной вклад в общую энергию пересольватации исследуемых электролитов вносит анион. Для катионов наблюдается противоположная картина.
ионов натрия [1] увеличиваются на 4 кДж·моль-1, а для ионов брома и иода на 8-9 кДж·моль-1. Таким образом, в водно-органических смесях, в которых в качестве неводного компонента выступает полярный апротонный растворитель - ацетонитрил, в отличие от тех смесей, где добавками к воде являются протонные растворители - спирты, основной вклад в общую энергию пересольватации исследуемых электролитов вносит анион. Для катионов наблюдается противоположная картина.Полученные данные можно объяснить тем, что ацетонитрил обладает слабой сольватирующей способностью по отношению к катионам, сольватная оболочка которых, по крайней мере, в ближайшем окружении, состоит в основном из молекул воды даже при относительно высоких концентрациях MeCN. Более того, согласно литературным данным, в присутствии ацетонитрила прочность связи катион-вода несколько усиливается.
Диметилсульфоксид и диметилформамид относятся к классу растворителей, молекулы которых способны вступать в донорно-акцепторную связь с ионами металлов. По этой причине при замене в сольватной оболочке молекул воды на молекулы DMSO и DMF положительный вклад в
 эффекта дегидратации компенсируется отрицательным вкладом эффекта сольватации катиона молекулами апротонного электронодонорного растворителя. Анионы, способные образовывать с протонодонорными растворителями водородные связи, в апротонных растворителях сольватируются слабо. Погрешность в определении
эффекта дегидратации компенсируется отрицательным вкладом эффекта сольватации катиона молекулами апротонного электронодонорного растворителя. Анионы, способные образовывать с протонодонорными растворителями водородные связи, в апротонных растворителях сольватируются слабо. Погрешность в определении  составляет 0.3 кДж·моль.
составляет 0.3 кДж·моль.Нами вычислены значения изменений поверхностных потенциалов на границе раздела раствор |газовая фаза для исследуемых органических растворителей и представлены в таблице 7.
Таблица 7.
Значения изменений поверхностного потенциала на границе раздела растворгазовая фаза для исследуемых органических растворителей (В) при температуре 298.15 К
| | Растворитель | ||||||
| Потенциал (В) | EtOH | n-PrOH | i-PrOh | Me2CO | MeCN | DMSO | DMF |
| - [наши] | 0.260 | 0.267 | 0.275 | 0.337 | 0.108 | 0.238 | 0.434 |
| - [литер] | 0.290 0.270 | | | 0.340 0.330 | 0.100 | 0.210 0.290 | 0.460 0.540 |
Полученные нами значения поверхностных потенциалов органических растворителей находятся в удовлетворительном согласии с литературными данными.
Величина погрешности определения поверхностного потенциала является основным моментом при расчете химических термодинамических характеристик отдельных ионов в растворах. В наших расчетах эта величина составила 0,001 В.
ИТОГИ РАБОТЫ
1. Методом компенсирующих напряжений вольта-цепей определены электрохимические характеристики растворов бромида и иодида натрия в смешанных растворителях [H2O - EtOH, - n-PrOH, - i-PrOH, - Me2CO, - MeCN, - DMSO, - DMF] в объеме жидкой фазы и на границе раздела растворгазовая фаза.
2. На основе полученных электрохимических экспериментальных данных рассчитаны: реальные
 и химические первичные эффекты среды
и химические первичные эффекты среды 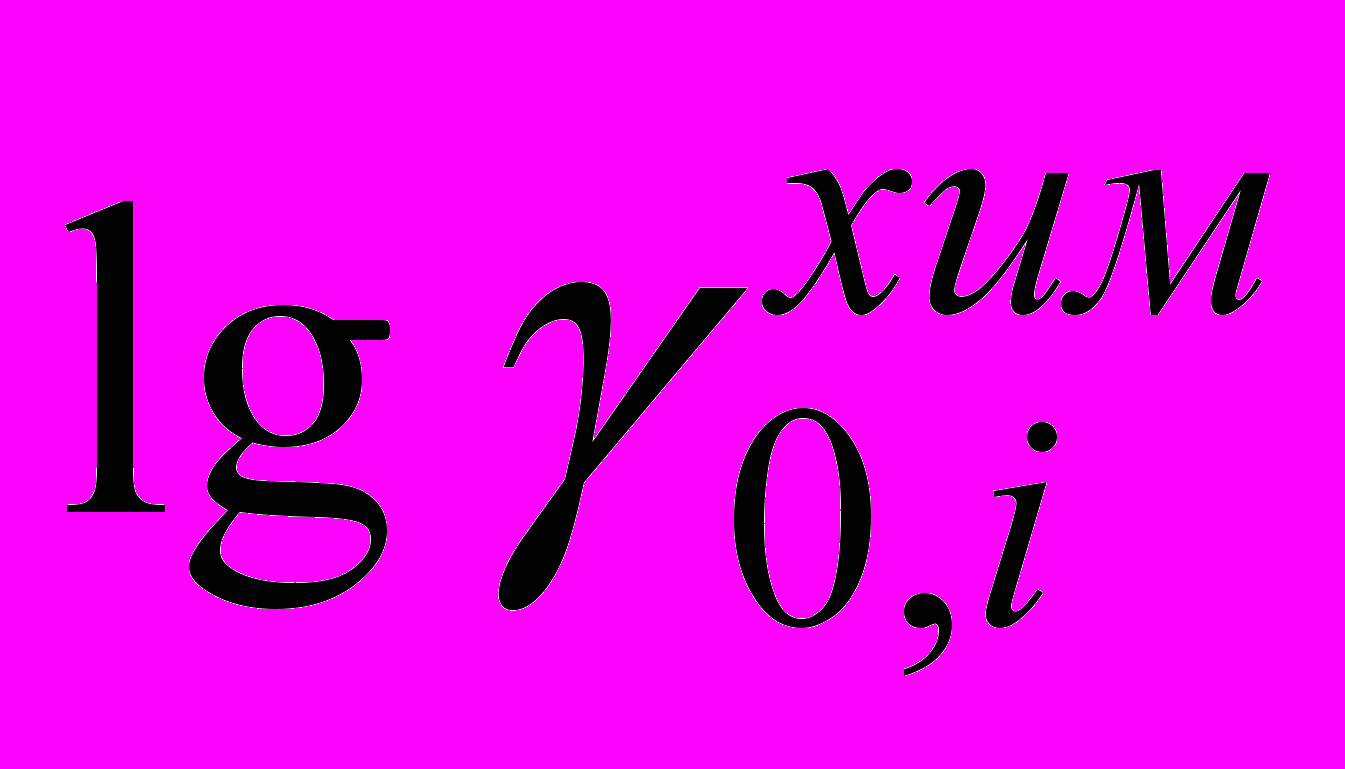 ; значения поверхностных потенциалов исследуемых органических растворителей; изменения реальной и химической энергии Гиббса при переносе ионов брома и иода из воды в водно - органический растворитель при 298.15 К.
; значения поверхностных потенциалов исследуемых органических растворителей; изменения реальной и химической энергии Гиббса при переносе ионов брома и иода из воды в водно - органический растворитель при 298.15 К.3. Проведено сравнение влияния состава смешанного растворителя на термодинамические параметры сольватации индивидуальных ионов. Найдены закономерности между изменениями этих характеристик, свойствами и структурными особенностями водно-органических смесей и природой ионов.
4.Установлены и объяснены следующие закономерности.
- Реальные первичные эффекты среды катионов и анионов имеют противоположные знаки. Характер их зависимости от состава смешанного растворителя определяется конкуренцией поверхностного и объемного вкладов. При малом содержании неводного компонента (X 0.1 м.д.) преобладает первый вклад.
- При добавлении к воде спиртов основной вклад в энергию пересольватации стехиометрической смеси ионов вносит катион.
- Состав сольватной оболочки в водно-ацетоновых смесях изменяется пропорционально изменению состава растворителя в объеме.
- Для смесей вода-ацетонитрил основной вклад в общую энергию пересольватации вносит анион. Катион сольватирован слабо.
- В смесях вода-DMSO и вода-ДМF при замене молекул воды на молекулы апротонных растворителей имеет место компенсация эффекта дегидратации эффектом координационной сольватации катиона электродонорными центрами неводного компонента. Анионы сольватированы слабо.
Основное содержание диссертации опубликовано в работах:
1. Парфенюк В.И., Парамонов Ю.А., Чанкина Т.И., Крестов Г.А. Термодинамические характеристики сольватации отдельных ионов, рассчитанные на основе метода вольтовых разностей потенциалов. // Доклады АН СССР. 1988. № 3. С.637
2. Парфенюк В.И., Парамонов Ю.А., Чанкина Т.И., Крестов Г.А. Первичный эффект индивидуальных ионов в водно-этанольных смесях. // Журн. физ. химии. 1989. Т.LXIII. Вып.6. С.1493-1497
3. Парфенюк В.И., Чанкина Т.И. Электрохимическое исследование растворов бромида натрия в смесях вода-ацетон, вода-изопропанол // Журн. физ. химии. 1992. Т.6. № 10. С.2781-2782
4. Чанкина Т.И., Кудринская Е.В. Парфенюк В.И Электрохимическое исследование систем хлорид кальция-вода-ацетон и хлорид кадмия-вода-ацетон методом ЭДС цепей без переноса. // Рукопись деп. в ВИНИТИ. 9.04.90 от № 1919-В90. 9 с.
5. Чанкина Т.И., Парфенюк В.И. Исследование сольватации ионов брома, иода и натрия в смесях вода-н-пропанол методом вольтовых разностей потенциалов. // Рукопись деп. в ВИНИТИ. 25.06.9 от № 2649-В91. 8 с.
6. Чанкина Т.И., Парфенюк В.И. Термодинамические характеристики сольватации иодида и бромида натрия в смесях вода-этиловый спирт. // Рукопись деп. в ВИНИТИ. 24.09.91 от № 3786-В91 (Электрохимия. 1992. Т.28. Вып.3). 9 с.
7. Чанкина Т.И., Парфенюк В.И. Электрохимическое исследование систем бромид натрия-вода-н-пропанол, иодид натрия-вода-н-пропанол методом ЭДС цепей без переноса.. // Рукопись деп. в ВИНИТИ. 24.09.91 от № 3787-В91 (Электрохимия. 1992. Т.28. Вып.3). 8 с.
- Парфенюк В.И., Чанкина Т.И. Термодинамические характеристики сольватации ионов брома и иода в водно-этанольных смесях, рассчитанные на основе метода вольтовых разностей потенциалов. // Электрохимия. 1994. Т.30. № 6. С.812-813
- Парфенюк В.И., Чанкина Т.И. Термодинамические характеристики сольватации ионов брома и иода в смесях вода-н-пропанол. // Журн. физ. химии. 1994. Т.68. № 11. С.2089-2090
10. Парфенюк В.И., Чанкина Т.И. Электрохимическое исследование сольватации ионов брома и иода в смесях вода-ацетонитрил. // Журн. физ. химии. 1996. Т.70. № 7. С.1330-1331
11. Парфенюк В.И., Чанкина Т.И. Исследование сольватации бромид- и иодид-ионов в смесях вода-н-пропанол методом вольтовых разностей потенциалов. // Электрохимия. 1996. Т.32. № 8. С.993-995
12. Парфенюк В.И., Чанкина Т.И. Оценка вклада иона в величину поверхностного вклада органических растворителей. // Журн. физ. химии. 1997. Т.71. № 3. С.547-550
- Парфенюк В.И., Чанкина Т.И. Сольватация ионов хлора в смесях вода-диметилсульфоксид по данным метода вольтовых разностей потенциалов. // Журн. физ. химии. 1997. Т.71. № 9. С.1707-1708
- Парфенюк В.И., Чанкина Т.И. Определение поверхностных потенциалов растворов электролитов в смесях вода-диметилсульфоксид на основе метода вольтовых разностей потенциалов. // Журн. физ. химии. 1998. Т.72. № 5. С.884-886
- Парфенюк В.И., Чанкина Т.И. Использование метода вольтовых разностей потенциалов для исследования термодинамических характеристик индивидуальных ионов и поверхностных свойств в растворах вода-диметилформамд. // Электрохимия. 1999. № 12. С.1473-1476
16. Парфенюк В.И., Чанкина Т.И. Термодинамические характеристики пересольватации ионов брома в смесях вода-диметилсульфоксид. // Электрохимия. 2002. № 3. С.368-370
- Парфенюк В.И., Чанкина Т.Т. Термодинамические характеристики пересольватации ионов иода в смесях вода-диметилсульфоксид. // Электрохимия. 2002. № 4. С.485-488.
18-28. Тезисы докладов коференций.
