Руководство по глаукоме (путеводитель) для поликлинических врачей
| Вид материала | Руководство |
- Руководство для врачей, 538.15kb.
- Руководство по военно-полевой хирургии содержит подробную и современную информацию, 107.5kb.
- «инфекции в хирургии и интенсивной терапии», 301.75kb.
- Методические указания предназначены для организаторов здравоохранения, специалистов, 325.02kb.
- В. В. Активное ведение родов. Руководство для врачей. Санкт-Петербург, Специальная, 54.77kb.
- Агрессия. Формы проявления и коррекции, 32.04kb.
- М. А. Выжигина респираторная поддержка искусственная и вспомогательная вентиляция лёгких, 4982.08kb.
- Пособие предназначено для врачей психиатров-наркологов, психиатров, а также врачей, 2459.51kb.
- Г. Бейс, В. Кучма школы здоровья в европе и россии, 4080.28kb.
- В. В. Антибиотики в акушерстве и гинекологии: Руководство, 36.91kb.
Одним из новых направлений в лечении глаукомы является нейропротекторная терапия. Нейропротекция подразумевает защиту сетчатки и волокон зрительного нерва от повреждающего действия различных факторов. Нейропротекторная терапия направлена прежде всего на коррекцию метаболических нарушений, возникающих при глаукоме в головке зрительного нерва, кроме того целью лечения является улучшение местной микроциркуляции и трофики тканей, нормализация реологических свойств крови, увеличение основного и коллатерального кровообращения.
Нейропротекторная терапия эффективна только при условии достижения “давления цели” с помощью медикаментозного лечения, лазерного или хирургического воздействий.
Исследовав структуру зрительного нерва при глаукоме M. Schwatz и E. Yoles (1998) выделили 4 степени изменения аксонов: безвозвратно погибшие; часть имела признаки соответствующие острой фазе дегенерации; в некоторых наблюдались дистрофические изменения, вследствие которых при сохранении условий существования они могли погибнуть и, наконец, были выявлены аксоны, структура которых была полностью сохранена. Учитывая эти данные следует сказать, что нейропротекторная терапия направлена прежде всего на уменьшения явлений дистрофии в третьей группе аксонов, а также на сохранения целостности структуры неизмененных элементов.
В настоящий момент принято выделять две группы нейропротекторных препаратов - прямые и непрямые нейропротекторы.
Согласно данной классификации прямые нейропротекторы непосредственно защищают нейроны сетчатки и волокна зрительного нерва. Эти препараты блокируют основные факторы повреждения клеток, которые обусловлены развитием ишемии в этой зоне, в результате которой наблюдается увеличение концентрации продуктов ПОЛ и свободных радикалов, ионов Са++, ацидоз. Прямыми нейропротекторными свойствами обладают природные витамины и флавоноиды - аскорбиновая кислота, -токоферол, витамин А, -аминомаслянная кислота (ГАМК); ферменты антиоксидантной системы организма – супероксиддисмутаза (СОД); неферментные антиоксиданты – эмоксипин, мексидол и гистохром; блокаторы кальциевых каналов – бетаксолол, нифедипин; нейропептиды – ретиналамин, кортексин; антигипоксанты – цитохром с. Кроме того, в настоящее время ведется поиск препаратов, которые могли бы непосредственно устранять факторы, способствующие активации апоптоза. Действие этих препаратов направлено на снижение неблагоприятного влияния глютамата и других субстратов на аксоны ганглионарных нейронов.
Непрямое нейропротекторное действие подразумевает влияние препаратов на различные факторы, увеличивающие риск повреждения клеток (снижение перфузионного давления, атеросклероз, изменение реологических свойств крови, ангиоспазм), а также повышение устойчивости организма к снижению перфузионного давления кислорода в тканях. Подобным эффектом обладают препараты, улучшающие микроциркуляцию (теофиллина этилендиамин и никотинат, винпоцетин, пентоксифиллин и др.), реологические свойства крови, снижающие уровень холестерина в крови, ноотропные средства.
^ Препараты прямого действия должны использоваться всегда у всех больных глаукомой, так как они влияют на основные, присутствующие практически у любого пациента звенья патогенеза.
Выбор препаратов непрямого действия зависит от преобладания в клинической картине тех или иных факторов, усугубляющих течение глаукомы. Таким образом, подбор нейропротекторной терапии требует тщательного системного обследования пациента, что позволит выявить признаки гемодинамических нарушений (гипотония и эпизоды ночных гипотонических кризов, периферический вазоспазм, мигрени, выраженные атеросклеротические изменения) и метаболических сдвигов (склонность к гипергликемии). Поэтому при обследовании пациентов необходимо привлекать специалистов других профилей (терапевтов, сосудистых хирургов, невропатологов и др.).
Контроль за эффективностью проводимой терапии следует проводить каждые 6 месяцев. Обследование должно включать современные методы контроля за состоянием зрительных функций (компьютерные способы оценки состояния поля зрения и электрофизиологическое обследование, в том числе с использованием вакуум-компрессионных проб, визоконтрастометрия и т.д.) и головки зрительного нерва с помощью таких приборов как гейдельбергский ретинальный томограф, оптические когерентные томографы.
^ Описание основных групп нейропротекторов
Блокаторы кальциевых каналов.
На сегодняшний день имеются сведения о существовании нескольких типов ионных каналов, а также различных препаратов, блокирующих поступление ионов Са++ в клетку по этим каналам. Блокаторы кальциевых каналов не только повышают устойчивость клеток к ишемии, но и оказывают сосудорасширяющее действи. Среди препаратов этой группы наибольшее внимание офтальмологов привлекает бетаксолол – селективный адреноблокатор, который применяется местно в виде инстилляций в конъюнктивальный мешок. При этом он не только эффективно снижает внутриглазное давление, но и оказывает прямое нейропротекторное действие. Нейропротекторное действие бетаксолола связано со снижением сосудистого сопротивления в артериях сетчатки и зрительного нерва и повышением устойчивости нейронов сетчатки к ишемии, что связано с его влиянием на кальциевый обмен и активность некоторых ферментативных систем (например, аспартатаминотрансферазу).
Фармакокинетика
Бетаксолол хорошо проникает во все структуры глазного яблока, в том числе и в сетчатку. Максимальная концентрация препарата в тканях глазного яблока возникает в течение первого часа после его введения. Период полувыведения в зависимости от отдела глазного яблока составляет от 1,5 до 2,0 часов (табл. 1).
Таблица 1.
^ Основные фармакокинетические параметры, характеризующие распределение бетаксолола в тканях глазного яблока.
| Ткань | Фармакокинетические параметры | |||||||
| AUC, мкг ч/мг | C0, мкг/мг | MRT, ч | T1/2, ч | T1/2 , ч | T1/2 a, ч | T1/2 , ч | Tmax, ч | |
| Роговица | 66,9 | 34,12 | 1,63 | 1,36 | 1,98 | 0,077 | 1,05 | 0,31 |
| ВГЖ | 43,33 | 15,17 | 1,85 | 1,98 | 3,65 | 0,33 | 1,73 | 1,0 |
| Хрусталик | 55,63 | 54,52 | 1,48 | 0,7 | 0,78 | 0,23 | 0,88 | 0,62 |
| Сосудистая оболочка | 77,31 | 43,29 | 2,0 | 1,24 | 1,87 | 0,32 | 13,86 | 1,3 |
| Стекловидное тело | 7,89 | 5,68 | 1,38 | 0,96 | 1,03 | 0,13 | 1,06 | 0,42 |
| Сетчатка | 40,23 | 21,32 | 1,89 | 1,28 | 1,33 | 0,36 | 0,99 | 0,91 |
С гипотензивной целью растворы бетаксолола инстиллируют в конъюнктивальную полость 1-2 раза в день. Однако, учитывая данные фармакокиненики, для создания эффективной терапевтической дозы препарата в заднем отделе глазного яблока требуется более частое введение препарата (до 3-4 раз в день).
При назначении бетаксолола следует учитывать противопоказания к его применению:
- гиперчувствительность
- дистрофия роговицы
- синусовая брадикардия
- сердечная недостаточность
- атриовентрикулярная блокада II-III степени,
- кардиогенный шок
Так же следует соблюдать осторожность в следующих ситуациях:
Сахарный диабет. Следует с осторожностью назначать больным со склонность к гипогликемии, т.к., обладая бета-адреноблокирующим эффектом, бетаксолол может маскировать симптомы острой гипогликемии (возбуждение, сердцебиение).
Тиреотоксикоз. Препарат может маскировать некоторые симптомы гипертиреоидизма (например: тахикардию). У пациентов с подозрением на тиреотоксикоз не следует его резко отменять, т.к. это может вызвать усиление симптомов. У больных с гипотиреозом изменяется время рефлекторной реакции.
Мышечная слабость. Препарат может вызвать симптомы, сходные с таковыми при миастении (например: диплопия, птоз, общая слабость).
Хирургия. Перед плановой операцией препарат должн быть постепенно (не одномоментно!) отменен за 48 часов до общей анестезии, т.к. во время общего наркоза он может уменьшить чувствительность миокарда к симпатической стимуляции, необходимой для работы сердца.
Следует применять с осторожность у больных с синдромом Рейно и феохромоцитомой (возможно резкое повышение артериального давления).
^ Беременность и лактация
Во время беременности применяют, если ожидаемая польза для матери превышает потенциальный риск для плода.
При необходимости применения во время лактации следует решить вопрос о прекращении грудного вскармливания.
При лечении необходим постоянный контроль (1 раз в 6 месяцев) за продукцией слезы, состоянием эпителия роговицы.
При применении препарата необходимо учитывать возможные взаимодействия с другими лекарственными средствами (табл. 2).
Таблица 2.
| Препараты | Эффект |
| Более выраженное снижение артериального давления и брадикардия. |
| Дополнительное снижение внутриглазного давления и усиление бета-адреноблокирующего воздействие на сердечно-сосудистую систему. |
| Усиление действия |
| Усиление их сосудосуживающего эффекта |
Побочные эффекты
- Со стороны сердечно-сосудистой системы - брадикардия, нарушение сердечной проводимости и сердечная недостаточность, при повышенной чувствительности может быть снижение артериального давления;
- Со стороны дыхательной системы - бронхоспазм;
- Со стороны ЦНС - сонливость, бессонница, кошмарные сновидения, головокружение, депрессию, возбуждение, астения, парестезии, усиление симптомов тяжелой псевдопаралитической миастении;
- Со стороны желудочно-кишечного тракт - диарея, рвота;
- Со стороны кожных покров -: аллергические реакции (крапивница, сыпь), обострение псориаза;
- Со стороны органа зрения – сухость глаза, раздражение конъюнктивы, отек эпителия роговицы, точечный поверхностный кератит, аллергический блефароконъюнктивит.
- Прочие - снижение потенции
При местном применении риск развития системных побочных эффектов значительно ниже, чем при системном использовании препаратов.
Препараты
- Бетоптик (Betoptic) (Alcon) - 0,5% глазные капли в пластмассовых флаконах-капельницах емкостью 5 мл.
- ^ Бетоптик С (Betoptic S) (Alcon) - 0,25% офтальмологическая стерильная суспензия в пластмассовых флаконах-капельницах емкостью 5 и 10 мл.
Ферментные антиоксиданты
Природным компонентом антиоксидантной защиты организма является супероксиддисмутаза (СОД) – фермент, который катализирует захват супероксидного анион-радикала с образованием кислорода и перекиси водорода. Супероксиддисмутаза (СОД) относится к классу металлопротеидов. Его активность зависит от концентрации супероксидного анион-радикала в тканях. При длительном сохранении стресса или условий гипоксии активность эндогенного СОД снижается. Вызывая разрушение активных форм кислорода, СОД оказывает антиоксидантное и противовоспалительное действие. В своих исследованиях В.Н. Алексеев и Е.Б. Мартынова показали, что СОД, благодаря выраженному антиоксидантному действию, тормозит развитие процессов деградации в трабекулярной ткани и в волокнах зрительного нерва
Фармакокинетика
СОД хорошо проникает в различные ткани глаза при различных способах введении. Максимальная концентрация препарата определяется через 60 -120 минут. Лучше всего препарат накапливается в сосудистой оболочке и сетчатке. Наиболее высокие концентрации препарата в сетчатке отмечаются при инстилляционном и субконъюнктивальном введении. Скорость выведения СОД из глазного яблока зависит от способа введения и исследуемой структуры глазного яблока. В среднем, период выведения составляет около 2-х часов.
Способ введения и дозы:
Учитывая данные фармакокинетики с нейропротекторной целью наиболее целесообразно инстилляционное введения препарата с частотой 5-6 раз в день. Возможно также использование метода форсированных инстилляций - в течение часа 1 капля препарата закапывается 6 раз с интервалом 10 минут. Курс лечения составляет 2-4 недели, промежуток между курсами 2 месяца.
Противопоказания: повышенная чувствительность к компонентам препарата.
Побочные эффекты: возможно развитие аллергических реакций.
Препараты
- Эрисод (ООО “Рэсбио” С-Петербург) - лиофилизированный порошок по 400000 ЕД и 1600000 ЕД в ампулах и флаконах. Для приготовления раствора (глазные капли) содержимое флакона (ампулы) разводят на 2 мл физиологического раствора ex tempore. Полученный раствор можно использовать в течение 3 дней.
- Рексод* (ООО “Рэсбио” С-Петербург) - лиофилизированный порошок по 800000 ЕД во флаконах. Для приготовления раствора (глазные капли) содержимое флакона разводят на 2 мл физиологического раствора ex tempore. Полученный раствор можно использовать в течение 3 дней.
* Следует отметить, что СОД, полученный из растительного сырья, отличается менее выраженными токсическими свойствами.
Неферментные антиоксиданты
Одним из активаторов ПОЛ является гидроксильный радикал (НО), который образуется вследствие разложения молекул перекиси водорода в присутствие ионов железа и меди (реакции Габера-Вейса). Как показали физико-химические исследования, эхинохром (гистохром) способен нейтрализовать катионы железа, накапливающиеся в зоне ишемии. Кроме того, он выполняет роль перехватчика свободных радикалов. А также улучшает энергетический обмен в тканях и реологические свойства крови на фоне ишемии.
Фармакокинетика
Гистохром при периокулярном введении наиболее хорошо накапливается во влаге передней камеры, сосудистой оболочке и сетчатке. Фармакокинетические параметры в отношении сетчатки при субконъюнктивальном и парабульбарном введении препарата отличаются незначительно, так при субконъюнктивальном введении максимальная концентрация составляет 47,6 мкг/мг, а при парабульбарном введении – 55,83 мкг/мг, время достижения максимальной концентрации в обоих случаях составляет один час, а период полувыведения 1,5 часа.
Противопоказания: индивидуальная непереносимость компонентов препарата.
Данных о безопасности применения при беременности, лактации и в педиатрии нет.
Побочные эффекты: аллергические реакции, умеренная болезненность в месте инъекции.
Способ применения и дозы: препарат вводится субконъюнктивально или парабульбарно по 0,3-0,5 мл ежедневно. Курс лечения 10 инъекций.
Препарат
- Гистохром (Hystochrom) (ЗАО «Брынцалов-А», Россия) - 0,02% раствор в ампулах по 1мл.
Другим механизмом сохранения электронно-транспортных систем является активация альтернативных НАДН-оксидазному пути. На ранних стадиях гипоксии с этой целью клеткой используется сукцинатоксидазный путь. Переход на преимущественное окисление сукцината является защитной реакцией клетки на недостаток поступления кислорода. Янтарная кислота и ее производные обладают положительным влиянием на течение разнообразных метаболических процессов: они способны модифицировать фосфолипиды, обеспечивая их ресинтез, снижают ионную проницаемость мембран и способствуют выходу К+ по градиенту концентрации, участвуют в регуляции кальциевого обмена, способны снижать избыток липидов и их метаболитов. Соли янтарной кислоты входят в состав различных пищевых добавок (митомин, энерлит, янтавит и др.).
Однако более перспективным является создание сукцинатсодержащих гетероциклитических соединений. К ним относят 2-этил-6-метил-3-оксипиридина сукцинат (мексидол). Он относится к группе синтетических фенольных соединений. При введении в организм мексидол оказывает такое же биологическое действие, как и природные фенольные соединения. В организме природные фенольные соединения содержатся практически во всех тканях и составляют 1-2% биомассы. Они являются синергистами аскорбиновой кислоты и образуют буферную окислительно–восстановительную систему. Биологические эффекты мексидола многообразны: он оказывает положительное влияние на процессы энергообразования в клетке, активизирует внутриклеточный синтез белка и нуклеиновых кислот. Активизируя ферментативные процессы цикла Кребса, препарат способствует утилизации глюкозы и увеличению образования АТФ. Кроме того, мексидол способен усиливать процессы гликолиза, которые являются компенсаторной реакцией тканей в условиях ишемии. Его фармацевтическое действие также обусловлено модулирующим влиянием на мембраносвязанные ферменты и рецепторные комплексы, что способствует сохранению структурно-функциональной организации мембран, транспорта медиаторов и улучшению синаптической передачи. Мексидол также улучшает кровоток в зоне ишемии, ограничивает зону ишемического повреждения и стимулирует репаративный процесс. Он стабилизирует мембраны клеток крови и способствует улучшению реологических свойств крови.
Фармакокинетика
При парентеральном введении максимальная концентрация в плазме наблюдается в течение 0,45-0,5 ч, он определяется в плазме в течение 4 ч, среднее время удержания препарата в организме 0,7-1,3 ч. После парентерального введения быстро переходит из кровеносного русла в различные ткани. Данных о степени проникновения в ткани глазного яблока нет. Метаболизируется в печени. Выводится в основном почками.
Противопоказания
- Острые нарушения функции почек и печени
- Повышенная чувствительность к препарату
Данных о безопасности применения при беременности, лактации и в педиатрии нет.
Особые указания
У пациентов с АД выше 180/100 мм рт.ст., кризовым течением артериальной гипертензии и выраженной афореактивной неустойчивостью требуется предварительная коррекция артериальной гипертензии и седативная терапия.
При применении препарата необходимо учитывать возможные взаимодействия с другими лекарственными средствами (табл. 3).
Таблица 3.
| Препараты | Эффект |
| Усиление действия перечисленных препаратов |
| Уменьшение токсического действия этилового спирта. |
Побочные эффекты
- Со стороны пищеварительной системы – тошнота, сухость во рту;
- Прочие – аллергические реакции
Передозировка (препарат малотоксичен и развитие передозировки маловероятно) – возникает сонливость и усиливается седетивное действие.
^ Способ введения и дозы
Препарат вводят внутримышечно в дозе 100 мг 2 раза в сутки в течение 10-14 дней.
Препараты
- Мексидол (Mexidol) (ООО НПК «Фармасофт», Россия) – 5% раствор в ампулах по 2 мл (100 мг).
Среди большого числа препаратов, оказывающих антиоксидантное действие, для защиты сетчатки при различных заболеваниях, сопровождающихся ишемией её тканей, эмоксипин (3-окси-6-метил-2 этил-пиридина гидрохлорид) был разработан одним из первых. Эмоксипин является структурным аналогом витамина В6. В организме природный витамин В6 играет роль физиологического антиоксиданта. Витамин В6 оказывает стимулирующее действие на сукцинатдегидрогеназу (СДГ) и ГАМК-трансаминазу. Аналогично витамину В6 его аналоги оказывают антиоксидантное действие. Вследствие наличия гидроксила фенольного типа в структуре азотистого гетероцикла 3-оксипиридин ингибирует ПОЛ. Эмоксипин является высокоэффективным ингибитором гидроксильных радикалов, первичных и вторичных радикалов пептидов. Кроме того, эмоксипин является эффективным ингибитором кальций-независимой фосфодиэстеразы, вследствие чего увеличивается концентрация цАМФ в тканях. Благоприятное влияние эмоксипина на энергетический обмен тканей заключается в торможении гликолитических процессов. Кроме того, эмоксипин уменьшает агрегацию тромбоцито и обладает фибринолитической активностью. Важным свойством эмоксипина является защитное влияние препарата на мембрану эритроцитов. Стабилизация мембран эритроцитов играет важную роль при нарушении микроциркуляции. Кроме того, он оказывает воздействие на тонус сосудистой стенки.
Фармакокинетика: препарат хорошо проникает в различные ткани глаза как при инстилляционном, так и при инъекционном введении. Эмоксипин быстро накапливается в тканях (в течение первых 15-30 минут достигается максимальная концентрация). Следует отметить, что при любом способе введения в сетчатке наблюдалось наиболее высокое накопление эмоксипина. При этом количество препарата, достигающее сетчатки, при парабульбарном введении превышало аналогичный показатель, определенный при субконъюнктивальном введении, на 40,2% и при инстилляционном введении на 21%. Препарат быстро метаболизируется в тканях глаза, что приводит к быстрому падению концентрации эмоксипина в глазу. Уже через 1 час препарат практически не определяется в тканях глазного яблока.
Противопоказания:
- гиперчувствительность
Особенности применения
Во время лечения эмоксипином следует контролировать свертываемость крови.
Нельзя смешивать раствор эмоксипина в одном шприце с другими препаратами.
Побочные эффекты
- Аллергические реакции
При введении в виде периокулярных инъекций возможно боль, жжение, зуд, покраснение и уплотнение параорбитальных тканей.
Эффект эмоксипина усиливается при его совместном применении с a-токоферолом, масляный раствор которого применяют внутрь по 50-100 мг в сутки
Способ введения и дозы:
Существует несколько способов введения эмоксипина: инстилляции в конъюнктивальный мешок, использование глазных лекарственных пленок (к сожалению, в настоящее время их производство практически прекращено) и периокулярные инъекции. Учитывая данные фармакокинетики, наиболее целесообразным является использование либо инстилляций с частотой до 5-6 раз в сутки. Можно также использовать метод форсированных инстилляций – в течение часа препарат закапывают 6 раз каждые 10 минут - в этом случае частоту инстилляций можно уменьшить до 3-4 раз в сутки. Кроме того, целесообразным является использование лекарственных пленок или контактных линз пропитанных раствором эмоксипина. Курс лечения составляет 2-4 недели, промежуток между курсами 2 месяца.
Препараты
- Эмоксипин (Россия) - раствор для инъекций 1% в ампулах по 1 мл.
- Эмоксипин (Россия) - 1% раствор (глазные капли) во флаконах по 5 мл.
- Пленки глазные с эмоксипином (ООО НПО “Экран”, Россия) – пленки глазные, содержащие 0,001 г эмоксипина.
Нейропептиды
Впервые попытка использовать эндогенные физиологически активные вещества для лечения различных заболеваний была предпринята французским физиологом Броун-Секаром в конце 18 века. Он использовал экстракты из семенных желез различных животных в качестве омолаживающего средства.
В дальнейшем для лечения различных заболеваний начали применять вещества полипептидной природы, полученные из различных органов и тканей (головного мозга, гипоталамуса, костного мозга, селезенки, лимфатических узлов, кровеносных сосудов, легких, печени, вилочковой железы, сетчатки и других).
Эти вещества получили название пептидных биорегуляторов или цитомединов. Термин «цитомедины» был предложен В.Г. Морозовым и В.Х. Хавинсоном. Он образован от греческого слова «citos» и латинского «mediator».
Эти вещества являются щелочными полипептидами, имеющими молекулярную массу от 1 000 до 10 000 Да. Их получают из различных тканей с помощью метода кислотной экстракции с последующей очисткой от балластных веществ. Данный метод получения исключает возможность переноса вирусов и протоонкогенов.
Цитомедины обладают способностью индуцировать процессы специфической дифференцировки в популяции клеток, являющихся исходным материалом для их получения. Используя иммунофлюоресценцию, установили, что регуляторные полипептиды расположены на поверхности клетки и отсутствуют в ядерной, митохондриальной и лизосомальной фракциях. Вероятно, они входят в состав клеточных мембран и появляются в межклеточных пространствах в результате их физиологической деструкции. Цитомедины влияют на клеточный и гуморальный иммунитет, состояние системы гомеостаза, ПОЛ и другие защитные реакции организма не зависимо от того из каких органов и тканей они были получены. Это действие выражено в разной степени и зависит от применяемой дозы. Следует отметить, что при хроматографическом разделении различных цитомединов на фракции последние оказывают разнонаправленное действие на течение физиологических процессов. Более выраженную активность проявляют низкомолекулярные фракции. Учитывая разнонаправленный характер действия, при использовании цитомединов в клинической практике применяют смешанные фракции.
Механизм действия цитомединов в настоящее время не до конца ясен. По всей видимости, их эффекты осуществляются через специфические рецепторы, расположенные на поверхности клетки. После экзогенного введения полипептидов происходит выброс эндогенных регуляторных пептидов, для которых введенный пептид является индуктором. Эффект пептидного каскада приводит к пролонгации эффекта цитомединов, который сохраняется даже после полного разрушения первоначального индуктора.
Цитомедины, получаемые из тканей головного мозга и сетчатки, обладают функцией нейропептидов и участвуют в регуляции деятельности нервной ткани.
Изучение возможности применения нейропептидов в офтальмологии началось в 1987 году. В настоящее время используют такие нейропептиды как ретиналамин и кортексин.
Кортексин – комплекс пептидов, выделенных из коры головного мозга крупного рогатого скота и свиней. Кортексин облает тропным действием в отношении коры головного мозга и регулирует процессы метаболизма нейромедиаторов и ПОЛ в коре головного мозга, зрительном нерве и нейронах сетчатки.
Ретиналамин представляет собой комплекс пептидов, выделенных из сетчатки крупного рогатого скота. Ретиналамин уменьшает деструктивные изменения в пигментном эпителии сетчатки при различных формах дегенерации, модулирует активность клеточных элементов сетчатки, улучшает эффективность функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов при развитии патологических процессов. Кроме того, ретиналамин стимулирует фибринолитическую активность крови и оказывает иммуномодулирующее действие (под его воздействием увеличивается экспрессия рецепторов на Т- и В-лимфоцитах, повышается фагоцитарная активность нейтрофилов).
Фармакокинетика:
Ретиналамин достаточно медленно накапливается в сетчатке – время достижения максимальной концентрации составляет около 2 часов. При этом он медленно покидает сетчатку – период полувыведения 2,3 часа. При оценке фармакокинетических параметров ретиналамина был выявлен эффект пептидного каскада – повторное нарастание эффекта в сроки превышающие время удержания препарата в тканях.
Данные о фармакокинетике кортексина отсутствуют.
Способ введения и дозы:
Ретиналамин вводят парабульбарно или внутримышечно 1 раз в день, курс лечения составляет 10 дней. Курсы лечения следует проводить 1 раз в 6 месяцев. Кортексин вводят внутримышечно 1 раз в день в течение 10 дней. Можно сочетать Парабульбарное введение ретиналамина и внутримышечное введение кортексина.
Противопоказания
- гиперчувствительность
- беременность.
При необходимости применения во время лактации следует прекратить грудное вскармливание.
Данных о безопасности применения в педиатрии нет.
Побочные эффекты
- Аллергические реакции
Умеренная болезненность при парабульбарном введении.
Препараты
- Кортексин (Cortexin) (ООО «Герофарм», Россия) - лиофилизированный порошок во флаконах по 10 мг.
- ^ Ретиналамин (Retinalamin) (ООО «Герофарм», Россия) - лиофилизированный порошок во флаконах. В каждом флаконе содержится 5 мг активного вещества и 17 мг глицина.
Для коррекции гемодинамических нарушений применяют спазмолитики и ангиопротекторы.
Спазмолитики
Применяют несколько групп спазмолитиков – производные пуринов, индольные и пуриновые алколоиды.
Сосудорасширяющий эффект производных пуринов связан с повышением концентрации цАМФ в сосудистой стенке. Кроме того, эти препараты ингибируют агрегацию тромбоцитов. К этой группе препаратов относятся теофиллин и ксантинола никотинат. Теофиллин применяют внутрь по 250 мг 3 раза в день в течение 2 недель. Ксантинола никотинат применяют внутрь по 150 мг 3 раза в день после еды в течение не менее 2 месяцев или в/м 15% раствор по 2 мл 1 раз в день в течение 10 дней.
Индольные алколоиды оказывают антиоксидантное, антигипоксантное и антиагрегантное действие. Их сосудорасширяюший эффект не сопровождается синдромом обкрадывания. Однако их следует с осторожностью применять у пациентов ИБС, аритмией, неустойчивым АД, пониженным сосудистым тонусом. Среди препаратов этой группы используют Винпоцетин (кавинтон), который вводят внуть по 5 мг 3 раза в день в течение 1 месяца, далее по 5 мг один раз в день длительно. Курс лечения можно начинать с внутривенного капельного введения 20 мг (растворяют в 500 мл физ. р-ра) в течение 10 дней.
Пуриновые алколоиды улучшают микроциркуляцию, снижают агрегацию тромбоцитов и вязкость крови, повышают эластичность эритроцитов. Их следует с осторожностью применять у пациентов ИБС, гипотонией, сахарным диабетом. Кроме того, следует снижать дозу у пациентов применяющих антигипертензивные и сахароснижающие лекарственные средства. К этой группе относится пентоксифиллин (трентал) и дипиридамол (курантил). Пентоксифиллин назначают внутрь во время или после еды по 400 мг 3 раза в день в течение 2 недель, далее 2 раза в день в течение 2 недель. Дипиридамол применяют внутрь по 75-600 мг/сут в несколько приемов за 1 час до еды. Дозу дипиридамола подбирают индивидуально.
Ангиопротекторы
Препараты этой группы улучшают микроциркуляцию, нормализуют проницаемость сосудистой стенки, уменьшают отечность тканей сосудистой стенки, регулируют метаболические процессы в сосудистой стенки, улучшают геологические свойства крови и уменьшают активность плазматических кининов.
Применяют такие препараты как добесилат кальция (доксиум) – внутрь по 0,25 г 3-4 раза в день 3-4 недель; пармидин (продектин) – по 0,25 г 3-4 раза в день в течение 2-4 недель; этамзилат (дицинон) - по 0,25 г 3 раза в день в течение 2-3 месяцев
Для коррекции метаболических нарушений применяют ноотропы и витамины.
^ Ноотропные препараты
Среди ноотропных препаратов наиболее часто применяют пирацетам (ноотропил).
Он улучшает метаболические процессы и микроциркуляцию в нервной ткани,кроме того он повышает утилизацию глюкозы.
Побочное действие
Со стороны пищеварительной системы: редко – диспепсия, боли в животе;
^ Со стороны ЦНС: редко – нервозность, раздражительность, расстройство сна, головокружение, головная боль, тремор, иногда – слабость, сонливость;
Прочие – повышение сексуальной активности.
Противопоказания
Геморрагический инсульт, тяжелая почечная недостаточность, повышенная чувствительность к препарату.
С осторожностью следует применять у пациентов с выраженным нарушением гомеостаза.
Способ применения и дозы
Применяют внутрь по 30-160 мг/кг/сут в течение 6-8 недель.
Особый интерес представляет комбинированный препарат который помимо пирацетама содержит блокатор кальциевых каналов циннаризин – препарат Фезам. Его применяют внутрь по 1-2 капс. 3 р/сут в течение 1-3 месяцев
Другими наиболее часто используемым препаратами являются производные гамма-аминомаслянной кислоты. Используют пикамелон, который является никотиновым эфиром гамма-аминомаслянной кислоты, поэтому он имеет свойства как ГАМК, таки никотиновой кислоты. Пикамелону свойственно ноотропное (улучшение метаболизма и функции головного мозга) и непродолжительное сосудорасширяющее действие.
Противопоказания
- гиперчувствительность
- острые и хронические заболевания почек
Побочные эффекты
- Аллергические реакции – сыпь, зуд кожных покровов.
- Со стороны ЦНС – раздражительность. Возбуждение, ощущение тревоги, головокружение, головная боль.
- Со стороны ЖКТ – тошнота.
Способ применения и дозы
Препарат применяют внутрь по 1 таблетке (10 мг) 3 раза в день.
Используется также другой аналог ГАМК - деанола ацеглумат (нооклерин).
Побочное действие
Аллергические реакции. У пациентов пожилого возраста – депрессия.
Противопоказания
Повышенная чувствительность к компонентам препарата, инфекционные заболевания ЦНС, лихорадка, заболевания крови, психотические состояния, тяжелые нарушения функции печени и почек, I триместр беременности, лактация.
Способ применения и дозы
Препарат применяют внутрь по 1-2 ч.л. 20% раствора 2-3 р/сут в течение 1,5-2,5 месяцев. Курс лечения проводят 2-3 раза в год.
Для лечения поражений зрительного нерва различной этиологии, в том числе и глаукомной оптиконейропатии применяют синтетический аналог фрагмента кортикотропина (АКТГ) – препарат Семакс.
Препарат улучшает энергетические процессы и увеличивает адаптационные возможности, повышая устойчивость к повреждению и гипоксии, нервной ткани, в том числе голоного мозга.
Фармакокинетика: при закапывании в нос препарат хорошо всасывается в сосуды слизистой. Около 60-70% введенной дозы попадает в системный кровоток.
Противопоказания
- гиперчувствительность
- острые психические расстройства, сопровождающиеся тревогой,
- беременность,
- лактация,
- эндокринные заболевания.
Данных о безопасности применения в педиатрии нет.
Побочные эффекты: не выявлены
Способ применения и дозы
Семакс применяется интраназально. В одной капле содержится 50 мкг активного вещества. Разовая доза составляет 200-2000 мкг (из расчета 3-30 мкг/кг). Обычно вводится 2-3 капли препарата в каждую ноздрю. Курс лечения составляет 5-14 дней.
Кроме того, препарат можно вводить в виде эндоназального электрофореза. При этом препарат вводится с анода 1 раз в день. Доза препарата составляет 400-600 мкг/сутки.
Глава 8. Организационно-методические основы диспансеризации и мониторинга больных глаукомой.
^ ОРГАНИЗАЦИЯ РАННЕЙ ДИАГНОСТИКИ ГЛАУКОМЫ.
ОРГАНИЗАЦИОННО-МЕТОДИЧЕСКИЕ ОСНОВЫ ДИСПАНСЕРИЗАЦИИ И МОНИТОРИНГА БОЛЬНЫХ С ГЛАУКОМОЙ.
1.Организация ранней диагностики глаукомы.
- Контингент обследуемого населения, кратность обследования
Обследованию на глаукому подлежат:
1.1.1. Все лица в возрасте 40 лет и старше;
1.1.2. Все лица старше 35 лет, имеющие факторы риска:
- миопия и гиперметропия любых степеней;
- лица с общей патологий- сахарный диабет, гипертоническая болезнь, различные виды нарушения общего кровообращения- мерцательная аритмия, экстрасистолия,системная гипотензия, обменные и другие нарушения, аутоиммунные заболевания;
- Лица, имеющие родственников , страдающих глаукомой;
- Лица, ранее перенесшие операции на глазном яблоке.
Обследование перечисленных выше лиц, входящих в группу 1.1.1., проводится 1 раз в три года, а лиц, входящих в группу риска – 1 раз в год.
- Штатный состав для обследования на глаукому
- Доврачебный этап: медицинские сестры-тонометристки – измеряют ВГД по Маклакову. Программа подготовки медсестер прилагается (Приложение №1);
- Врач общей практики проверяет остроту зрения, ВГД, (возможен осмотр глазного дна при наличии надлежащих навыков)
(Приказ МЗ РФ № 237 от 1992г. и № 350 от 2002г.);
- Врачи офтальмологических оптических салонов, частных глазных кабинетов осуществляют измерение ВГД, офтальмоскопию;
- Врач-офтальмолог районной, городской поликлиники проводит все необходимые офтальмологические обследования;
- Врачи специализированных глаукомных кабинетов и
- Врачи глаукомных центров и глазных стационаров проводят консультативный прием пациентов, отбор для глаукомного центра (консультативная помощь, стационарное консервативное и оперативное лечение)
^ 1.3. Виды ранней диагностики глаукомы
1.3.1. Активная
- проводимая в рамках Национального проекта «Здоровье нации» всех работающих лиц в возрасте до 55 лет;
- при проведении проф. осмотров при приемах на работу, согласно имеющимся приказам;
- при проведении диспансеризации участников и инвалидов ВОВ;
- при проведении диспансеризации лиц с различными общими заболеваниями, когда осмотры врача офтальмолога являются обязательными;
- при проведении осмотров лиц, работающих во «вредных» условиях;
- при приемах в оптических салонах и частных кабинетах;
- при бригадных выездах с участием врачей офтальмологов для осмотров населения в рамках различных программ;
- в кабинетах доврачебного осмотра средним мед.персоналом
1.3.2. По обращаемости
- при обращении к врачу офтальмологу или врачу общего приема по поводу различных глазных заболеваний, или появлении каких-либо жалоб со стороны глаз.
- Документооборот системы ранней диагностики глаукомы
- все сведения о проведенных исследованиях при всех видах активного выявления (п.1.3) вносятся в соответствующий маркированный журнал
При выявлении хотя бы одного из признаков глаукомного поражения – повышение ВГД, характерные изменения глазного дна, сужение поля зрения при периметрии – пациент направляется в глазной кабинет поликлиники по месту жительства или в приписанный по страховому полису кабинет.
Врач офтальмолог в глазном кабинете, после соответствующего более углубленного обследования заполняет амбулаторную карту и «Контрольную карту диспансерного наблюдения» (форма 30). Последняя хранится в кабинете у офтальмолога.
Все сведения о больных глаукомой окулисты поликлиник передают либо в глаукомные кабинеты города, района, либо в межрайонные глаукомные центры.
- Нормативы профилактических осмотров на глаукому (сроки, частота обследования)
Один раз в три года всех лиц, отмеченных в п 1.1 и один раз в год для всех лиц группы риска (1.1.2 – 1.1.4.)
В годовой план профилактических осмотров на глаукому следует включить не менее 1/3 лиц, отмеченных в п.1.1.
^ 2. Организационно-методические основы диспансеризации и мониторинга больных с глаукомой.
2.1.Определение понятия диспансеризация.
Под диспансерным методом понимается активное динамическое наблюдение за состоянием здоровья определенных контингентов населения (здоровых и больных), взятие этих групп населения на учет с целью раннего выявления заболеваний, динамического наблюдения, комплексного лечения заболеваний, проведение мероприятий по оздоровлению их условий труда и быта, предупреждению развития и распространения заболеваний, восстановлению трудоспособности и продлению периода активной жизнедеятельности (ЛисицынЮ.П., 1992, 1999; ЮрьевВ.К., КуценкоГ.И., 2000; и др.).
Диспансеризация, представляющая синтез лучшего метода профилактики и лечения, была заложена в основу направлений государственной системы организации медицинской помощи населению СССР в 1927 г. Н.А.Семашко.
2.2. Существующие нормативные документы по диспансеризации и профилактике слепоты от глаукомы. Предложения для законодательных изменений по диспансеризации больных с глаукомой
Законодательная база диспансеризации пациентов с глаукомой заложена в следующих приказах:
- Приказ МЗ СССР №925 от 22.09.1976г. «Об усилении мероприятий по раннему выявлению и активному наблюдению больных глаукомой»
- Приказ МЗ СССР №1000 от 23.09.1981г. «О мерах по усовершенствованию работы по раннему выявлению глаукомы»
- Приложение №9 к приказу МЗ СССР от 30.05.1986г. №770 «Инструкция по диспансеризации больных, практически здоровых лиц с факторами риска в амбулаторно-поликлинических условиях» (раздел офтальмология)
- Методические рекомендации по совершенствованию всеобщей диспансеризации населения (НИИ Соц. гигиены и организации здравоохранения им. Семашко, ВОЛИУХ 1 Ленинградский институт).
Приведенная выше нормативная база была создана в 70-80 годах прошлого века, при другой экономической системе, и в настоящее время морально устарела. В большинстве регионов существуют местные приказы по службе и стандарты ведения больных, согласованные со страховыми компаниями.
Медико-социальные потери, которые несет российское общество вследствие заболеваемости и инвалидности, определяют экономическую целесообразность мер по развитию и совершенствованию системы профилактики слепоты от глаукомы (Добромыслов А.Н., Алексеев В.Н., Куглеев М.А., 1986).
В связи с ростом слепоты и инвалидности вследствие первичной глаукомы, ростом заболеваемости глаукомой в регионах Российской федерации возникает необходимость восстановить систему диспансеризации этих пациентов на основе новой законодательной базы.
Основным нормативным актом, регламентирующим диспансерную работу по глаукоме, был приказ МЗ СССР № 925 от 22.09.76г., в котором были определены объемы работы с пациентами и утверждено активное выявление заболевания путем массовых профосмотров населения старше 40 лет. С изменением социально-экономических условий, введением страховой медицины, этот приказ устарел, а нового не последовало. Поэтому в настоящее время назрела необходимость восстановить порядок обязательных профилактических осмотров на глаукому, закрепить существование диспансерных дней в поликлиниках, определить объемы диспансерной работы врача-офтальмолога. В России в настоящее время рекомендованный объем обследования для больных глаукомой содержится в приказе МЗ СССР № 770 от 30.05.86 года, но он носит рекомендательный характер
В регионах РФ сохраняется правило введения в расписание поликлинического офтальмолога «диспансерного дня » для пациентов с глаукомой. Однако реальная нагрузка текущего приёма врача-офтальмолога с установленной нормой времени на пациента – 8-12 минут не позволяет врачу выполнить медико-технологический стандарт в процессе диспансеризации.
Для того, чтобы обосновать затраты рабочего времени на работу с диспансеризируемым, мы рекомендуем применять разработанную в Областном офтальмологическом диспансере г.Тюмень в 1995-97 гг. методологию хронометража и созданные технологические карты на каждую медицинскую услугу (Приложение №1). Таким образом определяется время, необходимое врачу в среднем на работу с больным глаукомой, оно составляет от 20 до 30 минут на одно посещение.
Хронометраж и разработанные технологические карты являются доказательной базой, положенной в обоснование необходимости законодательного оформления нормы рабочего времени на одного пациента в процессе диспансерного посещения врача офтальмолога (Коновалова Н.А.).
Приложение №1
^ ТЕХНОЛОГИЧЕСКАЯ КАРТА
ДИСПАНСЕРНОГО ОСМОТРА БОЛЬНОГО С ГЛАУКОМОЙ
1. ВИЗОМЕТРИЯ
Медсестpа 9 pазpяда – 2 мин
2. ПPОСТАЯ ОПТИЧЕСКАЯ КОPPЕКЦИЯ
Медсестpа 7 pазpяда – 2 мин
Вpач 11 pазpяда - 3 мин
3. БИОМИКPОСКОПИЯ
Вpач 11 pазpяда - 2 мин
^ 4. ПЕPИМЕТPИЯ ПPОСТАЯ
Медсестpа 7 pазpяда – 8 мин
Вpач 11 pазpяда - 2 мин
5. ТОНОМЕТPИЯ
Медсестpа 7 pазpяда – 8 мин
Вpач 11 pазpяда - 2 мин
^ 6. ПPЯМАЯ ОФТАЛЬМОСКОПИЯ*
Вpач 11 pазpяда - 2 мин
7. ОБPАТНАЯ ОФТАЛЬМОСКОПИЯ
Вpач 11 pазpяда - 3 мин
8. ГОНИОСКОПИЯ*
Вpач 11 pазpяда - 6 мин
^ 9. ЗАПИСЬ В АМБУЛАТОРНОЙ КАРТЕ
Вpач 11 pазpяда - 5 мин
10. БЕСЕДА С ПАЦИЕНТОМ
Вpач 11 pазpяда - 5 мин
* - медицинские услуги не входят в минимальный ежеквартальный осмотр.
^ 2.3. Подходы к обследованию контингента больных глаукомой, этапы диспансеризации, их цели и задачи.
Любая группа пациентов с хроническим заболеванием неоднородна. В ней можно выделить несколько подгрупп с разными стадиями заболевания и фазами патологического процесса (обострение, ремиссия). В течение жизни каждый пациент проходит различные фазы и стадии заболевания, то есть несколько раз переходит из одной подгруппы в другую. Естественно, что больные с нестабилизированным процессом требуют значительно большего внимания со стороны врача, более частого и активного наблюдения, большего объема реабилитационных мероприятий.
Эта проблема поднимается многими авторами (Драгомирецкий Г.А., Кравченко О.А., 1973; Сидоренко С.А. с соавт., 1984; Добромыслов А.Н. с соавт., 1986). Для её решения предлагалось, в частности, выделить внутри группы наблюдения подгруппу дестабилизации с более высокой частотой посещений, интенсифицировать работу офтальмологов районных поликлиник, чтобы с помощью дополнительного обследования своевременно выявить дестабилизацию.
В настоящее время такой подход выглядит механистическим, так как на практике получается, что офтальмолог городской поликлиники и ЦРБ, не имея в распоряжении приборов для исследования центрального поля зрения (и многих других современных диагностических возможностей), не в состоянии решить вопрос о стабилизации глаукоматозного процесса, и частые посещения не оправданы ни с клинической, ни с экономической точек зрения. Для решения тактических задач диспансеризации пациент должен быть направлен в учреждение более высокого уровня, то есть на следующий этап диспансеризации.
Таким координирующим центром активной диспансеризации может быть любое ЛПУ офтальмологического профиля: лечебно-диагностический центр, диспансер, глаукомный кабинет в составе крупной многопрофильной поликлиники, и т.д., определенное для этой цели офтальмологической Службой региона. Это учреждение вместе с офтальмологическими стационарами формирует следующий этап диспансеризации.
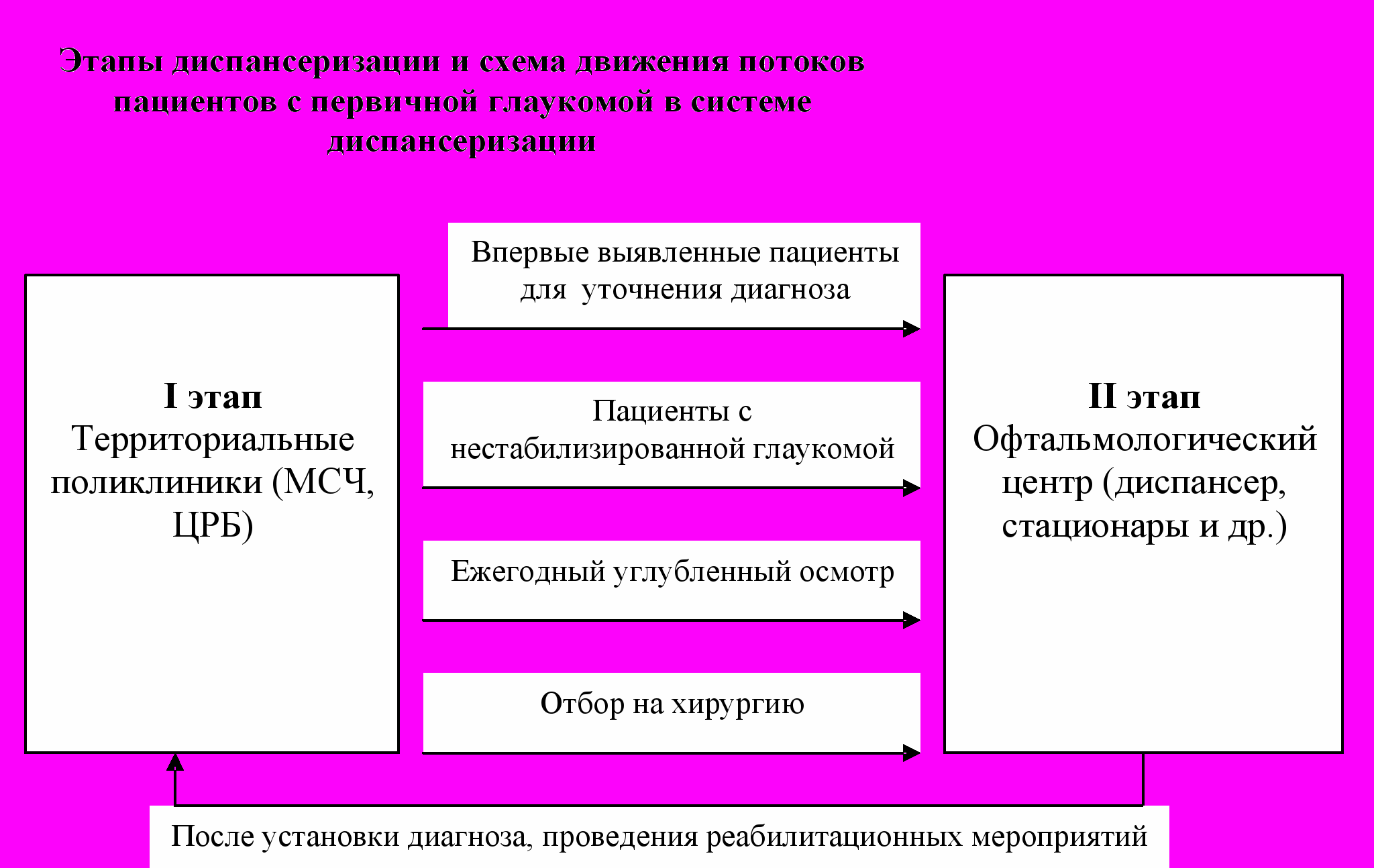
Таким образом, диспансеризация пациентов с глаукомой должна осуществляться в два этапа:
-на 1 этапе: в офтальмологических кабинетах территориальных поликлиник, ЦРБ, МСЧ и т.д.,
-на 2 этапе: в координирующем центре регионального или федерального уровня, являющимся не только лечебным, но и организационно-методическим центром Службы (в зависимости от региональных условий).
Движение потоков пациентов в системе диспансерного наблюдения представлено на Рисунке 1.
Рисунок №1
Цели этапов диспансерного наблюдения.
I этап:
- активное выявление больных с глаукомой и групп с факторами риска
- контроль за течением глаукоматозного процесса
II этап:
- ранняя диагностика глаукомы у больных, направленных с подозрением на глаукому
- проведение лечебных мероприятий для стабилизации процесса
Задачи I этапа:
- Активное выявление глаукомы
– организация и контроль за качеством профосмотров (в рамках Национального проекта «Здравоохранение»);
- работа с родственниками больных глаукомой, сбор генеалогического анамнеза;
- направление больных с подозрением на глаукому на второй этап диспансеризации для углубленного обследования.
- Мониторинг больных глаукомой.
- Ежеквартальный плановый осмотр всех больных глаукомой, закрепленных за данной территорией;
- Направление в координирующий центр впервые выявленных пациентов с глаукомой, больных с декомпенсацией ВГД и дестабилизацией глаукомного процесса, а так же всех больных один раз в год в плановом порядке (на углубленный осмотр);
- Проведение плановых курсов антидистрофического и нейропротекторного лечения всем больным не реже 2 раз в год.
^ Задачи II этапа:
- Углубленное обследование пациентов с применением новейших диагностических методик для раннего и доклинического выявления глаукомы;
- Динамическое наблюдение лиц с подозрением на глаукому;
- Реабилитация пациентов:
- с нестабильным течением процесса (проведение подбора режима гипотоников, хирургического и лазерного лечения, экстренной помощи при острых приступах);
- проведение плановых курсов консервативного лечения и плановой хирургии катаракты
После проведения указанных действий пациенты возвращаются на первый этап диспансеризации.
^ 2.4. Мониторинг диспансерного наблюдения больных с глаукомой. Медико-технологические стандарты обследования на этапах диспансеризации.
Мониторинг (от лат. monitor – надзиратель) – это наблюдение, оценка и прогноз глаукоматозного процесса. Мониторинг является частью диспансерных мероприятий и представляет собой комплекс диагностических методов, необходимых для уточнения степени глаукоматозного поражения органа зрения и скорости течения патологического процесса.
В современных условиях, в связи с усилением экономической и юридической ответственности врачей за исход лечения, возникает необходимость контроля качества диспансеризации, реализуемая через применение медико-технологических стандартов диагностики и лечения.
^ На первом этапе диспансеризации, исходя из имеющегося на сегодняшний день уровня оснащения большинства поликлиник и требований нормативных документов (Приказ МЗ СССР № 770 от 30.05.86) необходимым объемом обследования на глаукому в условиях поликлиники или ЦРБ является следующий:
- Визометрия – 4 раза в год;
- Офтальмоскопия - 4 раза в год;
- Периметрия – 2 раза в год кинетическая и 1 раз статическая;
- Тонометрия – 4 раза в год;
- Биомикроскопия – 4 раза в год;
- Гониоскопия – 1 раза в 2 года;
- Консультации специалистов (в случае наличия у пациента заболеваний, влияющих на клиническую картину);
- Сбор генеалогического анамнеза.
Возможности мониторинга на 2 этапе диспансеризации зависят от материально-технической базы координирующего центра и особенностей региона. Примерный медико-технологический стандарт обследования представлен в Таблице№1.
