Теоретической основой программы является химия неметаллов и их важнейших соединений. Ведущими идеями предлагаемого материала программы являются
| Вид материала | Документы |
- Аннотация программы дисциплины «Химия и физика высокомолекулярных соединений и изделий, 17.6kb.
- Цель программы «Мастер делового администрирования», 3479.39kb.
- Аннотация примерной программы дисциплины «Математический анализ» Рекомендуется для, 311.3kb.
- Рабочей программы учебной дисциплины квантовая химия уровень основной образовательной, 38.95kb.
- Рабочей программы учебной дисциплины органическая химия уровень основной образовательной, 97.78kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Васильева Нэлла Алексеевна пояснительная записка программа, 64.53kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Пояснительная записка Нормативно-правовой основой Программы «Толерантность» моу лицея, 134.04kb.
Преподавание прикладного курса «Химия элементов. Неметаллы» для учащихся 10 класса общеобразовательных школ естественно-математического направления.
Рыжова А.В., учитель химии СШ№16
Основная часть учебного материала программы – это формирование современного химического мировоззрения и оказание помощи учащимся 10 класса общеобразовательных школ естественно-математического направления, гимназий, лицеев при подготовке к научным соревнованиям, успешному поступлению в ВУЗы.
Теоретической основой программы является химия неметаллов и их важнейших соединений.
Ведущими идеями предлагаемого материала программы являются:
─ материальное единство веществ природы, их генетическая связь;
─ причинно-следственные связи между составом, строением, свойствами и применением веществ;
─ познаваемость закономерностей протекания химических реакций;
─объясняющая и прогнозирующая роль теоретических знаний для фактологического материала химии элементов;
─ представление о химическом соединении как о звене в непрерывной цепи превращений веществ, об участии веществ в круговороте химических элементов и в химической эволюции;
─ объективность и познаваемость – основы разработки принципов управления химическими превращениями веществ, экологически безопасных способов их производства и мероприятий по охране окружающей среды от загрязнения;
─ взаимосвязанность науки и практики: практика – движущая сила развития науки, а успехи практики – результат развития науки.
Важнейшей особенностью является стремление сохранить высокий теоретический уровень. Это достигается путем вычленения укрупненной дидактической единицы, в роли которой выступает основополагающее понятие «химический элемент и формы его существования».
Мы стремимся показать, что современные знания ничуть не сложнее, чем традиционные. Трудности заключаются не в восприятии такого материала школьниками, а в традициях, сложившихся в сознании учителя. И считаем, что, только углубляя теоретические знания, можно сокращать объем заучиваемого материала. Если мы объясняем какое-либо явление, нет нужды в его заучивании, на что часто расходуется основное учебное время.
Основными целями являются:
─ формирование знаний и умений, которые бы способствовали отработке навыков применения теоретического материала на практике.
─ углубление и расширение рамок программного материала.
─ пособие составлено таким образом, что предполагает подготовку учащихся к поступлению в ВУЗы, в которых требуется сдача экзамена по химии, без дополнительной подготовки.
─ содержание учебно-методического комплекса способствует применению знаний по химии в жизни.
─ развитие логики, активизация мыслительной деятельности.
Основными задачами являются:
─обеспечение высокого научного уровня знаний путем их углубления и обобщения; освещение вопросов, которые недостаточно полно представлены в курсе школьной химии.
─ формирование практических навыков активного использования полученных теоретических знаний в решении различного типа задач, делать выводы, моделировать; навыков к самообразованию и самокоррекции.
─ формирование целостного представления о научной картине мира путем интеграции знаний смежных дисциплин, развития внутрипредметных и межпредметных связей с физикой, математикой, биологией.
Планируемые результаты
Учащиеся должны
─ иметь современное представление о химических закономерностях, теориях, явлениях, процессах.
─ владеть химическим языком, мышлением, навыками практической работы.
─ знать алгоритмические подходы к решению расчетных и качественных задач.
─ уметь применять знания в нестандартных ситуациях.
Анализ проведенных учебных занятий показал эффективность использования разработанного учебно-методического комплекса (УМК) в преподавании прикладного
курса «Химия элементов. Неметаллы». Содержание учебного материала, методы обучения, формы организации познавательной деятельности направлены на реализацию профильного обучения и повышение качества подготовки учащихся к ЕНТ.
Методические разработки учебных занятий прикладного курса
«Химия элементов. Неметаллы»
А.В.Рыжова, учитель химии СШ№16
Тема: «Халькогены»
Урок – лекция.
Цель: дать общую характеристику халькогенам, акцентировать внимание на окислительно-восстановительных свойствах соединений на примере соединений серы. Систематизировать знания учащихся о протекании химических реакций между серой и простыми, сложными веществами; о сероводороде и кислородсодержащих соединениях серы; свойствах разбавленной и концентрированной серной кислоты; разложением сульфатов. Дополнить сведения о биологической роли халькогенов.
Развивать умение осуществлять такие мыслительные операции как анализ, сравнение и обобщение, специальные умения: проводить, анализировать химические реакции; развивать специальную и химическую речь.
Воспитание культуры учебного труда, адекватной самооценки, умение грамотно выражать свою мысль.
Оборудование:
- Телевизор.
- Видеомагнитофон.
- Кодоскоп.
- Кодопленки по теме «Халькогены».
- Реактивы: а) Н2SО4;
б) ВаCI2;
в) Na2S
г) Pb(NO3)2
Ход урока.
1. Объяснение нового материала по плану (прилагается)
VI A Общая характеристика (на кодопленке)
O Элементы при обычных условиях образуют простые вещества:
S О2↑,
Se S – твердое кристаллическое вещество, желтого цвета;
Te Se, Te, Po – твердые вещества с металлическим блеском
Po
1/ С увеличением заряда ядра атома уменьшаются неметаллические и усиливаются металлические свойства (О – неметалл, Ро – металл)
2/ На внешнем энергетическом уровне находится 6е, а это означает, что атомы элементов в невозбужденном состоянии имеют 2 неспаренных электрона (е) на р-подуровне, и поэтому характерная валентность этих элементов = двум.
Н2О, H2S, H2Se, H2Pо.
3/ Для кислорода валентность = двум является постоянной. Это объясняется тем, что у кислорода нет d-подуровня, а поэтому невозможно возбуждение атома в пределах второго энергетического уровня. У других элементов спаренные электроны s- и p – орбиталей легко возбуждаются и могут переходить на d-орбитали. При этом увеличивается число неспаренных электронов, а значит и валентность элементов до IV и VI.
4/ Халькогены – окислители. Для завершения внешнего энергетического уровня им не хватает 2е. Они их присоединяют, и в соединениях с металлами и водородом имеют степень окисления ─2.
Э0 + 2е→Э-2
5/ Сверху вниз окислительная способность уменьшается.
О0→S0→Se0→Те0.
6/ Халькогенид-ионы могут только отдавать е и поэтому являются восстановителями.
Э-2 – 2е→Э0.
Восстановительная способность халькогенид-ионов в указанном направлении увеличивается:
О-2→S-2→Se-2→Те-2.
7/ Элементы – халькогены образуют соединения с водородом одного типа – Н2Э. При растворении их в воде образуются кислоты.
Н2S→ Н2Se→ Н2Те.

Усиление кислотных свойств(увеличивается атомный радиус неметалла).
8/ Для халькогенов известны оксиды с общими формулами: ЭО2 и ЭО3.
Кислотным оксидам такого типа соответствуют кислоты Н2ЭО3 и Н2ЭО4.
Кислоты
Н
 2S Н2SО3 Н2SО4.
2S Н2SО3 Н2SО4.Сероводородная сернистая серная
Н2Sе Н2SеО3 Н2SеО4.
Селеноводородная селенистая селеновая
Н2Те Н2ТеО3 Н2ТеО4.
теллуроводородная теллуристая теллуровая
С
 ила кислот
ила кислотувеличивается т.к.
атомный радиус атома- Чем выше степень окисления образующего атома,
неметалла увеличивается. тем кислота сильнее.
(неМе(ОН)nОm; n – число атомов водорода
в кислоте. Чем больше m, тем кислота сильнее.
 У кислородсодержащих кислот их сила возрастает снизу вверх, т.к.
У кислородсодержащих кислот их сила возрастает снизу вверх, т.к. а) меньше расстояние между атомами;
б) больше силы отталкивания между центральным атомом и водородом.
Сера
Массовая доля серы в земной коре составляет 0,048% (15 место среди всех элементов).
Аллотропия cеры (фрагмент видеофильма)
превращается


| Р  омбическая S8 омбическая S8 | Моноклинная превращается | Пластическая |
| Молекулярная кристаллическая решетка. Кристаллическое вещество желтого цвета tпл =1130C | Темно-желтые игольчатые, tпл =1190C | Коричневая резинообразная масса |
Нахождение в природе (фрагмент видеофильма)
1/ В свободном состоянии.
2/ железный, серный колчедан, пирит –FeS2
3/ медный блеск –Cu2S
4/ свинцовый блеск – PbS
5/ серебряный блеск – Ag2S
6/ гипс –CaSO4 ∙ 2H2O
7/ горькая (английская) соль – MgSO4 ∙ 7H2O
8/ мирабилит, или глауберова соль – Na2SO4 ∙ 10H2O
Применение: при производстве резины, бумаги, спичек, пороха, серной кислоты, мазей от кожных болезней.
Способы получения
В лаборатории
1/ При сливании растворов сероводородной и сернистой кислот: 2H2S + H2SO3 →3S +3H2O
2/ При неполном сгорании сероводорода: 2H2S + O2 →2S +2H2O
Химические свойства
Так как сера имеет промежуточную степень окисления, то она проявляет свойства и окислителя, и восстановителя.
| S - окислитель | S – восстановитель |
| С простыми веществами | |
| 1/ металлами 2Na + S 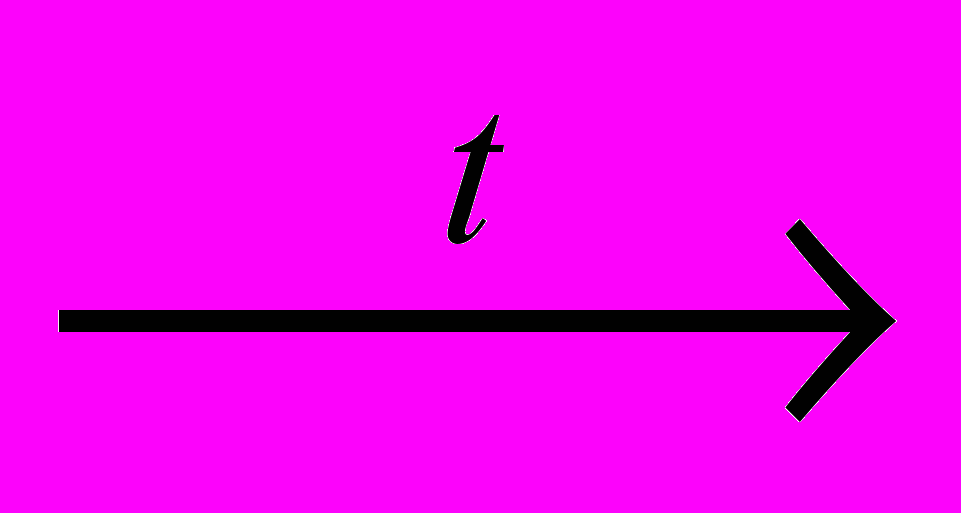 Na2S Na2S2/ углеродом C +2S 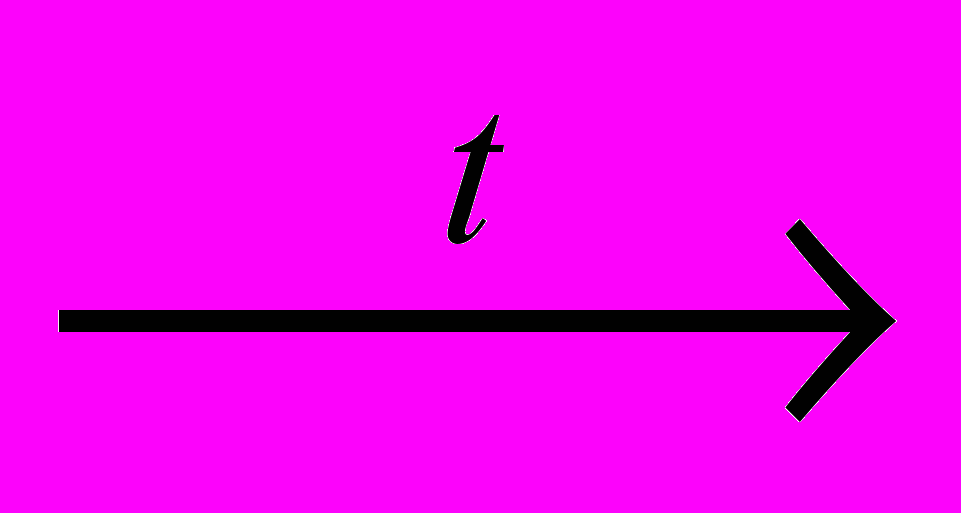 CS2 CS23/ фосфором 3S + 2P 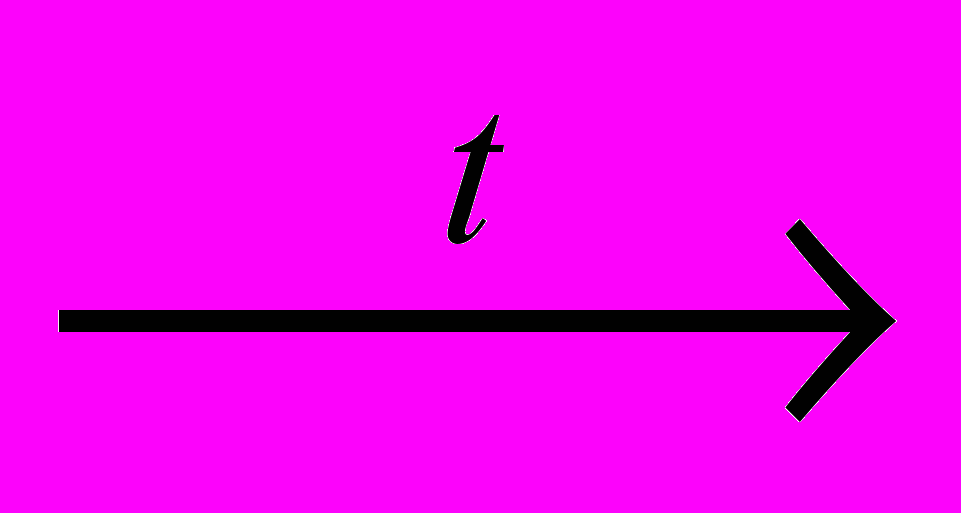 P2S3 P2S34/ водородом S + H2 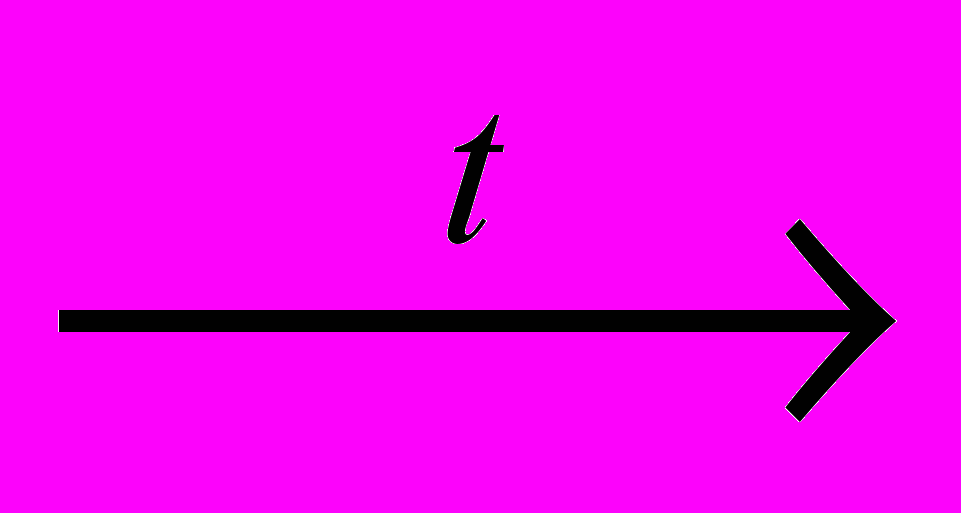 H2S↑ H2S↑ | 1/ кислородом S +O2 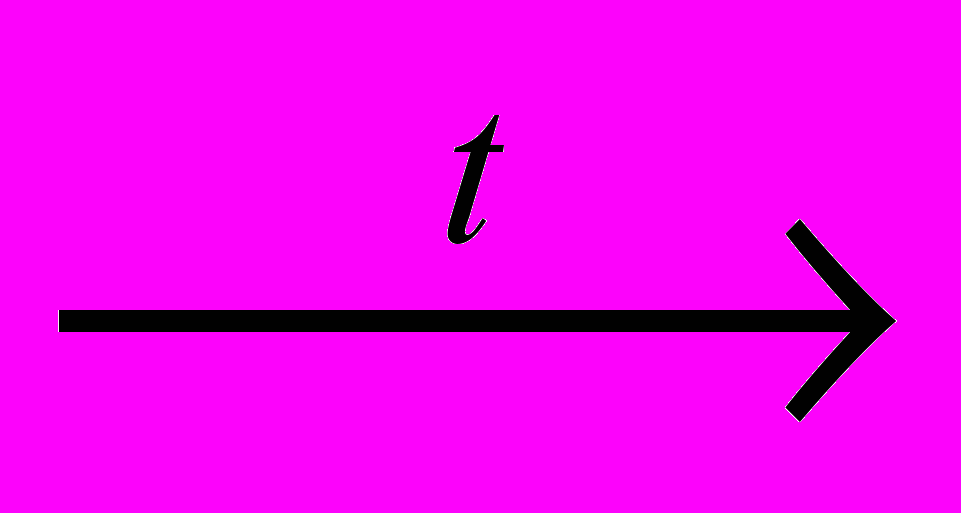 SO2 SO22/ хлором S+CI2 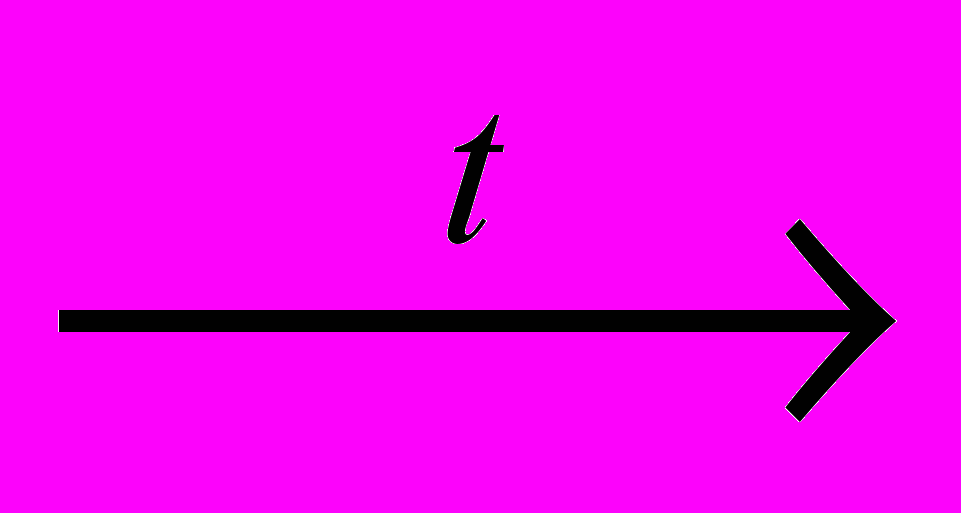 SCI2 SCI23/ фтором S+3F2→SF6 |
| Со сложными веществами | |
| | Как восстановитель взаимодействует с кислотами – окислителями (H2SO4, HNO3) при нагревании S + 2H2SO4(конц.) 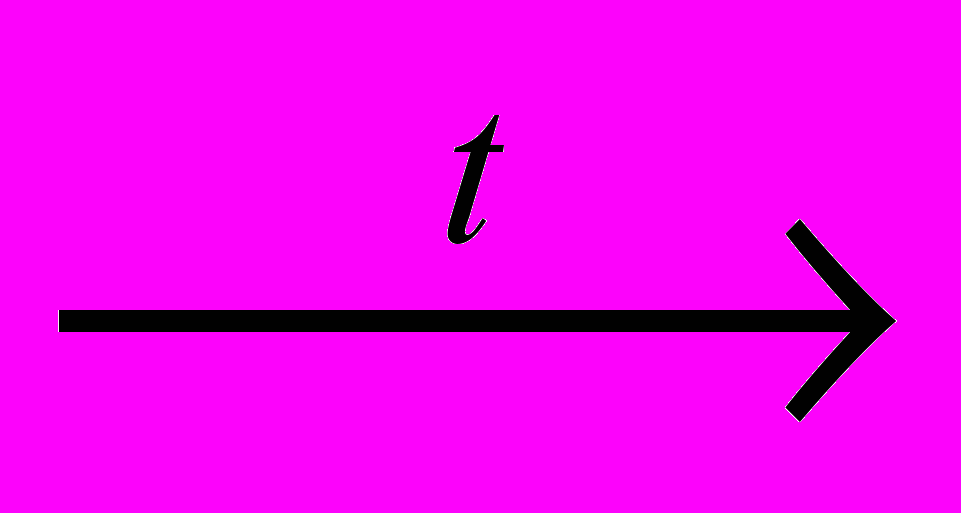 3SO2↑ + 2H2O 3SO2↑ + 2H2O S+6HNO3(конц.) 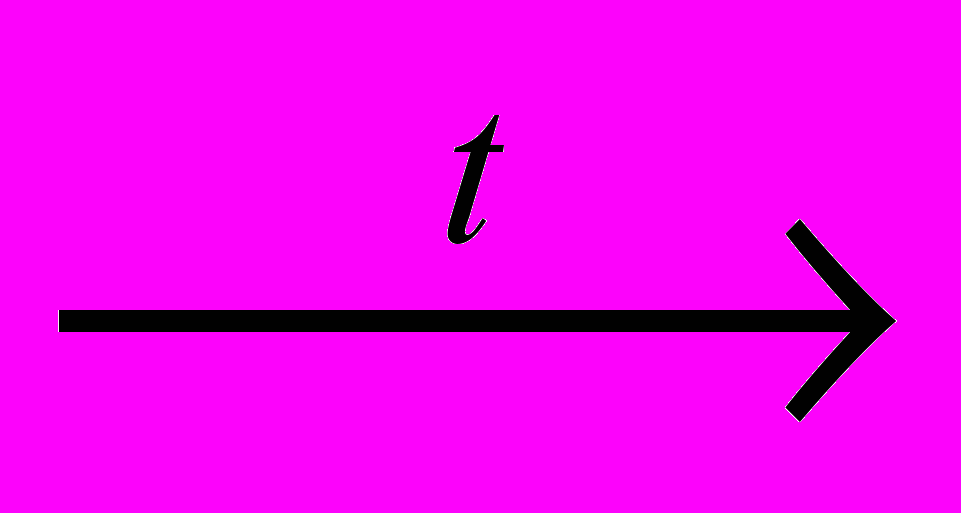 6NO2 +2H2O+ H2SO4 6NO2 +2H2O+ H2SO4S + 2HNO3(разб.)  2NO+ H2SO4 2NO+ H2SO4 |
Сероводород
H2S↑ - ядовит. При комнатной температуре в 1 объеме H2O растворяется 2,5 объема сероводорода. ПДК: 0,01 мг на 1 л воздуха, т.к. разрушает гемоглобин крови.
H2S (кислота) образует два ряда солей:
1) сульфиды;
2) гидросульфиды (образуются только щелочными и щелочноземельными металлами)
Применение: H2S↑ - составная часть минеральных вод.
Химические свойства (фрагмент видеофильма)
Так как S в H2S имеет низшую степень окисления, то в окислительно-восстановительных реакциях H2S проявляет только восстановительные свойства.
Являясь восстановителем, H2S↑ легко окисляется: а/ 2 H2S↑ + O2
 2H2O+ 2S (при недостатке O2) 2 H2S↑ + 3O2
2H2O+ 2S (при недостатке O2) 2 H2S↑ + 3O2 2H2O+ 2SO2 (в избытке O2) б/ с бромной водой, обесцвечивая её:
2H2O+ 2SO2 (в избытке O2) б/ с бромной водой, обесцвечивая её: H2S↑ + Br2→2HBr + S
в/ с раствором перманганата калия, обесцвечивая его: 5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4+2MnSO4 +8H2O г/ H2S (к-та) окисляется и более слабыми окислителями: H2S + 2FeCI3→2FeCI2 +2HCI + S 2H2S + H2SO3 →3S +3H2O
Качественной реакцией на кислоту H2S и ее растворимые соли (т.е. на S2-) является взаимодействие их с растворимыми солями свинца: S2-+Pb2+ →PbS↓ (черный)
Сернистый газ - SO2
SO2 – бесцветный газ, с резким запахом, ядовит. В 1 объеме H2O растворяется 40 объемов SO2.
Применение: отбеливание тканей, бумаги; получение H2SO4
Так как S в SO2 имеет промежуточную степень окисления, то в окислительно-восстановительных реакциях SO2 может быть как окислителем, так и восстановителем.
| SO2 - окислитель | SO2 – восстановитель |
| С более сильными восстановителями: SO2+2H2S→3S↓+ 2H2O SO2 +C 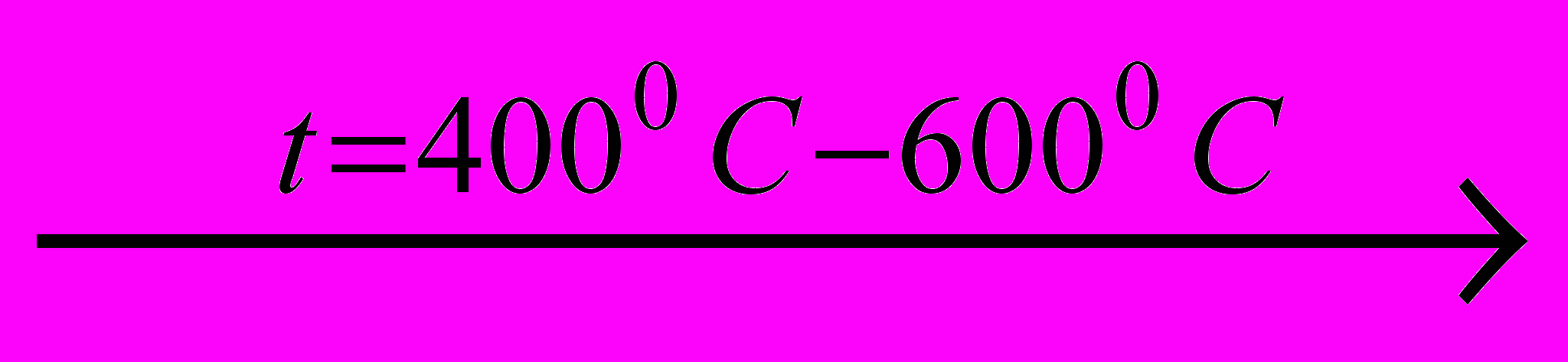 S↓+ CO2 S↓+ CO2SO2+2CO  S↓+ 2CO2 S↓+ 2CO2 | С более сильными окислителями: SO2 + 0,5O2  SO3 SO3SO2+2H2O+CI2→2HCI+H2SO4 SO2+CI2→ S+6O2CI2( хлористый сульфурил) SO2+2HNO3(конц.)→H2SO4 +2NO2 |
SO2 получают в промышленности путем обжига сульфидных руд: Cu2S +2O2
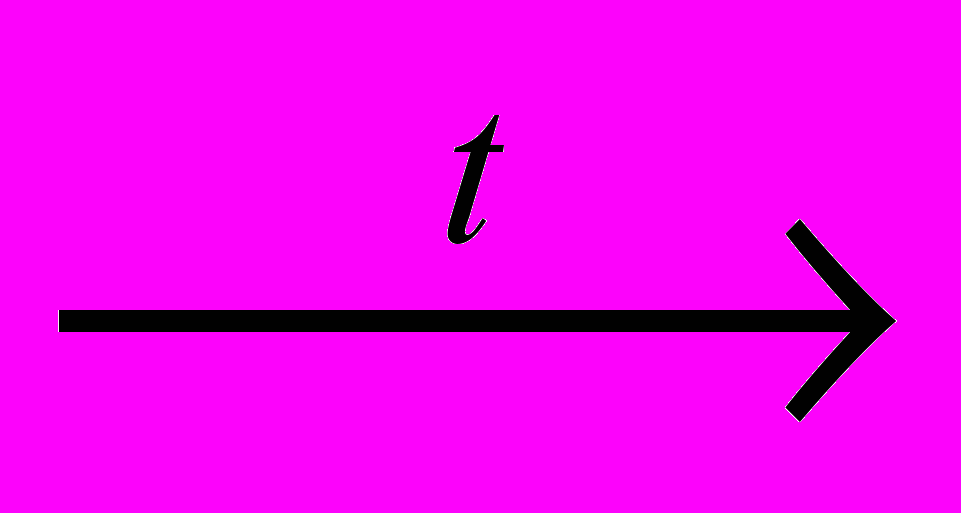 2CuO + SO2 2FeS2 + 5,5O2
2CuO + SO2 2FeS2 + 5,5O2 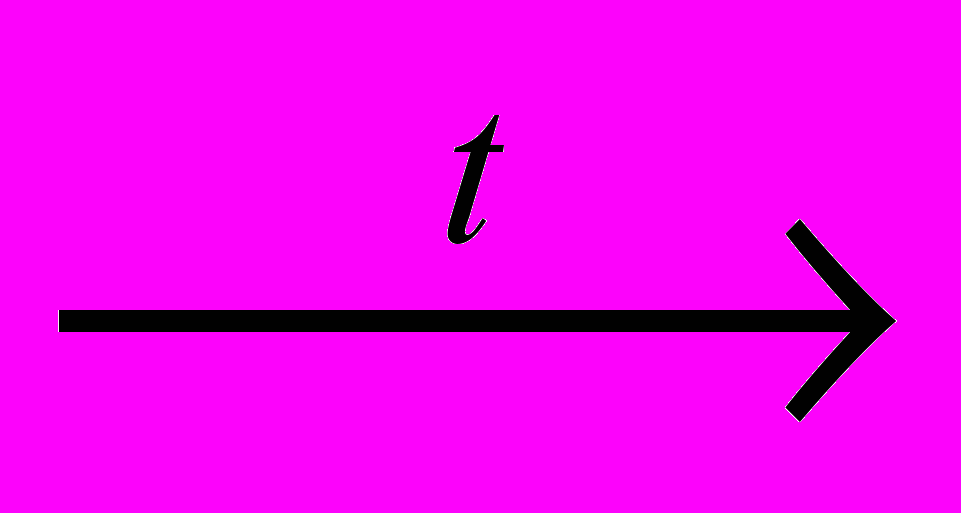 Fe2O3 + 4SO2
Fe2O3 + 4SO2SO3 – ангидрид H2SO4
При стандартных условиях – бесцветная жидкость, при понижении температуры затвердевает в бесцветные кристаллы, выше + 450С – закипает, ядовит.
Применение: практического значения не имеет.
SO3 – термически нестоек:
SO3
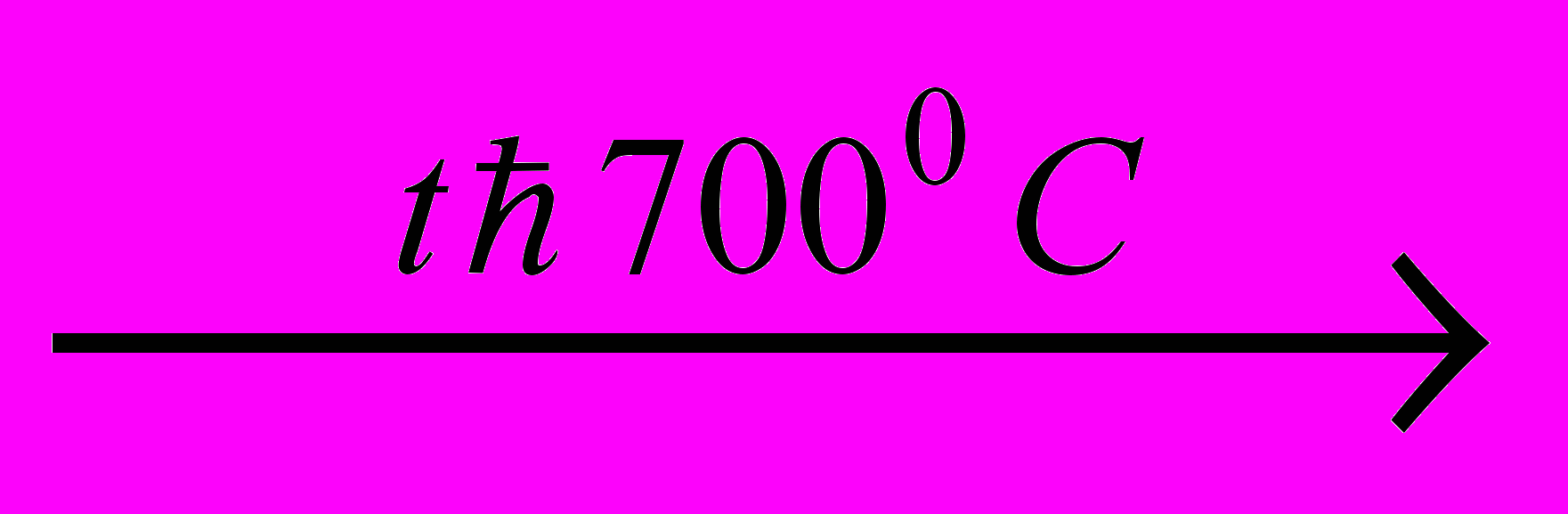 SO2 + 0,5O2
SO2 + 0,5O2SO3 – типичный кислотный оксид.
Так как S в SO3 находится в высшей степени окисления, SO3 обладает сильными окислительными свойствами. Так, фосфор при соприкосновении с ним воспламеняется:
5SO3 +2Р→ 5SO2 + Р2O5 Н2S↑ окисляется до SO2:
3SO3 + Н2S↑ → 4SO2+2H2O.
Окислительные свойства H2SO4
1/ H2SO4 (конц.) + Ме(не акт.) → S+4O2↑+ соль + H2O
2/ H2SO4 (конц.) + Ме(акт.) → S0+ соль + H2O
3/ H2SO4 (конц.) + Ме(акт.) → Н2S-2↑ + соль + H2O
4/ H2SO4 (конц.) + неМе → S+4O2↑ + ангидрид + H2O
5
 / H2SO4 (конц.) + неМе → S+4O2↑ + кислота + H2O
/ H2SO4 (конц.) + неМе → S+4O2↑ + кислота + H2O6/ H2SO4 (разб.) + Ме(не акт.) →
7/ H2SO4 (разб.)+ Ме(акт.) → соль + H2↑
Физические свойства: тяжелая маслянистая жидкость, без цвета и запаха, гигроскопична, хорошо растворяется в воде: при разбавлении кислоту приливают к воде!
Инструктаж по ТБ
Эксперимент (Качественная реакция на SO42-)
Применение (фрагмент видеофильма)
1/ Используют для получения красителей, минеральных удобрений, взрывчатых веществ, других кислот, металлов, искусственного шелка, глюкозы.
2/ Как электролит в аккумуляторах.
3/ Как водоотнимающее средство в органическом синтезе.
Получение (Кодопленка)
В промышленности – контактным способом:
1/ обжиг пирита
2FeS2 + 5,5O2
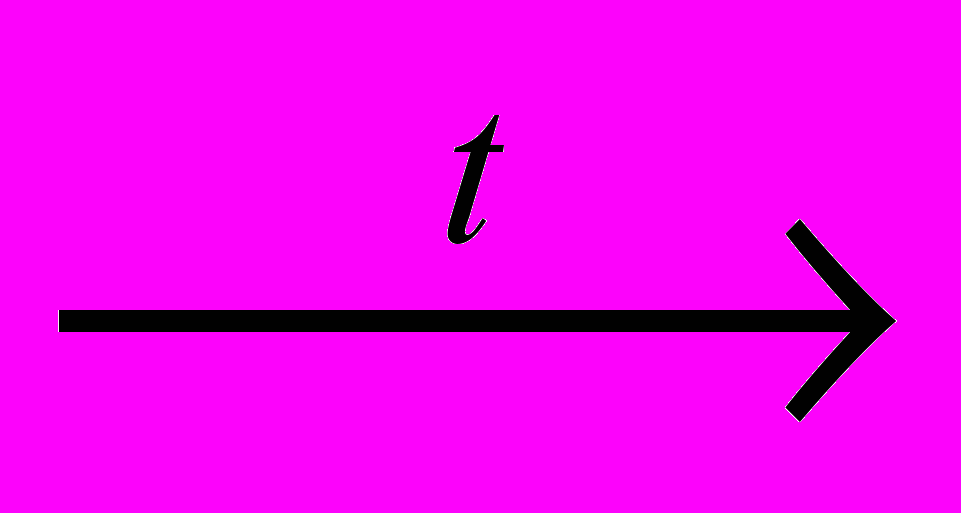 Fe2O3 + 4SO2 в печи для обжига в «кипящем слое»; 2/ очищенный газ – в контактный аппарат, где SO2 окисляется до SO3 на катализаторе SO2 + 0,5O2
Fe2O3 + 4SO2 в печи для обжига в «кипящем слое»; 2/ очищенный газ – в контактный аппарат, где SO2 окисляется до SO3 на катализаторе SO2 + 0,5O2 SO3
SO33/ поглощение SO3 конц. H2SO4 в поглотительной башне методом противотока nSO3 + H2SO4 (конц.)→ nSO3 ∙ H2SO4 (олеум)
Сульфаты (фрагмент видеофильма)
1/ Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами – CuSO4 ∙ 5H2O (медный купорос), FeSO4 ∙ 7H2O (железный купорос)
2/ Сульфаты щелочных металлов при нагревании не разлагаются.
3/ Сульфаты IIА группы:
MeSO4
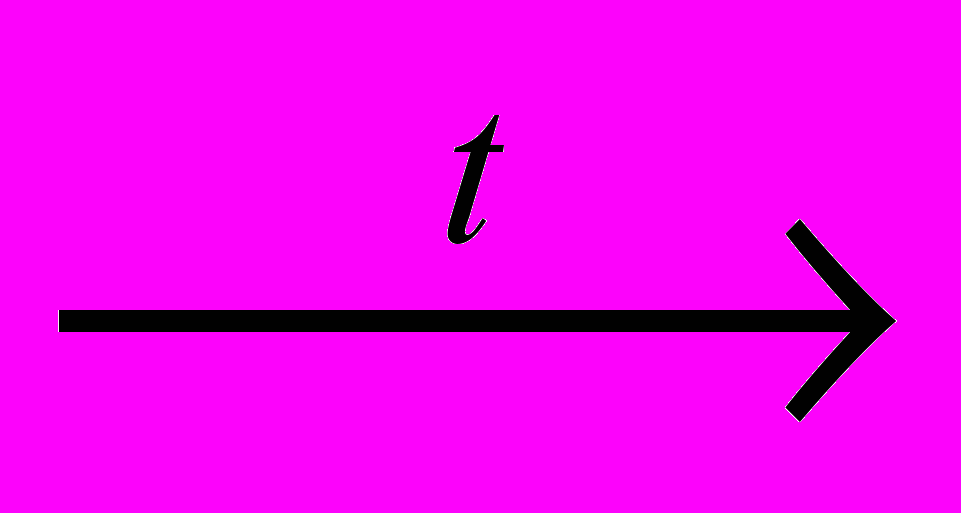 MeO+ SO2 +0,5 O2
MeO+ SO2 +0,5 O24/ FeSO4 и Fe2(SO4)3
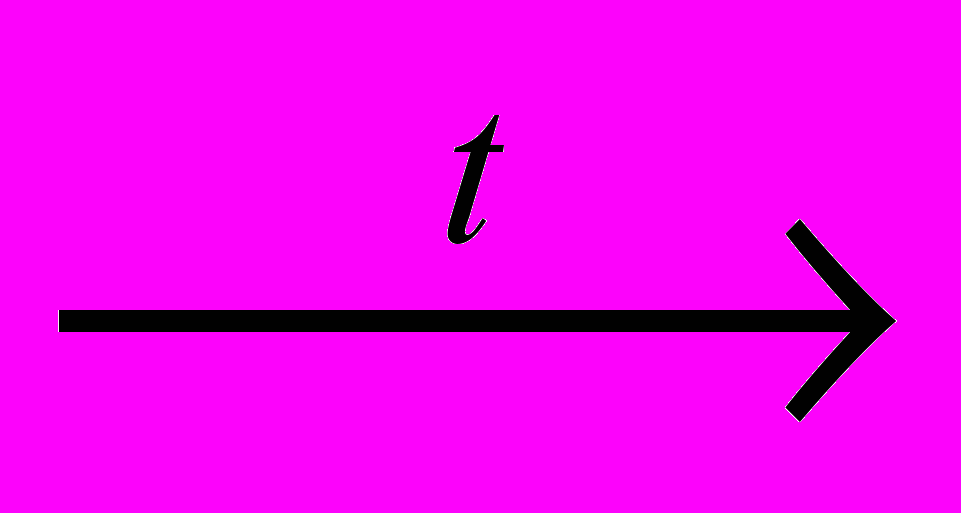 Fe2O3+ SO2 + O2
Fe2O3+ SO2 + O25/ Сульфаты тяжелых металлов:
Me2(SO4)n
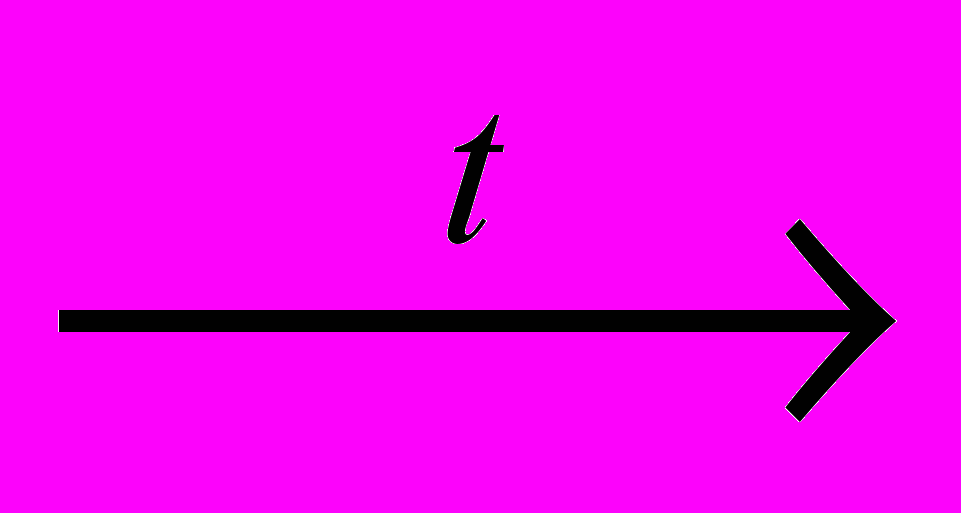 MeO+ SO2 + O2
MeO+ SO2 + O2Биологическая роль халькогенов (фрагмент видеофильма)
Сера играет важную роль в жизни растений, животных и человека. В животных организмах сера входит в состав почти всех белков, в серосодержащие аминокислоты – цистеин и метионин, а также в состав витамина В1 и гормона инсулина. При недостатке серы у овец замедляется рост шерсти, а у птиц отмечена плохая оперяемость.
Из растений больше всего потребляют серу капуста, салат, шпинат. Богаты серой также стручки гороха и фасоли, брюква, редис, репа, лук, хрен, тыква, огурцы; бедны серой арбуз и красная свекла.
Домашнее задание. Конспект.
Учебное занятие по решениею задач по теме: «Пниктогены»
Цель: обобщить и систематизировать знания учащихся о протекании химических реакций между азотом, фосфором и простыми, сложными веществами: водородных и кислородсодержащих соединений азота и фосфора; свойствах концентрированной и разбавленной азотной кислоты; разложении нитратов.
Развивать умение осуществлять такие мыслительные операции как анализ, сравнение и обобщение, специальные умения: проводить, анализировать химические реакции; развивать специальную и химическую речь.
Воспитание культуры учебного труда, адекватной самооценки, умение грамотно выражать свою мысль.
Тип урока: обобщение и систематизация.
Технология развивающего обучения с элементами проблемного изложения знаний.
Оборудование:
- Телевизор.
- Видеомагнитофон.
- Кодоскоп.
- Кодопленки по теме «Пниктогены»
Ход урока.
| 1/. Контроль домашнего задания. 2/. Повторение темы. а/. Цепочки превращений. б/. Решение задач. Домашнее задание, и инструктаж по домашнему заданию. | Тест по вариантам. Проконтролировать уровень подготовленности учащихся и подвести к реализации основной цели урока. Выявить уровень подготовленности учащихся к сформированности знаний свойств веществ. Совершенствование навыков решения задач. |
1/. Контроль домашнего задания.
Тест по теме: «Пниктогены»
1 вариант
- При взаимодействии азотной кислоты с металлами не образуется: A) оксид азота (II); B) оксид азота (IV); C) оксид азота (I); D) водород; E) нитрат аммония.
- Коэффициент перед формулой восстановителя в уравнении взаимодействия разбавленной азотной кислоты с фосфором, если получается Н3РО4 и NО, равен: A) 4; B) 3; C) 5; D) 2; E) 7.
- Соль состава Меx(РО4)y относится к : A) фосфоритам; B) гидрофосфатам; C) метафосфатам; D) ортофосфатам; E) фосфидам.
- Сумма коэффициентов в реакции взаимодействия серебра с концентрированной азотной кислотой равна: A) 3; B) 9; C) 6; D) 5; E) 7.
- Газ, выделившийся при нагревании 10,7 г хлорида аммония с избытком щёлочи, поглотился раствором, содержащим 19,6 г ортофосфорной кислоты. Масса и состав получившейся соли: A) 12 г фосфата аммония; B) 18 г гидрофосфата аммония; C) 23 г дигидрофосфата аммония; D) 26 г гидрофосфата аммония; E) 34 г дигидрофосфата аммония.
- «Царская водка» - это смесь: A) HNO3 + HCI (1 : 3 ); B) HCI + H2SO4 + HNO3 (1 : 1: 1 ) ; C) HNO3 + HCI ( 1: 1 ) ; D) HCI + H2SO4 (1 : 3); E) HNO3 + H2SO4 (1 : 2)
- По схеме реакции С + НNО3 (разб.) → СО2↑ + NО↑ + Н2О масса восстановителя, реагирующего с 8 моль окислителя, равна: A) 504 г; B) 720 ; C) 72 г; D) 50,4 г; E) 7,2 г.
- Если схема реакции Ag
 A
A 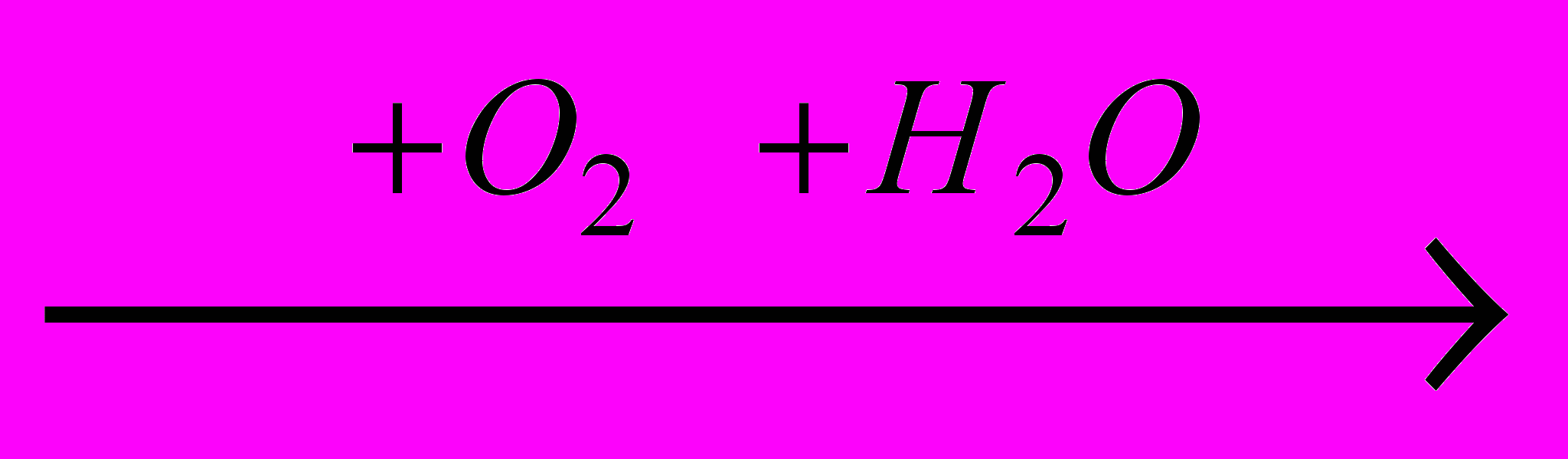 Б
Б 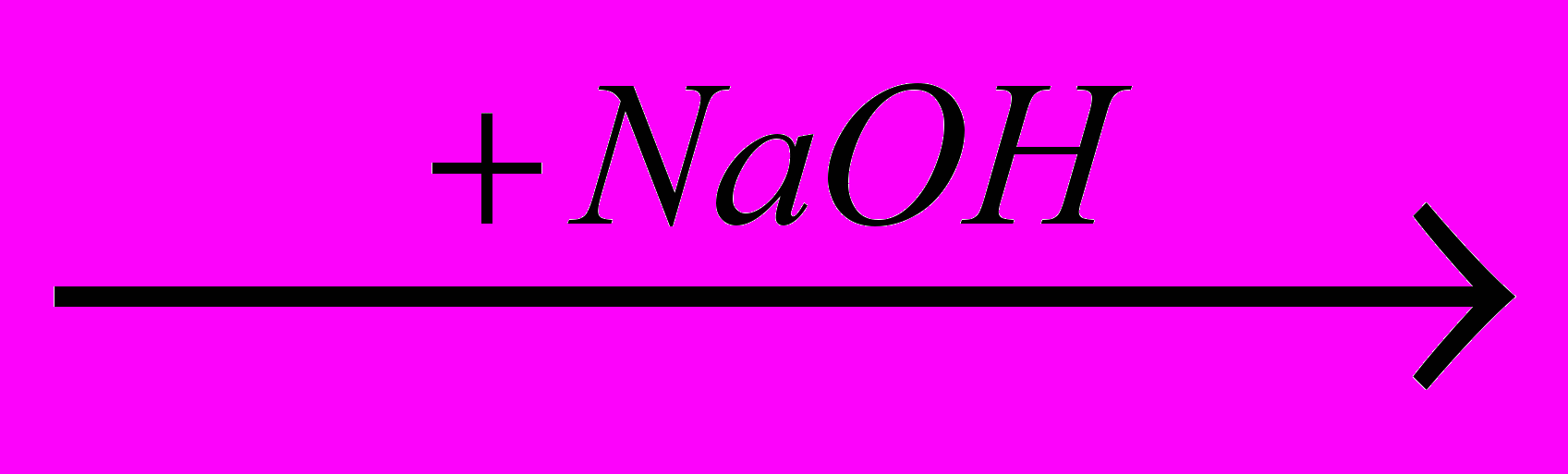 В
В 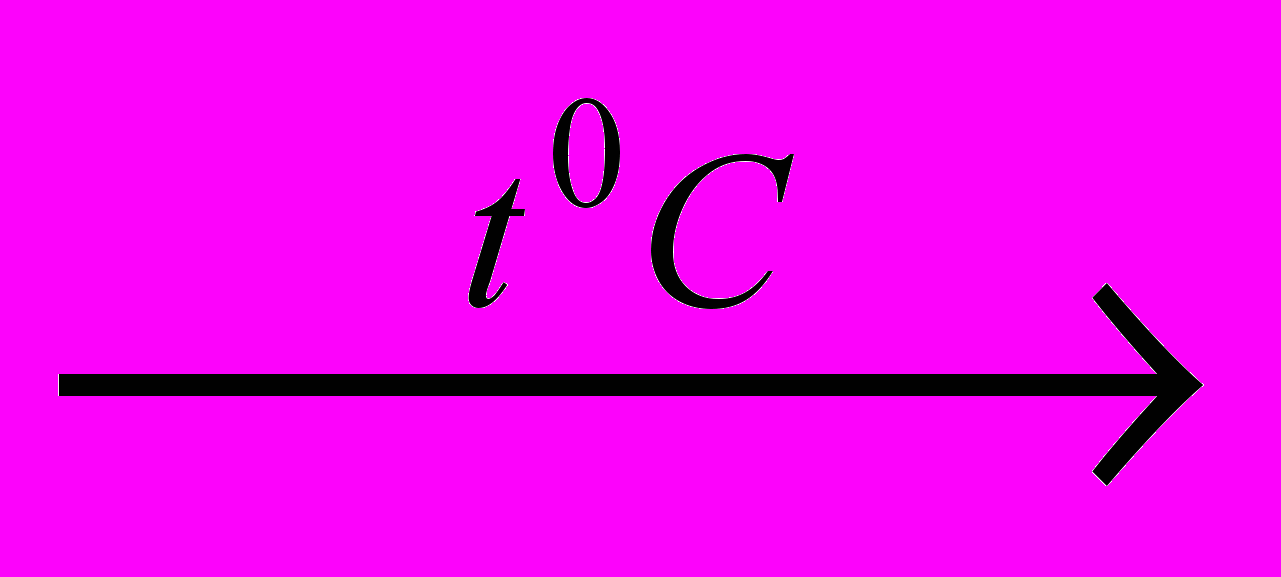 NaNO2, то сумма молекулярных масс веществ А и В равна: A) 144; B) 107; C) 109; D) 119; E) 131.
NaNO2, то сумма молекулярных масс веществ А и В равна: A) 144; B) 107; C) 109; D) 119; E) 131.
- Для получения фосфора в промышленности служит: A) НРО3; B) Р2О5; C) Nа3РО4; D) Н3РО4; E) Са3(РО4)2.
- В организме человека кальций концентрируется в костях преимущественно в виде солей: A) фосфорной кислоты; B) серной кислоты; C) соляной кислоты; D) азотной кислоты; E) угольной кислоты.
- У атома фосфора полностью завершённых уровней: A) 3; B) 2; C) 5; D) 4; E) 1.
- Масса фосфорного ангидрида, которую необходимо добавить к 500 г 64% раствора ортофосфорной кислоты для того, чтобы после нагревания получить 100% ортофосфорную кислоту, составляет: A) 677 г; B) 324 г; C) 473 г; D) 899 г; E) 345 г.
- Твёрдая кислота среди жидких – это: A) азотная; B) соляная; C) угольная; D) серная; E) метафосфорная.
- Сумма коэффициентов в уравнении реакции Ag + HNO3(разб.) = NO +… равна: A) 14; B) 12; C) 11; D) 13; E)16.
- В уравнении реакции меди и концентрированной азотной кислоты Cu + HNO3 → Cu(NO3)2 + X + Y вместо X и Y следует написать: A) NO и 2H2O; B) NO2 и H2O; C) 2NO2 и 2H2O; D) NO2 и H2O; E) 2NO и 2H2O.
2 вариант
- Укажите название удобрения, если при действии на него Н2SO4 (конц) и Cu выделяется бурый газ, а при действии щёлочи – ощущение запаха аммиака: A) натриевая селитра B) аммиачная селитра C) калиевая селитра D) карбамид E) аммофос
- Газ, выделившийся при нагревании 10,7 г хлорида аммония с гидроксидом натрия, поглощён азотной кислотой. Масса полученной соли равна A) 80 г B) 1,6 г C) 160 г D) 16 г E) 8 г.
- Определите формулу вещества Х, которое образуется в результате превращений: Р
 P2O5
P2O5 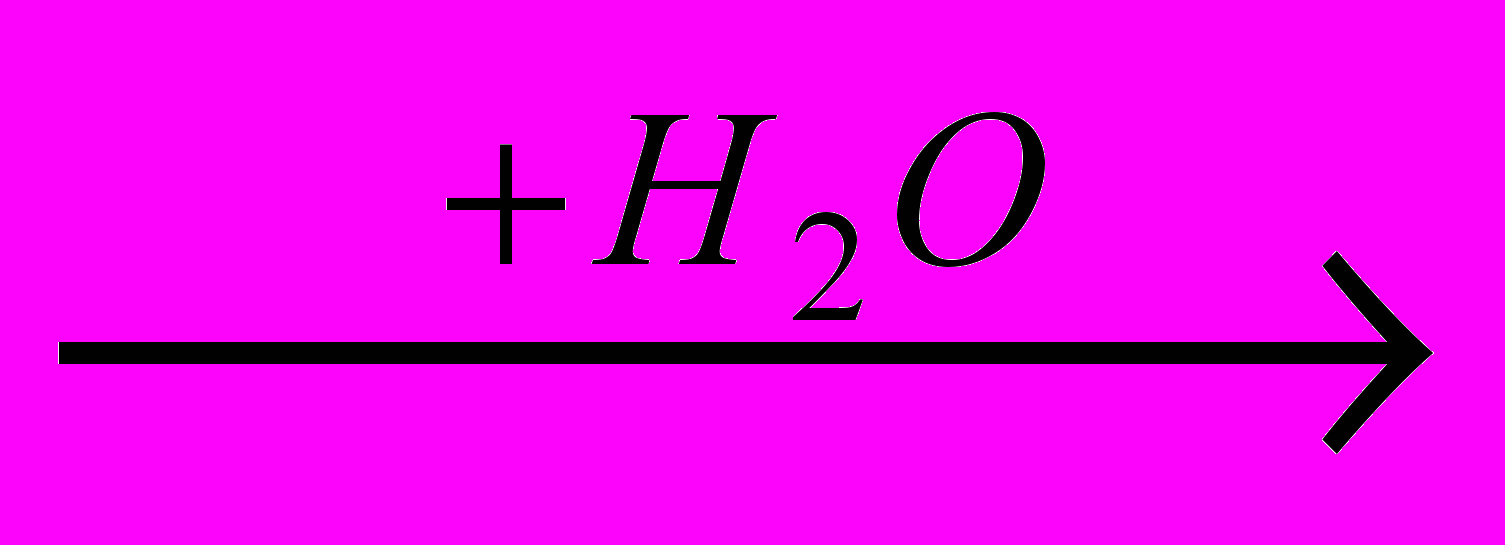 A Ca
A Ca CaO
CaO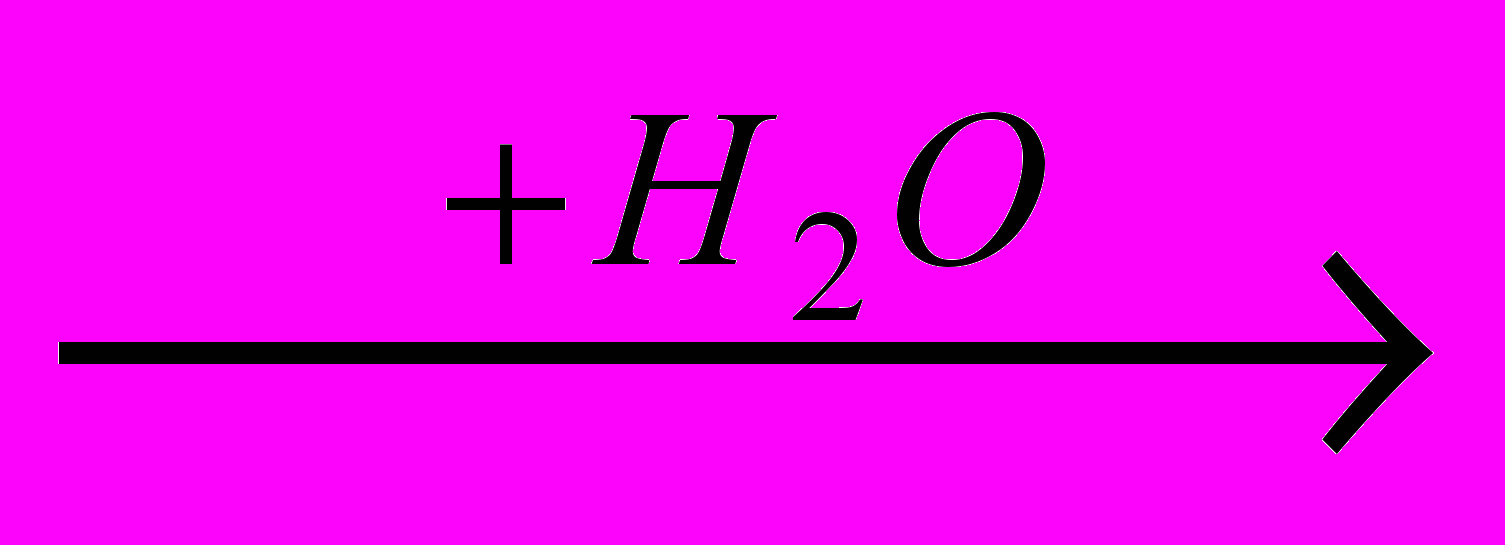 B A + B
B A + B 
 X + D A) Ca(HSO4)2 B) Ca3(PO4)2 C) H3PO4 D) CaSO4 E) Ca(OH)2
X + D A) Ca(HSO4)2 B) Ca3(PO4)2 C) H3PO4 D) CaSO4 E) Ca(OH)2
- Фосфор – окислитель в химической реакции: A) 2P+3CI2= 2PCI3 B) 6P + 5KCIO3 = 5KCI + 3P2O5 C) 2P + 3Ba = Ba3P2 D) 4P + 3O2 = 2P2O3 E) 4P + 5O2 = 2P2O5
- Максимальная масса гидрокарбоната аммония (в г.), полученного из аммиака количеством 3 моль, равна: A) 456 B) 124 C) 237 D) 345 E) 246
- Коэффициент перед формулой оксида азота (IV) в уравнении реакции меди с концентрированной азотной кислотой, равен: A) 4 B) 8 C) 3 D) 2 E) 6
- Наибольшее количество ортофосфат-ионов образуется в 1 л воды из 0,1 моль: A) ортофосфата кальция B) гидроортофосфата натрия C) дигидроортофосфата калия D) ортофосфорной кислоты E) ортофосфата натрия
- Веществами Б, Д, Е в схеме превращений NH3
 А + Б
А + Б 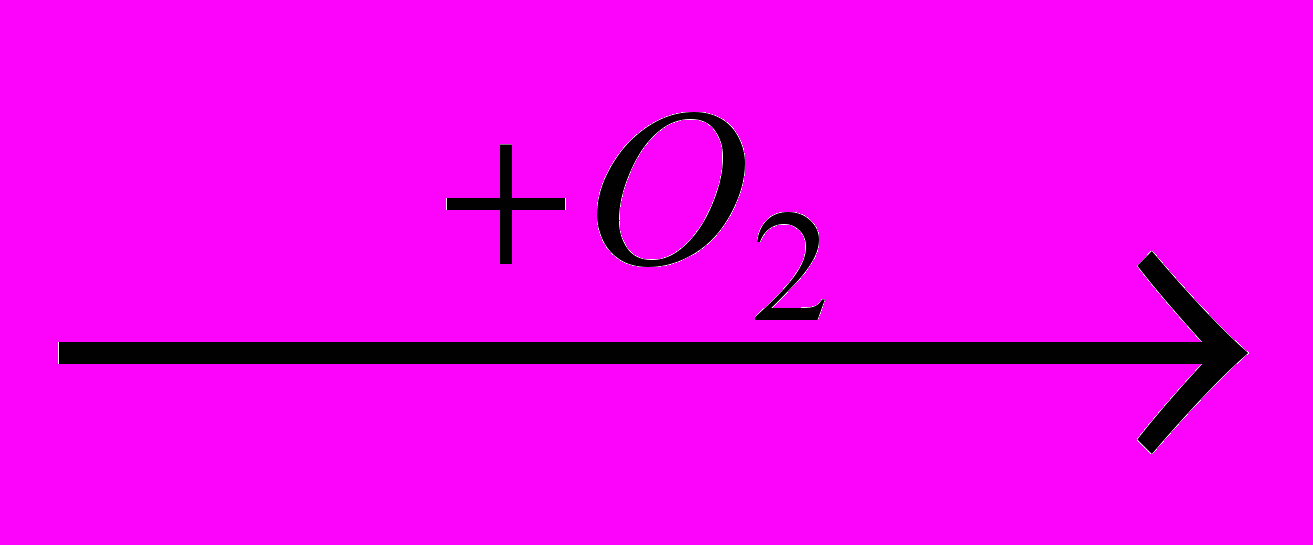 B
B 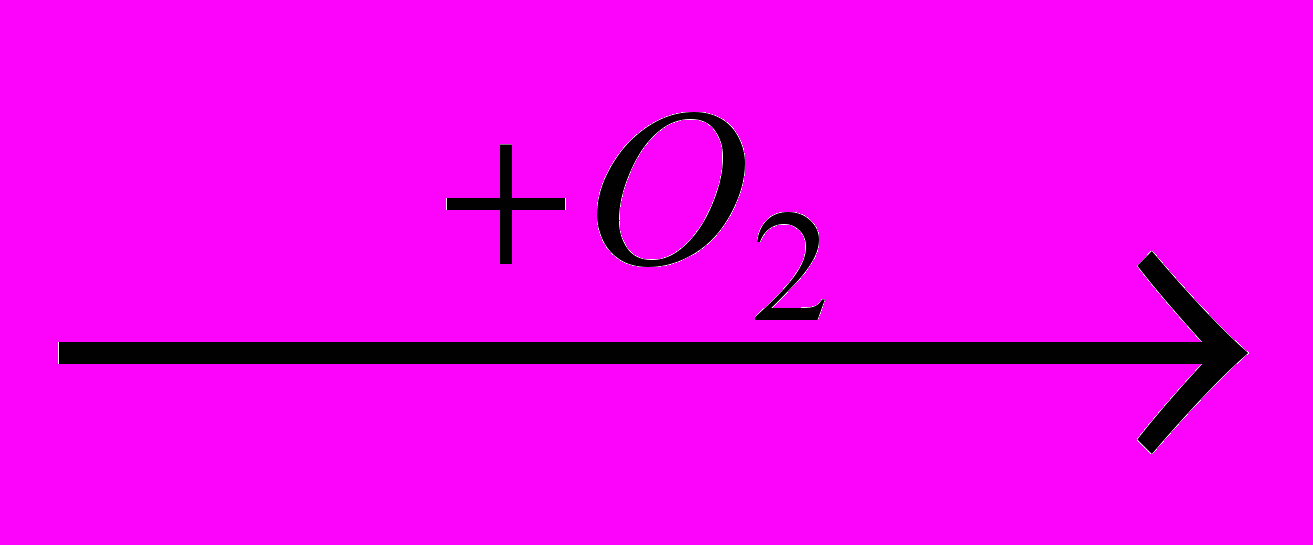 Г
Г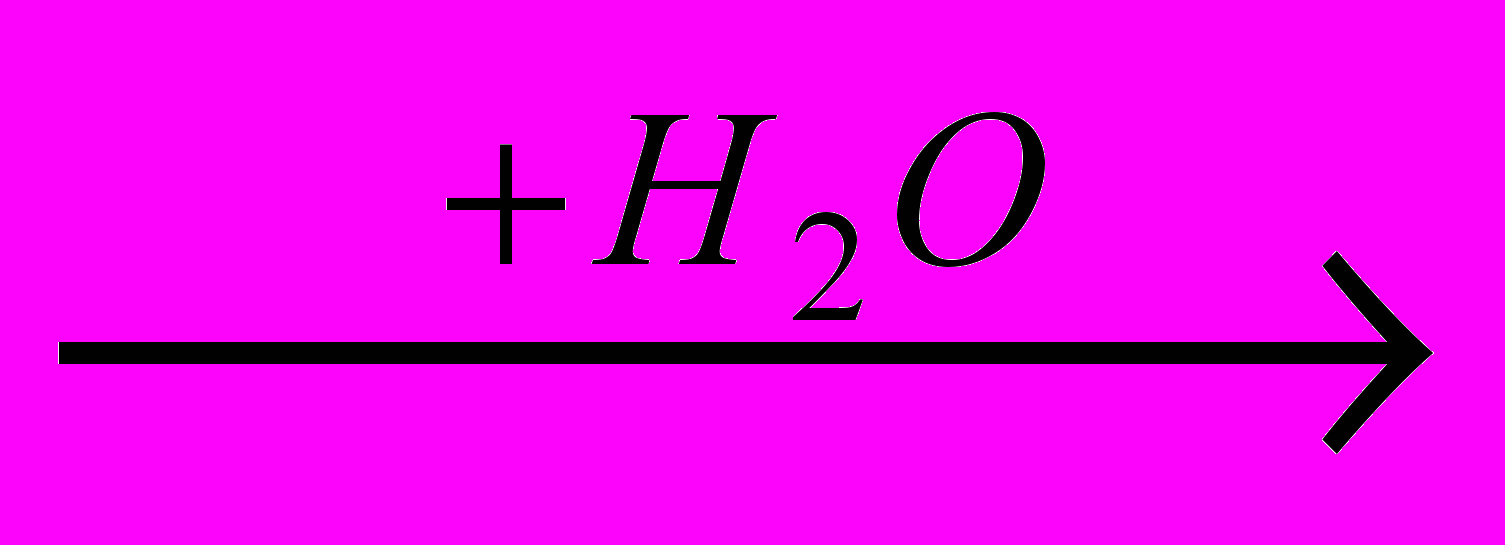 Д + В
Д + В 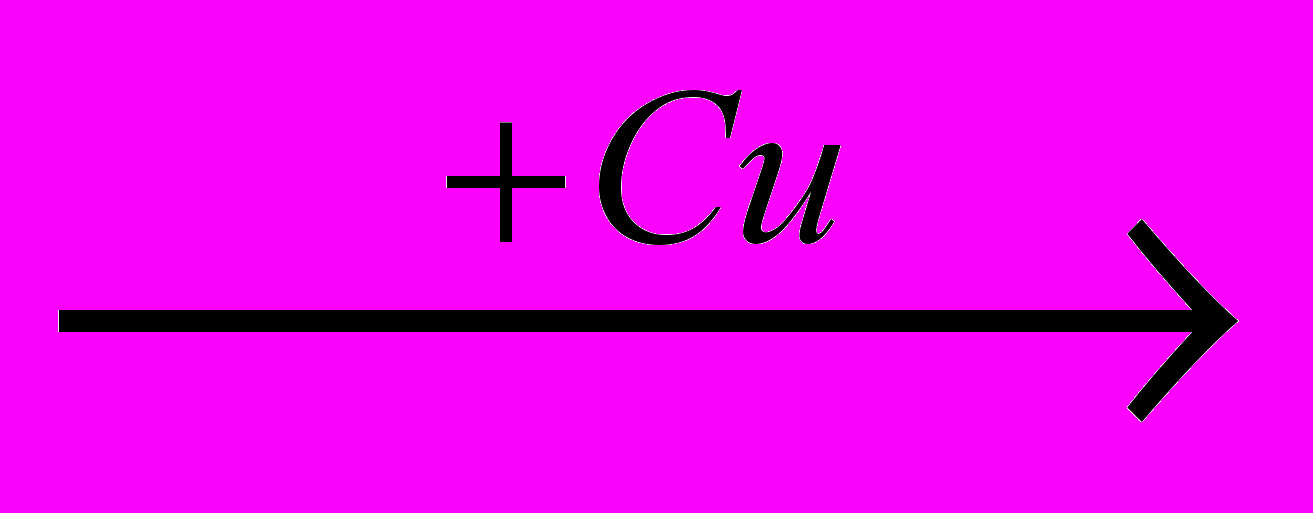 Е могут быть: A) азот, азотная кислота, нитрат меди (I) B) водород, азотная кислота, нитрат меди (I) C) азот, оксид азота (II), нитрат меди (II) D) водород, пероксид водорода, оксид меди (I) E) азот, азотная кислота, нитрат меди (II)
Е могут быть: A) азот, азотная кислота, нитрат меди (I) B) водород, азотная кислота, нитрат меди (I) C) азот, оксид азота (II), нитрат меди (II) D) водород, пероксид водорода, оксид меди (I) E) азот, азотная кислота, нитрат меди (II)
- В уравнении реакции меди и разбавленной азотной кислоты Cu + HNO3→Cu(NO3)2 + X + Y вместо X и Y следует написать: A) 2NO и 4H2O B) NO2 и H2O C) NO и 4H2O D) 2NO2 и 2H2O E) NO и H2O
- Нитрид магния получают в результате: A) MgO + NO2→ B) Mg + HNO3→ C) N2O + Mg(OH)2→ D) MgO + HNO3→ E) Mg + N2→
- При взаимодействии разбавленной азотной кислоты с магнием образуется: A) NH3 B) NH4NO3 C) Mg3N2 D) NO2 E) N2
- Сумма коэффициентов в кратном ионном уравнении взаимодействия Na + HNO3(оч.разб) →NaNO3 + NH4NO3 + H2O равна A) 33 B) 32 C) 30 D) 31 E) 29
- Превращение РО3- → Р2О74- является: A) восстановителем B) гомогенным C) не окислительно-восстановительным процессом D) окислительно-восстановительным процессом E) окислением
- Валентность кислотного остатка ортофосфорной кислоты равна: A) 3 B) 5 C) 1 D) 4 E) 2
- В результате превращений Ca3(PO4)2
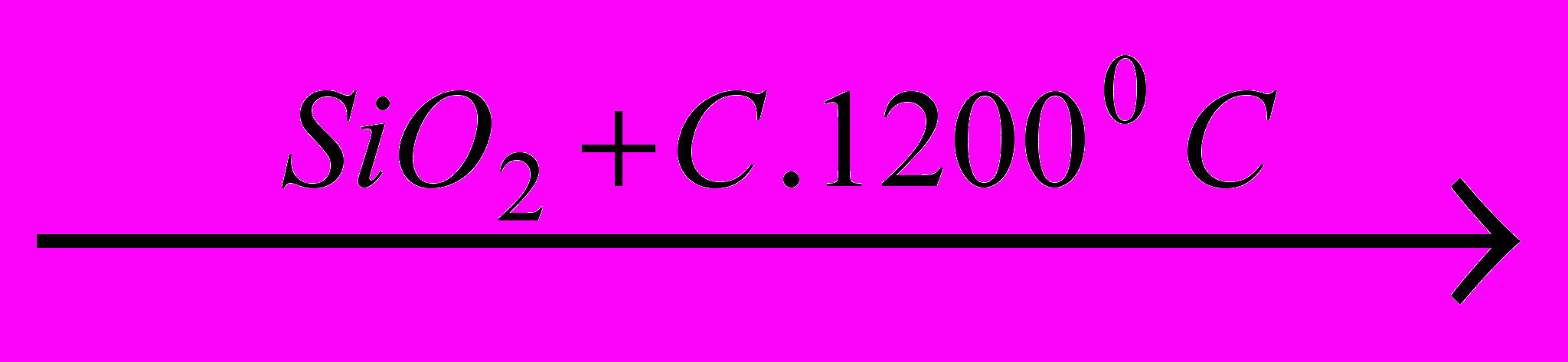 X1
X1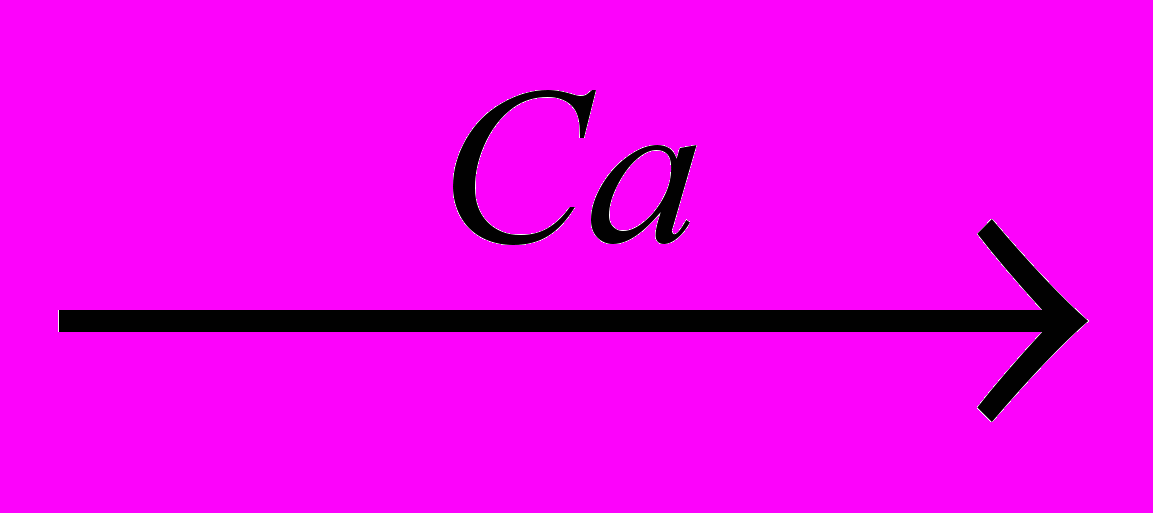 X2
X2 X3
X3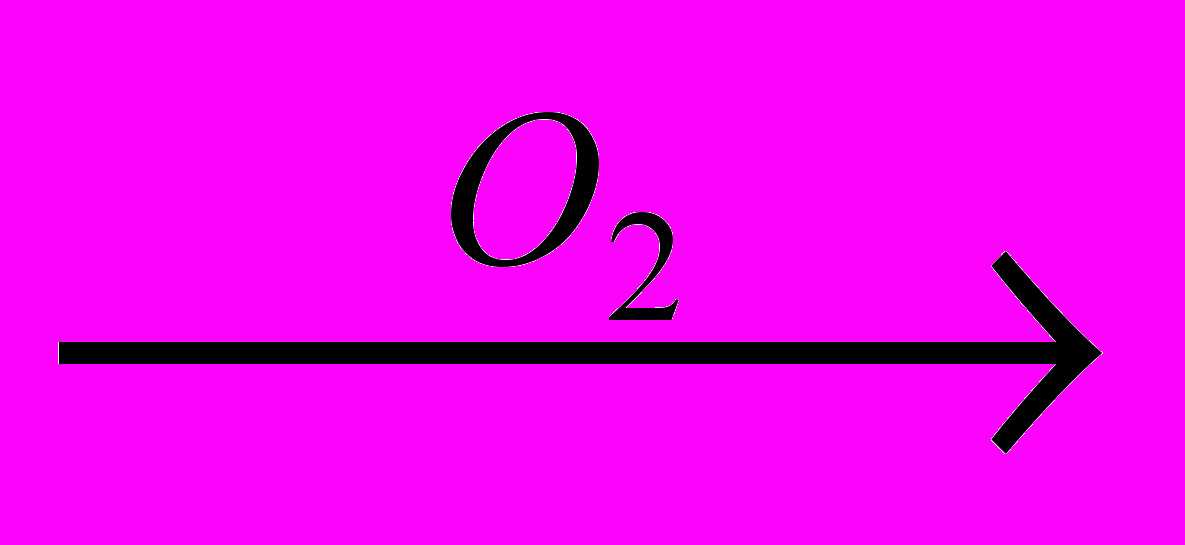 X4
X4 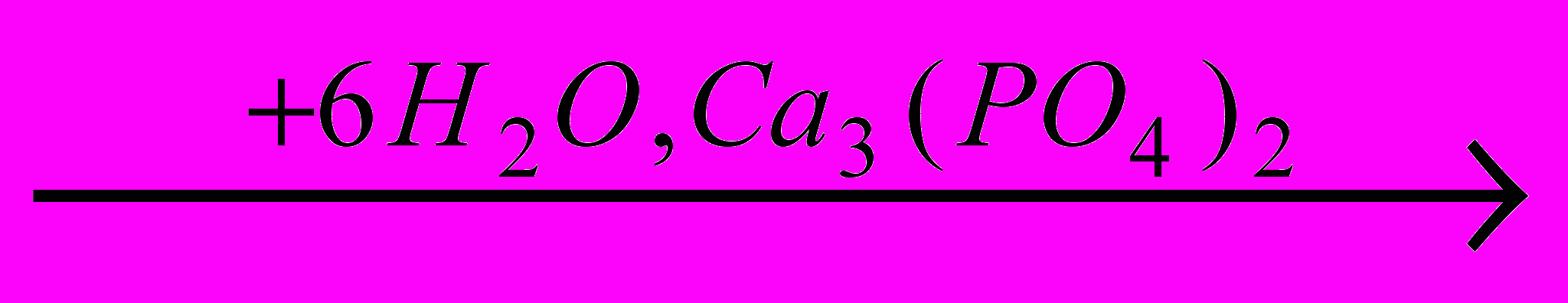
 X5 образуется конечный продукт A) Ca(H2PO4)2 B) CaHPO4∙2H2O C) CaHPO4 D) Ca3(PO4)2 E) Ca2P2O7
X5 образуется конечный продукт A) Ca(H2PO4)2 B) CaHPO4∙2H2O C) CaHPO4 D) Ca3(PO4)2 E) Ca2P2O7
Ключи ответов к тесту (На кодопленке)
| 1 вар | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| | D | B | D | C | C | A | C | E | E | A | B | C | E | D | C |
| 2 вар | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| | B | D | B | C | C | D | E | E | A | E | E | D | C | A | A |
2/. Повторение темы.
- Осуществить следующие превращения: (у доски)
а) NH3 → NH4NO2 → NH4OH N2O → O2
↓ ↕ ↑ ↑
Li3N ← N2 → NH3 → NH4NO3 → NaNO3
↓ ↑
NH3 → NO → NO2 → HNO3 → Cu(NO3)2
P2O5→ H3PO4
↑
б) Ca3(PO4)2 → P → H3PO4 → KH2PO4 → K2HPO4 → K3PO4 → Ag3PO4
↓
Ca3P2 → PH3 → H3PO4 → Ca3(PO4)2
↓
P2O5
- Решение задач.(У доски)
1. Какова массовая доля каждой из образующихся солей, если через 300 г
5,6%-ного раствора гидроксида калия пропустили 5,6 л (н.у.) оксида азота (IV)? (Ответ:
 (KNO3)=0,041;
(KNO3)=0,041;  (KNO2)=0,034),
(KNO2)=0,034), Помни! m(полученного р-ра) = m2(КОН) + m(NO2).
Помни! m(полученного р-ра) = m2(КОН) + m(NO2).- Через 250 г 19,6%-ного раствора серной кислоты было пропущено 20 л аммиака при давлении 100,1 кПа и температуре 280С. Вычислить массовые доли веществ в получившемся растворе. ( Ответ:
 (NH4HSO4)= 0,087;
(NH4HSO4)= 0,087;  ((NH4)2SO4)=0,15)
((NH4)2SO4)=0,15)
 Забыл? Смотри тему «Халькогены»
Забыл? Смотри тему «Халькогены»- Смесь цинка и его нитрата прокалили на воздухе, при этом её масса не изменилась. Определить массовую долю цинка в смеси.
- Массовая доля кислорода в газовой смеси, состоящей из углекислого газа и диоксида азота равна 0,7. Определить относительную плотность газовой смеси по гелию.
Решение задач (На кодопленке)
- Продукты полного сгорания фосфора массой 6,8 г поглощены 37 мл раствора с массовой долей гидроксида натрия 0,32 (ρ=1,35 г/мл). Определить состав соли и вычислить её массовую долю.
- Установить формулу кристаллогидрата нитрата меди (II), в котором половина всех атомов – атомы кислорода.
- В дождевой воде иногда присутствует некоторое количество азотной кислоты, образовавшейся естественным путем. Объяснить это явление с помощью уравнений реакций.
 Обрати внимание! 3HNO2 → HNO3 + 2NO↑ + H2O
Обрати внимание! 3HNO2 → HNO3 + 2NO↑ + H2OДомашнее задание.
- Смесь магния и его нитрата прокалили на воздухе, при этом её масса не изменилась. Определить массовую долю магния в смеси.(Ответ:
 (Mg) =0,5226)
(Mg) =0,5226)
- Массовая доля водорода в газовой смеси, состоящей из аммиака и фосфина (РН3) равна 0,12. Определить относительную плотность газовой смеси по азоту. (Ответ:0,89).
- Установить формулу кристаллогидрата сульфата натрия, в котором массовая доля кислорода составляет 0,378.
- При окислении фосфора раствором азотной кислоты (
 =0,55) получена фосфорная кислота и оксид азота (II). На нейтрализацию кислоты потребовалось 300 мл раствора с массовой долей гидроксида калия 0,2 (ρ=1,17 г/мл). Определить массу раствора азотной кислоты, израсходованного на окисление фосфора.
=0,55) получена фосфорная кислота и оксид азота (II). На нейтрализацию кислоты потребовалось 300 мл раствора с массовой долей гидроксида калия 0,2 (ρ=1,17 г/мл). Определить массу раствора азотной кислоты, израсходованного на окисление фосфора.
(Ответ: m2 (HNO3)= 80,2г).
