В. В. Курилкин основы химической технологии и лесопереработки конспект
| Вид материала | Конспект |
- Рабочая программа по дисциплине Ф. 13 «Системный анализ процессов химической технологии», 148.25kb.
- Основные вопросы рабочей программы по химической технологии, 282.59kb.
- Конспект лекций по курсу «Введение в специальность» направление, 941.35kb.
- М. В. Ломоносова Кафедра экономики и организации производства И. А. Назарова Основы, 599.04kb.
- Рабочая программа дисциплины компьютерные моделирующие системы в химической технологии, 239.63kb.
- Аннотации программ дисциплин Аннотация дисциплины, 62.94kb.
- Рабочая программа дисциплины инновационное развитие химической технологии модуль, 388.84kb.
- Московская государственная академия тонкой химической технологии им. М. В. Ломоносова, 319.7kb.
- Рабочая программа дисциплины системный анализ процессов химической технологии направление, 349.07kb.
- Физико-химические основы разделения биазеотропных смесей 05. 17. 04 Технология органических, 285.92kb.
Производство комплексных минеральных удобрений
Из комплексных минеральных удобрений наиболее распространены сложные. К ним относятся одинарные соли, содержащие несколько питательных элементов, например, KNO3 или (NH4)2HPO4, или композиции из солей, включающие два или три питательных элемента.
В сельском хозяйстве используется свыше 10 марок уравновешенных комплексных удобрений, среди которых наибольшее значение имеют удобрения формул (N:P2O5:K): в соотношениях 1:1:1; 1:1:0,5; 1:1; 5:1; 1:4:0. Все комплексные минеральные удобрения являются высококонцентрированными и применение их более эффективно, чем применение простых удобрений. Этим обусловлено интенсивное расширение производства и потребления сложных комплексных удобрений.
Ведущее место среди комплексных минеральных удобрений занимает аммофос, являющийся универсальным удобрением, которое используют как для внесения в почву, так и для изготовления минеральных удобрений смешанного типа.
Все сложные минеральные удобрения по методу их производства могут быть разделены на три группы:
- удобрения, получаемые переработкой фосфорной кислоты (аммофос, диаммофос);
- удобрения, получаемые переработкой смеси фосфорной и азотной кислот (нитроаммофос, нитроаммофоска);
- удобрения, получаемые разложением природных фосфатов азотной кислотой (нитрофос, нитроаммофоска).
Производство аммофоса
Аммофос представляет двойное (N+P) сложное комплексное удобрение, содержащее в качестве основного вещества моноаммонийфосфат NH4H2PO4 и примесь (до 10%) диаммонийфосфата (NH4)2HPO4, образующегося в процессе получения. Моно- и диаммонийфосфаты представляют собой твердые кристаллические вещества, малогигроскопичные, растворимые в воде. Из фосфатов аммония моноаммонийфосфат термически наиболее устойчив и при нагревании до 100 – 1100С практически не разлагается. Диаммонийфосфат и, особенно, триаммонийфосфат при нагревании диссоциируют с выделением аммиака.
В основе производства аммофоса лежит гетерогенный экзотермический процесс нейтрализации фосфорной кислоты газообразным аммиаком:
H3PO4ж + NH3г = NH4H2PO4 + 147,0 кДж.
Процесс ведут при избытке аммиака. Поэтому в системе, наряду с реакцией образования моноаммонийфосфата, частично протекает реакция образования диаммонийфосфата:
H3PO4 + 2NH3 = (NH4)2HPO4 + 75,4 кДж.
В результате чего в составе готового продукта содержится до 10% диаммонийфосфата.
Режим процесса нейтрализации выбирают так, чтобы обеспечить получение достаточно подвижной и способной к перекачиванию по трубопроводам аммофосной пульпы. Вязкость пульпы зависит от концентрации исходной кислоты, растворимости фосфатов аммония и температуры.
Производство нитроаммофоски
Нитроаммофоска представляет тройное (N+P+K) сложное комплексное удобрение и содержит в своей основе моноаммонийфосфат, нитрат аммония, нитрат калия и хлорид аммония. Присутствие двух последних солей снижает гигроскопичность продукта и улучшает его физические свойства. В зависимости от соотношения питательных веществ нитроаммофоску выпускают двух марок: марки А формулы 1:1:1 и марки Б формулы 1:1,5:1,5.
Нитроаммофоска может быть получена двумя методами: азотнокислотным разложением фосфатов и нейтрализацией смеси фосфорной и азотной кислот аммиаком. В обоих случаях для введения в состав продукта калийного компонента в реакционную смесь в процессе производства добавляют хлорид калия. Наиболее распространенный метод производства нитроаммофоски – нейтрализация.
В основе процесса получения нитроаммофоски по этому методу лежат реакции:
- Нейтрализация фосфорной и азотной кислот аммиаком с образованием, соответственно, моноаммонийфосфата и нитрата аммония:
H3PO4 + NH3 = NH4H2PO4,
HNO3 + NH3 = NH4NO3
- Обменная реакция вводимого в систему и растворяющегося в плаве хлорида калия с нитратом аммония:
NH4NO3 + KCl = KNO3 + NH4Cl.
Контрольные вопросы
- Перечислите основные виды фосфорных и комплексных минеральных удобрений на основе фосфора.
- Что такое водорастворимые, усвояемые и нерастворимые фосфорные минеральные удобрения?
- Из какого сырья получают фосфорную кислоту и фосфорные минеральные удобрения?
- Укажите промышленные методы производства фосфорной кислоты.
- В чем преимущество электротермического способа производства фосфорной кислоты перед экстракционным?
- К какому виду кислотного разложения относиться производство двойного суперфосфата? Почему это минеральное удобрение называется безбалластным?
ПРОИЗВОДСТВО ЕДКИХ ЩЕЛОЧЕЙ
Технологические процессы с использованием электрической энергии
Свыше 40% всей энергии, потребляемой химической промышленностью, составляет электрическая энергия. О высокой энергоемкости химических производств говорит тот факт, что химическая промышленность, производя около 6% всей промышленной продукции, потребляет до 12% производимой в РФ электроэнергии. При этом некоторые производства (аммиака, фосфора, карбида кальция, химических волокон, пластмасс и др.) используют до 60% электроэнергии, потребляемой всей химической отраслью.
Помимо применения электроэнергии для подсобных целей (транспортировка твердых материалов, перекачка и компримирование жидкостей и газов, обеспечение работы электрофильтров и магнитных сепараторов и др.) ее используют в химико-технологических процессах двух видов: электротермических и электрохимических.
Электротермическими называются технологические процессы, в которых энергия электрического тока используется для создания и поддержания высокой температуры реакционной системы, то есть превращается в теплоту, используемую для осуществления химической реакции. К таким процессам относится, например, производство карбида кальция, кальцийцианамида, элементарного фосфора.
Электрохимическими называются технологические процессы, в которых энергия электрического тока непосредственно используется для осуществления химических превращений, то есть трансформируется в химическую энергию.
Электрохимические процессы широко распространены в химической промышленности, что объясняется их преимуществами перед другими химико-технологическими процессами. К таким преимуществам следует отнести:
- простоту аппаратурного оформления, технологии и малостадийность процесса;
- высокую степень использования сырья и энергии;
- одновременное получение из одного сырья нескольких целевых продуктов (процесс с расходящимся материальным потоком);
- высокую чистоту производимой продукции;
- возможность проведения превращений и получения продуктов, недоступных при использовании чисто химических методов.
Основным недостатком электрохимических процессов является их высокая энергоемкость, которая приводит к значительной доле затрат на энергию в себестоимости продукции. Например, энергоемкость производства алюминия достигает 2 104 кВт ч/т, тогда как в производстве серной кислоты она не превышает 100 кВт ч/т продукции.
В химической и металлургической промышленности электрохимические процессы используют для:
- производства свободных галогенов (фтор, хлор);
- производства щелочей (гидроксиды натрия, калия, лития);
- электролиза воды с целью получения чистых кислорода и водорода;
- производства неорганических окислителей, в том числе, перманганатов MeMnO4, концентрированной перекиси водорода, хлоратов MeClO3 и перхлоратов MeClO4, персульфатов Me2S2O8, гипохлоритов MeClO и др.;
- выделения активных металлов (литий, натрий, калий, магний, алюминий, хром и др.)
- электролитического рафинирования цветных металлов (цинк, медь, никель, серебро и др.);
- производства некоторых органических веществ, например, альдегидов и кетонов анодным окислением спиртов, азотсодержащих соединений катодным восстановлением нитропроизводных и др.;
- нанесения защитных покрытий из цветных металлов (гальваностегия);
- изготовления и размножения металлических копий (гальванопластика).
Электролиз водного раствора хлорида натрия
Электролиз водного раствора хлорида натрия – одно из важнейших крупнотоннажных производств, основанных на процессе электролиза водных растворов электролитов. Он позволяет на основе одного сырья получить одновременно три продукта: гидроксид натрия, хлор и водород. Технологический процесс состоит их трех стадий: подготовки сырья к электролизу раствора хлорида натрия, очистки и переработки продуктов электролиза.
Подготовка сырья к электролизу. Сырьем для электролиза служит хлорид натрия в виде каменной соли, самоосадочной соли или подземного рассола. Подготовка сырья к электролизу включает операции растворения (при использовании твердой соли), очистки рассола от механических примесей и удаления ионов кальция и магния.
Механические примеси удаляют отстаиванием рассола с последующим фильтрованием осадка, а ионы кальция и магния, которые отрицательно влияют на процесс электролиза, обработкой рассола раствором карбоната натрия или известковым молоком, с последующей нейтрализацией избыточной щелочности соляной кислотой. Осадок карбонатов кальция и магния удаляют фильтрованием.
Полученный рассол должен иметь концентрацию соли 310 – 315 г/л, чтобы обеспечить возможно более низкий потенциал разряда ионов при электролизе. Также существуют допустимые пределы содержания ионов кальция и магния.
Рассол, поступающий на электролиз, представляет многокомпонентную систему, в которой содержатся ионы натрия, хлора, гидроксоний-катион и гидроксид-анион. Последовательность их разряда и образующиеся продукты определяются в соответствии с «правилом разряда» величиной их потенциалов разряда, которые зависят от условий электролиза и, весьма существенно, от материала катода. Различают два варианта технологического процесса электролиза водного раствора хлорида натрия: электролиз с твердым железным катодом (диафрагменный метод) и электролиз с жидким ртутным катодом.
Аноды электролизеров в обоих случаях изготавливают из одинаковых материалов: искусственного графита, пропитанного для уменьшения износа льняным маслом, или из титана, покрытого слоем оксидов рутения и титана. Аноды второго типа позволяют вести электролиз при высоких плотностях тока и более низком напряжении. Такие условия снижают расход электроэнергии на 10 – 12%. Поэтому оксидно-рутениевые аноды вытесняют графитовые: ими оснащено в настоящее время до 70% всех установок электролиза.
Электролиз раствора хлорида натрия с железным катодом. При прохождении постоянного тока через водный раствор хлорида натрия на железном катоде разряжаются ионы гидроксония H3O+, потенциал разряда которых в насыщенном растворе хлорида натрия, даже при учете перенапряжения, составляет +1,1 В, тогда как потенциал разряда ионов натрия равен +2,71В.
В то же время, на графитовом и окиснорутениевом анодах потенциал разряда ионов гидроксила OH- за счет высокого перенапряжения составляет -1,9В и превышает потенциал разряда ионов хлора, равный – 1,6В. Поэтому на подобных анодах разряжаются ионы хлора.
На практике, при проведении процесса электролиза с железным катодом, на токоподводах электролизера поддерживается напряжение около 4,0 В.
В результате разряда ионов H3O+ в катодном пространстве накапливаются ионы OH- и образуется раствор гидроксида натрия:
NaCl+ H2O = 0,5Cl2 + 0,5H2 + NaOH
В результате протекания вторичных процессов раствор гидроксида натрия, полученный электролизом с железным катодом, всегда содержит примесь гипохлорита и хлората натрия. Вторичные процессы снижают выход по току и коэффициент использования энергии.
Электролизер (электролитическая ячейка) – основной аппарат в технологическом процессе производства едкого натра и хлора электролизом водного раствора хлорида натрия с железным катодом. Диафрагменные электролизеры могут быть двух типов: с вертикально расположенными катодами с верхним и нижним токоподводом, или с горизонтально расположенными катодами. В настоящее время повсеместно используются электролизеры первого типа.
В цехе электролиза отдельные ячейки (электролизеры) объединены в группы до 150 штук.
Разновидность диафрагменного способа – более совершенный процесс электролиза в электролизерах с ионообменной мембраной. В таких электролизерах анодное и катодное пространства разделены полимерной мембраной, которая предотвращает попадание хлорида натрия из анодного пространства в которое подается рассол, в катодное и препятствует переносу ионов OH- к аноду электролизера. Хлор выделяется на аноде и выводится из анодного пространства вместе с обедненным рассолом. Ионы натрия и частично молекулы воды проходят через мембрану к катоду, куда подается вода в количестве, необходимом для образования щелока заданной концентрации. Электролизеры мембранного типа различаются числом ячеек (от 40 до 80) и имеют мощность до 80 тысяч тонн в год по гидроксиду натрия. В отличие от электролизеров с асбестовой диафрагмой нагрузка на ячейку (сила тока) значительно ниже и не превышает 7,5 кА. Поэтому электролизеры с ионообменной мембраной значительно экономичнее диафрагменных.
Электролиз раствора хлорида натрия с ртутным катодом. На ртутном катоде разряд ионов гидроксония H3O+ может происходить только при малых, менее 50 А/м2, плотностях тока. В условиях промышленного электролиза водных растворов хлорида натрия в электролизерах с ртутным катодом плотность тока составляет 5 – 10 кА/м2. При такой плотности тока, вследствие перенапряжения потенциал разряда ионов H3O+ составляет +2,0 В. В то же время, за счет растворения выделившегося металлического натрия в ртути, образуется амальгама NaHgn, представляющая качественно новый электрод, потенциал разряда натрия на котором составляет +1,2 В. Поэтому, на катоде будут разряжаться ионы натрия.
Первичные процессы разряда на аноде при электролизе с ртутным катодом те же, что и при электролизе с железным катодом.
Практически, при проведении электролиза с ртутным катодом на токоподводах электролизера поддерживается напряжение, равное 4,5 В.
Так как в электролизе с ртутным катодом не происходит разряда ионов H3O+, то концентрация ионов гидроксила в катодном пространстве электролизера не увеличивается и вторичные процессы в анодном пространстве отсутствуют.
Электролизер, используемый в процессе электролиза с ртутным катодом, состоит из собственно электролизера (ванны) и разлагателя. Конструктивно разлагатель может быть объединен в одно целое с электролизером или вынесен отдельно. По дну ванны, имеющему небольшой уклон, непрерывно движется тонкий (толщиной 5 мм) слой ртути, являющийся катодом.
Сопоставление диафрагменного и ртутного методов производства едкого натра и хлора позволяет заключить, что:
- электролизеры с ртутным катодом потребляют больше энергии вследствие высокого напряжения разложения, эксплуатация их сложнее, капитальные затраты выше, а условия труда из-за токсичности ртути тяжелее. Однако в них можно получать более концентрированные и свободные от хлорида натрия щелока, что облегчает последующее выделение гидроксида натрия,
- электролизеры с железным катодом позволяют использовать в качестве сырья подземные рассолы, тогда как в ваннах с ртутным катодом применяется только чистая соль. Их недостаток – высокое (до 0,04 мас. дол. против 0,0005 мас. дол. в ртутных ваннах) содержание в щелоке хлорида натрия, затрудняющее его переработку.
Себестоимость гидроксида натрия полученного электролизом с ртутным катодом на 10 – 15% выше, чем себестоимость полученного диафрагменным методом.
Технический гидроксид натрия (едкий натр) выпускают в твердом виде (плавленый и в виде чешуек) с содержанием NaOH не менее 95% (ГОСТ 2263-71) и в виде водного раствора с содержанием NaOH не менее 610 г/л (ГОСТ 11078-71).
Выходящий из электролизера хлор при температуре 70 – 900С содержит водяные пары. Влажный хлор корродирует черные и другие металлы, используемые в качестве конструкционных материалов. Кроме того, использование его как реагента в производстве различных органических соединений ведет к образованию побочных продуктов. Поэтому, хлор до превращения его в технический продукт предварительно подвергают сушке.
Жидкий хлор хранят и транспортируют в специальных стальных баллонах или цистернах емкостью до 50 тонн.
В процессе электролиза водного раствора хлорида натрия как с железным, так и с ртутным катодом образуется водород, который является побочным продуктом процесса. В том случае, если предполагается использование водорода в промышленных целях, его подвергают очистке, пропуская через колонны, наполненные активированным углем. Полученный продукт должен содержать не менее 99% водорода.
Производство соляной кислоты
Соляной кислотой называются растворы хлористого водорода в воде различной концентрации.
Хлористый водород HCl – в обычных условиях бесцветный газ с резким специфическим запахом, с температурой кипения – 84,80С и температурой плавления – 114,20С. Легко сжижается, критическая температура составляет 51,40С, критическое давление 8,2 МПа. Хлористый водород хорошо растворим в воде; при давлении 0,1 МПа растворимость его равна: при 00С 525 л/л (82,3 г/100 г воды), при 180С 451 л/л (70,7 г/100 г воды). Растворим в этаноле, диэтиловом эфире и других органических растворителях. Токсичен. ПДК – 5 мг/м3.
Хлористый водород применяется как гидрохлорирующий агент в различных производствах органического синтеза (получение хлорвинила из ацетилена, хлорэтила из этилена и т.п.), пластических масс и синтетических каучуков.
Соляная кислота – бесцветная прозрачная жидкость, иногда окрашенная солями железа и растворенным хлором в желтовато-зеленый цвет.
Температура кипения и плотность соляной кислоты зависят от ее концентрации, то есть от состава системы «HCl – H2O». Максимально возможное содержание HCl в соляной кислоте равно 46,15% мас. При концентрации 20,22% мас. образуется азеотроп с температурой кипения 108,60С. Наиболее распространенные сорта товарной соляной кислоты имеют концентрацию от 27 до 38% масс., что связано с особенностями ее производства. Температура замерзания такой кислоты составляет около – 300С.
По масштабам производства и применения соляная кислота занимает третье место после серной и азотной кислот. Соляная кислота применяется для получения хлоридов металлов, хлорида аммония, в гидролитических процессах (гидролиз целлюлозы и др.), для очистки поверхности металлов (травление). Для снижения коррозионной активности в соляную кислоту вводят ингибиторы, защищающие металл, но не препятствующие растворению оксидной пленки.
Соляную кислоту получают абсорбцией хлористого водорода водой. Из известных методов получения хлористого водорода практическое значение имеет только прямой синтез его из водорода и хлора. Другие методы производства (сульфатный и извлечением из продуктов хлорирования органических соединений) не получили применения из-за высокой загрязненности получаемого хлористого водорода и, следовательно, соляной кислоты.
Производство синтетической соляной кислоты включает две последовательных стадии: синтез хлористого водорода из хлора и водорода и абсорбцию хлористого водорода водой.
Синтез хлористого водорода из хлора и водорода – это обратимый гомогенный экзотермический процесс, протекающий в форме спонтанного (самопроизвольного) невзрывного горения водорода в хлоре, выражаемом уравнением:
H2 + Cl2 2HCl + 183,7 кДж.
Реакция горения протекает по цепному механизму и инициируется нагреванием или световым облучением высокой мощности. Состояние равновесия системы существенно зависит от температуры, выше 15000С оно сдвигается вправо. Однако на практике для обеспечения достаточно высокой скорости синтеза температуру в реакторе поддерживают в пределах 23000С, что позволяет, однако, обеспечить достаточно высокий выход хлористого водорода. Процесс ведут при избытке водорода в 3 – 10% сверх стехиометрического количества. Это не только способствует сдвигу равновесия вправо, но и обеспечивает отсутствие хлора в отходящих газах, общую экологическую чистоту технологии, работу в безопасных пределах состава смеси «хлор – водород» и позволяет избежать возможность взрыва.
Абсорбция хлористого водорода водой представляет собой гетерогенный обратимый экзотермический процесс образования гидратов хлористого водорода и их растворения в воде.
HCl + nH2O HCl nH2O - H.
Тепловой эффект абсорбции (растворения) хлористого водорода зависит от значения n, то есть от концентрации образующейся соляной кислоты и составляет при бесконечном разбавлении 75,1 кДж/моль.
Состояние равновесия процесса абсорбции зависит от концентрации хлористого водорода в абсорбируемом газе и температуры. С увеличением концентрации HCl в газе степень абсорбции и концентрация образующейся соляной кислоты возрастает. Поэтому на абсорбцию направляют газ с содержанием хлористого водорода не менее 90% об.
Без отвода теплоты из системы получить при абсорбции соляную кислоту концентрацией выше азеотропа (20,2%) невозможно. Для получения кислоты более высокой концентрации избыточная теплота абсорбции должна отводиться из системы. Это может быть достигнуто:
- отводом тепла в окружающую среду (изотермическая абсорбция);
- проведением процесса в адиабатических условиях, когда теплота используется внутри системы для испарения воды и увеличения концентрации кислоты (адиабатическая абсорбция).
Первый метод сложен в обеспечении, так как требует теплообменной аппаратуры с большой поверхностью охлаждения, работающей в контакте с коррозионно-активной жидкостью. Поэтому, наибольшее распространение получил метод адиабатической абсорбции, разработанный А. М. Гаспаряном. При использовании в качестве сырья 75%-ного хлора и 95%-ного водорода этим методом можно получить соляную кислоту концентрацией до 33%.
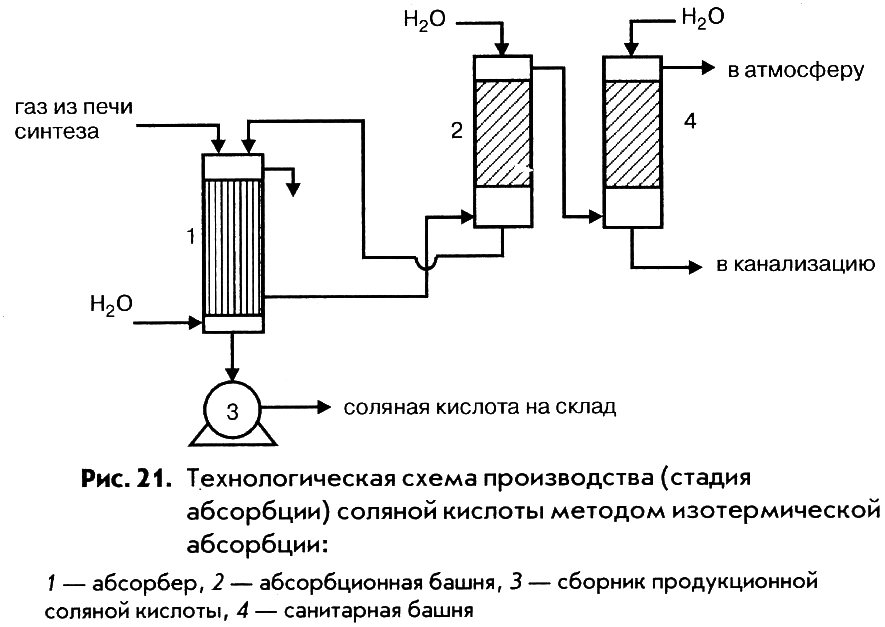
Метод изотермической абсорбции используется в ограниченных масштабах для получения соляной кислоты более высокой (39 – 40%) концентрации.
Современные установки по производству соляной кислоты включают, как правило, две технологические линии: одну для производства соляной кислоты и другую – для производства сжиженного хлористого водорода.
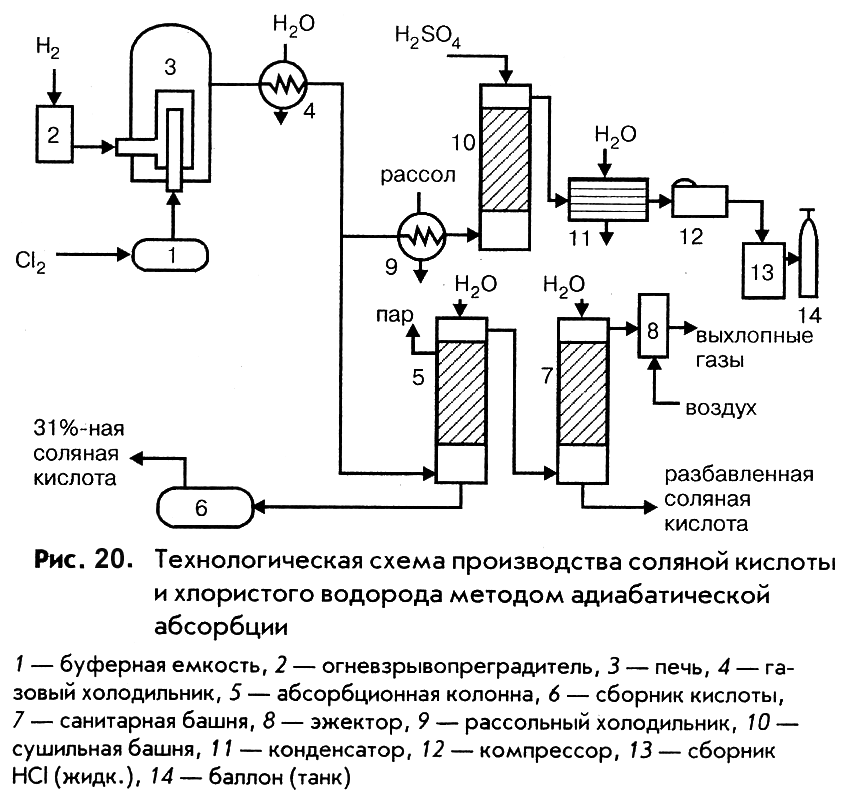
Ниже рассмотрены технологические схемы производства соляной кислоты по методам адиабатической и изотермической абсорбции (рис. 20 и 21).
Хлор (рис. 20) из буферной емкости 1, где от него отделяется серная кислота, увлекаемая хлором из сушильной башни, и водород через огневзрывопреградитель 2 подают в горелку печи 3 в соотношении, обеспечивающем избыток водорода. Выходящий из печи газ охлаждается в газовом холодильнике 4, орошаемом водой и разделяется на два потока. Один поток (линия соляной кислоты) поступает в абсорбционную колонну 5, орошаемую водой. Температура абсорбции составляет 80 – 850С и регулируется испарением воды, подаваемой в колонну. Продукционную соляную кислоту собирают в сборнике 6, а непоглощенные газы, содержащие хлористый водород, водород, азот и пары воды, направляют в санитарную башню 7, орошаемую водой, после чего выбрасывают через эжектор 8 в атмосферу. Второй поток газа (линия жидкого хлористого водорода) дополнительно охлаждается в рассольном холодильнике из тантала или графита 9 и направляется на осушку в башню 10, орошаемую концентрированной серной кислотой. Сухой хлористый водород проходит через конденсатор 11, сжимается компрессором 12 до давления 10 МПа и поступает в сборник жидкого продукта 13, откуда разливается в баллоны или танки.
 |
 |
Высокая коррозионная активность соляной кислоты и влажность хлористого водорода предъявляет повышенные требования к конструкционным материалам аппаратуры. Для ее изготовления используются керамика (насадка колонн), тантал и графит, пропитанный фенолформальдегидной смолой (холодильники) и кварц.
Товарными продуктами в производстве являются соляная кислота с содержанием HCl 27,5 и 31%, ингибированная соляная кислота и жидкий хлористый водород с содержанием HCl 99,5%.
Контрольные вопросы
- Какие процессы называются электрохимическими и чем они отличаются от электротермических процессов? Приведите примеры тех и других.
- В каких областях химической технологии используются электрохимические процессы?
- Что служит сырьем для электрохимического производства гидроксида натрия, хлора и водорода?
- Какие примеси должны быть удалены из раствора электролита перед электролизом?
- В чем принципиальное различие процессов электролиза при получении гидроксида натрия с железным катодом и ртутным катодом?
- Перечислите преимущества и недостатки процесса с ртутным катодом.
- Что называется соляной кислотой? Какая максимальная концентрация соляной кислоты может быть достигнута в производстве?
- Почему процесс синтеза хлористого водорода ведут в избытке водорода?
- Какие методы отвода тепла существуют на стадии абсорбции хлористого водорода в производстве соляной кислоты? В чем преимущества метода адиабатической абсорбции?
ТИТАН – металл космического века
В честь древних обитателей Земли немецкий химик М. Клапрот в 1795 г. назвал новый металл. Знаменитый химик еще плохо представлял свойства нового элемента и не подозревал, насколько удачное название он дал.
Стойкий большинству агрессивных сред, выдерживающий холод и высокие температуры, прочный и легкий титан лишь в 20 веке оправдал свое название. Среди металлов он занимает особое место. Ученые называют его металлом будущего, металлом космического века.
В конструкциях современных самолетов и вертолетов, ракет, космических кораблей и сверхмощных двигателей, подводных лодок и быстроходных судов – вот где широко применяют сейчас титан. Кроме того, титан незаменим в химическом машиностроении, в электронике, радиотехнике, медицине, металлургии и других областях.
Со времени открытия титана многие исследователи пытались получить его в чистом виде из его минералов.
В первой половине 20 века научные поиски в геологии и геохимии показали, что титан не такой уж редкий металл. Примечательно, что сейчас ученые ставят титан на 9 место по распространенности в земной коре (O, Si, Al, Fe, Ca, Na, Mg, K, Ti).
Содержание оксида титана (TiO2) в рудах составляет 0,5 – 35% (есть открытые залежи-россыпи песков в Австралии, Индии, Бразилии). Титан содержится и в органической природе: в зернах, плодах, стеблях растений, в тканях животных , даже в молоке и куриных яйцах (в миллиграммах). В человеческом организме около 20 миллиграммов титана, причем врачами установлено, что титан абсолютно безвреден для людей.
Широкая распространенность титана естественно породила интерес к изучению его свойств. Было установлено, что этот светло-серый металл обладает уникальным сочетанием свойств: его плотность равна 4,6 г/см3 (легкий), почти вдвое легче железа и в 1,5 раза тяжелее алюминия; небольшая плотность, как правило, связана с невысокой прочностью (например, алюминий в 3 раза легче стали и в несколько раз менее прочен), а титан – превосходит в 1,5 раза сталь по прочности и плавится при более высокой температуре (16700С). Титан уже при обычных температурах легко окисляется и покрывается пленкой оксида, что обеспечивает очень высокую стойкость титана к коррозии. Пленка, толщиной всего 10-9 – 10-10 м, прочно связана с основным металлом и защищает его от контакта с агрессивной средой. Возникает парадокс: окисление – злейший враг металлов – обеспечивает титану самозащиту. Поэтому, титан стоек в холодной и горячей воде, в растворах большинства солей и кислот.
О свойствах титана вспомнили лишь в 40-х годах прошлого столетия.
Неудовлетворение марками стали (самолеты и др.) ускорило развитие производства титана. После тщательного изучения специалисты остановились на способе Кролля:
TiCl4 + 2Mg = Ti + 2MgCl2
Сырьем для промышленного производства титана служат титановые рудные концентраты. Разрабатываемые руды на горно-обогатительных комбинатах (ГОК) измельчаются в пыль и пропускаются через магнитный сепаратор, где под действием сильных магнитов частицы оксидов железа и других ферромагнитных материалов отделяются от части руды, содержащей парамагнитный титан. Так получают концентраты, содержащие до 40 – 50% TiO2. Концентраты поступают на титановые заводы для извлечения из них металла в несколько стадий:
- Первоначально титановые концентраты подвергают восстановительной плавке в электродуговых печах. В печь загружают титановые концентраты, углесодержащие восстановители (кокс, антрацит) и ведут плавку компонентов при 16000С. В результате плавки оксиды железа и других металлов восстанавливаются и из-за более высокой плотности опускаются на дно ванны. Более легкие оксиды титана всплывают наверх и образуют продукт, называемый титановым шлаком, в нем содержится 80 – 90% TiO2.
- Шлак смешивают с каменноугольным песком, смолой, коксом и прессуют из смеси небольшие брикеты. Эти брикеты хлорируют в цилиндрических печах при 800 – 8500С. Подача хлора осуществляется через дно печи. В результате хлорирования образуется TiCl4 – бесцветная жидкость.
- Восстановление TiCl4 магнием происходит в специальных закрытых реакторах, заполненных инертным газом.
Из титана и его сплавов выпускают листы, ленты, проволоку, трубы. Обрабатывать титан непросто. Основные сложности связаны со свойством титана налипать и «задираться» при обработке. Считается, что титан обрабатывается в четыре раза хуже сталей.
Готовые изделия из титана и его сплавов находят применение во многих областях: 30 – 40% всех изделий – в самолетостроении; 20 – 30% - для изготовления реактивных двигателей; 20 – 30% - для строительства ракет и космических кораблей; 5 – 10% - для строительства аппаратуры, работающей в агрессивных химических средах.
Производство титана возникло благодаря реактивному самолетостроению. Замена стальных деталей титановыми дает экономию в массе на 30 – 40% (а это сотни килограмм). Но это еще не все. Известно, что экономия 1 кг в массе двигателя позволяет сберечь до 10 кг в общей массе самолета, а снижение массы – это скорость, высота, дальность полета. Титан устойчив к нагреванию обшивки при огромной скорости. Сейчас 30% массы каждого самолета – титановые сплавы. Лучшие гоночные автомобили – из титана.
Уникальная стойкость титана в морской воде дает возможность широко применять его в судостроении. Редкое свойство титана – хладостойкость, титан используется как конструкционный материал на крайнем Севере. Ведь железо – основа сталей – становится хрупким уже при – 400С. Отсюда частые поломки механизмов. А серийные титановые сплавы выдерживают температуру до – 1960С. TiC (карбид титана) – основа многих режущих инструментов
По мнению специалистов в 21 веке себестоимость титана снизится до стоимости нержавеющей стали. Но и сейчас есть смысл в замене деталей из нержавеющей стали на титановые. Срок эксплуатации стальных деталей 1- 2 года, а титановых – 10 – 20 лет. Поэтому его расход, по сравнению с нержавеющей сталью, в 10 раз меньше.
КЕРАМИКА – материал будущего
Слово «керамика» пришло из греческого языка («керамос» - обожженная глина, «керамике» - гончарное искусство). Трудно установить дату, когда на промышленную арену вышла керамика, которую теперь называют высокотехнологичной. Вероятно, первой разновидностью такой керамики был карбид кремния (SiC), производство которого одна из американских фирм начала более 100 лет назад. Уже в то время термин «керамика» приобрел более широкое значение: помимо традиционных материалов, изготовляемых из глин, к ней стали относить материалы получаемые из чистых, простых и сложных оксидов, карбидов, нитридов. Необычные механические, электрические, магнитные и оптические свойства, коррозионная и радиационная устойчивость, экологическая безопасность, а также специфика поведения керамики как твердофазного материала переменного состава, ставят ее вне конкуренции со многими другими традиционными материалами. Есть все основания считать, что будущее моторо- и станкостроения, а также новых систем автоматики и ЭВМ определяется успехом в создании новых видов керамики. Перспективность керамики обусловлена ее многофункциональностью, доступностью сырья, а также относительно низкими энергозатратами керамического производства. Само понятие «керамика» в последнее время трансформировалось. Сейчас под керамикой понимают любые поликристаллические материалы, получаемые спеканием неметаллических порошков природного или искусственного происхождения. Это определение исключает из числа керамических материалов стекла, хотя нередко их рассматривают как разновидность керамики.
Современные виды керамики иногда делят на две группы: 1) конструкционную; 2) функциональную. При этом, под (1) понимают керамику, используемую для создания механически стойких конструкций, а под (2) – керамику со специфическими электрическими, магнитными, оптическими или термическими функциями.
В мире современных материалов керамике принадлежит заметная роль, обусловленная широким диапазоном ее разнообразных физических и химических свойств. Керамика не окисляется и устойчива в более высокотемпературной области, чем металлы. Например, температура плавления карбида гафния (HfC) равна 39300С, на 2500С выше, чем у вольфрама. Что касается более распространенных керамических материалов (Al2O3, MgO и др.), то их термическая устойчивость намного превышает устойчивость большинства сталей и сплавов. Любопытно, что химические элементы, составляющие основу конструкционной керамики, образуют в периодической системе компактную группу, включающую 10 элементов (Be, B, С, N, O, Mg, Al, Si, Ti, Zr).
Объем производства керамических материалов во всех странах мира растет необычайно быстрыми темпами. Предполагается, что за грядущее 25-летие мировой объем производства керамики вырастет в 10 раз. В настоящее время основные производители керамики в капиталистическом мире – США (38%), Япония (48%). Причем, США доминирует в области конструкционной керамики, предназначенной в первую очередь для металлообрабатывающих целей, а Япония, будучи активной в области любых видов керамики, безраздельно доминирует в области функциональной керамики (основном компоненте электронных устройств).
Современная натриевая лампа (желтый цвет) высокого давления представляет собой тонкостенную (0,8 мм) цилиндрическую разрядную трубку из прозрачной поликристаллической алюмооксидной керамики. После соответствующей обработки, внутрь трубки вводится дозированное количество амальгамы натрия (Na + Hg) и инертный газ. Сама разрядная трубка монтируется внутри стеклянного баллона, который вакуумируется и запаивается. Такая система позволяет получить источник света со светоотдачей в 5 – 6 раз более высокой, чем у обычных ламп накаливания. К тому же, натриевые лампы высокого давления служат 9000 – 10000 часов, тогда как лампы накаливания в 3 раза меньше. Натриевые лампы широко применяются для освещения наиболее оживленных транспортных магистралей.
В последние годы внимание конструкторов привлекли керамические материалы на основе карбида и нитрида кремния (SiC, Si3N4). Их высокая прочность при повышенных температурах, хорошая стойкость по отношению к тепловым ударам, малая окисляемость, позволяют создавать газовые турбины, дизельные двигатели и двигатели внутреннего сгорания, работающие при температуре почти 14000С. Отсутствие необходимости систем охлаждения и малый вес двигателей дают возможность достичь большую мощность, экономить топливо, уменьшить выброс вредных веществ в атмосферу. Кроме того, благодаря высокой износостойкости, двигатели с рабочими телами из керамики не требуют большого количества смазки. Первые испытания дизельного двигателя для грузового автомобиля с керамическими поршневыми головками, цилиндрами и подшипниками показали, что расход топлива снижается на 27%, а КПД повышается с 30 до 45%. Сейчас считают, что промышленный выпуск керамических газотурбинных двигателей внутреннего сгорания начнется за рубежом уже в начале 21 века.
ПРОМЫШЛЕННОСТЬ ОРГАНИЧЕСКОГО СИНТЕЗА
Продукты основного органического синтеза
Основным или тяжелым органическим синтезом (ООС) называется совокупность производств органических веществ относительно простого строения, вырабатываемых в очень больших количествах и используемых как в качестве целевых продуктов, так и полупродуктов в других отраслях органической технологии.
К целевым продуктам ООС относятся синтетическое жидкое топливо, смазочные масла, растворители и экстрагенты, мономеры, пластификаторы полимерных материалов, пестициды, средства защиты растений и другие. В качестве полупродуктов ООС используются, как правило, простейшие представители гомологических рядов соответствующих соединений: углеводородов (этилен, пропилен, бензол), галогензамещенных (дихлорэтан, винилхлорид), спиртов (метанол, этанол), альдегидов и кетонов (ацетальдегид, ацетон), органических кислот (уксусная кислота) и т.д.
В отличие от ООС тонкий органический синтез (ТОС) объединяет производства органических веществ сложного строения, вырабатываемые в относительно небольших количествах и используемые преимущественно в качестве целевых конечных продуктов. К ним относятся красители, фото- и кинореактивы, фармацевтические препараты, взрывчатые вещества, парфюмерные средства и т.п.
Принятый в органической технологии термин «основной» органический синтез указывает на то, что он объединяет производства продуктов, являющихся основой всей остальной промышленной органической химии. При этом, в большинстве случаев, ООС отождествляется с нефтехимическим синтезом. Это связано с изменением структуры сырьевого баланса производств органической технологии в последние десятилетия и переориентацией их на нефтяное сырье.
Продукция ООС исчисляется многими сотнями тысяч и миллионами тонн в год. Так, например, мировое производство двадцати продуктов этой отрасли превышает 1 миллион тонн в год, а производство более чем ста продуктов достигает 200 тыс. т в год каждого.
Производство продуктов ООС базируется в настоящее время на ископаемом органическом сырье: нефти, природном газе, каменном угле и сланцах. В результате разнообразных химических и физико-химических процессов превращения этого сырья (крекинг, пиролиз, риформинг, ректификация, конверсия, коксование и полукоксование), получают исходные вещества для ООС.
Значение и перспективы развития ООС
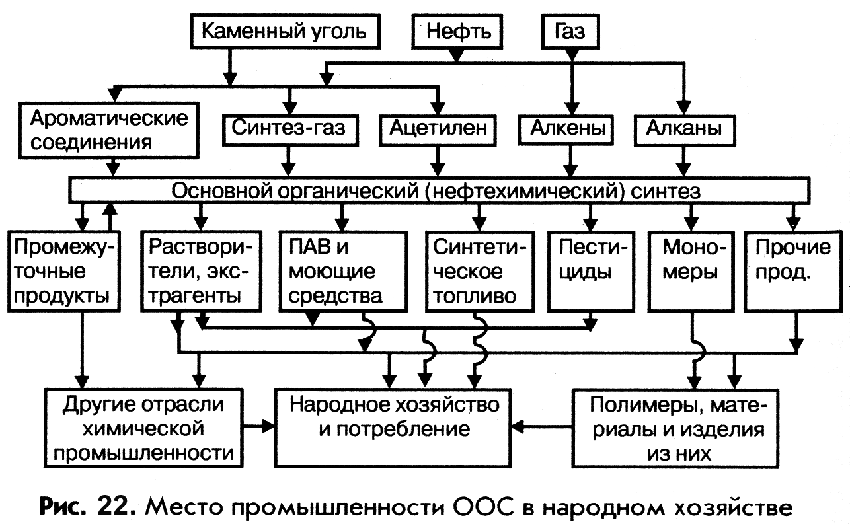
Современная промышленность ООС решает две основные задачи: крупномасштабное производство полупродуктов для других отраслей промышленности и получение целевых продуктов общего назначения. Поэтому, в настоящее время нет ни одной отрасли народного хозяйства, в которой не использовались бы продукты ООС и их переработки (рис. 22).
 |
- создание новых технологических процессов, базирующихся на более доступном и дешевом сырье. Например, переход от дорогого ацетилена к ароматическим углеводородам, алкенам, алканам и, наконец, синтез-газу.
- переход к прямым методам синтеза, исключающим потребление неорганических реагентов. Например, замена сернокислотной гидратации этилена прямой каталитической в производстве этанола.
- повышение селективности процессов за счет оптимизации параметров, выбора аппаратуры и подбора высокоселективных катализаторов.
- сокращение числа стадий производства. Например, замена двухстадийного процесса синтеза ацетальдегида из этилена через этанол одностадийным окислительным процессом.
- увеличение единичной мощности аппаратов и снижение за счет этого капитальных затрат. Например, в производстве метанола до 300 – 500 тыс. т/год.
- экономия энергии и повышение коэффициента полезного действия агрегатов, в частности за счет использования вторичных энергоресурсов и внедрения энерготехнологических схем.
Контрольные вопросы
- Производства каких продуктов относятся к основному органическому синтезу?
- Что является сырьем для производства основного органического синтеза?
Свойства и применение полимерных материалов
Полимерными материалами (ПМ) называются одно- или многокомпонентные системы, основу которых (матрицу) составляют высокомолекулярные соединения или полимеры. Состав ПМ весьма разнообразен и колеблется от почти индивидуальных полимеров до весьма сложных систем, включающих разнообразные компоненты, регулирующие технологические и эксплуатационные свойства материалов. К подобным компонентам относятся различные химически инертные или активные вещества: растворители, пластификаторы, загустители, красители, антипирены, антиоксиданты, термо- и светостабилизаторы, структуро- и порообразователи. Они получили название наполнителей. Поэтому большинство ПМ можно рассматривать как наполненные полимеры.
Для ПМ характерны широкие возможности регулирования состава, структуры и свойств, что не всегда может быть достигнуто в традиционных материалах (металлы, керамика, древесина). Поэтому, многовариантность свойств обусловливает весьма широкое и многообразное использование ПМ – от химических волокон и поропластов до твердого ракетного топлива.
Полимерные материалы классифицируют по области их использования и назначения, природе полимерной фазы, физическим и химическим превращениям, протекающим в ней при производстве и обработке.
По использованию и назначению ПМ делятся на:
- пластические массы (пластики) и композиты;
- эластомеры (каучуки и резины);
- химические волокна и пленки;
- полимерные покрытия, клей и герметики.
В соответствии с назначением среди них выделяют ПМ общего назначения и функциональные ПМ (фрикционные, тепло- и электроизоляционные, электропроводящие, антикоррозионные и т.п.).
По природе полимерной фазы (матрицы) ПМ делятся на:
- природные (натуральные);
- химические (искусственные и синтетические).
По характеру превращений, протекающих в полимерной фазе на стадиях производства и переработки в изделия, ПМ делятся на:
- термопластичные (под воздействием температур не меняют своих свойств);
- термореактивные ( при нагревании и охлаждении изменяют структуру, теряя способность плавиться и растворяться).
ПМ отличаются от традиционных материалов, используемых человечеством с глубокой древности, комплексом особых свойств, их сочетанием, эффективностью и высокой экономичностью методов переработки в изделия, практически неограниченной и стратегически неуязвимой сырьевой базой.
Особые свойства ПМ
- Малая плотность и, как следствие, высокий условный показатель прочности («весовая прочность») то есть отношение временного сопротивления на разрыв к плотности превышающий аналогичный показатель лучших сортов стали.
- Стойкость к агрессивным средам, атмосферному и радиационному воздействиям.
- Высокие радио- и электротехнические свойства, в том числе диэлектрические показатели, мало зависящие от температуры и частоты электрического поля.
- Широкий диапазон фрикционных и антифрикционных свойств.
- Специфические оптические свойства, способность пропускать лучи света в широком диапазоне волн, в том числе, ультрафиолетовые (70% для полиметилметакрилата против 1 – 3% для силикатного стекла).
- Многообразие физико-механических свойств (от жестких до упругих резиноподобных материалов) и сочетание в одном материале противоположных качеств, например, твердости и гибкости («бронированные» полимеры).
К недостаткам ПМ относятся:
- низкая теплостойкость (исключая фторопласты и кремнийорганические полимеры, она не превышает 1200С);
- недостаточная твердость (6 – 60 кг/мм2 по Бринеллю);
- ползучесть и релаксация напряжения;
- большое тепловое расширение;
- низкая теплопроводность, затрудняющая отвод тепла (в 500 – 600 раз ниже теплопроводности металлов).
Методы переработки ПМ в изделия
В отличие от переработки металлов и древесины, все методы переработки ПМ отличаются простотой, низкой энерго- и трудоемкостью, возможностью получить нужное состояние поверхности изделия без дополнительной обработки и практической безотходностью производства. Так, например, коэффициент использования материала при переработке ПМ достигает 0,95 – 0,98 в то время как при литье он составляет 0,6 – 0,8, а при механической обработке металлов всего 0,2 – 0,6. Поэтому, процессы изготовления изделий из ПМ являются наиболее экономичными.
Сырьевая база ПМ
ПМ производят из простых органических соединений – мономеров, источником которых являются широко распространенные и доступные виды сырья: ископаемые угли, нефть, газ, воздух и известь. Таким образом производство ПМ и изделий из них практически ограничено только уровнем развития химической и нефтехимической промышленности.
Перечисленные выше преимущества ПМ по сравнению с традиционными материалами обусловили все возрастающие масштабы и опережающий рост их производства по сравнению с производством металлов.
Так уже в период 70 – 90-х годов XX столетия производство ПМ увеличилось на 180%, тогда как производство стали выросло всего на 23%. Эта разница в темпах роста производства ПМ и металлов продолжает увеличиваться, что свидетельствует об определенной исчерпаемости потребления мировым народным хозяйством черных металлов и все возрастающей потребности его в ПМ. В результате, уже к 1975 г. в структуре общего потребления конструкционных материалов черные металлы составляли 63,7%, цветные металлы 6,3% и полимерные материалы около 30%.
Вследствие низкой себестоимости, экономии трудовых затрат при производстве готовой продукции и эффективности использования ее, потребителями ПМ стали практически все отрасли промышленности и народного хозяйства. Кним относятся:
- общее машиностроение (крупногабаритные элементы конструкций, трубы и детали арматуры, зубчатые колеса, ролики, подшипники, тормозные накладки, электроизоляционные детали и др.);
- авиастроение (силовые элементы летательных аппаратов, теплозащитные покрытия, подвесные топливные баки, элементы остекления, звуко- и теплопоглощающие панели, амортизаторы, шины, герметики швов, клеи и лакокрасочные материалы);
- автомобилестроение (кузова и кабины, тепло- и звукоизоляционные и декоративные детали, элементы двигателя и шасси, шланги и трубопроводы, наполнители сидений, детали остекления и осветительных приборов, шины, маслостойкие детали системы подачи топлива и тормозной системы, лакокрасочные материалы);
- электротехника и радиоэлектроника (изоляция электрических машин, аппаратов и кабельных изделий, в том числе, электродвигателей и генераторов, трансформаторов, коммуникационной аппаратуры, конденсаторы, магнитодиэлектрики, полупроводники, компаунды для заливки микросхем, клеи)
- железнодорожный транспорт (конструкционные элементы вагонов, фрикционные, уплотняющие и амортизационные детали, наполнители и облицовка сидений, прокладки для сцепления рельсов со шпалами, светофоры, изоляторы контактных сетей);
- судостроение (корпуса судов в целом и отдельные судовые конструкции, уплотнительные материалы для тепло-, звуко- и виброизоляции, прокладки, герметики, клеи, мастичные противоскользящие покрытия, лакокрасочные материалы);
- строительство (конструкционные элементы зданий, санитарно-техническое оборудование, стеновые панели и перегородки, кровельные материалы, покрытия полов, дверные и оконные переплеты, трубопроводы, тепло- и звукоизоляционные материалы);
- сельское и водное хозяйство (пленки и элементы конструкций для культивационных сооружений, материалы для мульчирования почвы, водорастворимые пленки для посева и дражирования семян, структурообразователи почв для защиты от коррозии и аккумуляции влаги, упаковочный материал, противофильтрационные экраны в мелиорации, водоснабжении, трубопроводы, облицовка каналов);
- пищевая промышленность (конструкционные материалы и покрытия пищевых машин, тароупаковочные материалы, консервные лаки и эмали, иониты для обработки молока);
- медицина (изделия медицинской техники, детали восстановительной хирургии из биоинертных и биоассимилируемых полимеров, функциональные узлы аппаратов искусственного кровообращения, вживляемые стимуляторы сердечной деятельности, крове- и плазмозаменители, пролонгаторы действия лекарственных препаратов и полимерные лекарственные вещества).
Потребление ПМ в различных отраслях народного хозяйства неравноценно. Наиболее эффективно использование ПМ в машиностроении, где 1 т ПМ заменяет 5 – 6 т черных и цветных металлов и 3 – 3,5 т древесины, а экономия трудовых затрат достигает 800 человеко-часов на 1 т ПМ. Наиболее высок удельный вес ПМ в электротехнике и электронике, потребляющих около 50% всех ПМ, используемых в машиностроении. В электротехнике с использованием ПМ производится 80%, а в приборостроении до 95% всей выпускаемой продукции
Внедрение ПМ не только положительно сказывается на состоянии уже существующих традиционных отраслей народного хозяйства. Оно вызвало также качественный скачок в развитии техники и технологии, определило технический прогресс в современном машиностроении, ракетной и атомной промышленности, в самолетостроении, телевидении, радиоэлектронике, восстановительной хирургии и медицине в целом и др.
Контрольные вопросы
- Какие системы относятся к группе полимерных материалов (ПМ) и на какие виды они подразделяются?
- Перечислите особые качества ПМ, обусловившие их широкое использование.
- Какими свойствами обладают полимеры, составляющие основу ПМ?
ПЛАСТМАССЫ
Пластическими массами (ПлМ) называют полимерные материалы, полимерная фаза которых находится в период формования изделия в вязкотекучем или высокоэластическом состоянии, а при эксплуатации в аморфном стеклообразном или кристаллическом состоянии. Таким образом, рабочим интервалом температур для ПлМ, в котором они используются как твердые конструкционные материалы, является ТхрТэкспТс, где Тхр температура хрупкости, при которой полимер разрушается под нагрузкой, не переходя в высокоэластическое состояние.
В основу классификации ПлМ положены их состав, отношение к нагреванию и природа полимерной фазы.
По составу ПлМ делятся на однофазные (гомогенные) и многофазные (гетерогенные, наполненные, композиционные). В гомогенных ПлМ полимер является основным компонентом, определяющим их свойства, остальные компоненты растворены в полимерной фазе. В гетерогенных ПлМ полимер представляет дисперсионную среду (связующее), а введенные в него наполнители составляют самостоятельные фазы. По природе наполнителя ПлМ делятся на ПлМ с твердым наполнителем и газонаполненные. Первые могут быть дисперснонаполненными, в которых наполнитель равномерно распределен в ПлМ, и армированными, в которых наполнителем служат волокна, ткань, бумага. Газонаполненные ПлМ делятся на пенопласты, в которых пузырьки газа изолированы друг от друга пленкой полимера, и поропласты, которые пронизаны каналами, соединяющими газовую фазу.
По отношению к нагреванию ПлМ подразделяются на термопластичные или термопласты, полимерная фаза которых при горячем формовании изделия не отверждается и ПлМ сохраняет способность переходить вновь в вязкотекучее состояние при повторном нагреве, и термореактивные или реактопласты, переработка которых в изделия сопровождается реакциями образования трехмерной структуры в полимерной фазе (отверждение полимера) и изделие необратимо теряет способность переходить в вязкотекучее состояние.
По природе полимера, составляющего полимерную фазу, ПлМ делятся на полимеризационные, к которым относятся полиэтилен, полипропилен, полистирол, полиакрилонитрил, полиметилметакрилат, политетрафторэтилен и поликонденсационные, из которых наиболее распространены феноло-альдегидные или фенопласты и анилино-альдегидные или аминопласты, и модифицированные на основе целлюлозы (целлулоид, этролы).
Единой терминологии ПлМ не существует. Одни и те же материалы выпускаются в разных странах под разными названиями, например, полиэтилен (РФ), алкатен (Англия), хифлекс (США), ротен (Япония).
Состав конкретных ПлМ зависит от их назначения и требуемых свойств и может меняться в широких пределах: от почти чистого полимера (полиэтилен, полипропилен) до систем, содержащих 50 и более процентов различных добавок. В общем случае в состав ПлМ входят следующие компоненты, каждый из которых выполняет определенную функцию.
- Полимеры (связующие, полимерная фаза), создающие основу материала.
- Наполнители, обеспечивающие нужные механические свойства, прочность и повышающие экономичность производства.
- Пластификаторы.
- Стабилизаторы, повышающие стойкость к действию высоких температур, кислорода воздуха, фото- и радиационному воздействиям (антиоксиданты, антирады, светостабилизаторы) и уменьшающие способность ПлМ к старению.
- Антипирены, понижающие горючесть ПлМ (инертные и химически активные, вступающие в реакцию с полимером).
- Красители.
- Отвердители, создающие трехмерную сшитую структуру полимера.
- Порофоры ( порообразователи, вспенивающие вещества), разлагающиеся при нагревании и вводимые в композиции для получения газонаполненных пластических масс.
- Смазывающие вещества, предотвращающие прилипание материала к оборудованию в процессе переработки и изготовления изделия.
Основную массу производимых ПлМ составляют полиолефины, полистирол, поливинилхлорид, фенолальдегидные и карбамидные полимеры. Они составляют около 85% от всего производства пластических масс.
В РФ пластические массы производятся на специализированных предприятиях в Волгограде, Владимире, Екатеринбурге, Казани, Кемерове, Москве, Новосибирске, Орехово-Зуеве, Нижнем Тагиле, С.-Петербурге, Тюмени, Уфе.
Контрольные вопросы
- Какие ПМ называются пластическими массами (ПлМ)?
- По каким признакам классифицируются ПлМ?
- Какие наполнители могут входить в состав ПлМ и какова их роль?
- К какому типу ПлМ относятся полиэтилен? полистирол? Фенолформальдегидные полимерные материалы?
ХИМИЧЕСКИЕ ВОЛОКНА
Волокнами называют материалы, частицы которых представляют гибкие и прочные тела с длиной многократно превышающей размеры поперечного сечения, пригодные для изготовления пряжи и текстильных изделий. По происхождению волокна делятся на природные (натуральные) и химические.
К природным волокнам относят:
- волокна растительного происхождения, основу которых составляет целлюлоза, формирующаяся в процессе развития растений на поверхности семян (хлопок), в стеблях (лен, пенька, джут, кенаф, рами), в листьях (сизаль, манильская пенька) и в оболочках плодов (койр из орехов кокоса);
- волокна животного происхождения, состоящие из белка: кератина (шерсть различных животных) и фиброина и серицина (выделения гусениц тутового и других шелкопрядов);
- волокна минерального происхождения (асбест).
Химическими волокнами (ХВ) называются волокна, формируемые из органических природных или синтетических полимеров. По природе исходного полимера они делятся на:
- искусственные ХВ, получаемые в результате полимераналогичных превращений полимера, при которых он сохраняет свою полимерную природу:
