В. В. Курилкин основы химической технологии и лесопереработки конспект
| Вид материала | Конспект |
- Рабочая программа по дисциплине Ф. 13 «Системный анализ процессов химической технологии», 148.25kb.
- Основные вопросы рабочей программы по химической технологии, 282.59kb.
- Конспект лекций по курсу «Введение в специальность» направление, 941.35kb.
- М. В. Ломоносова Кафедра экономики и организации производства И. А. Назарова Основы, 599.04kb.
- Рабочая программа дисциплины компьютерные моделирующие системы в химической технологии, 239.63kb.
- Аннотации программ дисциплин Аннотация дисциплины, 62.94kb.
- Рабочая программа дисциплины инновационное развитие химической технологии модуль, 388.84kb.
- Московская государственная академия тонкой химической технологии им. М. В. Ломоносова, 319.7kb.
- Рабочая программа дисциплины системный анализ процессов химической технологии направление, 349.07kb.
- Физико-химические основы разделения биазеотропных смесей 05. 17. 04 Технология органических, 285.92kb.
ПРОИЗВОДСТВО КАЛИЙНЫХ УДОБРЕНИЙ
Общая характеристика
Калийные минеральные удобрения представляют собой природные или синтетические соли и содержат питательный элемент в форме иона К+. В зависимости от природы аниона калийные удобрения подразделяются на хлоридные (содержащие анион Cl-) и бесхлоридные.
К калийным удобрениям хлоридного типа относят природные минералы (каинит, сильвинит), продукты промышленной переработки минералов (хлорид калия), смешанные калийные соли, полученные смешением природных минералов с хлоридом калия, электролитные растворы (побочный продукт электролиза карналлита). К бесхлоридным калийным удобрениям относятся сульфат калия и калимагнезия (двойная соль сульфата калия и сульфата магния).
Все калийные удобрения растворимы в воде. Их выпускают в кристаллическом и гранулированном виде. Содержание питательного элемента в них (в пересчете на K2O) колеблется от 10% в природных минералах до 60% в концентрированном удобрении – хлориде калия.
 |
Из приведенных данных видно, что в настоящее время основным калийным удобрением, обеспечивающим свыше 95% потребностей сельского хозяйства, является хлорид калия. Природные низкоконцентрированные минералы (каинит, сильвинит) без предварительной переработки в настоящее время не используются.
Хлорид калия представляет собой твердое кристаллическое вещество с температурой плавления 7680С. Это безбалластное удобрение содержит 63,1% калия в пересчете на K2O. Растворимость в воде составляет 0,219 мас. долей при 00С, 0,265 мас. долей при 250С и 0,359 мас. долей при 1000С. Кристаллический хлорид калия способен слеживаться. Для уменьшения слеживаемости его обрабатывают раствором солянокислых солей высокомолекулярных аминов.
Сырьем для производства хлорида калия служит почти исключительно природный минерал сильвинит – смесь сильвина KCl и галита NaCl с содержанием калия 22 – 25% считая на K2O. Значительно реже хлорид калия получают из карналлита KCl MgCl2 6H2O, содержащего около 17% K2O. Потенциальным источником для производства калийных удобрений может стать Мировой океан, в водах которого концентрация калия достигает 0,07%, что в пересчете на K2O составляет 7 1014 тонн.
Существуют два метода производства хлорида калия из сильвинита: флотационный и галургический (избирательное растворение с раздельной кристаллизацией). В настоящее время флотационным методом вырабатывают около 80% всего хлорида калия. В зависимости от метода производства хлорид калия выпускают в виде продукта марки «К» (получаемый кристаллизацией из растворов) и продукта марки «Ф» (получаемый флотационным обогащением калийных руд).
Флотационный способ производства
Флотационный способ выделения хлорида калия из сильвинита основан на флотогравитационном разделении водорастворимых минералов калийной руды в среде насыщенного ими солевого раствора. Это достигается селективной гидрофобизацией поверхности частиц калийных минералов с помощью флотореагентов – собирателей.
Технологические схемы флотационного производства хлорида калия зависят от минерального и гранулометрического состава флотируемого сильвинита: содержания в нем примесей (глинистых шламов), размеров зерен компонентов и различаются методами обработки глинистых шламов. В общем случае флотационный метод выделения хлорида калия из сильвинита включает следующие операции:
- Измельчение сильвинитовой руды до размеров частиц 1 – 3 мм с последующим мокрым размолом до размера 0,5 мм.
- Отделение глинистого шлама – тонкодисперсных глинисто-карбонатных примесей методами флотации, гидравлической классификации, или гравитации.
- Флотационное разделение водорастворимых минералов руды (сильвина и галита) в присутствии собирателей (основная флотация).
- Перечистная флотация полученного концентрата для удаления из него оставшихся примесей.
- Обезвоживание концентрата методами сгущения и фильтрования с возвратом в процесс оборотного раствора.
- Сушка влажного концентрата.
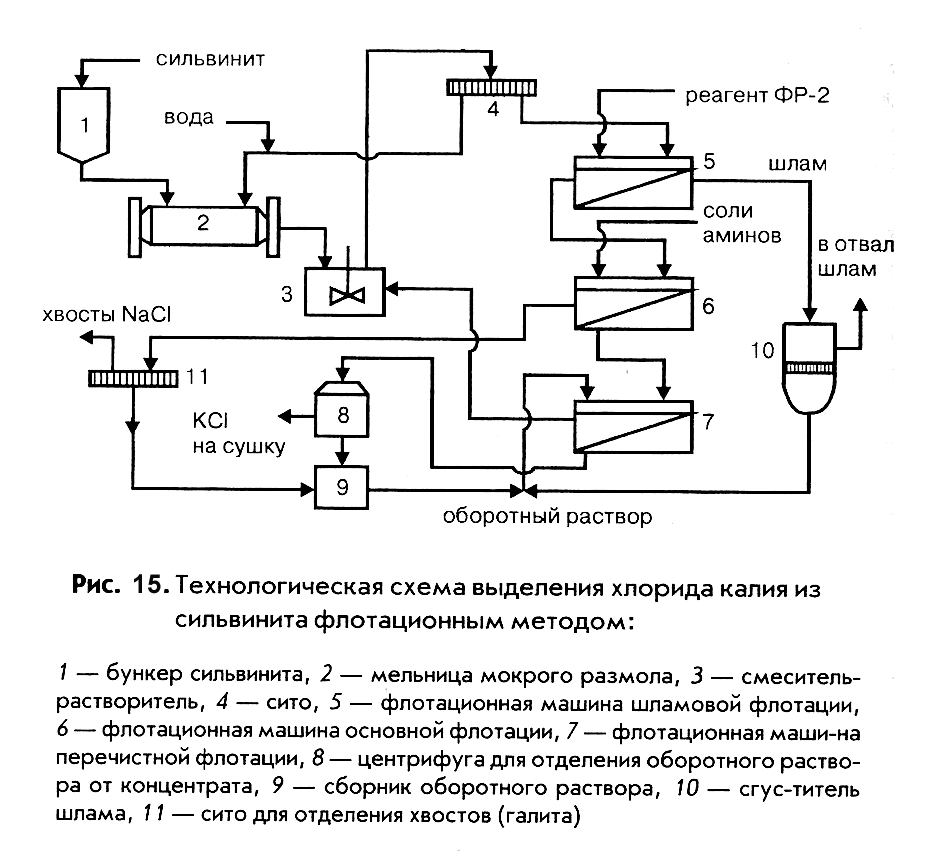 |
На рис. 15 представлена технологическая схема выделения хлорида калия из сильвинита с предварительной флотацией глинистого шлама, применяемая для переработки руд с невысоким (менее 2,5%) содержанием нерастворимого остатка. Для руд с более высоким содержанием его используются схемы с предварительным механическим обесшламиванием или с отделением шлама путем введения депрессора – карбоксиметилцеллюлозы, способствующего отделению шлама на стадии основной флотации.
Флотационный метод эффективен при извлечении хлорида калия из высококачественных сильвинитовых руд, содержащих незначительное количество шлама. Степень извлечения хлорида калия достигает 0,90 – 0,92 дол. ед., а готовый продукт (концентрат) содержит 93 – 95% соли. Степень извлечения может быть повышена, если в технологической схеме предусмотрена перечистная флотация отделяемого глинистого шлама для извлечения из него хлорида калия.
Галургический способ производства
Галургический способ выделения хлорида калия из сильвинита или метод избирательного растворения и раздельной кристаллизации основан на различии температурных коэффициентов растворимости хлоридов калия и натрия при их совместном присутствии, то есть в системе «KCl – NaCl – H2O». В растворах, насыщенных обеими солями, при повышении температуры от 20 – 250С до 90 – 1000С содержание хлорида калия возрастает примерно в два раза, а хлорида натрия несколько уменьшается.
При охлаждении такого горячего раствора он становится пересыщенным относительно хлорида калия, который будет кристаллизоваться, а хлорид натрия останется в растворе. При последующем нагревании этого раствора он останется насыщенным относительно хлорида натрия и становится ненасыщенным относительно хлорида калия
Поэтому при обработке подобным раствором нового количества сильвинита из него будет извлекаться только хлорид калия, переходя в раствор, а хлорид натрия растворяться не будет. Это свойство системы «KCl – NaCl – H2O» и используется в галургическом методе извлечения хлорида калия из сильвинитовых руд для организации циклического процесса.
Процесс галургического извлечения хлорида калия из сильвинита включает шесть основных стадий.
- Измельчение сильвинитовой руды.
- Выщелачивание хлорида калия из сильвинита горячим оборотным раствором (щелоком).
- Отделение горячего щелока от твердой фазы (хлорида натрия и пустой породы) и его осветление.
- Охлаждение раствора и кристаллизация из него хлорида калия.
- Сушка хлорида калия.
- Нагревание оборотного раствора и возвращение его на стадию выщелачивания сильвинита.
Технологическая схема этого процесса представлена на рис. 16.
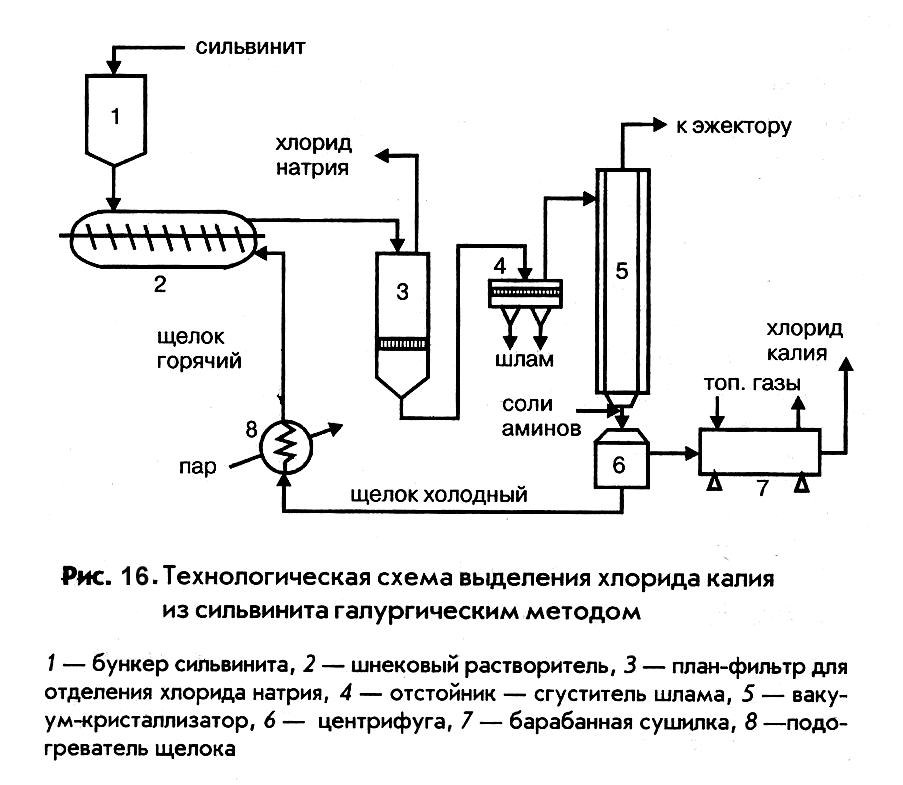 |
Контрольные вопросы
- Какие методы используются для выделения хлорида калия из сильвинита?
- В какой среде и почему проводятся процессы размола и флотации калийного сырья (сильвинита)?
- На чем основан галургический метод выделения хлорида калия из сильвинита?
- В чем преимущество и недостатки галургического метода выделения хлорида калия перед флотационным?
ПРОИЗВОДСТВО АЗОТНЫХ УДОБРЕНИЙ
Общая характеристика
Азотные удобрения могут содержать азот в форме свободного аммиака и аминов (аммиакаты), ионов NH4+ и NO3-, аминогруппы NH2, а также в их сочетании. В соответствии с этим различают следующие виды азотных удобрений: аммиачные, аммонийные, нитратные, амидные и аммонийнонитратные.
Все азотные удобрения водорастворимы, азот из них хорошо усваивается растениями, особенно из аниона NO3-, который отличается высокой подвижностью в почве. По агрегатному состоянию азотные удобрения делятся на твердые (соли и карбамид) и жидкие (аммиак, аммиачная вода и аммиакаты, представляющие собой растворы твердых удобрений). В табл. 8 приведены характеристики важнейших азотных удобрений и удельный вес их в общем балансе производства.
 |
Ниже рассматривается технология производства наиболее распространенных азотных удобрений – нитрата аммония и карбамида, на долю которых приходится свыше 60% общего выпуска азотных удобрений.
Производство нитрата аммония
Свойства нитрата аммония
Нитрат аммония (аммонийная селитра) NH4NO3 – кристаллическое вещество с температурой плавления 169,60С, хорошо растворимое в воде. Растворимость при 200С равна 0,625 мас. долей, при 1600С – 0,992 мас. долей. Нитрат аммония сильно гигроскопичен и легко поглощает влагу из атмосферы, в зависимости от температуры может существовать в пяти кристаллических модификациях, различающихся плотностью и структурой кристаллов. Вследствие высокой растворимости в воде, гигроскопичности и полиморфных превращений, сопровождающихся выделением тепла, нитрат аммония легко слеживается. Для уменьшения слеживаемости, которая затрудняет использование продукта, в промышленности используют следующие меры:
- перед складированием полученный продукт охлаждают до температуры ниже 320С, так как именно в интервале от 32,30С до – 170С нитрат аммония находится в стабильной ромбической модификации;
- выпускают товарный продукт в гранулированном виде, обрабатывая поверхность гранул ПАВ, образующими на них гидрофобную пленку;
- вводят в состав продукта кондиционирующие добавки в виде нитрата магния и других солей, которые связывают свободную воду и препятствуют переходу одной модификации в другую.
Нитрат аммония в твердом состоянии или в виде высококонцентрированного раствора (плава) при нагревании выше 180 – 2000С разлагается:
NH4NO3 = N2O + 2H2O + 36,8 кДж.
При быстром нагревании в замкнутом пространстве до 400 – 5000С или инициировании нитрат аммония разлагается со взрывом по уравнению:
NH4NO3 = N2 + 2H2O + 0,5O2 + 118 кДж.
Разложение ускоряется в присутствии минеральных кислот и органических веществ. На этом основано использование нитрата аммония в качестве компонента аммонийноселитряных взрывчатых веществ – аммонитов (смеси с органическими веществами), аммотолов (смеси с взрывчатыми веществами) и аммоналов (смеси, содержащие алюминий).
Нитрат аммония является безбалластным азотным удобрением и содержит 34,8% азота, из них 17,4% в аммиачной (NH4+) и 17,4% в нитратной (NO3-) форме. Поэтому, стоимость транспортировки содержащегося в нем азота значительно ниже, чем при перевозке других балластных удобрений (например, сульфата аммония).
Технологические схемы производства
Технологический процесс производства нитрата аммония состоит из следующих основных стадий: нейтрализации азотной кислоты газообразным аммиаком, выпаривания раствора нитрата аммония, кристаллизации и гранулирования плава, охлаждения, классификации и опудривания готового продукта
В настоящее время, в связи с освоением производства 58 – 60%-ной азотной кислоты, основная масса нитрата аммония производится на установках АС-67, АС-72 и АС-72М, мощностью 1360 и 1575 т/сутки с упариванием в одну ступень, а также на установках безупарочного типа (рис. 17).
Газообразный аммиак из подогревателя 1, обогреваемого конденсатом сокового пара, нагретый до 120 – 1600С и азотная кислота из подогревателя 2, обогреваемого соковым паром, при 80 – 900С поступают в аппарат ИТН (с использованием теплоты нейтрализации) 3. Для уменьшения потерь аммиака вместе с паром реакцию ведут в избытке кислоты. Раствор нитрата аммония из аппарата ИТН нейтрализуется в донейтрализаторе 4 аммиаком, куда одновременно добавляется кондиционирующая добавка нитрата магния и поступает на упаривание в выпарной аппарат 5. Из него образовавшийся плав нитрата аммония через гидрозатвор-донейтрализатор 6 и сборник плава 7 направляется в напорный бак 8 и из него с помощью виброакустических грануляторов 9 поступает в грануляционную башню 10. В нижнюю часть башни засасывается атмосферный воздух и подается воздух из аппарата для охлаждения гранул «КС» 12. Образовавшиеся гранулы нитрата аммония из нижней части башни поступают на транспортер 11 и в аппарат кипящего слоя 12 для охлаждения гранул, в который через подогреватель 13 подается сухой воздух. Из аппарата 12 готовый продукт направляется на упаковку. Воздух из верхней части башни 10 поступает в скрубберы 14, орошаемые 20%-ным раствором нитрата аммония, где отмывается от пыли нитрата аммония и выбрасывается в атмосферу. В этих же скрубберах очищаются от непрореагировавшего аммиака и азотной кислоты газы, выходящие из выпарного аппарата и нейтрализатора. Аппарат ИТН, грануляционная башня и комбинированный выпарной аппарат – основные аппараты в технологической схеме АС-72М.
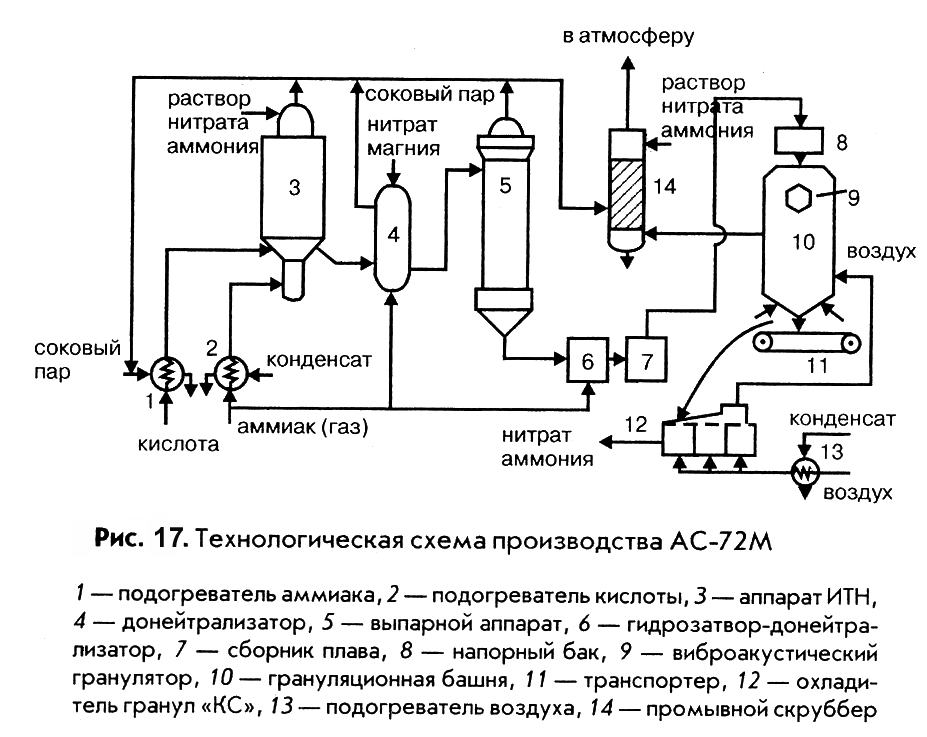 |
В этих условиях на стадии нейтрализации образуется парожидкостная эмульсия, после разделения которой получают плав концентрацией 98,5%, что позволяет исключить отдельную стадию упаривания раствора.
Производство карбамида
Свойства карбамида
Карбамид (мочевина) – диамид угольной или амид карбаминовой кислот CO(NH2)2. Карбамид представляет твердое кристаллическое вещество с температурой плавления 132,70С. Хорошо растворим в воде, этаноле и жидком аммиаке, что используется для получения аммиакатов. При нагревании выше 1300С подвергается термической диссоциации с образованием биурета и выделением аммиака. Водные растворы карбамида устойчивы до 800С, при более высокой температуре разлагаются через образование карбоната аммония на аммиак и оксид углерода (IV). Это исключает возможность длительного нагревания растворов карбамида при атмосферном давлении, например, в процессе выпаривания.
Карбамид – безбалластное высококонцентрированное МУ. Он легко усваивается растениями. Содержание азота в нем в амидной форме составляет 46,6%. По сравнению с нитратом аммония карбамид более богат азотом, меньше слеживается, не взрывоопасен в смесях с органическими веществами и медленнее вымывается из почвы.
