Вопрос Катализаторы как инструмент экологической безопасности переработки горючих ископаемых (безотходные технологии, экологическое топливо, переработка отходов)
| Вид материала | Документы |
- Актуальные вопросы рециклинга, переработки отходов и чистых технологий, 141.62kb.
- Безотходные технологические процессы и охрана окружающей среды в химической технологии, 340.8kb.
- Программа дисциплины по кафедре «Строительные и дорожные машины» Обогащение полезных, 211.66kb.
- Vii переработка химических продуктов термической переработки твердых горючих ископаемых, 256.07kb.
- Экологическое право гусейнов, 16.05kb.
- Программа спецкурса «Геология каустобиолитов» Для специальностей «геология», «геохимия»,, 110.58kb.
- Рабочая программа по дисциплине ен. В. 02. 02 «Малоотходные и безотходные технологии, 151.8kb.
- Положение Об организации утилизации и переработки бытовых и промышленных отходов, 89.39kb.
- Рекомендации межрегионального семинара-совещания и выставки «Оборудование и технологии, 126.8kb.
- 1 отделение профилактической медицины, 432.97kb.
Вопрос 1. Катализаторы как инструмент экологической безопасности переработки горючих ископаемых (безотходные технологии, экологическое топливо, переработка отходов)
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется.
Безотходные технологии.
Безотходная технология - технология, подразумевающая наиболее рациональное использование природных ресурсов и энергии в производстве, обеспечивающее защиту окружающей среды.
Безотходная технология - принцип организации производства вообще, подразумевающий использование сырья и энергии в замкнутом цикле. Замкнутый цикл означает цепочку первичное сырьё - производство - потребление - вторичное сырьё.
Экологическое топливо.
В современных автомашинах присутствует каталитический преобразователь или автомобильный катализатор. Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
В каталитических преобразователях существуют два различных типа катализаторов: восстанавливающий катализатор и окислительный катализатор. Оба типа состоят из керамической структуры, покрытой металлическим катализатором (обычно это платина, родий и/или палладий). Идея заключается в том, чтобы создать структуру, которая подставляет под поток выхлопных газов максимальную площадь катализатора и свести к минимуму задействованное при этом количество самого катализатора, так как используемые материалы весьма дороги. В некоторых преобразователях даже стали использовать золото с примесью более традиционных катализаторов. Золото дешевле по сравнению с остальными катализаторами, и может повысить степень окисления на 40 процентов, что необходимо для снижения количества вредных газов
Большинство современных выхлопных систем в автомобилях оснащены тремя каталитическими преобразователями, по одному для каждого из веществ, выброс которых необходимо уменьшить.
Восстанавливающий катализатор - первый этап каталитического преобразователя. Он использует платину и родий чтобы уменьшить выбросы NOx. Когда молекула NO или NO2 встречается с молекулами катализатора, от нее отделяется атом азота, высвобождая кислород - O2. Атом азота же связывается с другим атомом азота, образуя N2.
Окислительный катализатор - второй этап каталитического преобразователя. Он снижает количество несгоревшего топлива и окиси углерода в результате их сжигания (окисления) с помощью таких катализаторов, как платина и палладий. Этот катализатор также помогает СО вступить в реакцию с несгоревшим кислородом, образуя углекислый газ СО2.
Переработка отходов.
Перерабо́тка (другие термины: вторичная переработка, рециклинг отходов (англ. recycling), рециклирование и утилизация отходов) — повторное использование или возвращение в оборот отходов производства или мусора. Наиболее распространена вторичная, третичная и т. д. переработка в том или ином масштабе таких материалов, как стекло, бумага, алюминий, асфальт, железо, ткани и различные виды пластика. Также с глубокой древности используются в сельском хозяйстве органические сельскохозяйственные и бытовые отходы.
ТЕХНОЛОГИИ ПЕРЕРАБОТКИ ТВЁРДЫХ БЫТОВЫХ ОТХОДОВ.
В настоящее время в мировой практике реализовано более десятка технологий переработки твердых бытовых и промышленных отходов (ТБПО). Наиболее распространенными среди них являются термические способы. Анализ этих технологий показал, что они обладают рядом недостатков, основным из которых является неудовлетворительная экологическая чистота. Она связывается в последние годы главным образом с отходами, содержащими хлорорганические вещества и (или) выделяющие другие высокотоксичные органические соединения (фураны, диоксины и тп.). Диоксинообразующими компонентами ТБПО являются такие материалы как картон, газеты, пластмассы, изделия из поливинилхлорида и т.п.
Технологии по сжиганию отходов в топках с псевдосжиженным слоем и в циркулирующем псевдоожиженном слое не решают проблему утилизации и обезвреживания твёрдых остатков - шлака, и особенно летучей золы.
Сжигание ТБПО по технологии "Пиролиз и высокотемпературное сжигание" сложно аппаратурно как на стадий пиролиза и сжигания отходов, так и на стадии газоочистки.
Технология переработки отходов в печи Ванюкова при всей сложности системы газоочистки малоэффективна в смысле осаждения аэрозолей, а, следовательно, и образования диоксинов, т.е. не гарантирует необходимую экологическую обработку. Плавильная печь капиталоемкая и сложна в эксплуатации.
Из сказанного видно, что основополагающим при переработке ТБПО является проблема образования диоксидов.
Есть основание предполагать, что при обычном способе сжигания мусора в газовом тракте снова образуются токсичные соединения (диоксины, полиароматические углеводороды (ПАУ) и т.д.), где главную функцию синтеза и транспортировки выполняют аэрозоли сажи:
а) образование синтезгаза С + Н2О = СО + Н2;
б) гетерогенный каталитический синтез органических соединений на поверхности аэрозолей сажи;
в) сорбция продуктов синтеза на поверхности сажи.
СО + Н2 + НС1 = ПАУ, диоксины и т.д.
2. Катализ, тория и классификация. Типы катализаторов.
КАТАЛИЗ, ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Катализ может быть положительным (когда скорость реакции увеличивается) и отрицательным (когда скорость реакции уменьшается). Для обозначения отрицательного катализа часто используют термин ингибирование. Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой. Биологические катализаторы (ферментами), участвуют в регуляции биохимических процессов. Без катализаторов не могли бы протекать многие промышленные процессы.
Важнейшее свойство катализаторов – селективность, т.е. способность увеличивать скорость лишь определенных химических реакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условиях слишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образование нужных продуктов.
Теории катализа. Для объяснения механизма каталитических реакций были предложены три группы теорий: геометрические, электронные и химическая. В геометрических теориях основное внимание обращено на соответствие между геометрической конфигурацией атомов активных центров катализатора и атомов той части реагирующих молекул, которая ответственна за связывание с катализатором. Электронные теории исходят из представления, что хемосорбция обусловливается электронным взаимодействием, связанным с переносом заряда, т.е. эти теории связывают каталитическую активность с электронными свойствами катализатора. Химическая теория рассматривает катализатор как химическое соединение с характерными свойствами, которое образует химические связи с реагентами, в результате чего формируется нестабильный переходный комплекс. После распада комплекса с высвобождением продуктов катализатор возвращается в исходное состояние. Последняя теория считается сейчас наиболее адекватной.
ТИПЫ КАТАЛИЗАТОРОВ Катализаторы классифицируют исходя из природы реакции, которую они ускоряют, их химического состава или физических свойств. Каталитическими свойствами обладают в той или иной степени практически все химические элементы и вещества – сами по себе или, чаще, в различных сочетаниях. По своим физическим свойствам катализаторы делятся на гомогенные и гетерогенные. Гетерогенные катализаторы – это твердые вещества, гомогенные диспергированы в той же газовой или жидкой среде, что и реагирующие вещества.
Группы катализаторов:
1.Металлы (массивные, чистые, сплавы, скелетные, нанесенные) - гетерогенные катализаторы.(Fe, Ni, Co, Pt, Pd)
2. Твердые бинарные соединения металлов МmЭn, где Э - О, S, Se, Te, As, P, C, N, Si, B, гетерогенные катализаторы. Из этой группы чаще всего используются оксиды или халькогениды металлов полупроводникового типа. ( MgO, ZnO, Fe2O3, Cr2O3, WO3, MoO3, V2O5, Al2O3и др. )
3. Кислоты и основания (гом и гет кат) - протонные кислоты Бренстеда (НА) в водных и неводных средах, апротонные кислоты Льюиса - Усановича (BF3, AlCl3, TiCl4, RI), протонные и апротонные центры твердых оксидов (оксиды алюминия, алюмосиликаты), любые типы оснований (в том числе твердые - МgO, CaCO3, ионообменные смолы). На них реакции кислотно-основного катализа, а именно крекинг нефтяных фракций (на алюмосиликатах и цеолитах), дегидратация и гидратация, синтез аминов из спиртов (на Al2O3), этерификация спиртов и кислот, конденсация альдегидов и кетонов. 4) Комплексы металлов, включая соли (гом и гет). 5) Ферменты (гом, гет).
Гетерогенные катализаторы обладают большой поверхностью, пронизанной многочисленными порами. Во многих случаях оксиды с большой площадью поверхности служат подложкой, на которой в виде небольших кластеров осаждаются частички металлического катализатора. Это обеспечивает эффективное взаимодействие реагентов в газовой или жидкой фазе с каталитически активным металлом. Особый класс гетерогенных катализаторов составляют цеолиты – кристаллические минералы группы алюмосиликатов. Гетерогенные катализаторы обычно имеют небольшое число активных центров, на долю которых приходится малая часть суммарной поверхности. Катализаторы могут утрачивать свою активность в присутствии каталитических ядов. Эти вещества связываются с активными центрами, блокируя их. Определение структуры активных центров является предметом интенсивных исследований.
3. Приготовление катализаторов.
Требования к промышленным катализаторам: 1) стойкость к ядам (S, N2); 2) стойкость к перегревам и недогревам; 3) механическая прочность; 4) срок службы должен быть не менее месяца, лучше — несколько лет. Катализаторы из метанола работают до 5 лет. В процессе приготовление нужно обеспечить высокую активную поверхность
Типы катализаторов по методам приготовления:1) осажденные; 2) пропиточные; 3) сплавленные.
1.Для катализаторов с развитой удельной поверхностью наибольшее распространение получил метод осаждения (процесс образования твердой фазы в результате химической реакции при сливании растворов исходных компонентов. Переход растворенного вещества в осадок — совокупность двух процессов: образования актив центров твердой фазы и роста кристаллов или укрупнения гёлеобразных частиц при одновременном их осаждении) из водных растворов солей с последующим прокаливанием образующихся соединений (многие оксиды металлов). При этом предпочтительно использование водного NH3, поскольку отпадает необходимость отмывки осадка от щелочных металлов. При увеличении рН среды образуется гидроксид, содержащий примеси основных солей. Для большинства гидроксидов металлов размер частиц после осаждения составляет 4-5 нм. В дальнейшем более растворимые гидроксиды могут подвергаться рекристаллизации с образованием укрупненных частиц размером 10-103 нм. Для получения смешанных оксидных катализаторов применяют методы осаждения из смеси различных солей, например, осаждение нерастворимых СоМоО4 из растворов молибдата аммония и нитрата кобальта
2.Металлические (реже оксидные) катализаторы готовят обычно(пропиточные катализаторы) нанесением активного компонента на носитель. При проведении реакций в кинетической области выгодно равномерное распределение катализаторы по всему объему пористой гранулы носителя, во внутреннедиффузионной области - распределение активного компонента вблизи наружной поверхности гранулы. Выбранный носитель (Al2О3, силикагель и т.д.) пропитывают раствором, содержащим необходимые компоненты катализаторы, подвергают сушке и нагреванию. Для равномерного распределения активного компонента на носителе применяют спец. режимы сушки.
3. Сплавные катализаторы готовятся путем сплавления нескольких каталитически активных металлов с алюминием или кремнием, роль которых сводится к приданию определенной структуры катализатору. Сплав обрабатывается едкой щелочью, которая растворяет и вымывает алюминий и кремний. В результате образуется сильно пористая масса губчатого вида. Это и есть активный сплавной, или скелетный, катализатор.
Формирование катализатора: коагуляция в капле, экструзия, таблетирование, вмазывание пасты, гранулирование, сушка в распылительной сушилке, размол материала. Формовку материала коагуляцией в капле и сушкой в распылительной сушилке широко используют при изготовлении осажденных катализаторов. Наиболее универсальными методами являются экструзия пасты и таблетирование.
Цилиндрические гранулы получают выдавливанием (экструзией) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики. Последние могут быть закатаны в сферические гранулы в специальных грануляторах.
Таблетирование проводят под давлением до 30 МПа, получают гранулы в виде цилиндров, колец, седел, звездочек и т. д. В качестве связующих материалов используют тальк, графит, жидкое стекло, некоторые органические кислоты и другие вещества. Вмазывание пасты в отверстия перфорированной стальной пластины возможно для гранулирования осадков различной природы и консистенции. Размер получаемых гранул определяется толщиной пластины и диаметром отверстий. После подсушки гранулы выбивают из пластины специальным штампом либо выдавливают сжатым воздухом.
Распылительная сушка, заключающаяся в быстром обезвоживании суспензии катализаторы вследствие разности парциальных давлений паров жидкости в окружающей среде и на поверхности движущихся капель высушиваемого катализаторы Таким методом получают однородные частицы сферической формы с размерами порядка 100 мкм, например, в производстве алюмосиликатных катализаторы.
Размол монолитных катализаторов осуществляют на дробилках и фракцию отделяют на виброситах или в барабанных сепараторах. При этом частицы имеют неправильную форму, наблюдается большое количество отходов в виде мелочи и пыли, но интервал получаемых размеров зерна может быть очень широк.
4. Каталитичесике реактора
Цель работы реактора – обеспечить благоприятный режим работы катализатора.
2 типа реакторов:
- реакторы идеального вытеснения (аппараты, в которых движение
реагентов носит поршеневой характер, то есть каждый предыдущий объем,
проходящий через аппарат, не смешивается с последующим, так как вытесняется им.)
- реакторы идеального смешения (аппараты, в которых потоки
реагентов мгновенно и равномерно перемешиваются во всем реакционном объеме).
Каталитические реакторы могут быть с неподвижным, движущимся и псевдоожиженным слоем катализатора.
Адиабатический реактор представляет собой металлический цилиндр, в нижней части которого находится решетка, на которую насыпается катализатор в виде различного типа гранул: таблеток, шариков, зёрен неправильной формы и т. д. Газовую реакционную смесь можно направлять в аппарат как сверху вниз, так и снизу вверх. Стенки цилиндра теплоизолированы.
Самый простой тип каталитических реакторов. Катализатору там некомфортно. Преимущество: простота.
Эта конструкция используется в настоящее время, в основном, при создании экологически чистых технологий для каталитической очистки выходных газов от окислов азота и серы, сероводорода, органических веществ и т. д., а также при разработке малотоннажных процессов.
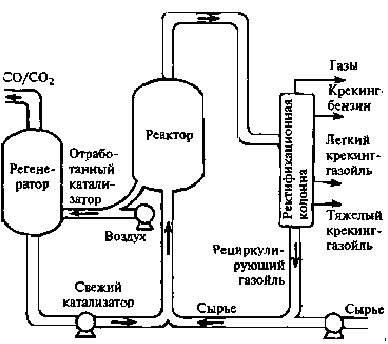
Реакторы с кипящим слоем катализатора. Микросферический катализатор витает в потоке паров сырья. По мере закоксовывания частицы катализатора тяжелеют и падают вниз. Далее катализатор выводится на регенерацию, которая проходит также в кипящем слое, а продукты идут на разделение. Типовые установки - 1А/1М, 43-103. Реакторы кипящего слоя применяют в промышленности для крекинга нефтепродуктов на алюмосиликатном катализаторе. Эти реакторы являются самыми крупными аппаратами с кипящим слоем катализатора.
И
 зотермические реактора выдерживают все тепло равномерно. Примерами изотермич реакоров являются трубчатый реактор, пластинчатый
зотермические реактора выдерживают все тепло равномерно. Примерами изотермич реакоров являются трубчатый реактор, пластинчатыйТрубчатый реактор заполняется твердым катализатором и через него пропускается поток газа или жидкости. Такой реактор подходит для реакций, протекающих с большой скоростью. Реактор может быть изготовлен в варианте с нисходящим или восходящим потоком. В нем может быть более 2 тыс трубочек, чем они тоньше, тем изотермичнее реактор. Дорого.
И-исходные в-ва; П- продукты р-ции; Т - теплоноситель; К – катализатор.
Пластинчатый:
Реактора с радиальным движением, — лучшее распределение газосырьевого потока по сечению аппарата, меньшее гидравлическое сопротивление потоку при прохождении через слой катализатора, при проектировании новых и реконструкции действующих установок в основном используют реакторы с радиальным вводом сырья. При этом реакторы с радиальным движением потока применяются главным образом в парогазовых процессах. Если в газосырьевом потоке имеется жидкая фаза, то это может привести к накапливанию в реакторе жидкости и нарушению режима его работы. Газосырьевая смесь проходит через слой катализатора в радиальном направлении, т.е. от периферии к центру. Такое конструктивное решение позволяет в несколько раз снизить потери давления в потоке. Но, как было показано выше, реактор с радиальным вводом желательно использовать только в том случае, когда сырье находится либо в жидком, либо в парогазовом состоянии.
Суспензионный.
5 Цеолиты, строение, классификация, получение.
Цеолиты резко повлияли на защиту ОС(уменьшение парниковых газов), повышение производительности, качество продукции, создание экологически чистого моторного топлива, появились биологически разлагаемые детергенты(стиральные порошки) и упаковочные материалы, на переработку отходов, глубину переработки нефти, возможность переработки газа и альтернативных топлив(коряво)).
Цеолиты — алюмосиликаты с кристаллической решеткой и открытыми полостями, занятыми ионами металлов и водой. Эти ионы и вода имеют подвижность, позволяющую осуществить катионный обмен и дегидратацию.
Впервые были синтезированны в 1938 году, в 1954 началось промышленное производство и использование в качестве осушителей (они впитывают воду до 26% от своего веса), 1962 — осуществленна денормализация (намеренное изменение структуры)
Кристаллическая структура цеолитов природных и искусственных образована тетраэдрическими группами SiO2/4 и AlO2/4, объединёнными общими вершинами в трёхмерный каркас, пронизанный полостями и каналами (окнами) размером 2-15 Ангстерм. Открытая каркасно-полостная структура цеолитов [AlSi]O4- имеет отрицательный заряд, компенсирующийся противоионами (катионами металлов, аммония, алкиламмония и др. ионов, введённых по механизму ионного обмена) и легко дегидратирующимися молекулами воды.
По структурно-химической классификации цеолиты относятся к каркасным алюмосиликатам щелочных и щелочно-земельных элементов.
По происхождению природные цеолиты — гидротермальные, экзогенные, реже метаморфические минералы.
Искусственно синтезированные цеолиты (пермутиты) находят широкое применение в водоочистительных приборах, как адсорбенты, ионообменники, молекулярные сита; применяют в качестве доноров и акцепторов электронов. Также цеолиты получили весьма широкое применение как катализаторы многих процессов нефтехимии и нефтепереработки и как гетерогенных катализаторов. Широко используются в аналитической химии в качестве цеолит-модифицированных электродов; для обнаружения газов; для разделительных и концентрационных методов.
Наиболее распространённые представители группы цеолитов: садалиты, шабазиты, мордениты, натролиты, гейландиты.
Возможности получения цеолитов с заданной структурой и составом определяются температурой, составом алюмосиликатных систем и особенно природой щелочного компонента. В ряде случаев результаты синтеза зависят также и от состояния исходных реагентов используемых при синтезе. Если синтез цеолитов осуществляется путем нагревания щелочных силикаалюмогелей, предварительно полученных смешением растворов силикатов и алюминатов, то при выбранной температуре природа кристаллизующихся цеолитов и состав кристаллов зависят только от состава гелей. (картинка с получением у меня)
6. Применение цеолитов для процессов осушки, очистки и денормализации углеводородов.
Синтетические цеолиты - наиболее дорогие адсорбенты, но их использование на установке осушки существенно снижает эксплуатационные расходы
Уникальная структура синтетических цеолитов наряду с осушкой газа позволяет извлечь тяжелые углеводороды. Цеолиты более устойчивы к воздействию низких температур, чем силикагель. Опыт эксплуатации адсорбентов в условиях северных месторождений, а также лабораторные исследования показывают, что при многократных воздействиях низких температур силикагель растрескивается: обводненный силикагель разрушается на 15-20%, а регенерированный - на 5-7%; цеолит же в этих условиях визуально не изменяется и не снижает своих эксплуатационных свойств.В зависимости от удельного количества извлекаемых компонентов, глубины осушки газа, характеристики применяемого оборудования и свойства адсорбентов на практике могут реализоваться схемы 3-х и 2-х адсорберных установок осушки газа.
Особенности цеолита как осушителя: работают при малых давлениях; высокая сорбционная емкость по воде про высоких температурах.
При адсорбционной очистке из нефтепродуктов удаляются непредельные углеводороды, смолы, кислоты и др., а также полициклические ароматические и нафтеноароматические углеводороды. Адсорбционную очистку осуществляют при контактировании нагретого продукта с тонкодисперсными адсорбентами(контактная очистка) или фильтрацией продукта через зёрна адсорбента. Избирательная адсорбция при помощи молекулярных сит (цеолитов) позволяет выделить нормальные парафины из лёгких бензиновых и керосино-газойлевых фракций.
С помощью цеолитов также можно очищать этилен от пропилена и ацетилена (чистота 99.9%! очищать тяжело, процесс идет при ниpких температурах — 70). Очистка газов от СО2 (применяются цеолиты с большим типом окна — фажазиты) и от серного ангидрида, вызывающего кислотные дожди.
Денормализация углеводородов (своими словами) намеренное изменение структуры при пропускании через реактор с использовнием цеолитов. Были обычные С6-С10, а стали iС6-С10 — готовым высокоотановым бензином. Потому что мохнатые, чем мохнатее строение углеводорода, тем выше октан(ингибировани взрыва).
