Вопрос Катализаторы как инструмент экологической безопасности переработки горючих ископаемых (безотходные технологии, экологическое топливо, переработка отходов)
| Вид материала | Документы |
Содержание7. цеолитные катализаторы Алкилирование изопарафинов олефинами на цеолитных катализаторах Физико-химические основы процесса. 8. Приро́дный газ 10.Синтез фишера-тропша 11. Получение спиртов и олефинов из синтез-газа. Синтол – процесс оксосинтез. Синтезы из оксида углерода и водорода Синтез углеводородов из со и h2 Синтез углеводородов из метанола Синтез спиртов из со и н2. получение метанола. Процесс оксосинтеза 12. Метанол: производство, особенности аппаратуры, катализаторы. Метанол как заменитель нефти при производстве продуктов нефтехи Производство и аппаратура. 13. Диметиловый эфир – как экологически чистое моторное топливо. Получение и применение. Катализаторы и оборудование. 1) CH3OH + HOCH3 → CH3OCH3 + H2O (в качестве катализаторов Al2O3, алюмосиликаты (степень превращения 14. Формальдегид из метанола. Оборудование и применение. Диметоксиметан как экологически чистое моторное топливо. 15. Высокооктановый бензин и экологически чистые добавки (эфиры) из метанола. 16. Получение этилена и пропилена из метанола. Программа МТО (метанол в олефины). Экологические преимущества процесса перед гидр Нефтяного сырья 17. Получение водорода. Водород как экологически чистое топливо. Топливные элементы ... 3 7. цеолитные катализаторы,-гетерогенные многофазные катализаторы на основе цеолитов; один из видов катализаторов процессов нефтепереработки. Представляют собой кристаллич. цеолиты, включенные в матрицу. Цеолиты, входящие в состав цеолитсодержащих катализаторов, имеют вид каркаса, построенного из бесконечной одно-, двух- или трехмерной сетки тетраэдров SiO4 и А1О4, связанных общими атомами О, и пронизанного полостями и каналами. Матрица цеолитсодержащего катализатора может состоять из А12О3, SiO2, глины или аморфного алюмосиликата (иногда из смеси этих в-в); в ней распределен и закреплен кристаллический цеолит. При протекании реакции диспропорционирования парафиновых углеводородов на морденитсодержащих цеолитных катализаторах в продуктах реакции не обнаруживаются углеводороды с молекулярной массой выше исходного, так как имеет место реакция их гидрокрекинга Процессы изомеризации пеитан-гексановых фракций. Существующие в настоящее время промышленные процессы изомеризации пентан-гекса-новых фракций осуществляются на алюмоплатиновых катализаторах высокотемпературной и низкотемпературной изомеризации, а также на цеолитных катализаторах. Процессы изомеризации пентан-гексановых фракций на цеолитных катализаторах. Среди процессов, в которых применяются цеолитные катализаторы для изомеризации пентан-гексановых фракций, промышленное применение получили процесс хайзомер фирмы Shell и созданный на его основе комбинированный процесс полной изомеризации фирмы Union Carbide. Конденсация ксилолов и метанола на цеолитных катализаторах : Результаты конденсации ксилолов, тулуола и метанола на цеолитных катализаторах. Изучение реакции конденсации метилнафталшюв и метанола на цеолитных катализаторах Таким образом, при взаимодействии сс-метил, р-метилнафталинов и метанола на цеолитных катализаторах с ионообменными катионами калия и рубидия, как и в случае толуола, метилирование протекает в боковую цепь с образованием соответствующих винил- и этилнафталинов, что не удается осуществить ни на одном из известных катализаторов . АЛКИЛИРОВАНИЕ ИЗОПАРАФИНОВ ОЛЕФИНАМИ НА ЦЕОЛИТНЫХ КАТАЛИЗАТОРАХ Подтверждением предположения могут служить результаты для других реакций карбоний-ионного типа. Например, олефины способствуют ускорению крекинга w-алканов на цеолитных катализаторах, лишь будучи взятыми в определенных, «пороговых» концентрациях . Если учесть независимо протекаютуя обратимую реакцию изомеризации бутена-1 в бутен-2, то можно допустить ч го в определенный момент времени концентрация бу-тена в определенной зоне слоя катализатора может быть ниже, чем в последующей. Обладая высокой алкилирующей способностью в начальный период протекания реакции, катализатор постепенно утрачивает ее, проявляя лишь изомеризующую и впоследствии димеризую-щую или полимеризующую активность. При этом правильнее, безусловно, говорить о том, что изначально катализатор способен инициировать указанные процессы, однако постепенно его алкилирующая функция ослабляется с сохранением сначала изомеризующсй, а затем — только полимеризующей функций. Последние две функции не обнаружены нами сразу только по причине высоких разбавлений бутена-1 изобутаном . Реализованные условия препятствуют заметному контакту бутена с поверхностью катализатора, благодаря чему процессы изомеризации и димеризации бутена протекают лишь в незначительных масштабах. КАТАЛИТИЧЕСКИЙ РЕФОРМИНГ, каталитич. переработка бензиновых фракций (в осн. прямогонных) под давлением Н2 с целью получения высокооктановых автомобильных бензинов, ароматич. углеводородов (бензола, толуола, ксилолов и др.) и водородсодержащего газа. Каталитический реформинг-один из важнейших процессов нефтеперерабатывающей и нефтехим. пром-сти. Физико-химические основы процесса. Каталитический реформинг осуществляют в реакторах с неподвижным или движущимся слоем катализатора. В первом случае процесс проводят под давлением 1,5-4 МПа, что обеспечивает достаточную продолжительность работы катализатора без регенерации. Во втором случае (давление ок. 1 МПа) катализатор непрерывно выводят из реакторов и подвергают регенерации в отдельном аппарате. Несмотря на разницу в технол. оформлении и катализаторах, общий характер превращений углеводородов в обоих случаях одинаковый, различаются только скорости отдельных р-ций. Осн. процессы каталитического реформинга приводят к образованию ароматич. и изопарафиновых углеводородов. Ароматич. углеводороды получают в результате дегидрирования 6-членных и дегидроизомеризации алкилированных 5-членных нафтеновых углеводородов, а также дегидроциклизации парафиновых углеводородов. Изопарафиновые углеводороды образуются гл. обр. при изомеризации и гидрокрекинге более высокомол. парафиновых углеводородов. Одновременно происходят побочные р-ции - гидрирование и полимеризация непредельных углеводородов, деалкилирование и конденсация ароматич. углеводородов, способствующие отложению кокса на пов-сти катализатора. При каталитическом реформинге нафтеновые углеводороды на 90-95% превращ. в ароматические; степень конверсии парафиновых углеводородов зависит от давления (табл. 1). С повышением общего давления и одновременно парциального давления Н2 снижается выход ароматич. углеводородов и интенсифицируется разложение парафинов; кроме того, уменьшается кок-сообразование и увеличивается продолжительность работы катализатора без регенерации КАТАЛИТИЧЕСКИЙ КРЕКИНГ, термокаталитич. переработка нефтяного сырья с целью получения продуктов меньшей мол. массы - компонентов высокооктановых бензинов, легкого газойля, углеводородных газов С3-С4 и др. Каталитический крекинг - один из важнейших процессов, обеспечивающих глубокую переработку нефти. Осн. достоинство процесса -большая эксплуатац. гибкость: возможность перерабатывать практически любые нефтяные фракции в высококачеств. продукты; сравнительная легкость совмещения с др. процессами, напр., с алкилированием, гидрокрекингом, гидроочисткой, адсорбц. очисткой, деасфальтизацией и т. д. Такой универсальностью объясняется весьма значит. доля каталитического крекинга в общем объеме переработки нефти, напр., в 1984 в США - более 30%, в Зап. Европе - 10%. 8. Приро́дный газ — смесь газов, образовавшаяся в недрах земли при анаэробном разложении органических веществ. Природный газ относится к полезным ископаемым. Природный газ в пластовых условиях (условиях залегания в земных недрах) находится в газообразном состоянии — в виде отдельных скоплений (газовые залежи) или в виде газовой шапки нефтегазовых месторождений, либо в растворённом состоянии в нефти или воде. При нормальных условиях (101,325 кПа и 20 °С) природный газ находится только в газообразном состоянии. Основную часть природного газа составляет метан (CH4) — до 98 %. В состав природного газа могут также входить более тяжёлые углеводороды — гомологи метана: этан (C2H6),пропан (C3H8),бутан (C4H10), а также другие неуглеводородные вещества: водород (H2),сероводород (H2S),диоксид углерода (СО2),азот (N2),гелий (Не). Чистый природный газ не имеет цвета и запаха. Чтобы можно было определить утечку по запаху, в газ добавляют небольшое количество веществ, имеющих сильный неприятный запах (т. н. одорантов). Чаще всего в качестве одоранта применяется этилмеркаптан. Для облегчения транспортировки и хранения природного газа его сжижают, охлаждая при повышенном давлении. Природный газ находится в земле на глубине от 1000 метров до нескольких километров. Сверхглубокой скважиной недалеко от города Новый Уренгой получен приток газа с глубины более 6000 метров. В недрах газ находится в микроскопических пустотах (порах). Поры соединены между собой микроскопическими каналами — трещинами, по этим каналам газ поступает из пор с высоким давлением в поры с более низким давлением до тех пор, пока не окажется в скважине. Движение газа в пласте подчиняется определённым законам. Газ добывают из недр земли с помощью скважин. Скважины стараются разместить равномерно по всей территории месторождения. Это делается для равномерного падения пластового давления в залежи. Иначе возможны перетоки газа между областями месторождения, а также преждевременное обводнение залежи. Газ подготавливают по различным схемам. Согласно одной из них, в непосредственной близости от месторождения сооружается установка комплексной подготовки газа (УКПГ), на которой производится очистка и осушка газа в абсорбционных колоннах. Такая схема реализована на Уренгойском месторождении. Если газ содержит в большом количестве гелий либо сероводород, то газ обрабатывают на газоперерабатывающем заводе, где выделяют гелий и серу В настоящее время основным видом транспорта является трубопроводный. Газ под давлением 75 атмосфер прокачивается по трубам диаметром до 1,4 метра. По мере продвижения газа по трубопроводу он теряет кинетическую энергию, преодолевая силы трения как между газом и стенкой трубы, так и между слоями газа, которая рассеивается в виде тепла. Поэтому через определённые промежутки необходимо сооружать компрессорные станции (КС), на которых газ дожимается до 75 атм и охлаждается. Сооружение и обслуживание трубопровода весьма дорогостоящи, но тем не менее — это наиболее дешёвый с точки зрения начальных вложений и организации способ транспортировки газа на небольшие и средние расстояния. Кроме трубопроводного транспорта широко используют специальные танкеры — газовозы. Это специальные суда, на которых газ перевозится в сжиженном состоянии в специализированных изотермических емкостях при температуре -150 -160 градусов Цельсия. При этом степень сжатия достигает 600 раз в зависимости от потребностей. Таким образом, для транспортировки газа этим способом, необходимо протянуть газопровод от месторождения до ближайшего морского побережья, построить на берегу терминал, который значительно дешевле обычного порта, для сжижения газа и закачки его на танкеры, и сами танкеры. Обычная вместимость современных танкеров составляет порядка от 150.000 до 250.000 м³. Такой метод транспортировки является значительно более экономичным, чем трубопроводный, начиная с расстояний до потребителя сжиженного газа более 2000–3000 км, так как основную стоимость составляет не транспортировка, а погрузочно - разгрузочные работы, но требует более высоких начальных вложений в инфраструктуру, чем трубопроводный. К его достоинствам относится так же тот факт, что сжиженный газ куда более безопасен при перевозке и хранении, чем сжатый. В экологическом отношении природный газ является самым чистым видом минерального топлива. При сгорании его образуется значительно меньшее количество вредных веществ по сравнению с другими видами топлива. Однако сжигание человечеством огромного количества различных видов топлива, в том числе природного газа, за последние полвека привело к некоторому незначительному увеличению содержания углекислого газа в атмосфере, который является парниковым газом. Некоторые ученые на этом основании делают вывод об опасности возникновения парникового эффекта и как следствие — резкого потепления климата. В связи с этим в 1997 г. некоторыми странами был подписан Киотский протокол по ограничению парникового эффекта. По состоянию на 26 марта 2009 Протокол был ратифицирован 181 страной мира (на эти страны совокупно приходится более чем 61 % общемировых выбросов). Протокол является первым успешным рыночным механизмом по уменьшению выбросов парниковых газов в атмосферу. Следующим шагом было внедрение в действие с весны 2004 года негласной альтернативной глобальной программы ускоренного преодоления последствий техноэкологического кризиса. Основой программы стало установление адекватного ценообразования на энергоносители по их топливной калорийности. Цена определяется исходя из стоимости получаемых энергий на конечном потреблении из единицы измерения энергоносителя. С августа 2004 года по август 2007 года было рекомендовано и поддерживалось регуляторами соотношение $0,10 за киловаттчас (средняя стоимость нефти $68 за баррель). С августа 2007 года была произведена ревальвация соотношения до $0,15 за киловаттчас 9. Синтез-газ Синтез-газ — смесь монооксида углерода и водорода. В промышленности получают паровой конверсией метана, парциальным окислением метана, газификацией угля. В зависимости от способа получения соотношение CO:Н2 варьируется от 1:1 до 1:3. В зависимости от применяемого сырья и вида конверсии (водяным паром или нестехиометрическим количеством О2) соотношение компонентов в газовой смеси изменяется в широких пределах: СН4 + Н2О : СО + 3Н2 Паровая конверсия СН4 + ½O2 : СО + 2Н2- парциальное окисление —СН2—+ Н2О:СО + 2Н2 —СН2—+ ½O2 :СО + Н2 Это соотношение определяется также методом и условиями газификации углей. По наиболее распространенному методу Лурги получают сырой газ след, состава: 15-18% СО, 38-40% Н2, 9-11% СН4, 30-32% СО2; с повышением температуры увеличивается доля СО, с возрастанием давления - Н2 и СН4. Примесями могут быть инертные газы (N2 и др.) и Н2S, если сырье содержало серу. Синтез-газ очищают от Н2S и СО2 селективными растворителями; соотношение между СО и Н2 регулируют, если необходимо, конверсией оксида углерода водяным паром. Синтез-газ получают также наряду с целевым продуктом ацетиленом при окислительном пиролизе природного газа. В азотной промышленности синтез-газ называют смесь N2 и Н2, применяемую в синтезе аммиака. Катализаторы-металлы 8-й группы, температура 700*С Первым способом получения синтез-газа была газификация каменного угля, которая была осуществлена еще в 30-е годы XIX века в Англии с целью получения горючих газов: водорода, метана, монооксида углерода. Этот процесс широко использовался во многих странах до середины 50-х годов XX века, а затем был вытеснен методами, основанными на использовании природного газа и нефти. Однако в связи с сокращением нефтяных ресурсов значение процесса газификации снова стало возрастать. В настоящее время существуют три основных промышленных метода получения синтез-газа. 1. Газификация угля. Процесс основан на взаимодействии угля с водяным паром: C + H2O = H2 + CO. Эта реакция является эндотермической, равновесие сдвигается вправо при температурах 900-1000ºС. Разработаны технологические процессы, использующие парокислородное дутье, при котором наряду с упомянутой реакцией протекает экзотермическая реакция сгорания угля, обеспечивающая нужный тепловой баланс: C + 1/2O2 = CO. 2. Конверсия метана. Реакция взаимодействия метана с водяным паром проводится в присутствии никелевых катализаторов (Ni-Al2O3) при повышенных температурах (800-900ºС) и давлении: CH4 + H2O = CO + 3H2. В качестве сырья вместо метана может быть использовано любое углеводородное сырье. 3. Парциальное окисление углеводородов. Процесс заключается в неполном термическом окислении углеводородов при температурах выше 1300ºС: CnH2n+2 + 1/2nO2 = nCO + (n + 1)H2. Способ применим к любому углеводородному сырью, но наиболее часто в промышленности используют высококипящую фракцию нефти - мазут. 10.СИНТЕЗ ФИШЕРА-ТРОПША Синтез Фишера-Тропша может рассматриваться как реакция восстановительной олигомеризации монооксида углерода, при которой образуются углерод-углеродные связи, и в общем виде она представляет собой сложную комбинацию ряда гетерогенных реакций, которую можно представить суммарными уравнениями: nCO + 2nH2 = (CH2)n + nH2O, 2nCO + nH2 = (CH2)n + nCO2 . Продуктами реакции являются алканы, алкены и кислородсодержащие соединения, то есть образуется сложная смесь продуктов, характерная для реакции полимеризации. Первичными продуктами синтеза Фишера-Тропша являются a- и b-олефины, которые превращаются в алканы в результате последующего гидрирования. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются на распределении продуктов. Так, при использовании железных катализаторов велика доля олефинов, тогда как в случае кобальтовых катализаторов, обладающих гидрирующей активностью, преимущественно образуются насыщенные углеводороды. В настоящее время в качестве катализаторов синтеза Фишера-Тропша в зависимости от поставленных задач (повышение выхода бензиновой фракции, увеличение выхода низших олефинов и др.) используются как высокодисперсные железные катализаторы, нанесенные на оксиды алюминия, кремния и магния, так и биметаллические катализаторы: железо-марганцевые, железо-молибденовые ,металлы VIII группы: наиболее активен Ru, затем Co, Fe, Ni. Для увеличения поверхности их часто наносят на пористые носители, так силикагель и глинозём. В промышленности нашли применение только Fe и Co. Рутений слишком дорог, кроме того, его запасы на Земле слишком малы для использования в качестве катализатора в многотоннажных процессах. На никелевых катализаторах при атмосферном давлении образуется в основном метан (n=1), при повышении же давления никель образует летучий карбонил и вымывается из реактора. Побочными реакциями синтеза углеводородов из СО и Н2 являются: -гидрирование оксида углерода до метана: СО + 3Н2 → СН4 + Н2О + 214 кДж/моль -реакция Белла – Будуара (диспропорционирование СО): 2СО → СО2 + С -равновесие водяного газа: СО + Н2О ↔ СО2 + Н2 Термодинамические закономерности для продуктов синтеза ФТ таковы: Возможно образование из СО и H2 углеводородов любой молекулярной массы, вида и строения кроме ацетилена. Вероятность образования углеводородов уменьшается в ряду: метан > другие алканы > алкены. Вероятность образования нормальных алканов уменьшается, а нормальных алкенов повышается с увеличением длины цепи. Повышение общего давления в системе способствует образованию более тяжелых продуктов, а увеличение парциального давления водорода в синтез-газе благоприятствует образованию алканов. В настоящее время две компании коммерчески используют свои технологии, основанные на процессе Фишера – Тропша. Shell в Бинтулу, Малайзия, использует природный газ в качестве сырья и производит, преимущественно, малосернистое дизельное топливо. Процесс Фишера – Тропша — это хорошо проработанная технология, уже применённая в больших масштабах, хотя её распространению мешают высокие капитальные затраты, высокие затраты на эксплуатацию и ремонт и относительно низкие цены на сырую нефть. В частности, использование природного газа как исходного сырья становится целесообразным, когда используется «stranded gas», то есть источники природного газа находящиеся далеко от основных городов, которые нецелесообразно эксплуатировать с обычными газопроводами и технологией LNG. {картинка только так влезает} 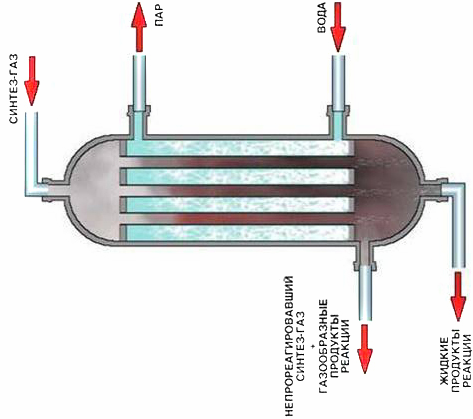 11. Получение спиртов и олефинов из синтез-газа. Синтол – процесс оксосинтез. Органический синтез на основе оксида углерода получил за последние десятилетия очень большое промышленное развитие. Главное практическое применение получили следующие процессы: 1) синтезы из оксида углерода и водорода, применяемые для получения алифатических углеводородов и спиртов (процессы Фишера–Тропша); 2) процессы оксосинтеза, или гидроформилирования олефинов, ведущие к образованию альдегидов и из них — первичных спиртов; 3) синтез карбоновых кислот и их производных (сложных эфиров, ангидридов и др.). Масштабы производств на основе оксида углерода очень значительны: около 35 млн. т/г метанола, около 10 млн. т/г продуктов оксосинтеза — спиртов и альдегидов, более 50% всей уксусной кислоты (общий объем производства более 5 млн. т) и существенная доля уксусного ангидрида (общий объем производства более 1,2 млн. т). В настоящее время производство синтез–газа, CO и продуктов на их основе базируется на природном газе и нефти, СИНТЕЗЫ ИЗ ОКСИДА УГЛЕРОДА И ВОДОРОДА Каталитические превращения СО и Н2 очень многообразны, но из них можно выделить два наиболее важных: синтез углеводородов, в том числе топлива, и получение спиртов, особенно метанола. СИНТЕЗ УГЛЕВОДОРОДОВ ИЗ СО И H2 Одной из хорошо известных реакций СО и Н2 является образование метана прикатализе металлическим никелем при 200—250°С под давлением: 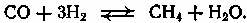 (метанирование) (метанирование)В 20-х годах XX в. Э. Фишер и Г. Тропш обнаружили, что из смеси СО и Н2 при добавлении к металлическим катализаторам щелочей и высоком давлении (10–15 МПа) образуется смесь кислородсодержащих соединений, а при понижении давления до 3 МПа получаются главным образом углеводороды. В последнем случае получаемые продукты состоят из парафинов и олефинов, большей частью линейного строения и с концевым положением двойной связи, а также из некоторого количества кислородсодержащих соединений, в основном спиртов и карбонильных соединений. С кобальтом, обладающим гидрирующей активностью, реакция идет с выделением воды и преимущественным образованием парафинов, а с железом — с образованием диоксида углерода и высоким содержанием олефинов в продуктах: 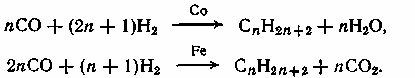 (восстановительная олигомеризация у.в вроде это и есть Синтол)) По фракционному составу углеводороды представляют собой смесь низших гомологов (С3–С4), бензина, дизельного топлива, мягкого и твердого парафина. Групповым и фракционным составом продуктов можно управлять, изменяя температуру, давление и катализаторы. В частности, синтез можно направить на преимущественное образование углеводородов изостроения, обладающих более высоким октановым числом, линейных α-олефинов и т. д. До 1945 г. синтез моторного топлива по методу Фишера и Тропша на основе угольного сырья получил значительное развитие в Германии (смесь углеводородов — когазин (от Kohle–Gas–Benzin), а ее бензиновая фракция — синтин (синтетический бензин)). Позднее, с развитием нефтехимии, интерес к этим процессам резко снизился, но в последние годы вновь возрастает. Сейчас наиболее масштабно углеводородное топливо из угля производят в ЮАР — более 5 млн. т/год на заводах фирмы “Sasol”. Новые заводы пока в основном строятся в странах, не имеющих своего нефтяного сырья, — в Австралии, Новой Зеландии, Японии и др. СИНТЕЗ УГЛЕВОДОРОДОВ ИЗ МЕТАНОЛА Синтез углеводородов можно осуществить не только из СО и Н2, но _______и из метанола (фирма “Mobil”) и/или диметилового эфира (ДМЭ) при катализе цеолитами: 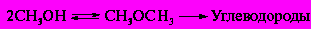 Жидкие углеводороды в получаемом продукте содержат не более 11 атомов С, т. е. соответствуют бензиновой фракции. Полученный бензин содержит значительное количество ароматических углеводородов, имеет о. ч. 92–95, что существенно лучше, чем у бензина, получаемого по классическому методу Фишера–Тропша. В газе находятся низшие олефины и парафины. Варьируя условия, можно получать больше этилена или пропилена с бутенами СИНТЕЗ СПИРТОВ ИЗ СО И Н2. ПОЛУЧЕНИЕ МЕТАНОЛА. При высоком давлении процесс Фишера–Тропша приводит к образованию смеси кислородсодержащих соединений — спиртов, альдегидов, кетонов, карбоновых кислот и сложных эфиров (синтол). Процесс можно направить в сторону образования высших или низших спиртов (например, изобутанола). Однако наибольшее значение из всех этих процессов получил синтез метанола. Метанол — один из основных продуктов многотоннажной химии, широко ис- пользуется для получения множества ценных химических веществ: формальдегида, МТБЭ, уксусной кислоты, метилметакрилата, диметилтерефталата, растворителей, аминов и др. Раньше метанол получали сухой перегонкой древесины (древесный спирт), но этот метод полностью вытеснен синтезом из оксида углерода и водорода. Синтез метанола из СО и Н2 был впервые разработан Патаром в 1924 г., применившим в качестве катализатора ZnO. Затем оксид цинка стали активировать оксидом хрома, а в настоящее время используют Zn–Cu–Cr–O–катализаторы. Образование метанола из оксида углерода и водорода протекает по обратимой высоко экзотермической реакции 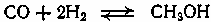 Кроме метанола, в заметных количествах образуются ДМЭ (за счет дегидратации метанола), метан (как продукт гидрирования метанола и СО), диоксид углерода и вода: 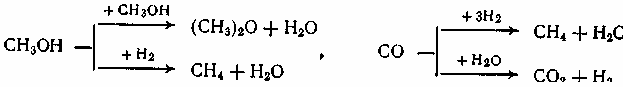 причем ДМЭ в последние годы не считается побочным продуктом. Другие спирты также можно получать на основе СО и Н2. Так, по реакции гомологизации метанола образуется этанол: 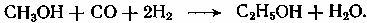 ПРОЦЕСС ОКСОСИНТЕЗА Synthoi синтол — процесс синтеза углеводородов и кислородсодержащих продуктов из окиси углерода и водорода ( а ваще это для качков херь) Реакция взаимодействия олефинов и синтез-газа с образованием альдегидов: 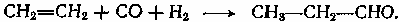 была открыта О. Рёленом в 1938 г. При этом происходит присоединение формильной группы —СНО и водорода по двойной связи, поэтому эту реакцию называют гидроформилированием. Технологии, основанные на этой реакции, помимо стадии гидроформилирования, обязательно включают дореакционную стадию получения катализатора, послереакционную стадию удаления катализатора из продуктовой массы, часто — стадию гидрирования альдегидов, а также стадию выделения продуктов. Совокупность всех этих стадий называют процессом оксосинтеза. Очень часто понятия гидроформилирования и оксосинтеза отождествляют. Так как практическое значение имеют преимущественно н-альдегиды и первичные спирты линейного строения, очень важным является соотношение оксопродуктов нормального и изостроения. На кобальткарбонильных катализаторах отношение н-:изо- составляет (3,5÷4):1, на модифицированных кобальтовых достигает (8÷10):1, на родиевых — даже (15÷25):1. При этом модифицированные Co–катализаторы обладают сильным гидрирующим действием, поэтому уже на стадии гидроформилирования выход спиртов составляет более 80 %. При гидроформилировании на Co–карбонильных катализаторах 80 %, а на Rh–катализаторах более 95 % продуктов составляют альдегиды. 12. Метанол: производство, особенности аппаратуры, катализаторы. Метанол как заменитель нефти при производстве продуктов нефтехимии. Метанол важнейший по значению и масштабам производства органический продукт, выпускаемым хим. промышленностью. Впервые метанол был найден в древесном спирте в 1661 г., но лишь в 1834 г. был выделен из продуктов сухой перегонки древесины Думасом и Пелиготом. В это же время была установлена его химическая формула. Способы получения метилового спирта могут быть различны: сухая перегонка древесины, термическое разложение формиатов, гидрирование метилформиата, омыление метилхлорида, каталитическое неполное окисление метана, каталитическое гидрирование окиси и двуокиси углерода(так получают сейчас). Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом: :CO + 2 H2 → CH3OH Производство и аппаратура. Основным аппаратом в синтезе метанола служит реактор — контактный аппарат, конструкция которого зависит, главным образом, от способа отвода тепла и принципа осуществления процесса синтеза. В современных технологических схемах используются реакторы трех типов: — трубчатые реакторы, в которых катализатор размещен в трубах, через которые проходит реакционная масса, охлаждаемая водным конденсатом, кипящим в межтрубном пространстве; — адиабатические реакторы, с несколькими слоями катализатора, в которых съем тепла и регулирование температуры обеспечивается подачей холодного газа между слоями катализатора; —реакторы, для синтеза в трехфазной системе, в которых тепло отводится за счет циркуляции жидкости через котел-утилизатор или с помощью встроенных в реактор теплообменников. 1) схема производства метанола при низком давлении на цинк-медь-алюминиевом катализаторе из синтез-газа состава: H2 — 67%, СО — 22%, С02 — 9% -объемных, полученного конверсией метана, производительностью 400 тыс. т в год.Очищенный от сернистых соединений синтез-газ сжимаетсяв компрессоре 1 до давления 5—9 МПа, охлаждается в холодильнике 3 и поступает в сепаратор 4 для отделения сконденсировавшейся воды. Пройдя сепаратор, синтез-газ смешивается с циркуляционным газом, который поджимается до рабочего давления в компрессоре 2. Газовая смесь проходит через адсорбер 5, где очищается от пентакарбонила железа, образовавшегося при взаимодействии оксида углерода (II) с материалом аппаратуры, и разделяется на два потока. Один поток подогревают в теплообменнике 8 и подают в верхнюю часть реактора 6, а другой поток вводят в реактор между слоями катализатора для отвода тепла и регулирования температуры процесса. Пройдя реактор, реакционная смесь при температуре около 300°С также делится на два потока. Один поток поступает в теплообменник 8, где подогревает исходный синтез-газ, другой поток проходит через котел-утилизатор 9, вырабатывающий пар высокого давления. Затем,потоки объединяются, охлаждаются в холодильнике 7 и поступают в сепаратор высокого давления 10, в котором от циркуляционного газа отделяется спиртовой конденсат. Циркуляционный газ дожимается в компрессоре 2 и возвращается на синтез. Конденсат метанола-сырца дросселируется в дросселе 11 до давления близкого к атмосферному и через сборник 12 поступает на ректификацию. В ректификационной колонне 13 от метанола отгоняются газы и. диметиловый эфир, которые также сжигаются. Полученный товарный метанол с выходом 95% имеет чистоту 99,95%. 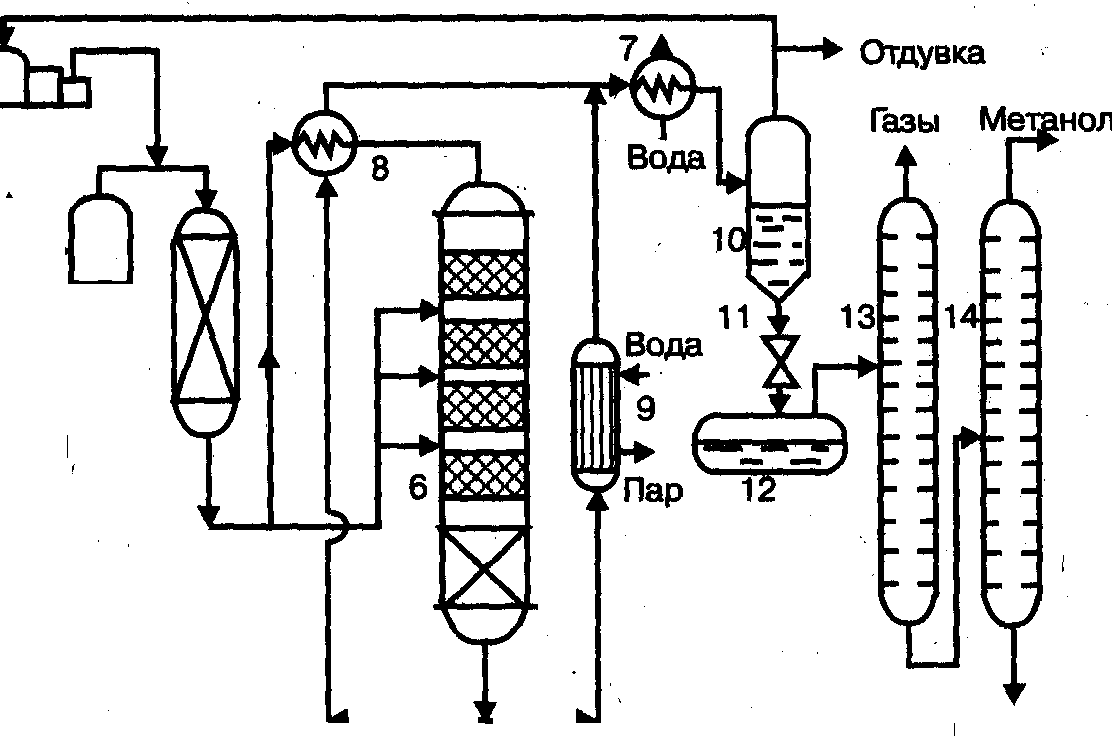 Рис. 1. Технологическая схема производства метанола при низком давлении: 1 — турбокомпрессор, 2 — циркуляционный компрессор, 3, 7 —холодильники, 4 — сепаратор, 5 — адсорбер, 6 — реактор адиабатического действия, б — теплообменник, 9 — котел-утилизатор, 10 — сепаратор, 1 1 — дроссель, 12 — сборник метанола-сырца, 13, 14 — ректификационные колонны 2) Очищенный от соединений серы синтез-газ сжимается в компрессоре 1 до давления 3—10 МПа, подогревается в теплообменнике 5 продуктами синтеза до 200— 280°С, смешивается с циркуляционным газом и поступает в нижнюю часть реактора 4.' Образовавшаяся в реакторе парогазовая смесь, содержащая до 15% метанола, выходит из верхней части реактора, охлаждается последовательно в теплообменниках 5 и б и через холодильник-конденсатор 7 поступает в сепаратор 8, в котором от жидкости отделяется циркуляционный газ. Жидкая фаза разделяется в сепараторе на два слоя: углеводородный и метанольный. Жидкие углеводороды перекачиваются насосом 9 в реактор, соединяясь с потоком углеводородов, проходящих через котел-утилизатор 10. Таким образом жидкая углеводородная фаза циркулирует через реактор снизу вверх, поддерживая режим кипящего слоя тонкодисперсного катализатора в нем, и одновременно обеспечивая отвод реакционного тепла. Метанол-сырец из сепаратора 8 поступает на ректификацию или используется непосредственно как топливо или добавка к топливу. 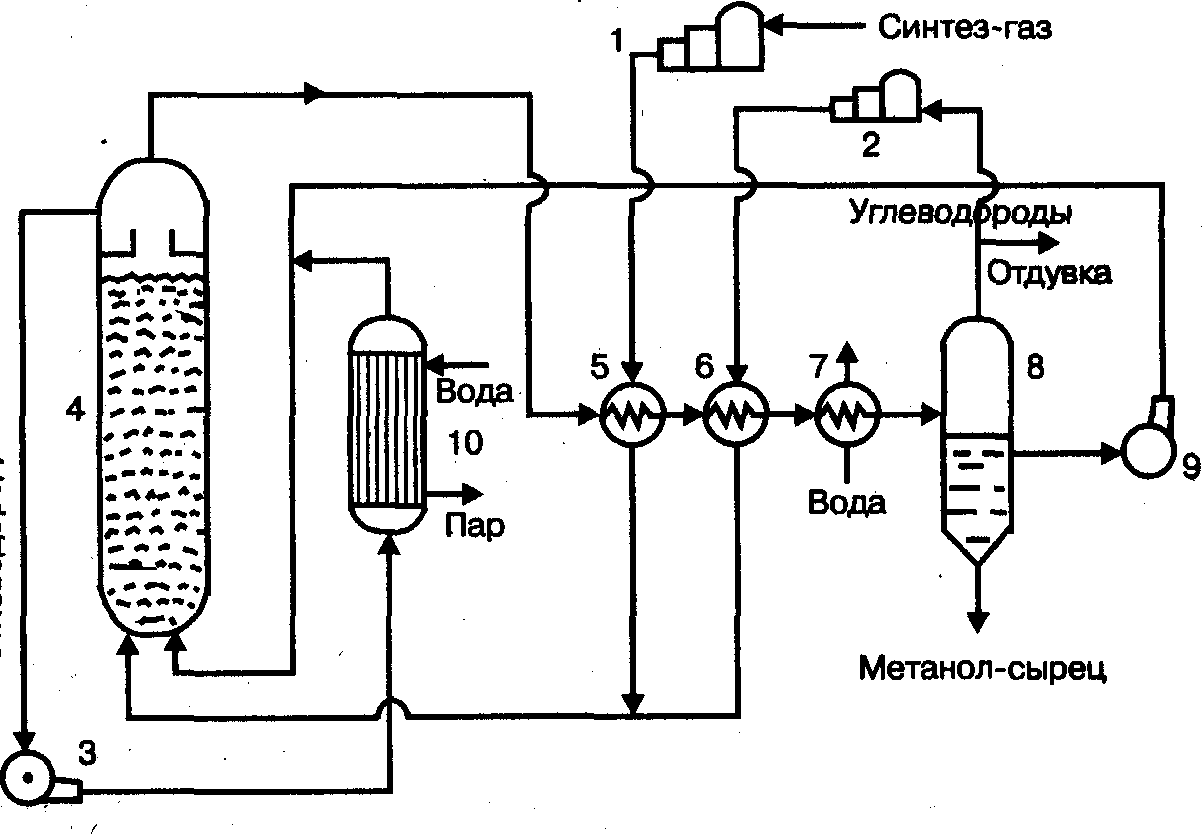 Рис. 2. Технологическая схема производства метанола в трехфазной системе: 1 — компрессор, 2 — циркуляционный компрессор, 3,9 — насосы, 4 • реактор кипящего слоя, 5,6 — теплообменники, 7 — холодильник-конденсатор, 8 — сепаратор, 10 — котел-утилизатор. Используется в основном, для производства энергетического продукта. В качестве жидкой фазы в нем применяются стабильные в условиях синтеза и не смешивающиеся с метанолом углеводородные фракции нефти, минеральные масла, полиалкилбензолы. К указанным выше преимуществам трехфазного синтеза метанола следует добавить простоту конструкции реактора, возможность замены катализатора в ходе процесса, более эффективное использование теплового эффекта реакции. Вследствие этого установки трехфазного синтеза более экономичны по сравнению с традиционными двухфазными как высокого так и низкого давления. В производстве метанола катализаторы важны так же, как и сам природный газ. Без них ни один процесс происходить не будет. На оптимизацию процесса влияет тип и качество катализаторов, используемых на всех стадиях синтеза метанола. На основе метанола можно синтезировать практически все: формальдегиды, метиалмины(диметиламины), метил-трет-бутиловый эфир - МТБЭ, монометиламин - ММА(высокооктановые добавки к бензинам), топливные элементы, метиловые эфиры (ДМЭ), водород, высокооктановый бензин, спирты, уксусную кислоту, растворители и т. д. Метанольный бензин, получаемый в процессе «Mobil» имеет октановое число 92-95, синтезирован на ZSM-5 (синтетический высококремниземный цеолит). ДМЭ (CH3OCH3) — газ, прекрасное дизтопливо (цетановое число ≈80), двигатель работает практически бесшумно, выхлоп пахнет хорошо. Безвреден. Выхлоп разлагается за 1 — 1.5 дня, не успевает долететь до озонового слоя, применятеся как заменитель хладона в спреях. Из ДМЭ можно синт этилен, пропилен.. CH3OH + HOCH3 → CH3OCH3 + H2O (в кач катализатора Al2O3) 2CO + 4H2 → CH3OCH3 + H2O (при повыш температуре) — совр метод. ММА (монометил анилин) — антидетонационная присадка для бензинов. Вредно. Добавляется в бензин примерно 1 %. 13. Диметиловый эфир – как экологически чистое моторное топливо. Получение и применение. Катализаторы и оборудование. Диметиловый эфир (C2H6O)-широко применяемый на практике простой эфир.ДМЭ известен достаточно давно, но раньше его применяли лишь в парфюмерии для создания давления в баллонах с лаками и дезодорантами. Там он заменил вредные газы — фреоны, бутан и пропан. Использовался диметиловый эфир также как хладагент и растворитель. В последнее десятилетие XX века австрийские, датские и американские исследователи предложили использовать ДМЭ в качестве альтернативы дизельному топливу. Сегодня общественный транспорт Швеции и Дании полностью переведен на ДМЭ. (В Москве тоже хотели). Диметиловый эфир производится из природного газа, угля или биотоплива. Это производная метанола, которая получается в процессе преобразования газа в жидкое состояние. Существует два типа ДМЭ: высший сорт — содержание диметилового эфира не менее 99,5%, используется в парфюмерии, а в качестве моторного топлива применяется низший сорт — содержание ДМЭ на уровне 95%. Диметиловый эфир — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя. Без переделки возможно применение на автомобилях с LPG-двигателями при 30 % содержании в топливе. 1) CH3OH + HOCH3 → CH3OCH3 + H2O (в качестве катализаторов Al2O3, алюмосиликаты (степень превращения метанола в диметиловый эфир - 60%) и цеолиты (селективность процесса близка к 100%)) — дегидротация. 2) 2CO + 4H2 → CH3OCH3 + H2O (при повышенной температуре) — совр метод. 1) Дегидратация метанола проводится при умеренных температурах (до 160 ºС). .Исходный метанол из емкости Е-1 насосом Н-2 через подогреватель Т-3, обогреваемый водяным паром, подается в нижнюю ректификационную зону реакционно-ректификационного аппарата К-10. Реакционно-ректификационный аппарат (РРА) К-10 состоит из трех зон: двух ректификационных (нижней и верхней) и средней реакционной - заполненной катализатором. В реакционной зоне на катализаторе протекает реакция межмолекулярной дегидратации метанола с образованием ДМЭ и воды. Верхняя ректификационная зона предназначена для отделения ДМЭ от метанола и воды, нижняя ректификационная зона предназначена для разделения метанола и воды. Обогрев РРА осуществляется водяным паром через выносной кипятильник Т-7. Из куба колонны К-10 выводится вода, которая сбрасывается в химзагрязненную канализацию. Пары ДМЭ с верха колонны К-10 конденсируются в дефлегматоре Т-4, охлаждаемом оборотной водой. Конденсат после Т-4 собирается в емкости Е-5, откуда насосом Н-6 частично возвращается в колонну К- 10 в качестве флегмы, а балансовый избыток – товарный ДМЭ – направляется на склад. 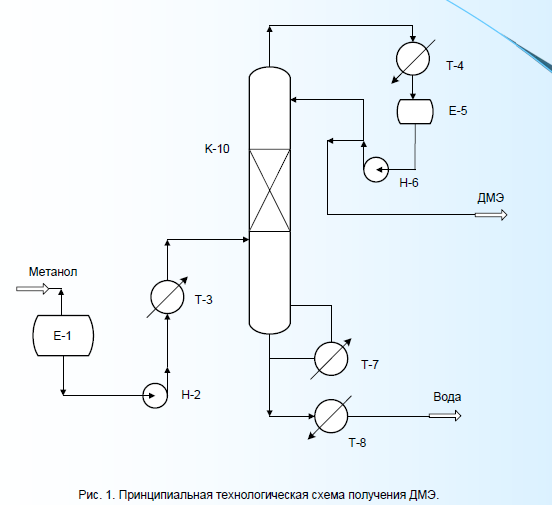 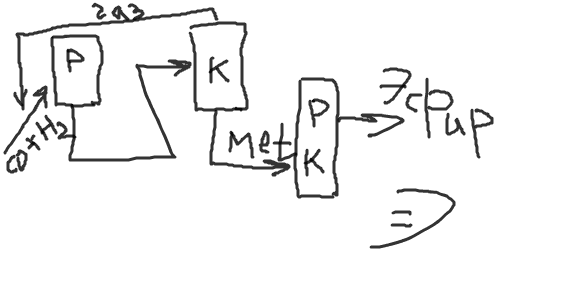 2) Диметиловый эфир получают также из синтез-газа на полифункциональных катализаторах при 200-250 °С и давлении 7-9 МПа; степень превращения метанола в диметиловый эфир составляет 59-88%. 2) Диметиловый эфир получают также из синтез-газа на полифункциональных катализаторах при 200-250 °С и давлении 7-9 МПа; степень превращения метанола в диметиловый эфир составляет 59-88%. Р-реактор; К-конденсатор; РК-ректиф колонна. Met-метанол. 14. Формальдегид из метанола. Оборудование и применение. Диметоксиметан как экологически чистое моторное топливо. Формальдегид (от лат. formica — муравей), рекомендуемое международное название метаналь, устаревшее — муравьиный альдегид (CH2=O) — газообразное бесцветное вещество с острым запахом, первый член гомологического ряда алифатических альдегидов. Альдегид муравьиной кислоты. Тк=-19 °С, Тз= - 118 °С. Взрывоопасен в диапазоне 7-72% содержания в воздухе. Выпускается и хранится в воде формалина : 40% водный раствор с 6-10% метанола. Водный раствор формальдегида — формалин — свёртывает белки, поэтому он применяется для дубления желатина при производстве кинофотоплёнки. Используется для консервации биологических материалов (создание анатомических и других препаратов), а также в медицине, как антисептик (формидрон — аптечный препарат, смесь растворов формальдегида и одеколона). Еще применяется для получения качественного каучука(реакция с изобутеленом через образование триоксана). Формальдегид широко применяется при изготовлении пластмасс (таких, как фенопласт и аминопласты), искусственных волокон, из него получают пентаэритрит (сырьё для производства взрывчатых веществ и пластификаторов), триметилопропан. Основная часть формальдцегида идет на изготовление древесностружечных материалов, где он используется для получения карбамидной смолы. В некоторых случаях формальдегид используется в качестве стабилизирующей добавки при производстве медицинских препаратов. Этот факт послужил основой различного рода суждений о низком качестве вакцин. Получение Основной способ получения формальдегида — окисление метанола: 2CH3OH + O2 → 2HCHO + 2H2O, экзотермична. Окисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Недавно разработан более перспективный способ, основанный на использовании железо-молибденовых катализаторов. При этом реакция проводится при 300 °C. В обоих процессах степень превращения составляет 99 %. Процесс дегидрирования метанола, осуществленный на цинк-медных катализаторах при 600 °C, пока не получил широкого развития, однако он является очень перспективным, поскольку позволяет получать формальдегид, не содержащий воды. CH3OH → CH2O + H2 эндотермична ∆H = 112 кДж/моль Существует также промышленный способ получения формальдегида окислением метана: CH4 + O2 → HCHO + H2O Процесс проводят при температуре 450 °C и давлении 1—2 МПа, в качестве катализатора применяется фосфат алюминия Al3(PO4)2 Установка получения формальдегида на Кусковском заводе: 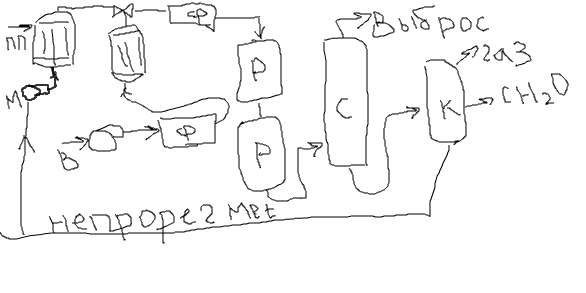 Метанол подается насосом со склада и вводится в испаритель метанола, в котором нагревается с помощью перегретого пара. Подогретая смесь метанол-воздух проходит через фильт, затем поступает в реактор. Реактор представляет собой кожухотрубный теплообменник с катализатором в трубном пространстве и кипящей теплопередающей жидкостью в межтрубном пространстве. Смесь газов входит в реактор и прежде всего проходит через трубки над катализатором, где метанол превращается в формальдегид. Выделяется тепло, которое вызывает повышение температуры газа при прохождении через трубки. Когда основная часть метанола прореагировала, температура снова снижается, чтобы на выходе из трубы приблизиться к температуре кипящего теплоносителя. Затем выходящий газ поступает в скруббер, где отчищается от примесей. (перед скруберром скорее всего есть еще конденсатор, для охлаждения газа, выходящего из реактора). Катализатором служит тонкий сло серебра нанесенный на Al2O3. Также на Co-Mo катализаторе. Диметоксиметан (ДММ) — жидкое дизельное топливо из формальдегида и метанола, обладающее абсолютно чистым выхлопом и высоким цетановым цислом ( > 80). Чрезвычайно горуч, раздражает слизистые оболочки. Тк=50 °С. Получение: CH2O + 2CH3OH (или ДМЭ) → CH2(CH3O)2 Вполне вероятно, это вещество станет перспективным топливом, получаемым на базе метанола. Это бесцветная прозрачная жидкость с высоким содержанием кислорода (42%). Уже не раз проводились испытания этого продукта, которые показали хорошие результаты в отношении технических характеристик двигателей и низкой эмиссии дыма. Диметоксиметан улучшает смазывающую способность дизельного топлива и полностью смешивается с этим топливом при всех температурах. Он изготавливается путем метоксилирования формальдегида метанолом. Это вещество является превосходным окислителем дизельного топлива, и его использование может стать одним из вариантов уменьшения образования дыма от сжигания дизельного топлива. Так же в качестве дизельного топлива выгодно использовать полиметоксиметан (ПММ) CH3(CH20)nCH3, где n=1...8. Жидкость, двигатель на ней работает бемшумно, эеологически безопасно. 15. Высокооктановый бензин и экологически чистые добавки (эфиры) из метанола. Углеродные атомы в молекулах углеводородов, входящих в состав бензинов, могут соединяться друг с другом различными способами и образовывать прямые цепочки, кольца или ветвистые структуры. Углеводороды с углеродным скелетом в виде ветвистых структур и колец имеют более высокие октановые числа, чем углеводороды с прямыми цепями. Современные авиамоторы поршневого типа работают на бензинах с октановыми числами от 85 до 100 и даже выше. Такие высокооктановые бензины должны содержать большое количество углеводородов с углеродными скелетами в виде ветвистых структур и колец (мохнатые). Бензины, получаемые прямой перегонкой нефти, обычно содержат немного таких углеводородов, в связи с чем их октановые числа лежат в пределах от 50 до 75. Авиационные бензины готовят, добавляя к бензинам прямой гонки или каталитического крекинга 20 — 40% высокооктановых углеводородов и сотые доли процента тетраэтилсвинца (ТЭС). Высокооктановые углеводороды получают химической переработкой углеводородов с прямой цепочкой или синтезом из более мелких молекул газообразных углеводородов (пропилен, изобутилен, изобутан). Так перестройка прямой углеродной цепи пентана в разветвленную позволяет повысить октановое число с 62 до 90. Этот процесс (изомеризация) протекает при повышенных температурах в присутствии катализаторов. Другой способ перестройки углеродного скелета — превращение прямых цепей углеводородов в кольца (циклизация). Циклизацию производят, пропуская пары бензина при температурах около 500° над твердыми катализаторами (окись хрома, окись молибдена). Циклизация нормального гептана с октановым числом 0 дает толуол с октановым числом 104. Наиболее важные высокооктановые углеводороды — изооктан и триптан — получают из газообразных углеводородов, имеющих 3 и 4 углеродных атома в молекуле. Такие газообразные углеводороды а больших количествах получаются при крекинге нефти. Две молекулы изобутилена, соединяясь друг с другом в присутствии серной или фосфорной кислот, являющихся катализаторами, дают вещество, которое после присоединения водорода представляетизооктан. Такой процесс соединения одинаковых молекул называется полимеризацией. Взаимодействие предельного углеводорода с непредельным называется алкилированием. Алкилирование изобутана пропиленом, проводимое при высоких температурах и давлениях, приводит к образованию триптана, имеющего октановое число 115. Таким же способом в присутствии серной кислоты из изобутана и бутилена получают изооктан. В настоящий момент известны данные о получении бензина при каталитической обработке таких продуктов не нефтяного происхождения, как метанол СН3ОН и диметиловый эфир (СН3)2 О (ДМЭ). В ряде стран в качестве добавки, расширяющей ресурсы высокооктановых бензинов, используют метил-трет-бутиловый эфир (МТБЭ). Антидетонационная эффективность его по сравнению с алкилбензином в 3—4 раза выше, благодаря чему с помощью эфира можно получить широкий ассортимент неэтилированных высокооктановых бензинов. Наибольшую антидетонационную эффективность эфир проявляет в составе бензинов прямой перегонки и каталитического риформинга обычного режима. Октан около 120. Сгорает полностью, выхлоб чистый. Стоит дорого, поэтому идет как добавка. Бензины с добавками эфира характеризуются хорошими пусковыми качествами и при пониженных оборотах двигателя имеют более высокие фактические октановые числа по сравнению с товарными бензинами. ДМЭ (CH3OCH3) — газ, прекрасное дизтопливо (цетановое число ≈80), двигатель работает практически бесшумно, выхлоп пахнет хорошо. Безвреден. Выхлоп разлагается за 1 — 1.5 дня, не успевает долететь до озонового слоя, применятеся как заменитель хладона в спреях. Из ДМЭ можно синт этилен, пропилен.. (выше пали билет!) ММА (монометиланилин) — антидетонационная присадка для бензинов. Вредно. Добавляется в бензин примерно 1 %. ММА также используют в качестве сырья органического синтеза и промежуточного продукта для красителей. Получение: C6H5NH2 (анилин)+ CH3OH (Н2, кат-р) → C6H5NHСН3+ Н2О Согласно ГОСТам, установленным Министерством природных ресурсов РФ, ММА относится ко 2–му классу опасности, и его степень воздействия на окружающую природную среду оценивается как высокая. В случае малейшего нарушения техники безопасности при обращении с ММА период восстановления экосистемы после полного устранения источника вредного воздействия оценивается Минприроды в 30 лет. В Европе ММА практически не используется – тамошние производители перешли на более безопасные присадки. МТБЭ является гораздо более безопасной основой присадок, правда, его производство стоит несколько дороже по сравнению с ММА 16. Получение этилена и пропилена из метанола. Программа МТО (метанол в олефины). Экологические преимущества процесса перед гидропиролизом бензина. Синтез этилена и пропилена из метанола на силикоалюмофосфатном катализаторе sapo34 Н 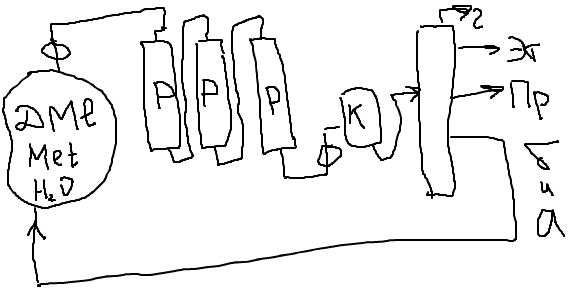 ethanol to olefins (MTO) - получения этилена и пропилена из метанола. Компании UOP и Haldor Topsoe разработали этот процесс. В Китае и Бельгии уже работают первые установки. На сегодня изучен процесс получения этилена и пропилена из метанола на катализаторе на основе микропористого силикоалюмофосфата SAPO34. Катализатор на основе SAPO34 высокоэффективен по селективности образования этилена и пропилена, на котором при 350–450 °С достигается суммарный выход С2=–С4=олефинов 77–84 % при конверсии метанола до 96–99 %; выход этилена ~ 36 % в конверсии метанола в токе гелия при 450 °С выше, чем при 375 °С (~29 %), а выход пропилена ~30 % при 450 °С ниже, чем при 375 °С (~38 %). Применение в качестве разбавителя паров воды и гелия увеличивает выход этилена при 375 °С до ~ 36 % , а при 450 °С до ~ 50 %. При конверсии метанола при 450 °С только в парах воды без гелия выход этилена достигает ~ 44–49 %, а пропилена 24–29 %. Соотношение С3=/С2= в процессе варьируется от ~ 0,5 до 1,5. Для получения преимущественно пропилена — при более высоком давлении, этилена — высокой температуре. Высокая эффективность катализатора на основе SAPO34 обусловлена микропористой структурой цеолита и высоким содержанием кислотных центров средней силы. Катализатор в процессе конверсии метанола дезактивируется вследствие закоксовывания. После регенерации воздухом при 550 °С активность катализатора полностью восстанавливается при сохранении кристаллической структуры цеолита и кислотных свойств катализатора. Продолжительность активной работы катализатора в одном цикле продлевается при использовании паров воды как разбавителя и предварительной высокотемпературной паровой обработки катализатора. В России промышленные технологии получения этилена и пропилена из ненефтяного сырья отсутствуют. Результаты педсавленные выше соответствуют показателям процесса «UOP»/«Norsk Hydro» на катализаторе на основе SAPO34. Катализатор может быть рекомендован для дальнейшей проверки на пилотной установке с движущимся слоем катализатора по типу FCC. Сырье — метанол, ДМЭ и вода Р-адиабатический реактор (в них имеет место перегрев); К — конденсатор(из него водица вытекает, недорисовала); и ректификационная колонна. Эт — этилен, ПР — пропилен, Б и А — бутены и амилены. Чистота получаемых олефинов достигает 99,5 % 2CH3OH → CH3OCH3 (отлетает вода) → СH2=CH2 ПИРОЛИЗ НЕФТЯНОГО СЫРЬЯ, процесс деструктивного превращ. углеводородов нефти при высоких т-рах (обычно выше 650-7000C) в газообразные (пирогаз) и жидкие (смола пиролиза) продукты. Деструктивные процессы при т-рах до 6000C имеют самостоят. Значение. Пиролиз впервые применен в кон. 19 в. для получения из керосиновой фракции нефти осветительного газа. С 50-х гг. 20 в. пиролиз-осн. пром. процесс, обеспечивающий крупнотоннажное произ-во этилена, пропилена, а также др. мономеров и полупродуктов для хим. пром-сти (бутенов, бутадиена, циклопентадиена, бензола, толуола, ксилолов и др.). В 1980 на процессы пиролиза направляли 6% мировой добычи нефти и газа, а к 2000 эта доля составит ~ 20%. Сырьем служат основные промышленные газы нефтепереработки, бензиновые и газойлевые фракции нефти. Гидропиролиз проводят, как и термический пиролиз, при повышенных температуре ( 500 С) и давлении ( 10 МПа) и времени контакта от нескольких секунд до одной минуты, но в среде водорода. Гидропиролиз характеризуется отсутствием катализатора. (про экологич преимущества не нашла) 17. Получение водорода. Водород как экологически чистое топливо. Топливные элементы. Наиболее старый способ получения водорода - электролиз воды, при котором, пропуская постоянный ток, на катоде накапливают водород, а на аноде - кислород. Такая технология делает его слишком дорогим энергоносителем. Чаще для получения водорода используют технологию горячей переработки водяного пара при температуре 700-900 °С с участием легкого бензина и тяжелого жидкого топлива, отбирающего кислород. Это тоже дорогой способ. Существует несколько проектов дешевого получения водорода. Например, предлагается построить в Гренландии несколько электростанций, которые будут использовать талую воду ледников для производства электроэнергии, а энергия будет на месте затрачиваться на электролиз для получения водорода, его сжижения и транспортировку по трубопроводам и в танкерах в Европу и Америку. Другие проекты - использование энергии атомных и специальных солнечных электростанций для получения водорода путем электролиза воды. Иммобилизованные ферменты могут быть использованы для получения водорода. Делаются попытки создания такого порошка с ферментами. Возможен также микробиологический способ получения водорода. В почве существует ряд микроорганизмов, которые выделяют водород в виде побочного продукта.
|
