На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
Ненашева
Наталья Михайловна
КЛИНИЧЕСКИЕ ФЕНОТИПЫ АТОПИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЫ И ДИФФЕРЕНЦИРОВАННАЯ ТАКТИКА ДИАГНОСТИКИ И ЛЕЧЕНИЯ
14.00.36. — Аллергология и иммунология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва-2008г.
Работа выполнена в ГОУ ДПО Российская медицинская академия последипломного образования
Научный консультант:
Доктор медицинских наук, профессор, академик РАМН Кашкин Кирилл Павлович
Официальные оппоненты:
доктор медицинских наук, профессор Ильина Наталья Ивановна
доктор медицинских наук, профессор Резников Юрий Петрович
доктор медицинских наук, профессор Ревякина Вера Афанасьевна
Ведущая организация: ГОУ ВПО «Российский государственный медицинский университет» Росздрава
Защита состоится «18 » марта 2009 г. в 10 часов на
заседании диссертационного совета Д. 208.071.04
При ГОУ ДПО «Российская медицинская академия последипломного образования» по адресу 123995, г. Москва, Баррикадная ул., д. 2/1
С диссертацией можно ознакомиться в библиотеке ГОУ ДПО «Российская медицинская академия последипломного образования»
(125445, г. Москва, ул. Беломорская, д.19).
Автореферат разослан « »_______________________2009 года
Ученый секретарь диссертационного совета,
доктор медицинских наук В.Т.Морозова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Бронхиальная астма (БА) относится к одному из самых распространенных заболеваний человека во всех возрастных группах. По экспертной оценке академика А.Г. Чучалина в России БА страдают около 7 млн человек. Частота атопической БА у взрослых колеблется от 40% до 80% в общей структуре заболевания и зависит от условий проведения исследования. И, хотя ассоциация между астмой и атопией установлена и хорошо известна, однако точные связи между этими двумя состояниями не ясны и полностью не определены (GINA, 2006). Следует отметить малочисленность отечественных работ, посвященных атопической БА у взрослых, ее доле в общей структуре БА, возрастной и гендерной структуре, особенностям течения и контроля, спектру сенсибилизации и сочетанной патологии.
В настоящее время в значительной степени изучены особенности течения БА у детей различного возраста, а также у взрослых и менее изучены особенности подростковой БА. Многие лечебно-консультативные центры России сталкиваются с проблемой медицинского освидетельствования подростков и призывников с целью верификации диагноза БА, что обусловлено развитием клинической ремиссии БА у 80% пациентов в возрасте между 10 и 20 годами и отсутствием алгоритма верификации диагноза БА у подростков.
БА – заболевание, имеющее генетическую предрасположен-ность. В дополнение к генам, которые предрасполагают к развитию БА, существуют гены, которые ассоциированы с определенным ответом на противоастматическую терапию. Примером является ген β2-адренергического рецептора - ADRB2. На сегодняшний день неизвестны особенности течения и терапии БА у больных, являющихся гомозиготами по аргинину в 16-ой позиции β2-адренергического рецептора, по сравнению с пациентами, не имеющими данной аминокислотной последовательности в 16-ой позиции рецептора.
Современные представления о БА, как о системном заболевании, диктуют необходимость системного подхода к лечению, наглядным образцом которого является аллергенспецифическая иммунотерапия (АСИТ). В этой связи актуальной является оценка эффективности и безопасности локальных методов АСИТ у взрослых больных атопической БА.
Основной концепцией GINA2006 и целью лечения больных БА является достижение и поддержание оптимального контроля БА. Несмотря на прогресс, достигнутый в терапии БА за последние десятилетия, у большинства пациентов с БА заболевание адекватно не контролируется. Выяснение причин неконтролируемой атопической БА, определение критериев адекватной фармакотерапии, ее схем и методов, разработка комплексной оценки контроля атопической БА, включающей клинико-функциональные параметры и маркеры аллергического воспаления в нижних дыхательных путях, являются актуальными задачами, решение которых позволит оптимизировать контроль БА и улучшить качество жизни больных.
Таким образом, изучение клинических и патогенетических характеристик атопической БА у подростков и взрослых представляет значительный научный и практический интерес с точки зрения разработки дифференцированных диагностических подходов к верификации различных фенотипов этой формы заболевания, а также определения оптимальных терапевтических режимов.
Цель исследования. Установить клинические и прогностические особенности формирования и течения атопической бронхиальной астмы у подростков и взрослых для разработки эффективных диагностических и дифференцированных терапевтических мероприятий.
Задачи исследования:
- Представить возрастную и гендерную структуру, а также клинико-функциональную характеристику атопической бронхиальной астмы взрослых.
- Охарактеризовать клинические фенотипы ранней и поздней атопической БА, с точки зрения прогноза течения заболевания.
- Определить диагностические особенности и представить клинико-функциональную характеристику атопической БА у подростков в возрасте от 16 до 18 лет и разработать методы выявления специфической бронхиальной реактивности при длительной стойкой ремиссии атопической БА.
- Разработать алгоритм верификации диагноза БА для медицинского освидетельствования подростков и призывников.
- Изучить возрастные особенности содержания общего IgE и аллерген-специфической кожной реактивности у больных атопической БА разной степени тяжести.
- Исследовать особенности течения и терапии БА у лиц с В16 Arg/Arg типом β2-адренорецептора.
- Оценить эффективность и безопасность различных режимов фармакотерапии в достижении контроля атопической БА.
- Изучить эффективность и безопасность сублингвальной и интраназальной АСИТ у пациентов с аллергическим риноконъюнктивитом, страдающих легкой интермиттирующей атопической астмой в сравнении с пациентами, не имеющими астматических проявлений.
- Разработать комплексную оценку эффективного контроля атопической БА, включающую клинико-функциональные параметры и маркеры воспаления.
Научная новизна. Получены новые теоретические знания, касающиеся клинических фенотипов атопической БА у взрослых. Впервые выделены и охарактеризованы клинические фенотипы атопической БА с ранним и поздним дебютом. Определена вероятность формирования более тяжелой формы БА с частыми обострениями у больных с поздним началом болезни.
Впервые показано, что в настоящее время приоритетным пыльцевым аллергеном у взрослых больных атопической БА – жителей Москвы, является пыльца деревьев.
Дана полная клинико-функциональная характеристика атопической БА у подростков мужского пола. Клинический фенотип атопической БА подростков мужского пола характеризуется легким интермиттирующим течением и нормальными функциональными показателями у большинства больных. Показано, что пик заболеваемости атопической БА у мальчиков приходится на возраст от 7 до 13 лет и существенно снижается после 15 лет.
Впервые разработан специфический бронхопровокационный тест (БПТ) двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для верификации пациентов с интермиттирующей атопической БА в фазе стойкой ремиссии.
Показано, что исследование индуцированной мокроты у больных интермиттирующей БА может служить дополнительным диагностическим методом, особенно в сочетании с низкодозовым БПТ со специфическим аллергеном. Доказано существование суб-клинического воспаления в нижних дыхательных путях у пациентов с атопической БА в фазе стойкой ремиссии, проявляющееся повышенным содержанием эозинофилов и эозинофильного катионного протеина (ЕСР) в индуцированной мокроте.
Приоритетными являются результаты, обнаруживающие нали-чие В16-Arg/Arg типа β2-адренорецептора у 19% больных БА – жителей Московского региона России. Доказано, что наличие этого типа β2-адренорецептора не влияет на естественное развитие БА, но паци-енты с этим типом рецептора проявляют более выраженный бронходилатационный ответ на воздействие антихолинергического препарата, по сравнению с короткодействующим β2-агонистом. Одновременно была доказана одинаковая эффективность комбинированных препаратов ингаляционных кортикостероидов и длительнодействующих β2-агонистов (ИГКС+ДДβ2А) у пациентов с положительным В16-Arg/Arg и отрицательным В16-Arg/Arg типами β2-адренорецептора.
Показана одинаковая эффективность и безопасность комбинированных препаратов ИГКС+ ДДβ2А, применяемых двумя различными режимами (стабильного дозирования и SMART) у больных среднетяжелой и тяжелой атопической БА, в отношении достижения клинико-функционального контроля болезни и улучшения качества жизни.
Показана эффективность и безопасность локальных (сублингвального и интраназального) методов АСИТ у больных легкой атопической БА.
Впервые показана эффективность комплексной оценки контроля атопической БА, сочетающей клинико-функциональные параметры и маркеры аллергического воспаления. Доказана высокая информативность АСТ-теста, коррелирующего с функциональными показателями, степенью бронхиальной гиперреактивности (БГР) и уровнем оксида азота в выдыхаемом воздухе (NOex).
Впервые определена высокая специфичность и чувствитель-ность, в зависимости от этиологической формы БА, метода измерения NOex с помощью портативного прибора NIOX MINO. NO в выдыхаемом воздухе является важным и высокочувствительным маркером для больных с атопической формой БА и для пациентов со смешанным вариантом БА.
Показано, что NOех является чувствительным маркером ответа на противовоспалительную терапию: снижение NOex ≥ 20% свидетельствует об эффективности назначенного лечения и сопряжено с высокой вероятностью достижения контроля БА.
Практическая значимость.
Определена пропорция атопической БА в общей структуре болезни, дана возрастная и гендерная характеристика атопической БА взрослых.
Определен спектр сенсибилизирующих аллергенов у взрослых больных атопической БА – жителей Московского региона и впервые показано доминирование (среди пыльцевых аллергенов) сенсибилизации к пыльце деревьев у жителей Москвы, больных атопической БА.
Обоснована целесообразность выделения клинических фенотипов ранней и поздней атопической БА. Пациенты с поздним дебютом (после 16 лет) АБА требуют пристального внимания и раннего назначения противовоспалительной базисной терапии ИГКС или ИГКС+ДДβ2А.
Доказана высокая чувствительность и разработаны показания к проведению специфического БПТ двукратными разведениями аллергена.
Разработан и внедрен специфический БПТ двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для пациентов в фазе стойкой ремиссии атопической БА.
Доказана диагностическая значимость определения индуци-рованной мокроты у больных интермиттирующей БА, особенно в сочетании с низкодозовым БПТ со специфическим аллергеном.
Доказана одинаковая эффективность и безопасность комбинированных препаратов ИГКС+ ДДβ2А, применяемых двумя различными режимами (стабильного дозирования и SMART) у больных среднетяжелой и тяжелой атопической БА, в отношении достижения клинико-функционального контроля болезни и улучшения качества жизни.
Обоснована эффективность и безопасность локальных (сублингвального и интраназального) методов АСИТ у больных легкой атопической БА.
Обоснована необходимость комплексной оценки контроля атопической БА, включающей оценку интенсивности воспаления неинвазивными методами.
Доказана целесообразность применения АСТ-теста на всех уровнях медицинской помощи больным БА для оптимизации терапии и достижения более высокого контроля болезни.
Обоснована целесообразность проведения генетического типирования β2-адренорецепторов у больных БА. Пациентам с В16-Arg/Arg типом β2-адренорецептора показано применение антихолинергического или комплексного (антихолинергический+короткодей-ствующий β2-агонист) препарата, в качестве средства для купирования приступов удушья.
Доказана полезность мониторинга уровня NOex у больных атопической БА для определения эффективности проводимой противоастматической терапии. Снижение NOex ≥ 20% свидетельствует об эффективности назначенного лечения и сопряжено с высокой вероятностью достижения контроля БА.
Основные положения, выносимые на защиту.
- Атопическая БА доминирует в общей структуре заболевания у взрослых, характеризуясь преобладанием полисенсибилизации и легкой формы у 2/3 пациентов. Большинство больных атопической БА заболевают в детском и юношеском возрасте. Клинические фенотипы атопической БА с ранним (до 16 лет включительно) и поздним дебютом БА различаются по полу, частоте отягощенной наследственности, вероятности формирования более тяжелой формы бронхиальной астмы с частыми обострениями.
- Клинический фенотип атопической БА подростков мужского пола характеризуется легким интермиттирующим течением и сочетанием с аллергическим ринитом у большинства больных; нормальными функциональными показателями и наличием полисенсибилизации к различным ингаляционным аллергенам. Большинство подростков имеют высокую или среднюю степень бронхиальной гиперреактивности, несмотря на ремиссию и легкую форму болезни. Пик заболеваемости атопической БА у мальчиков приходится на возраст от 7 до 13 лет и существенно снижается после 15 лет.
- Разработанный специфический бронхопровокационный тест двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для пациентов в фазе стойкой ремиссии атопической БА и отрицательными прямыми БПТ, является безопасным и обладает аллергенспецифической чувствительностью.
- Распространенность В16 Arg/Arg типа β2-адренорецептора составляет 19% у больных БА – жителей Москвы и Московской области. Наличие В16-Arg/Arg типа β2-адренорецептора не влияет на естественное развитие БА, но определяет выраженность бронходилатационного ответа на короткодействующие β2-агонисты.
- У большинства пациентов со среднетяжелой и тяжелой неконтролируемой атопической БА возможно достижение клинико-функциональной ремиссии астмы в результате применения фармакотерапии комбинированными препаратами (ИГКС+ДДβ2А) с использованием разных лечебных режимов.
- Сублингвальная АСИТ аллергеном клещей домашней пыли и интраназальная АСИТ аллергоидом и водно-солевым аллергеном домашней пыли, являются эффективными и безопасными методами лечения аллергических риноконъюнктивитов и легкой формы атопической БА, обусловленных сенсибилизацией к бытовым аллергенам, позволяющими проводить лечение в домашних условиях.
- Комплексная оценка контроля БА, включающая не только клинико-функциональные параметры, но и маркеры аллергического воспаления, позволяет проводить объективный мониторинг состояния БА и эффективности противоастматической терапии. NO в выдыхаемом воздухе является важным маркером для БА, высокочувствительным для лиц с атопической формой болезни и для пациентов со смешанным вариантом БА. Снижение NOex ≥ 20% свидетельствует об эффективности назначенного лечения и сопряжено с высокой вероятностью достижения контроля БА.
Внедрение в практику. Результаты исследований внедрены в практику работы аллергологического отделения ГКБ №52 и поликлинического консультативного аллергологического центра на базе ГКБ №52 г. Москвы, а также включены в материалы лекций, практических и семинарских занятий на кафедре клинической аллергологии РМАПО. По результатам исследований написаны методические рекомендации и учебные пособия для врачей.
Апробация диссертации. Основные результаты работы доложены и обсуждены на совместном заседании кафедр клинической аллергологии и иммунологии ГОУ ДПО РМАПО (ноябрь, 2008 г.), а также на 16-ом Национальном Конгрессе по болезням органов дыхания (г. Санкт-Петербург, ноябрь 2006 г.), на 2-м Международном Конгрессе «Иммунитет и болезни: От теории к терапии» (г. Москва, 2007 г.) на 17-ом Национальном Конгрессе по болезням органов дыхания (г. Казань, октябрь 2007 г.), на XII Конгрессе педиатров России (г. Москва, февраль 2008 г.).
Публикации по теме диссертации включают 52 наименования, из них 15 статей в рецензируемых журналах, 2 учебных пособия для врачей, методические рекомендации, глава в монографии под редакцией академика А.Г.Чучалина «Бронхиальная астма. Клинические рекомендации», глава в монографии под редакцией проф. А.Н.Цой «Бронхиальная астма. Новые решения».
Объем и структура диссертации. Диссертационная работа изложена на 325 страницах машинописного текста, содержит 42 таблицы, иллюстрирована 47 рисунками и состоит из введения, обзора литературы, материалов и методов исследования, результатов исследования (главы 3-6), обсуждения, выводов, практических рекомендаций, списка литературы и приложения. Библиографический указатель содержит 539 источников литературы, из которых 84 – в отечественной и 455 – в зарубежной печати.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом для настоящей работы явились: результаты обследования 1154 пациентов в возрасте от 16 до 82 лет с диагнозом БА (1089 из них были с атопической БА различной степени тяжести), результаты ретроспективного анализа 515 амбулаторных карт пациентов, наблюдающихся в консультативной поликлинике ГКБ №52 с диагнозом БА.
Исследование проводилось на кафедре клинической аллергологии РМАПО, в аллергологическом отделении и консультативной поликлинике ГКБ №52.
Методы исследования
1. Общеклиническое обследование включало оценку физикального статуса пациента, проведение стандартных лабораторно-инструментальных методов обследования.
2. Специфическое аллергологическое обследование включало: сбор аллергологического анамнеза; постановку кожных проб; проведение провокационных (назальных и бронхиальных) тестов с аллергенами, в том числе определение порога специфической тканевой чувствительности.
3. Функциональные методы. Для изучения функции внешнего дыхания (ФВД) использовали спирометрию; измерялись показатели кривой «поток - объем». Исследование проводили на аппарате фирмы «Jaeger» Master Screen Lab. Процедуру проводили согласно протоколу «Стандартизация легочных функциональных тестов» Европейского респираторного общества. Проба на обратимость бронхиальной обструкции, выполнялась согласно тем же стандартам и считалась положительной в случае увеличения ОФВ1 более чем на 15%. Для оценки неспецифической бронхиальной гиперреактивности (БГР) проводился тест с метахолином (Acetyl-β-methycholine chloride, SIGMA). Применяли дозовый метод с помощью компрессорного небулайзера фирмы «Пари». Для определения степени БГР использовалась провокационная концентрация метахолина, которая вызвала падение ОФВ1 на 20% (ПК20 ОФВ1). ПК20 метахолина равная 0,03-0,124мг/мл выявляет тяжелую степень БГР, 0,125 – 1,99мг/мл – среднюю степень БГР, а 2,00 – 7,99мг/мл – легкую степень БГР. ПК20 >8,00мг/мл – норма. БПТ с физической нагрузкой проводился с помощью беговой дорожки. Пациент подвергался физической нагрузки в течение 6 минут. Измерение ОФВ1 производилось через 1, 5, 10, 15, 20, 30 минут после нагрузки. Тест считался положительны при падении ОФВ1 на 15%.
4. Бронхопровокационные тесты с аллергенами. Специфические БПТ с десятикратными разведениями аллергенов проводились пациентам с использованием методики предложенной Адо А.Д., 1976г.: производилась последовательная ингаляция раствора аллергена в концентрациях 10, 100, 1000 PNU/мл (1:1000, 1:100, 1:10). Ингаляции проводились с помощью компрессорного небулайзера, методом непрерывного дыхания, в течение 2-х минут. Диагностически значимым считалось появление жалоб на дыхательный дискомфорт, сухих свистящих хрипов над поверхностью легких, снижение ОФВ1 на 15% и более от исходного, в течение 60 мин после провокации.
БПТ двукратными разведениями аллергена проводился по методике, описанной Cockcroft D. W. и коллегами, 1987г. Использовали стандартизованные водно-солевые экстракты аллергенов в двойных разведениях от 1:4096(2,44 PNU) до 1:2(5000 PNU). Предполагаемую дозу аллергена, при которой следует ожидать 20% снижение ОФВ1, определяли с помощью логарифмической формулы, предложенной Cockcroft D. W. и коллегами:
Log ПК20 аллергена = 0,41 Log ПК20 метахолина+0,50 Log конечной точки кожного теста- 0,42 (1)
Конечная точка кожного теста определялась с помощью кожного аллергометрического титрования. Она представляла собой концентрацию аллергена, продуцирующую папулу диаметром 2мм или на 2мм больше отрицательного тест-контроля. Для обеспечения безопасности теста, использовалась начальная концентрация аллергена - на 2 разведения ниже предполагаемой. Применяли метод непрерывного дыхания. Исследование продолжали до развития ранней астматической реакции или, при отсутствии таковой, пока не достигалась максимальная концентрация аллергена (на 4 дозы выше предсказанной). Развитие ранней астматической реакции соответствует падению ОФВ1 ≥15 % в течение первого часа после ингаляции аллергена, а поздней - падением ОФВ1 ≥10% между третьим и седьмым часом после последней ингаляции. Наблюдение за пациентом осуществлялось в течение суток для оценки поздней астматической реакции.
Стандартной методики для проведения провокационного теста с низкой дозой аллергена не существует. В нашем исследовании низкая (субклиническая) доза аллергена вычислялась как среднее арифметическое дозы, вызывающей 5% снижение ОФВ1 при проведении БПТ с аллергеном по стандартной методике. Ингаляция субклинической дозы аллергена проводилась однократно с помощь компрессорного небулайзера. Оценка субклинического ответа на низкодозовую провокацию аллергеном проводилась с помощью метода индуцированной мокроты, в которой анализировались маркеры воспаления.
5. Определение оксида азота в выдыхаемом воздухе (NOex). Оксид азота в выдыхаемом воздухе определяли с помощью портативного прибора для определения NOex (NIOX MINO; Aerocrine AB, Щвеция). Данный прибор, рекомендованный к применению Европейским респираторным и Американским торакальным обществами, функционирует на основании электрохимического сенсора. Пределы измерения NOex с помощью NIOX MINO от 5 до 300 ppb. В качестве контрольной группы нами было обследовано 7 здоровых лиц (4 мужчин и 3 женщины). Уровень NO у них составил Ме=10; 5÷17 pрb.
6. Метод индуцированной мокроты. Индуцированную мокроту получали в соответствии с общепринятой методикой проведения данной процедуры у больных БА. В ходе индукции использовались концентрации, начиная с 3% NaCl, и последовательно увеличивающиеся до 4% и 5 % NaCl. Ингаляции проводились с использованием ультразвукового небулайзера OMRON Micro AIR с мощностью распыления от 0,25мл/мин, средним размером распыляемых частиц менее 5мкм. Исследование мокроты проводилось не позднее чем через 2 часа после ее получения. Полученный материал гомогенизировали с помощью дитиотреитола (DTT), с последующей обработкой на водяной бане и фильтрацией для получения клеточной суспензии, которую центрифугировали при 800 об/мин в течение 10 минут. Далее готовились мазки для изучения клеточного состава мокроты. Дифференцированный подсчет клеток осуществлялся под микроскопом «вручную». Полученный супернатант сохранялся при температуре -70 °C для последующего определения ЕСР.
7. Лабораторные методы. Уровень общего IgE в сыворотке крови определяли иммуноферментным методом с помощью диагностических наборов «IgE общий–ИФА–БЕСТ», производства компании Вектор-Бест в соответствии с инструкцией производителя. Анализы производили в клинико-диагностической лаборатории ГКБ№52 г. Москвы. Нормальные показатели общего IgE в сыворотке крови у взрослых, по данным лаборатории, составляют от 15 до 140 МЕ/мл.
Определение количества эозинофилов в назальном секрете оценивали с помощью эксфолиативного цитологического анализа. После приготовления и окрашивания мазка, подсчитывали количество клеток, определяя процент эозинофилов.
Определение содержания ECP в назальном секрете и сыворотке крови пациентов проводили иммунохемилюминесцентным методом на приборе «UniCAP 100» (Phadia, Швеция) с применением реагентов для определения ECP в сыворотке крови и секретах, согласно инструкции производителя. Исследования проводили в лаборатории иммунологии, биохимии и микологии ФГУ НКЦ оториноларингологии Росздрава. Содержание ЕСР в сыворотке крови здоровых лиц, по данным этой лаборатории, составляет до 15 мкг/л, а ЕСР в назальном смыве здоровых лиц до 156 мкг/л. ЕСР в индуцированной мокроте определяли иммунохемилюминесцентным методом с помощью системы UniCap ECP, Pharmacia CAP System ECP FEIA, в соответствии с инструкцией производителя.
Для измерения уровня sIgA в назальном секрете использовали набор реагентов для количественного определения sIgA в биологических жидкостях человека "sIgA-ИФА" производства компании «Хема-Медика», методом твёрдофазного иммуноферментного анализа. Исследования проводили в лаборатории иммунологии, биохимии и микологии ФГУ НКЦ оториноларингологии Росздрава. Содержание sIgA в назальном секрете здоровых лиц, по данным этой лаборатории, составляет 170-2920 мг/л.
8. Выявление пациентов с В16 Arg/Arg типом β2-адренорецептора. Пациенты с В16 Arg/Arg типом β2-адренорецептора были определены в результате международного клинического исследования BI 205.342. Наличие В16 Arg/Arg типа β2-адренорецептора у больных БА являлось критерием включения в данное клиническое исследование. Генетическое исследование соскобов со слизистой оболочки щеки проводилось в международной лаборатории EPIDAUROS Biotechnologie AG, Германия.
9. Оценка клинических симптомов и качества жизни. При проведении курса фармакотерапии или АСИТ все пациенты вели дневники самоконтроля, где отмечали выраженность симптомов БА и аллергического ринита (АР). Степень выраженности симптомов оценивали по четырех бальной шкале для БА, учитывая отдельно ночные и дневные симптомы. Степень выраженности симптомов АР также учитывалась в баллах от 0 – нет симптомов до 3-х – тяжёлая степень выраженности симптомов.
Исследование качества жизни (КЖ) больных БА проводили с помощью русифицированной версии вопросника «Качество жизни больных бронхиальной астмой» (AQLQ) , а у больных аллергическим риноконъюнктивитом с помощью вопросника «Качество жизни больных аллергическим риноконъюнктивитом» (RQLQ).
10. Методы оценки контроля бронхиальной астмы. Оценку контроля БА проводили по балльной шкале симптомов; показателям ФВД (ОФВ1 и ПСВ); уровню NOex и уровню БГР, оцениваемой в метахолиновом тесте; и с помощью АСТ-теста.
11. Методы статистической обработки. Данные обрабатывали с помощью компьютерной программы Statistica 6.0. В исследовании проводили анализ вариационных рядов методами описательной статистики. Качественные переменные описывали абсолютными и относительными частотами, для количественных переменных определяли среднее арифметическое (М), стандартное отклонение (ϭ), медиану (Me) и интерквартильный интервал (IQR, 25%÷75%). Анализ вида распределения количественных данных проводился с использованием критерия Шапиро-Уилка. Анализ различий по количественным признакам выполнялся методами множественного сравнения зависимых и независимых групп. Для проверки статистических гипотез о различиях абсолютных и относительных частот, долей и отношения шансов (ОШ) в двух независимых выборках использовался критерий χ2 с поправкой Йетса. Доверительные интервалы (ДИ) строились для вероятности р=95%. В работе применялся непараметрический метод ранговой корреляции по Спирмену. Статистическая оценка зависимости признаков осуществлялась методом многофакторного дисперсионного анализа. Непараметрическое сравнение средних в связанных выборках проводилось с помощью критерия Вилкоксона и Манна-Уитни для сравнения показателей внутри групп.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Ретроспективная оценка клинических фенотипов атопической БА. Возрастные особенности содержания общего IgE в сыво-ротке крови больных атопической БА. Проведен ретроспективный анализ 515 амбулаторных карт пациентов, обращавшихся в консультативную поликлинику ГКБ№52 в период с 2003 по 2008 гг. 402 пациента (78%) имели атопическую форму БА (АБА), 103 (20%) – неатопическую БА (НАБА) и 10 (2%) – атопическую и неатопическую БА (АБА+НАБА). Мужчин было 280 человек, женщин–235. В возрастной структуре АБА преобладают лица юношеского и молодого возраста (66,4% больных) (Рис.1), тогда как среди больных НАБА - лица среднего и пожилого возраста (92,2% больных), что, по-видимому, является закономерным отражением более позднего дебюта неатопической БА. При сравнении возраста начала БА у больных АБА и НАБА в выборках, совпадающих по возрастной периодизации, оказалось, что возраст начала астмы у больных АБА (М=36,0 (13,7)) лет, статистически значимо (р<0,05) отличался от возраста начала болезни у пациентов с НАБА (М=51,6 (11,9)) лет. Большинство пациентов с АБА (62%) заболевают в детском и юношеском возрасте. Гендерная характеристика АБА отличается превалированием мужчин среди лиц молодого и юношеского возраста (82%), а среди пациентов старших возрастных групп – женщин (75%) (Рис.1). Данное явление–следствие того, что БА в детском и подростковом возрасте значительно чаще встречается у лиц мужского пола. Возрастная и гендерная структура НАБА, напротив, характеризуется доминированием женщин (77,7%), относящихся к старшим возрастным группам.
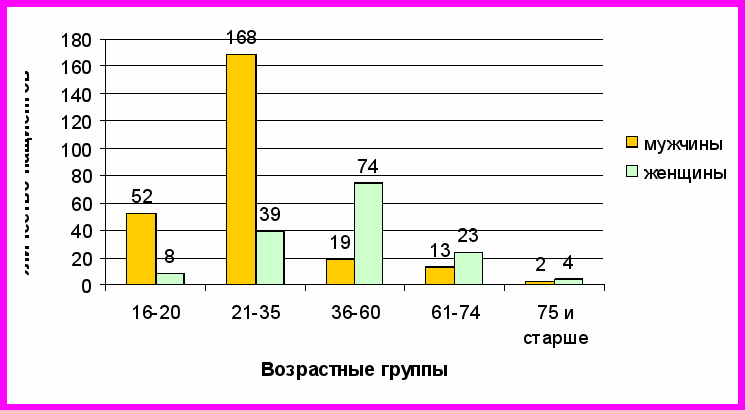
Рис. 1 Возрастная и гендерная структура атопической БА
Для пациентов с АБА характерна отягощенная наследственность по БА и/или атопии (у 44% больных). У больных НАБА отягощенная наследственность была отмечена у 15,5% пациентов.
Выявлено, что наиболее распространенным причинно-значимым аллергеном у больных АБА, жителей Московского региона, является домашняя пыль (у 363 (90%) больных), затем следуют клещи домашней пыли–328 пациентов (81,6%) (Рис.2). На первом месте среди пыльцевых аллергенов оказалась пыльца деревьев (51,7%), затем злаковых (39,1%) и сорных трав (36,8%) (Рис.2). Однако общепризнанным фактом считалось, что в центральных регионах России наиболее распространенными являются аллергены пыльцы луговых трав, и в меньшей степени, деревьев и сорняков. Наши результаты, причем полученные на разных выборках больных (при анализе амбулаторных карт 402 больных АБА и при обследовании 716 подростков с АБА), показывают, что сенсибилизация к пыльце деревьев (березы, ольхи, орешника, дуба и др.) доминирует среди пыльцевой аллергии у взрослых больных АБА - жителей Москвы. По-видимому, смена первенства среди пыльцевых аллергенов произошла в последние годы в результате глобального потепления климата в центральном регионе России. Более раннее наступление весны, вероятно, приводит к удлинению периода пыления деревьев, что в свою очередь способствует более распространенной сенсибилизации. Моносенсибилизацию к одной группе ингаляционных аллергенов имели лишь 64 пациента (16%) с АБА, остальные имели сочетанную сенсибилизацию к нескольким группам ингаляционных аллергенов.
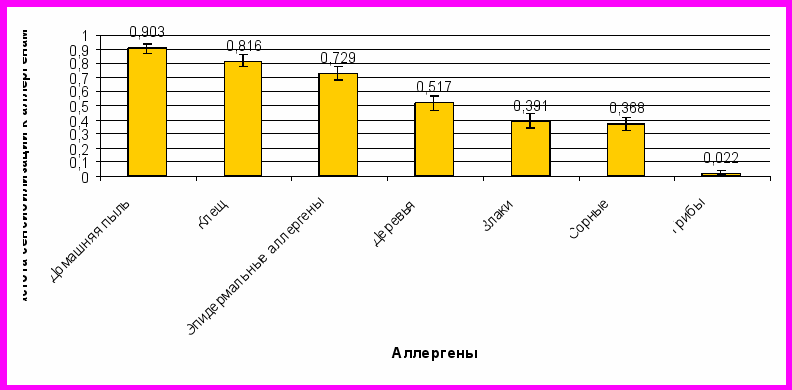
Рис.2 Частота встречаемости сенсибилизации к различным ингаляционным аллергенам у больных атопической БА
Была отмечена высокая частота сочетания АБА с АР: у 98% больных, причем у 65% больных АР предшествовал БА. Медиана периода времени от начала АР до дебюта БА составила у этих пациентов Ме=6,25 (2 ÷ 7) года. У 28% больных АР начался одновременно с БА.
Анализ тяжести БА показал, что у больных АБА преобладает легкая форма болезни – у 264 человек (65,67%), 126 пациентов (31,34%) имели среднетяжелую БА и лишь 12 больных (3 %) страдали тяжелой формой АБА. Данное распределение по тяжести совпадает со структурой тяжести БА в целом, что еще раз свидетельствует о доминирование атопической формы БА в общей структуре болезни. В анализируемой выборке пациентов с АБА, мы не обнаружили статистически значимой зависимости тяжести АБА от моно- и полисенсибилизации, и от спектра сенсибилизации. Среди больных с НАБА, доминировала среднетяжелая форма астмы – у 75 больных (72,82%), легкая форма встречалась у 16 пациентов (11,3%), тяжелая – у 12 (11,65%).
При анализе терапии АБА, обращает на себя внимание низкий процент больных (12,9%, 52 пациента), получавших АСИТ, и только у 27 было проведено 3-и и более курсов АСИТ.
С целью оценки реального состояния БА у пациентов, нами был проведен опрос пациентов, случайно выбранных из 515 больных, чьи амбулаторные карты были включены в ретроспективный анализ. Опрос больных осуществлялся с помощью телефонного интервью по специально разработанной анкете, включающей 6 вопросов, касающихся течения БА за последний год, а также терапии и контроля БА. Для оценки контроля астмы использовали АСТ-тест. Получить ответы на все вопросы интервью удалось у 200 пациентов с БА в возрасте от 17 до 77 лет (средний возраст–34 ± 15,8), мужчин было 121, женщин 79 человек. Большинство пациентов (168 человек) имели АБА, 29–страдали НАБА и 3 пациента– АБА+НАБА. У 122 больных, по данным амбулаторных карт, была легкая БА, у 73 – среднетяжелая БА и у 5–тяжелая БА.
Была отмечена выраженная диссоциация в фармакотерапии между данными амбулаторной карты и результатами опроса больных. Частота использования препаратов β2-агонистов короткого действия в качестве монотерапии в 2,5 раза выше по результатам интервью, чем по данным амбулаторных карт, а частота базисной терапии ИГКС, наоборот, в 2,2 раза ниже, также как и кромонов – в 2,8 раза ниже. Комбинированные препараты (ИГКС+ДДβ2-агонисты), напротив, использовало в 2 раза большее число больных, чем по данным анализа амбулаторных карт. Результаты интерактивного опроса показали, что 43% больных БА имеют неконтролируемую астму, причем большинство больных (79,5%) отмечали обострения болезни в течение последнего года, по поводу которых, 10% больных лечились в стационаре, а 8% - прибегали к неотложной помощи. 74% пациентов (148 человек) обращались к врачу в течение последнего года, в связи с ухудшением БА, причем большинство обращений (40%) было к врачу-терапевту, что демонстрирует важность первичного звена медицинской помощи в отношении лечения и контроля БА. Наши данные согласуются с результатами последних международных исследований по оценке контроля БА. В частности, в исследовании REACT (Real-world Evaluation of Asthma Control and Treatment), проведенном в США, результаты АСТ-теста показали, что 45% пациентов имели контролируемую БА и 55% - неконтролируемую БА.
С целью определения уровня общего IgE в крови больных АБА различного возраста, пола, с разной степенью тяжести БА и спектром сенсибилизации, был обследован 91 пациент (58 мужчин и 33 женщины) в возрасте от 16 до 82 лет. Большинство пациентов (59,3%), независимо от возраста и пола, имели повышенный уровень общего IgE сыворотки крови. Уровень общего IgE у мужчин (Ме=189; 80÷409) оказался несколько выше, чем у женщин (Ме=160; 86÷330), однако разница статистически незначима (р=0,8656) (Рис. 3).
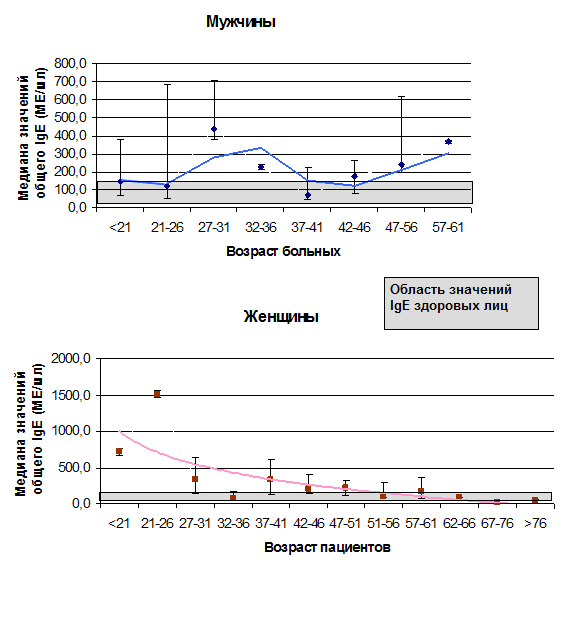
Рис. 3 Содержание общего IgE в крови больных атопической БА
Уровень общего IgE сыворотки крови статистически значимо коррелирует с аллергенспецифической кожной реактивностью у всех больных АБА (R=0,37, p=0,0002) независимо от пола и возраста: чем шире спектр сенсибилизации, тем выше общий IgE. Уровень общего IgE у мужчин имел характерную кривую и статистически значимо положительно коррелировал с тяжестью астмы (R=0,34, p=0,01), что не наблюдалось у женщин. Полученные данные, возможно, обусловлены возрастной разницей между мужчинами и женщинами с АБА. Выявлена статистически значимая обратная корреляция уровня общего IgE в зависимости от возраста женщин (R=-0,44, p=0,01).
На основании результатов проведенного исследования и использования статистического анализа, мы выделили клинические фенотипы АБА взрослых, в зависимости от возраста начала астмы. Были выделены: возраст раннего начала БА до 16 лет включительно (детство и ранний подростковый возраст) и возраст позднего дебюта БА – после 16 лет. Результаты проведенного исследования показали, что эти клинические фенотипы АБА различаются (Табл.1). Для АБА с ранним началом, более характерна отягощенная наследственность по БА (ОШ=2,15; ДИ 1,31-3,52) и атопии (ОШ=2,84; ДИ 1,74-4,65), по сравнению с больными, заболевшими после 16 лет. Вероятность заболеть АБА в возрасте до 16 лет выше у мужчин (ОШ =11,8; ДИ 7,29-19,09, р<0,05), а в возрасте после 16 лет выше у женщин (ОШ= 0,08; ДИ 0,05-0,14, р<0,05). Кроме этого, возраст начала болезни может служить в некоторой степени предикторным фактором относительно дальнейшего течения АБА. У больных АБА, заболевших после 16 летнего возраста, вероятность формирования более тяжелой формы БА выше, по сравнению с заболевшими в детстве и подростковом возрасте (ОШ 0,37; ДИ 0,24-0,56, р<0,05) (Рис. 4). Косвенным подтверждением этого является наличие статистически значимого (р<0,001) различия в средних значениях ОФВ1 (% должного) между этими группами: ОФВ1 у заболевших до 16 лет - 88,7% (17,3), а у заболевших после 16 лет – 75,8% (17,26). При этом, мы обнаружили статистически значимое (р<0,05) различие в частоте встречаемости полисенсибилизации к бытовым+пыльцевым+эпидермальным аллергенам у больных, заболевших до и после 16- летнего возраста (Р=0,57, ДИ 0,50;0,63 и Р=0,39, ДИ 0,31;0,47), что свидетельствует о том, что лица, заболевающие астмой в детском и подростковом возрасте, чаще имеют полисенсибилизацию к наиболее распространенным ингаляционным аллергенам, но при этом течение их БА значимо легче, что было продемонстрировано нами при проведении исследования реального контроля БА у 200 пациентов. Пациенты с поздним дебютом БА, имеют достоверно (р<0,05) большую частоту обострений БА за последний год (ОШ=0,51; ДИ 0,28-0,93), а также получают достоверно больший объем противовоспалительной фармакотерапии (ОШ=0,24; ДИ 0,13-0,44, р<0,05). Одновременно было статистически значимо (р<0,05) показано, что достижение контролируемой астмы по результатам АСТ-теста преобладает в группе лиц, заболевших до 16 лет (ОШ=2,83, ДИ 1,58-5,9).
Таблица 1.
Характеристика клинических фенотипов раннего
и позднего дебюта атопической БА
| Признак | АБА с ранним (до 16 лет включительно) началом | АБА с поздним (после 16 лет) началом | Статистическая значимость признака |
| Пол | Более вероятно мужской | Более вероятно женский | p<0,05 |
| Тяжесть течения БА | Более вероятно легкая | Более вероятно среднетяжелая или тяжелая | p<0,05 |
| Функция легких | Менее вероятно снижение | Более вероятно снижение | p<0,05 |
| Полисенсибилизация к ингаляционным аллергенам | Более вероятна | Менее вероятна | p<0,05 |
| Частота обострения БА | Редкие | Частые | p<0,05 |
| Достижение контроля БА | Более характерно | Менее характерно | p<0,05 |
| Частота сопутствую-щих заболеваний | Менее выражена | Более выражена | p<0,05 |
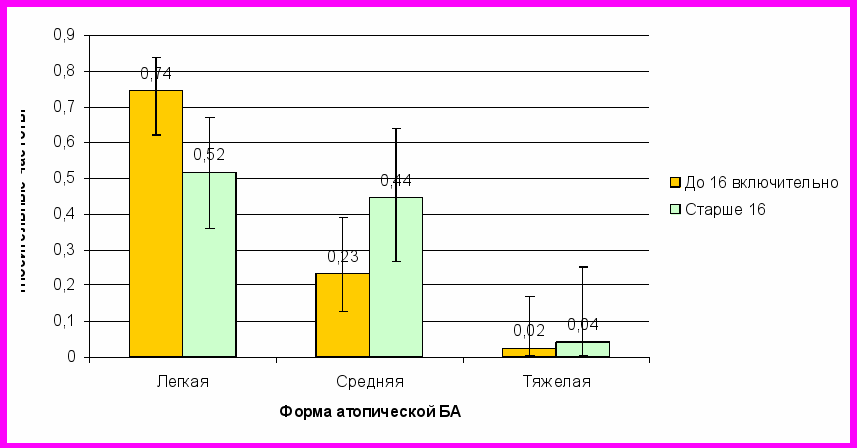 Рис. 4 Тяжесть течения атопической БА в зависимости от клинических фенотипов с ранним и поздним дебютом
Рис. 4 Тяжесть течения атопической БА в зависимости от клинических фенотипов с ранним и поздним дебютомТаким образом, клинический фенотип АБА с поздним дебютом, характеризуется большей вероятностью формирования более тяжелой неконтролируемой астмы, а стало быть, требует особого подхода к назначению базисной противовоспалительной терапии и мониторингу больных.
2. Клинический фенотип атопической бронхиальной астмы подростков мужского пола. Обследовано 728 подростков мужского пола с БА (средний возраст: 17,3±0,8 лет). Контрольную группу (10 человек) составили подростки 16-18 лет без анамнеза аллергических заболеваний, с отрицательными результатами кожных тестов с аллергенами и отсутствием нарушений бронхиальной проходимости. Всем им проводились БПТ с метахолином и субклинической дозой аллергена.
Выявлено, что у подростков мужского пола, страдающих астмой, доминирует атопическая форма болезни (у 98% больных). Клинический фенотип атопической БА подростков мужского пола характеризуется: легким интермиттирующим течением у большинства (72%) больных; нормальными показателями ФВД (у 95,5% больных); сочетанием с АР практически у всех пациентов (99%); наличием сочетанной сенсибилизации к бытовым и пыльцевым аллергенам у 42,0, а к бытовым, пыльцевым и эпидермальным у 30,6% больных; моносенсибилизаци к бытовым или пыльцевым аллергенам – у 14,4%. Аллергены пыльцы деревьев оказались на втором месте (у 70,1% больных) после домашней пыли –(у 93,8% больных) по частоте положительных кожных тестов. 41,6% подростков с пыльцевой сенсибилизацией отметили наличие перекрестной пищевой аллергии, преимущественно к свежим фруктам и овощам. Самым частым пищевым аллергеном (исключая перекрестную пищевую аллергию) у обследованных подростков оказалась рыба - 9,8%. Большинство подростков (62,5%) с АБА имели отягощенную наследственность по БА и/или атопии.
Пик заболеваемости атопической БА у мальчиков приходится на возраст от 7 до 13 лет и существенно снижается после 15 лет (Рис. 5). Частота постановки диагноза АБА у мальчиков до 5 лет и после 15 лет практически совпадают. Интервал с момента появления первых симптомов болезни до постановки диагноза исчислялся 2 – 5 годами и составил в среднем 3,6 лет.

Рис. 5 Возраст постановки диагноза атопической БА у подростков
В связи с особенностями естественного течения заболевания с частыми длительными ремиссиями, возникают проблемы диагностики БА у лиц подросткового возраста, что особенно актуально для юношей. В этой связи большое значение предается бронхопровокационным тестам (БПТ), направленным на выявление БГР, как основного маркера БА, ибо выявление обратимости бронхиальной обструкции для этой категории пациентов является малоинформативным. Наши результаты показали, что тест на выявление обратимой обструкции бронхов оказался положителен лишь у 20,5% подростков с БА, что обусловлено стабильной ремиссией болезни и отсутствием функциональных нарушений у большинства пациентов. БПТ с метахолином оказался высокочувствительным (Se=90,2%) и специфичным (Sp=90%) методом для диагностики БА у подростков. Прогностическая ценность положительного результата (+PV) - 99,8%, а прогностическая ценность отрицательного результата (-PV) – 14,5%. Несмотря на ремиссию и легкую форму БА, большинство подростков (59%) имели высокую или среднюю степень БГР, что свидетельствует о наличии персистирующего бессимптомного воспаления в нижних дыхательных путях у этих пациентов. Чувствительность провокационного теста с физической нагрузкой, выполненного у 23 подростков с БА (положительный – у 11 больных), по результатам нашего исследования, составила Se = 47,8%.
С целью изучения диагностической значимости специфического БПТ, а также различных малоинвазивных методов определения аллергического воспаления в нижних дыхательных путях, было обследовано 78 подростков и молодых людей мужского пола, страдающих легкой интермиттирующей АБА и 7 здоровых субъектов в возрасте от 16 до 23 лет, составивших контрольную группу. Все пациенты были в возрасте от 16 до 25 лет и на момент проведения исследования имели ремиссию или стойкую ремиссию легкой формы БА.
На первом этапе проводили традиционное обследование (общеклиническое, специфическое аллергологическое, исследование ФВД с тестом на обратимость бронхообструкции и БПТ с метахолином). На втором этапе проводили изучение диагностической значимости специфического БПТ с аллергеном, исследования индуцированной мокроты до и после субклинического БПТ с аллергеном, определение NOex. В зависимости от результатов начального этапа обследования, пациенты были разделены на четыре группы. В первую группу вошли 13 пациентов с отрицательным БПТ с метахолином и низкой кожной специфической чувствительностью. На втором этапе им проводился БПТ с десятикратными разведениями аллергена домашней пыли. Во вторую группу вошли 18 пациентов с положительным БПТ с метахолином. Все эти пациенты имели сенсибилизацию к домашней пыли и на втором этапе исследования им проводился провокационный ингаляционный тест с аллергеном из домашней пыли по стандартной методике (Cockcroft D.W. и коллеги, 1987 г). Третью группу составили 31 пациент с отрицательным неспецифическим БПТ с метахолином и для них был специально разработан специфический БПТ с расчетом предполагаемой дозы аллергена на основании кожного титрования. Четвертую группу составили 16 пациентов в стадии стойкой ремиссии БА. Симптомы болезни отсутствовали у этих больных на протяжении более 2-х лет (в среднем: 4,5 ± 3,07). Все они были сенсибилизированы к бытовым, а 10-ь человек и к пыльцевым аллергенам. Пациентам из этой группы было проведено изучение в индуцированной мокроте клеточного состава и содержания ЕСР до и после БПТ с низкой (субклинической) дозой специфического аллергена (домашней пыли).
БПТ с десятикратными разведениями аллергена домашней пыли был положительным у 4-х пациентов и у 9-и – отрицательным. Чувствительность этого теста, по результатам нашего исследования, составила Se =30,8%. Целью проведения исследования во 2-й группе являлось изучение чувствительности методики, определение корреляции между специфической кожной чувствительностью и чувствительностью бронхов, а также определение субклинической дозы аллергена для дальнейшего проведения низкодозового специфического БПТ. В результате БПТ с аллергеном домашней пыли у пациентов из 2-ой группы оказался положительным у 17-и человек, и только у одного пациента - отрицательным. Снижение ОФВ1 происходило в течение 15-30 мин после ингаляции клинически значимой дозы специфического аллергена, поздних астматических реакций зафиксировано не было. Чувствительность (Se) БПТ с двукратными разведениями аллергенами, выполненного по стандартной методики, составила - 94,4%. Было выявлено существование статистически значимой корреляции только между фактической ПК20 аллергена и конечной точкой кожного теста (R=0,492, p=0,045). Данный факт послужил основой для разработки специфического БПТ для пациентов с отрицательным БПТ с метахолином. Нами (совместно с Л.А.Горячкиной и М.Ч.Тотиковой) [32,44] был разработан специфический БПТ двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для пациентов с отрицательными неспецифическими БПТ. При аллергометрическом кожном титровании для пыльцевых аллергенов и аллергенов клеща домашней пыли использовали разведения от 1:4096(2,44 PNU) до 1:4(2500 PNU), для аллергена домашней пыли от 1:4096(2,44 PNU) до 1:2(5000 PNU). После определения конечной точки кожного теста, выбирали начальную концентрацию аллергена, отступая на 4-е двукратных разведения ниже конечной точки кожного теста и это разведение специфического аллергена являлось стартовым. Дальнейшее проведение БПТ не отличалось от стандартного метода. У 7-и пациентов, предполагаемая (по кожному тесту) доза аллергена, совпала с фактической дозой, вызвавшей 20% снижение ОФВ1 при БПТ. У половины больных (10 человек) фактическая доза превышала расчетную в 1-4 раза, и только у 5-и пациентов она оказалась ниже предполагаемой на 1-3 разведения. У 9-и пациентов БПТ со специфическим аллергеном был отрицательным. Чувствительность, разработанного нами теста, зависит от вида аллергена: Se аллергена клеща домашней пыли =54,55%, Se аллергена дом. пыли =66,67%, Se пыльцевых аллергенов =88,89%. Наши результаты показали, что в случае отрицательного БПТ с метахолином, для расчета предполагаемой ПК20 аллергена для специфического БПТ, возможно использовать результаты кожного титрования со специфическим аллергеном, отступая на 4-е разведения вниз, т.к. риск развития тяжелого бронхоспазма для этих пациентов составляет Р =0,32, ДИ: 0,074-0,720, р<0,05.
У 21 подростка с атопической БА было проведено определение NO в выдыхаемом воздухе: медиана (Ме) выборки составляла 17(10 ÷ 31) ppb. Было отмечено существование слабой обратной корреляционной связи (R=0.26) между уровнем NOех и ПК20 метахолина у этих пациентов, что закономерно, т.к. известно, что NОех и БГР являются биологическими маркерами аллергического воспаления при БА. 6-и пациентам с отрицательным результатом БПТ со специфическим аллергеном и 4-м с положительным, было проведено определение NOex до и через 24 часа после БПТ. У пациентов с отрицательным БПТ с аллергеном, не наблюдалось статистически достоверных различий уровня NOех по сравнению с контрольной группой, как до БПТ (Ме=11, 7÷17, p=0,15), так и после (Ме=12,5, 11÷15, p=0,15), что служит косвенным подтверждением отсутствия аллергического эозинофильного воспаления в дыхательных путях у этих пациентов. А у пациентов с положительным БПТ с аллергеном было отмечено статистически значимое изменение уровня NOex через 24 часа после БПТ (Ме до=39,5, 29 ÷ 53; Ме после=58,5, 48,5 ÷ 95, р=0.067). Таким образом, изменение NOex является чувствительным маркером бронхиального ответа на специфический аллерген.
Субклиническая (низкая) доза аллергена для проведения низкодозового БПТ для пациентов в фазе стойкой ремиссии БА (4-я группа) составила 1250 PNU. Пациентам провели исследование индуцированной мокроты до и после (через 8-10 часов) низкодозового БПТ с аллергеном домашней пыли. Такая же процедура исследования была проведена подросткам, составившим контрольную группу. Содержание эозинофилов и уровень ЕСР в индуцированной мокроте больных БА были достоверно выше, по сравнению с контрольной группой здоровых (р<0,05), до проведения специфического БПТ. После БПТ, в позднюю фазу ответа у больных происходило достоверное увеличение (р<0,05) количества эозинофилов и ЕСР в индуцированной мокроте, тогда как в контрольной группе значимых изменений не наблюдалось (Рис. 6). Достоверных изменений количества других клеток отмечено не было.
Таким образом, у пациентов с атопической БА даже в фазе стойкой ремиссии болезни отмечаются признаки субклинического аллергического воспаления в нижних дыхательных путях, проявляющегося повышенным содержанием эозинофилов и ЕСР в индуцированной мокроте, которые достоверно возрастают после низкодозовой провокации аллергеном. Исследование индуцированной мокроты у больных интермиттирующей БА может служить дополнительным диагностическим методом, особенно в сочетании с низкодозовым БПТ со специфическим аллергеном.
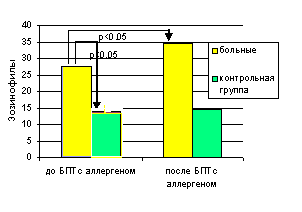
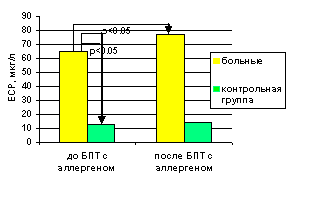
Рис 6. Изменение количества эозинофилов и уровня ЕСР в индуцированной мокроте больных БА, по сравнению со здоровыми после БПТ со специфическим аллергеном
| | | | ||
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
Нами разработан алгоритм медицинского освидетельствования подростков и призывников с БА (Рис. 7). Следуя этому алгоритму, диагноз БА может быть подтвержден на различных этапах обследования, в зависимости от полученных результатов. Комплексная поэтапная диагностика БА, включающая функциональное обследование легких с проведением БПТ, и специфическое аллергологическое обследование, позволяет верифицировать диагноз БА даже в фазе стойкой ремиссии болезни у подростков.
Оценка уровня контроля БА у подростков с помощью АСТ-теста показала, что более половины (56%) подростков, имеющих легкую форму БА, отмечают неконтролируемое ее течение, не получают адекватной фармакотерапии и, соответственно, являются группой риска развития обострения БА. Анализ результатов АСТ и объективных параметров контроля БА (ОФВ1 и степени БГР) выявил наличие статистически значимой корреляции между ОФВ1 и АСТ (R=0,28, р<0,05) и между порогом БГР (ПК20) и АСТ (R=0.24, р<0,05). Показатель АСТ-теста связан с функциональными маркерами контроля БА и, прежде всего, с ОФВ1, что важно, так как не во всех медицинских учреждениях возможно проведение спирометрического исследования.
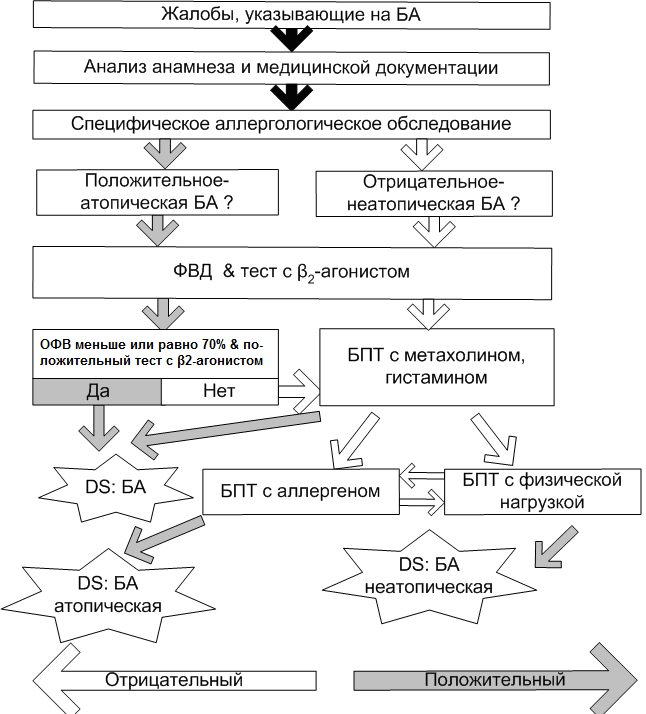
Рис. 7 Алгоритм медицинского освидетельствования подростков и
призывников с БА
