На правах рукописи
| Вид материала | Автореферат |
Содержание4. Эффективность различных методов лечения и контроля атопической бронхиальной астмы Таблица 4 Уровень NOex при различных этиологических формах БА АБА+НАБА (n=16) |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
3. Клинический фенотип бронхиальной астмы у больных с В16 Arg/Arg типом β2-адренорецептора. В результате скринингового обследования 100 пациентов с БА (муж. 47, жен. 53; средний возраст: 42,6±13,2) было выявлено 19 больных (19%), являющихся гомозиготами по В16-Arg/Arg β2-адренорецептора. На основании проведенного анализа и расчета ОШ, показано, что наличие В16-Arg/Arg типа β2-адренорецептора не зависит от пола, этиологической формы БА и степени тяжести болезни, наличия ринита и частоты сопутствующих заболеваний. При анализе возраста начала БА у пациентов с В16-Arg/Arg типом β2-адренорецептора (Ме=21; 7÷30) и не имеющих такового (Ме=27; 14÷35) с помощью критерия Манна-Уитни не было обнаружено статистически значимого (р=0,054) различия, однако прослеживается тенденция к более раннему развитию БА у больных, имеющих В16-Arg/Arg тип β2-адренорецептора. Анализ длительности применения комбинированных препаратов (ИГКС+ДДβ2А) больными в группе с В16-Arg/Arg типом β2-адренорецептора и в группе больных, не имеющих этого типа рецептора (ОШ =1,87; ДИ: 0,57- 6,09) позволяет утверждать, что не существует статистически значимого различия (р<0,05) между данными группами с точки зрения эффективности применения комбинированных препаратов. Данный факт нашел косвенное подтверждение в анализе функциональных параметров. Средние значения ОФВ1, составившие в 1-й группе больных (+В16-Arg/Arg тип β2-адренорецептора) 73,3% (13,8), а во 2-й - 75,6 (13,6), статистически значимо (р=0,5229) не различались. С целью изучения воздействия различных бронхолитических препаратов на пациентов 1-й (+В16-Arg/Arg тип β2-адренорецептора) и 2-й (-В16-Arg/Arg тип β2-адренорецептора) групп, мы провели тесты на выявление обратимой обструкции бронхов с препаратом β2-агонистом (сальбутамол в дозе 400 мкг) и антихолинергическим препаратом (ипратропия бромид 80 мг) (Рис. 8).
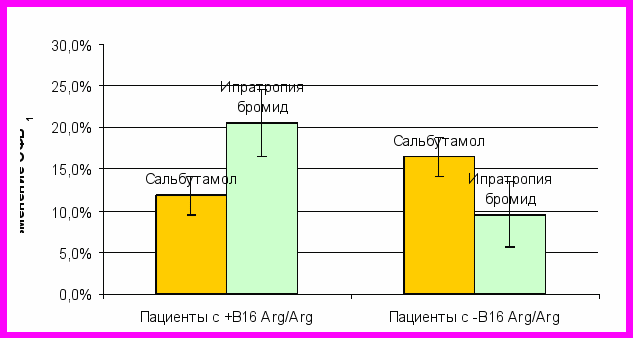
Рис. 8 Изменение ОФВ1 у больных 1-й (+В16-Arg/Arg тип β2-адренорецептора) и 2-й (- В16-Arg/Arg тип β2-адренорецептора) групп в бронхолитическом тесте с сальбутамолом и ипратропия бромидом
У пациентов с + В16-Arg/Arg типом β2-адренорецептора бронхолитический ответ на сальбутамол (∆ОФВ1=11,8% (5,6%)) менее выражен, чем на ипратропия бромид (∆ОФВ1= 20,5% (10,4%)), р=0,0037, в отличие от пациентов 2-й группы, с отрицательным В16-Arg/Arg типом β2-адренорецептора. У последних бронхолитический ответ на короткодействующий β2-агонист (∆ОФВ1=16,5% (6,9%)) статистически значимо (р=0,0047) выше, по сравнению с ответом на антихолинергический препарат (∆ОФВ1=9,54% (5,56%)), а также по сравнению с ответом на сальбутамол у больных 1-й группы (p=0,038). При исследовании БГР у этих больных в тесте с метахолином, не было выявлено статистически значимых (р=0,4414) различий в средних значениях ПК20 для 1-й (Ме=0,75; 0,5÷4,0) и 2-й групп (Ме=1,0; 0,6÷4,0).
4. Эффективность различных методов лечения и контроля атопической бронхиальной астмы
Эффективность и безопасность различных режимов фармакотерапии в достижении контроля атопической БА. ИГКС являются приоритетными препаратами среди группы противовоспалительных противоастматических средств, однако, зачастую среди пациентов с легкой БА отмечается низкая приверженность этому виду фармакотерапии. Мы исследовали возможность альтернативной базисной противовоспалительной фармакотерапии с помощью антилейкотриенового препарата монтелукаст в качестве монотерапии (10 мг один раз в сутки вечером в течение 12 недель) у 15 пациентов с легкой неконтролируемой БА. Контрольной группой являлись 5 пациентов с легкой персистирующей АБА, получавшие только короткодействующие β2-агонисты в режиме по требованию.
Оценка эффективности терапии проводилась с использованием комплекса параметров, позволяющих оценить не только клинический, но и противовоспалительный эффект проводимого лечения: динамики симптомов и потребности в скоропомощных препаратах по дневникам самонаблюдения пациентов, показателей пикфлоуметрии и спирометрии, АСТ-теста, измерение NOех, изменение БГР в метахолиновом тесте. Безопасность терапии исследовалась путем выявления нежелательных побочных явлений с помощью опроса пациентов. В результате монотерапии монтелукастом была отмечена статистически значимая положительная динамика в дневных симптомах БА (до лечения – 10 (7÷9), после – 0 (0÷6), р=0,0034) и потребности в бронхолитических препаратах (до лечения 2,5 (2÷5), после 0 (0÷0), р=0,0483). Увеличилась утренняя ПСВ (л/мин) (до лечения 385.7 (334,3÷497,1), после – 402,1 (344,3÷499,1), р=0,0323) и ОФВ1 (%долж.) (до лечения 88 (72÷100), после – 98 (84÷106), р=0,047). Уровень контроля астмы, оцениваемый больными с помощью АСТ-теста, также статистически значимо вырос (до лечения – 19 (18÷20), после – 23,5 (21÷25), р=0,0327). На момент включения в исследование, уровень NОex у больных в группе лечения (Me=77; 46÷86 ppb), а также в контрольной группе (Me=35; 21÷40) оказался статистически значимо выше по сравнению со значениями NОex в контрольной группе здоровых (Me=10; 5÷17), р=0,0008 и р=0,017, соответственно. Изменения в уровне NОex после лечения монтелукастом, хотя и имели тенденцию к уменьшению, но статистически незначимую. Изменения в пороге БГР у пациентов также оказались статистически не достоверны до и после лечения монтелукастом. Каких-либо значимых изменений показателей в контрольной группе не отмечалось. Все пациенты, получавшие монтелукаст, отметили хорошую его переносимость и отсутствие каких-либо побочных эффектов.
Полученные результаты показывают, что клинический контроль БА не означает контроль воспаления дыхательных путей. Изучаемые маркеры воспаления (NOex и БГР) свидетельствуют об отсутствии контроля воспаления у данных пациентов. Применение антилейкотриенового препарата, в качестве монотерапии в течение 12 недель, у больных легкой персистирующей неконтролируемой АБА, является эффективным для достижения клинико-функционального контроля, но недостаточно эффективным для достижения контроля воспаления.
У 44 больных со среднетяжелой и тяжелой АБА проводилось сравнительное исследование клинической эффективности и безопасности комбинированных препаратов (ИГКС+ДДβ2А), применяемых с помощью различных терапевтических режимов. 18 пациентов получали терапию сальметерол/флутиказона пропионат (САЛ/ФП) в виде стабильной дозы (50/500 мкг дважды в день в течение 12 недель) с использованием сальбутамола в качестве скоропомощного препарата. 26 больных получали формотерол/будесонид (ФОР/БУД) (в дозе 9/320 дважды в день в течение 12 недель) в режиме SMART (Symbicort Maintenance and Reliever Therapy), который подразумевает использование одного ингалятора, как в качестве средства базисной терапии, так и для купирования приступов затрудненного дыхания. Группы больных имели сходные характеристики в отношении возраста, пола, тяжести БА и сопутствующих заболеваний. Эффективность проводимого лечения у этих больных оценивалась по тем же самым клинико-функциональным параметрам и маркерам воспаления, что и у больных, получавших монтелукаст. На время вводного периода (1 неделя) все пациенты были переведены на монотерапию ИГКС (беклометазона дипропионат 500 мкг дважды в день + сальбутамол «по требованию»). В результате лечения, в группе больных, получавших ФОР/БУД в режиме SMART, была отмечена статистически значимая положительная динамика в дневных (вводный период – 7 (3-11), последняя неделя лечения – 4 (0-8), р=0,044) и ночных симптомах (1 (0-4) и 0 (0-0), соответственно, р=0,032) астмы, в снижении потребности в дополнительных ингаляциях ФОР/БУД (вводный период – 8 (2-12), последняя неделя лечения – 1(0-8), р=0,033) в функциональных показателях (ОФВ1 ввод. период – 74,5 (58,0-89,0), последняя неделя лечения – 83 (70-89), р=0,012). Произошло статистически значимое снижение NOex (34 (21-66) и 21 (11-32), р=0,004), однако не было отмечено статистически значимого изменения неспецифической БГР, измеренной у 10 больных из этой группы. В результате лечения, количество больных с хорошо контролируемой астмой увеличилось на 16 больных (на 633%) по результатам АСТ-теста. Статистически значимо выросло качество жизни этих пациентов, оцененное по вопроснику AQLQ (вводный период – 146,5 (121-181), последняя неделя лечения – 189 (173-199) баллов, р<0,0001).
В группе больных, получавших САЛ/ФП в режиме стабильной дозы, была отмечена статистически значимая выраженная положительная динамика всех клинико-функциональных показателей, а также уровня NOex после 12-недельного лечения. Исследование неспецифической БГР было выполнено лишь у трех пациентов из этой группы и не выявило значимых изменений в результате проведенного лечения. В этой группе больных, количество пациентов с хорошо контролируемой астмой увеличилось на 7 человек (на 275%) и также произошло статистически значимое улучшение качества жизни больных. С целью сравнения двух режимов лечения комбинированными препаратами больных АБА, мы сопоставили изменения, произошедшие в клинико-функциональных параметрах, NOex, АСТ и AQLQ у больных, получавших ФОР/БУД в режиме SMART и САЛ/ФП в режиме стабильного дозирования (Таблица 3). Как видно из таблицы, не было выявлено существенной разницы в клинико-функциональной эффективности этих двух режимов фармакотерапии БА. Оба они оказались эффективными в отношении достижения хорошо контролируемой астмы (по данным АСТ-теста) и привели к улучшению качества жизни больных. Было зафиксировано более выраженное уменьшение дневных симптомов и снижение NOex у больных, получавших САЛ/ФП в режиме стабильной дозы, что возможно отражает большую противовоспалительную активность данного режима. Однако это предположение требует дальнейших исследований. Частота побочных эффектов также статистически значимо не различалась у пациентов, получавших САЛ/ФП в режиме стабильной дозы, и у пациентов, получавших ФОР/БУД в режиме SMART.
Эффективность и безопасность сублингвальной АСИТ. С целью изучения эффективности и безопасности СЛАСИТ у пациентов с аллергией к клещу домашней пыли, проведено открытое несравнительное исследование СЛАСИТ сублингвальными аллергенами смеси клещей (Acarus siro, Dermatophagoides farinae, Dermatophagoides pteronyssinus) фирмы «Sevapharma» (Чехия) у пациентов, страдающих изолированным аллергическим риноконъюнктивитом (8 больных) или в сочетании с АБА легкого интермиттирующего или персистирующего течения (9 пациентов). Никто из пациентов, включенных в исследование, ранее не получал АСИТ. Общая продолжительность исследования составила 408,0 (399,0÷418,0) дней.
Таблица 3.
Сравнение изменений в клинико-функциональных параметрах, NOex, АСТ и AQLQ у больных, получавших ФОР/БУД в режиме SMART и САЛ/ФП в режиме стабильного дозирования
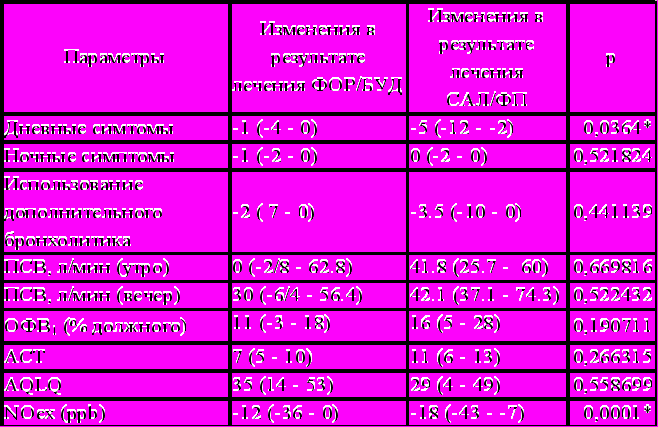
* статистически значимо
Средняя продолжительность СЛАСИТ составила 367,1 (2,6) дней. Мы использовали сокращенную схему, при которой инициирующая фаза длится в течение 50 дней. Пациенты начинали с приёма 1 капли минимальной концентрации (1 PNU) и каждый день повышали дозу на 1 каплю вплоть до достижения 10 капель. После чего переходили на 1 каплю следующей повышенной концентрации. По достижении максимальной концентрации (10 000 PNU) и дозы (10 капель), пациенты переходили на поддерживающую дозу (5-10 капель аллергена концентрации 10 000PNU) 1 раз в 7-10 дней. Средняя суммарная доза аллергена, полученная за период исследования, составила - 329559 (1015,8) PNU. В результате СЛАСИТ у всех пациентов отмечено статистически значимое уменьшение клинических проявлений АР, БА и аллергического конъюнктивита, проявляющиеся в
снижении общего балла клинических симптомов (с 14,0 (13,0÷16,0) до лечения, до 4,0 (3,0÷5,0) – после, р=0,0003). У всех пациентов произошло уменьшение (р<0,05) потребности в симптоматической терапии (антигистаминовых препаратах, интраназальных кортикостероидах, бронхолитических препаратах), проявляющееся в сокращении количества дней использования этих препаратов. До проведения СЛАСИТ, все больные имели положительный специфический провокационный назальный тест с аллергеном клеща, причем средний порог чувствительности составил 156,25 (39,1÷312,5) PNU. После проведения СЛАСИТ, назальная провокация аллергеном клеща оказалась положительной только у 6 пациентов, а порог специфической назальной чувствительности вырос до 10000 (2500÷10000) PNU. Системный эффект СЛАСИТ демонстрирует и значимое снижение кожной специфической чувствительности, проявляющееся в уменьшении размера кожной пробы на аллерген клеща после лечения (до СЛАСИТ - 8,9 (1,5) мм, после - 6,9 (2,4), р=0,0007). Мы не обнаружили статистически значимых изменений в уровне ЕСР в сыворотке крови, однако было выявлено статистически значимое снижение количества эозинофилов и ЕСР в назальном секрете больных после проведения СЛАСИТ. Процентное содержание эозинофилов в назальном секрете больных до СЛАСИТ–15,0 (12,0÷20,0), после–7,5 (4,5÷12,0), р=0,005; ЕСР: 474,0 (416,0÷599,0) и 78,0 (56,0÷321,0) μg/л, соответственно, р=0,02. Одновременно отмечалось выраженное увеличение sIgA в назальном секрете у пролеченных пациентов (с 55,0 (23,5÷97,5) до 330,0 (270,5÷929,0) μg/л, р=0,01). По-видимому, именно этими изменениями объясняется снижение специфической назальной гиперреактивности, в основе которой, лежит эозинофильное воспаление в слизистой носа. В качестве косвенного подтверждения можно рассматривать существование сильной обратной корреляционной связи (R=-0,94, р=0,0008) между изменением количества эозинофилов в назальном секрете и порогом специфической назальной чувствительности. Все эти локальные изменения свидетельствуют о противовоспалительном эффекте СЛАСИТ. У пациентов, получавших СЛАСИТ, статистически значимо повысилось качество жизни, оцениваемое с помошью вопросников RQLQ и AQLQ. Статистически значимой разницы в изучаемых показателях у больных АР+АБА по сравнению с пациентами, страдающими изолированным АР, обнаружено не было. Из чего было сделано заключение об одинаковой эффективности СЛАСИТ для больных АР и АБА.
Безопасность СЛАСИТ оценивалась по наличию побочных реакций в процессе проведения АСИТ. Системных реакций не было отмечено ни у одного больного. Локальные побочные реакции зафиксированы у 2 пациентов (11,8%) и проявлялись жжением, зудом, покалыванием в ротовой полости. Эти реакции были легкими, возникали сразу после приема аллергена и, как правило, проходили в течение 30 минут самостоятельно.
В результате СЛАСИТ у 16 пациентов (94,1%) получены отличные и хорошие результаты лечения, у одного больного - удовлетворительный эффект.
Эффективность и безопасность интраназальной АСИТ. В открытом рандомизированном исследовании нами совместно с О.С. Дробик изучена клиническая эффективность и безопасность ИНАСИТ аллергеном клеща домашней пыли и аллергоидом домашней пыли по сравнению с классическим подкожным методом (ПКАСИТ) при круглогодичном аллергическом рините легкого течения без или в сочетании с АБА легкого персистирующего течения. Использовали вариант проведения ИНАСИТ, в основе которого была схема, предложенная Ушаковой Т.А., 1973г. Для проведения ИНАСИТ, начальную концентрацию аллергена определяли выявлением пороговой чувствительности пациента с помощью аллергометрического титрования на слизистой носа. Проведение ИНАСИТ рекомендуется пациентам с порогом специфической назальной чувствительности 100 PNU/мл или выше. Начальная концентрация аллергена при ИНАСИТ: 0,1 PNU/мл для водно-солевых аллергенов и 1 PNU/мл для аллергоидов, как при подкожном методе АСИТ. Количество вводимой аллерговакцины было постоянным, с постепенно повышающейся концентрацией. Общее количество (0,25мл) аллерговакцины закапывали интраназально инсулиновым шприцом по 5 капель в каждую ноздрю. Наблюдая за пациентом в течение 30 минут, оценивали реакцию со стороны слизистой оболочки носа. Суммарная доза аллергена, так же как и кратность введения, были индивидуальны для каждого больного: учитывалась назальная реакция и общее самочувствие пациента. Интервал между введениями аллергена составлял 24—48 часов, в зависимости от предыдущей реакции на введение аллергена. По достижении концентрации аллергена 2500 PNU, лечение продолжали в режиме поддерживающих доз (один раз в 7-14 дней) в течение года, с учетом индивидуальной переносимости лечения. В исследование было включено 48 пациентов: 9 женщин и 39 мужчин, в возрасте от 18 до 26 лет (средний возраст 19,7±2,5). 9 (18,7%) пациентов имели изолированный АР, а 39 (81,2%) - сочетание АР и АБА обусловленные сенсибилизацией только к бытовым аллергенам. 1-я группа больных (29 человек) получали лечение ИНАСИТ, 2-я (19 больных) – ПКАСИТ. Общая продолжительность лечения составила 12 месяцев. Эффективность терапии оценивали по совокупности параметров: клинических проявлений и их интенсивности (общий индекс симптомов АР и БА), потребности в симптоматической терапии, а также по объективным критериям, таким как ФВД, специфической назальной реактивности, порогу чувствительности к метахолину. У всех пациентов была отмечена статистически значимая (р<0,05) положительная динамика симптомов АР и БА, и функциональных показателей.
У большинства пациентов в результате проведения АСИТ произошло уменьшение БГР, наиболее выраженное в группе больных, получавших ИНАСИТ аллергоидом домашней пыли ( ПК 20 мг/мл до ИНАСИТ - 0,18±0,01, после – 4.5±0,9, р<0,001). Пациенты, получавшие ИНАСИТ аллергоидом домашней пыли, достигали самой большой курсовой дозы PNU ─ 100 909, что в 6,8 раза превысило дозу при подкожном методе АСИТ (14 702 PNU).
Отличный эффект АСИТ был получен в 59% случаев, причем в подгруппе пациентов, получавших ИНАСИТ аллергоидом домашней пыли, отличный эффект отмечен у 15 человек (100% группы).
За время лечения ни у одного из пациентов в обеих группах (ИНАСИТ и ПКАСИТ) не было зарегистрировано системных реакций. Локальные побочные реакции регистрировались чаще при АСИТ аллергенами, по сравнению с аллергоидами, особенно при переходе на новое разведение. Местные реакции возникали через 10─20 минут после введения аллерговакцины интраназально и проявлялись чиханьем, зудом в носу, ринореей, иногда - преходящей заложенностью носа, слезотечением. В подгруппе пациентов, получавших аллергоид домашней пыли интраназально, побочные реакции были отмечены только у двух пациентов (13,3%), а в подгруппе больных, получавших ИНАСИТ аллергеном клеща домашней пыли ─ у 9-и (64,3% ) пациентов. В подгруппе пациентов, получавших аллергоид домашней пыли подкожно, местные реакции наблюдались у 9 человек (81,8%). Не было отмечено статистически значимой разницы в эффективности и переносимости ИНАСИТ у больных с изолированным АР, по сравнению с больными, страдающими АР+АБА.
Роль NOex в оценке контроля атопической БА. С целью оценки клинического значения определения NO в выдыхаемом воздухе у больных БА, а также его роли в качестве критерия контроля болезни и взаимосвязи с другими показателями контроля, нами были обследованы 114 больных БА (91 – с АБА, 7 – с НАБА, 16 – с АБА+НАБА). Уровень NOex у больных, в зависимости от этиологической формы БА, представлен в Таблице 4.
Как видно из таблицы, уровень NOex у больных АБА и АБА+НАБА статистически значимо выше, чем в контрольной группе здоровых и у пациентов с НАБА. У пациентов с НАБА уровень NOex не отличался от значений в контрольной группе здоровых.
В результате проведенного корреляционного анализа было установлено существование статистически значимых корреляционных связей между уровнем NOex и фазой БА (R=0,3739,p=0,0002), уровнем NOex и ОФВ1 (R=-0,262,p=0,0124), NOex и уровнем контроля астмы (АСТ-тест) (R=-0,245,p=0,0194) только для больных АБА.
Таблица 4
Уровень NOex при различных этиологических формах БА
| | АБА (n=91) | НАБА (n=7) | АБА+НАБА (n=16) | Контрольная группа здоровых (n=7) |
| NOex, Me(25%-75%) | 35 (17 – 66) | 14 (9 – 16) | 36 (22 – 116) | 10 (5 – 17) |
| АБА | - | - | - | - |
| НАБА | p=0.004* | - | - | - |
| АБА+НАБА | p=0.3490 | p=0.004* | - | - |
| Контрольная группа | p=0.0008* | p=0.9307 | p=0.019* | - |
*-статистически значимо
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
Специфичность, применяемого нами метода определения NOex (NIOX MINO), при диагностически значимом значении NOex для БА у взрослых >20 ppb, составила Sp=85,7%. Чувствительность была рассчитана для различных этиологических форм БА и составила: SeАБА=73,6%; SeНАБА=0%; : SeАБА+НАБА=81,3%.
Таким образом, результаты проведенного исследования демонстрируют, что NOex является важным маркером для БА, высокочувствительным для лиц с атопической формой болезни и для пациентов со смешанным вариантом БА, при котором, по-видимому, доминирует аллергическое эозинофильное воспаление.
Всем пациентам с неконтролируемой БА была скорректирована (увеличена на 1 ступень) базисная противоастматическая фармакотерапия.
На основании вычисления ОШ достижения контролируемого состояния БА в группе больных, у которых снижение NОex в ответ на коррекцию терапии составило ≥20% от первоначального уровня, и группы больных, у которых снижение NОex в ответ на коррекцию терапии составило <20%, можно утверждать, что снижение NOex ≥ 20% в ответ на проводимую терапию является признаком, который формирует группу больных, в которой статистически значимо (p<0,05) более вероятно достижение контроля БА, ОШ= 3,18; ДИ:1,13-8,92, по сравнению с больными у которых в результате лечения NOex снизился <20%.
Таким образом, NO в выдыхаемом воздухе является чувствительным маркером ответа на противовоспалительную терапию при БА, позволяющим оценивать эффективность назначенного лечения, причем именно в отношении влияния на воспаление в нижних дыхательных путях.
