Гестационный сахарный диабет (эндокринологичeские, акушерские и перинатальные аспекты) 14. 01. 01 Акушерство и гинекология 14. 01. 02 Эндокринология
| Вид материала | Автореферат |
СодержаниеЧастота основных факторов риска, осложнений беременности и неонатального периода в зависимости от результатов катамнестического Практические рекомендации |
- Ооловна акушерские и перинатальные исходы у беременных с хронической фетоплацентарной, 304.06kb.
- "Сахарный диабет. Синдром диабетической стопы", 66.36kb.
- Что такое диабет?, 30.26kb.
- Сахарный диабет мелких домашних животных, 130.15kb.
- Новицкая Наталья Александровна Течение беременности и перинатальные исходы после экстракорпорального, 304.17kb.
- Сахарный диабет 2 типа, 89.86kb.
- Сахарный диабет у детей, 89.39kb.
- Подпрограмма «Сахарный диабет на 2012 2014 годы» Паспорт Подпрограммы, 71.38kb.
- Сахарный диабет у детей: причины возникновения, симптомы и признаки, диагностика, лечение, 107.19kb.
- Министерство внутренних дел российской федерации главный военный клинический госпиталь, 1637.93kb.
*Достоверность р=0,02 с 2-й и 3-й группами ** Достоверность р0,001 с 1-й и 3-й группами *** Достоверность р0,001 с 2-й и 3-й группами **** Достоверность р=0,005 с 1-й и 2-й группами.
Группа С - 37 (8,2%) новорожденных со среднетяжелым поражением ЦНС, в состоянии которых в раннем постнатальном периоде не было отмечено положительной динамики (несмотря на проводимую терапию). Клинические проявления перинатального повреждения ЦНС сохранялись до 5-6 суток жизни, что потребовало их перевода на этапное выхаживание. В этой группе достоверно (в 4-6 раз) преобладали новорожденные 2-й и 3-й групп по сравнению с детьми 1-й группы (p<0,001).
Группа D - 56 (12,4%) новорожденных с тяжелым или очень тяжелым состоянием в течение раннего неонатального периода за счет перинатального поражения ЦНС различного генеза, которым проводилась интенсивная терапия и в дальнейшем переведенные на этапное выхаживание, из них – 51% в отделения реанимации. Распределение новорожденных 1-й и 2-й групп было практически однородным и достоверных различий между ними выявлено не было. Однако детей 3-й группы (55,3%) было достоверно больше в сравнении с новорожденными, где отсутствовали фенотипические признаки ДФ (1-я группа), либо они были умеренными (2-я группа) (р=0,005).
Группа Е - 3 (0,7%) постнатально погибших ребенка. У них отмечались признаки тяжелого перинатального повреждения ЦНС в виде угнетения безусловно-рефлекторной деятельности, общей мышечной гипотонии, гипо- и адинамии или гипервозбудимости, вплоть до судорожного синдрома, выраженных глазодвигательных расстройств. Клинические проявления поражения ЦНС сопровождались тяжелыми общесоматическими нарушениями - дыхательными и сердечно-сосудистыми.
Самые низкие показатели исходного ИМТ 26,8 (22,930,8) кг/м2 отмечались у женщин, родивших детей в удовлетворительном состоянии (группа А, р=0,002) и у женщин, родивших детей с легким поражением ЦНС (группа В, р=0,03) 27,9 (23,032,2) кг/м2, что достоверно отличало их от группы С 31,0 (25,636,2) кг/м2 (p=0,02), группы D 30,1 (24,637) кг/м2 (р=0,006), а наиболее высокий ИМТ имели пациентки с постнатально погибшими детьми (группа Е) 34,5 (25,537) кг/м2 (p0,0001).
Тяжесть перинатального поражения ЦНС у детей от матерей с ГСД достоверно зависела от уровня глюкозы крови в течение беременности. Так, наиболее низкий уровень гликемии 5,4 (4,66,3) ммоль/л (44 П) был отмечен у матерей, родивших детей в удовлетворительном состоянии, а наиболее высокий 6,7 (5,97,9) ммоль/л (99,7 П) у матерей, чьи дети погибли (p0,0001). Следует отметить, что у всех детей 3-й группы отмечалась неонатальная гипогликемия, потребовавшая внутривенного или перорального введения раствора глюкозы. Во 2-й группе у 20% детей отмечалась неонатальная гипогликемия длительностью не более 3-х часов, купированная пероральным приемом раствора глюкозы и ранним и частым кормлением. В 1-й группе неонатальной гипогликемии не было. Патологическая гипербилирубинемия отмечалась у 90 (20%) новорожденных, причем она практически в 2 раза чаще встречалась в 3-й группе 17 (44,7%), тогда как в 1-й группе и 2-й группе она развивалась, соответственно, у 52 (17,1%) и 21 (19,4%) новорожденных (р=0,0001).
Перинатальный исход оценивался у 451 (99,6%) ребенка. Домой в удовлетворительном состоянии были выписаны 86% детей из 1-й группы, тогда как во 2-й группе их было 68,5% (р<0,05), а в 3-й группе только 26,3% новорожденных (р<0,005). На этапное выхаживание также было значительно больше переведено детей 2-й и 3-й группы (24,1% и 31,6%, соответственно) по сравнению с 1-й группой (8,6%), р=0,005. В то же время, именно в 3-й группе 39,5% детей по тяжести состояния потребовали лечения в палате интенсивной терапии неонатологического отделения МОНИИАГ и затем были переведены в реанимационные отделения детских больниц. В 1-й и 2-й группе таких детей было значительно меньше (р<0,005) – 3,6% и 5,6%, соответственно. Среди детей с макросомией 31,2% родились с тяжелым и среднетяжелым поражением ЦНС, у 21,9% было легкое поражение ЦНС, и только 46,9% детей родились в удовлетворительном состоянии. На этапное выхаживание были переведены 18,8% детей с макросомией, а 13,1% детей по тяжести состояния находились в реанимационном отделении.
ВПР наблюдались в 8% случаев, что почти в 3,5 раза превышает общепопуляционную по МО (2,4%) (Жученко Л.А., 2009). Перинатальные потери составили 0,9%.
На втором этапе работы проведено изучение катамнеза 453 пациенток с ГСД (обследованных на первом этапе работы) и выявлено, что при максимальном периоде наблюдения до 12 лет 14,6% из них заболели СД, при этом 28 (6,2%) СД 1 типа и 38 (8,4%) пациенток СД 2 типа. У 25 женщин при повторной беременности снова развился ГСД.
Данные о факторах риска ГСД, особенностях течения беременности, родоразрешения и перинатального исхода в зависимости от данных катамнеза представлены в таблице 8.
Таблица 8.
Частота основных факторов риска, осложнений беременности и неонатального периода в зависимости от результатов катамнестического обследования пациенток с ГСД
| | СД 1 типа | СД 2 типа | «Условно здоровые» | |||
| n | % | n | % | n | % | |
| Возраст старше 30 лет | 5 | 17,9* | 27 | 71,1** | 178 | 46 |
| СД у родствеников | 9 | 32,1 | 21 | 55,3** | 181 | 47,6 |
| ИМТ≥27 кг/м2 | 1 | 3,6* | 30 | 79** | 192 | 49,6 |
| ГСД в анамнезе | 2 | 7,1 | 4 | 10,5** | 29 | 7,5 |
| Глюкозурия | 18 | 64,3* | 14 | 36,8** | 103 | 26,6 |
| Гипергликемия натощак | 28 | 100* | 27 | 71,1** | 149 | 38,5 |
| Крупный плод в анамнезе | 4 | 14,3 | 9 | 23,7** | 71 | 18,3 |
| Артериальная гипертензия | - | -* | 19 | 56** | 95 | 24,6 |
| Отягощенный акушерский анамнез | 4 | 14,3 | 9 | 23,7** | 51 | 13,2 |
| ТГ в анамнезе | 1 | 3,6 | 4 | 10,5** | 11 | 2,8 |
| СПКЯ | 1 | 3,6* | 14 | 36,8** | 54 | 14 |
| Клинические симптомы диабета | 21 | 75* | 6 | 15,8** | 30 | 7,8 |
| Угроза прерывания | 20 | 71,4* | 22 | 57,9 | 232 | 60 |
| Многоводие | 10 | 35,7* | 11 | 29 | 131 | 33,9 |
| СГ | 1 | 3,6 | 10 | 26,3** | 33 | 8,5 |
| 1-я группа | 9 | 25,7* | 23 | 62,2* | 273 | 72 |
| 2-я группа | 10 | 28,6* | 9 | 24,3 | 89 | 23,5 |
| 3-я группа | 9 | 25,7* | 6 | 16,2 | 23 | 6,1 |
| Инсулинотерапия | 28 | 100* | 31 | 81,5** | 137 | 36,1 |
| Преждевременные роды | 6 | 17,1 | 7 | 18,4 | 27 | 6*** |
| ЭКС | 7 | 25 | 9 | 23,7 | 56 | 14,4*** |
| Крупный плод (4 кг и более) | 5 | 14,3* | 2 | 5,3 | 41 | 10,8 |
| Макросомия плода | 17 | 48,6* | 13 | 34,2 | 130 | 28,8 |
*Достоверные различия с СД 2 типа и «условно здоровыми» ** Достоверные различия по сравнению с СД 1 и «условно здоровыми» *** Достоверные различия с СД 1 и СД 2 типа.
Было выявлено, что пациенток, у которых после родов развился СД 1 типа, отличали более молодой возраст (р0,001), низкий ИМТ (p=0,00001), наличие СД 1 типа у ближайших родственников (р0,05), выраженные клинические симптомы диабета (р0,05), которые сопровождались снижением массы тела, раннее появление и высокая частота гипергликемии натощак и глюкозурии (р0,001), высокий уровень гликемии в течение беременности (р0,05) и неэффективность монотерапии диетой (все беременные получали инсулинотерапию).
При анализе динамики глюкозы крови было выявлено, что у пациенток с развившимся после родов СД 1 типа, гликемия в течение всего периода гестации находилась на самом высоком среди всех беременных с ГСД уровне (рис.15). Она неоднократно достигала крайне высоких значений в 16, 26 и 32 нед. Снижение гликемии 75 П было достигнуто только после 36 нед. гестации (эффект дородовой госпитализации).
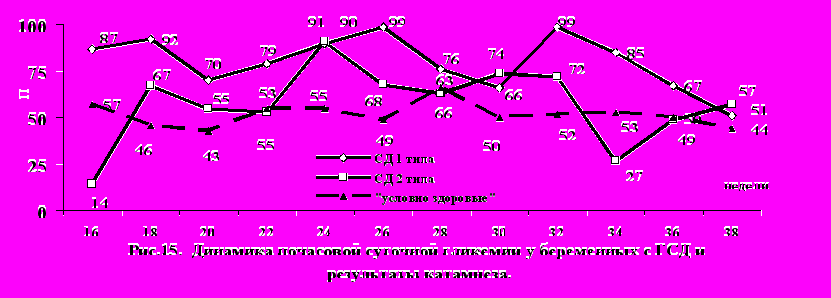 У беременных с развившимся после родов СД 2 типа гликемия находилась в диапазоне от 63 до 78 П с максимумом в 24 нед. По динамике суточной гликемии беременные этой группы достоверно отличаются от «условно здоровых» пациенток, где гликемия находилась в диапазоне от 43 (2478) П до 66 (4293) П (р0,05).
У беременных с развившимся после родов СД 2 типа гликемия находилась в диапазоне от 63 до 78 П с максимумом в 24 нед. По динамике суточной гликемии беременные этой группы достоверно отличаются от «условно здоровых» пациенток, где гликемия находилась в диапазоне от 43 (2478) П до 66 (4293) П (р0,05). Для пациенток с развившимся после родов СД 1 типа было характерно наиболее раннее внутриутробное формирование макросомии (рис.16).
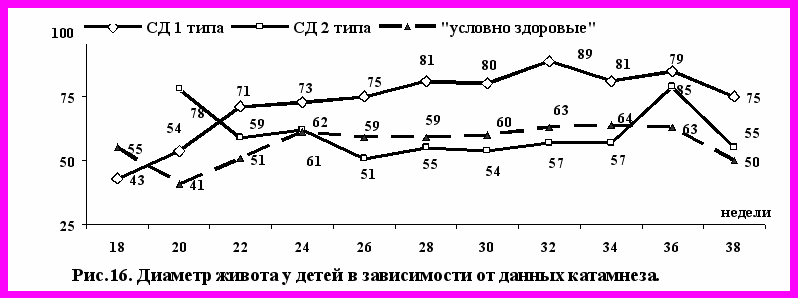
Так, ДЖ плода начинал увеличиваться уже с 2022 нед., а с 26 нед. гестации он превышал 75 П, достигая максимума к 32 нед. и далее незначительно снижаясь до 82 (63-94) П. Между динамикой ДЖ у беременных с СД 2 типа и не болеющих СД пациенток достоверных различий выявлено не было, его колебания не превышали популяционный диапазон.
Рано возникшая и длительно текущая гипергликемия у беременных, в дальнейшем заболевших СД 1 типа, привела к тому, что частота тяжелой формы ДФ у их новорожденных составила 25,7%, что значительно больше, чем у остальных беременных – 16,2% и 6,1% (р0,0001).
У пациенток с выявленным в разные сроки после родов СД 2 типа, глюкозурия и гипергликемия натощак также появлялись достаточно рано (но не было выявлено достоверных различий по сравнению с пациентками с СД 1 типа), однако этих беременных отличали наиболее высокая встречаемость таких факторов риска, как старший возраст (р0,005), ИМТ≥27 кг/м2 (р0,001), СД 2 типа у ближайших родственников (р0,005), ГСД, роды крупным плодом (р0,005), отягощенный акушерский анамнез (р0,005), тяжелые формы гестоза в анамнезе (р0,05), АГ и СПКЯ (р0,05). Течение беременности у них наиболее часто по сравнению со всеми другими пациентками с ГСД осложнялось развитием различных форм гестоза 47,4% (р0,001), что, по-видимому, обусловлено не только выраженным прегестационным ожирением, но и наличием АГ и более старшем возрасте беременных. Эти факторы в сочетании с декомпенсированной ФПН привели у этой категории пациенток к наиболее высокой по сравнению с другими женщинами частоте преждевременных родов – 18,4% (р0,001) и родоразрешения путем ЭКС – 23,7% (р0,05). Перинатальная смертность также наиболее часто отмечалась среди детей от матерей, заболевших в дальнейшем СД 2 типа – 5,3%, что было в 1,9 больше, у женщин, заболевших СД 1 типа (р0,05) и в 17,7 раза больше, чем у не болеющих СД пациенток (р0,0001).
На третьем этапе работы согласно разработанному нами алгоритму обследования и наблюдения пациенток с ГСД был проведен сплошной скрининг 748 беременных женщин (ПГТТ с 75 г глюкозы), в результате которого было выявлено 30 (4%) пациенток с ГСД. Основными факторами риска развития ГСД были: ИМТ ≥27 кг/м2 в 50%, СД у близких родственников - 46,6%, глюкозурия - в 36,6%, гипергликемия натощак – в 16,6% наблюдений. В I триместре ГСД был выявлен у одной, во II триместре – у 10, в III триместре – у 19 пациенток. Значительные различия в частоте впервые выявленной гипергликемии натощак между пациентками, обследованными на первом этапе работы и пациентками, выявленными при сплошном скрининге (52,5% и 16,6% случаев, соответственно) связаны с тем, что, с одной стороны, под наблюдение в МОНИИАГ поступают пациентки с наиболее тяжелыми формами ГСД, а, с другой стороны, положительный результат ПГТТ при сплошном скрининге и своевременно назначенное лечение опережали и предупреждали развитие выраженной гипергликемии.
Своевременное выявление ГСД, проведение самоконтроля гликемии, адекватная инсулинотерапия привели к снижению макросомии новорожденных в этой группе с 35,5% до 12,5%, гестоза – с 59,2% до 26,7%, а ЭКС с 15,9% до 6,7% по сравнению с пациентками, обследованными на первом этапе работы.
ВЫВОДЫ:
- Распространенность ГСД в Московской области составляет 4%. Ведущими факторами риска развития ГСД являются: возраст 30 лет – 55,4%, гипергликемия натощак - 52,5%, ИМТ≥27 кг/м2 – 49,2%, СД у ближайших родственников – 46,6%, глюкозурия – 43%.
- Инсулинотерапия при ГСД проводилась в 43,5% наблюдений. В инсулинотерапии нуждались беременные, имевшие ≥3 фактора риска ГСД (р0,005), с впервые выявленной гликемией натощак 7,5 ммоль/л (p0,0001) и ГСД, выявленном 24 недель гестации (p<0,005).
- При ГСД акушерские осложнения развиваются в 93% наблюдений, при этом угроза прерывания у 53,9% и гестоз у 59,2% беременных. Тяжелая ДФ у плода наиболее часто сочеталась с многоводием (52,6%), гестозом средней тяжести (15,8%) и тяжелым гестозом (2,6%) (р0,005). На тяжесть гестоза и способ родоразрешения при ГСД наиболее значимое влияние оказывали прегравидарный ИМТ пациентки 26,6 кг/м2 (p0,001), патологическая прибавка массы тела в течение беременности (ИМТ50 П) (р0,001) и длительная гипергликемия, превышающая 75 П (p0,0001).
- Содержание плацентарного лактогена у беременных с ГСД достоверно (р0,05) превышало показатели, характерные для популяции, достигая максимума в сроке 2931 неделя. Его снижение 25П с 38 недель гестации (р<0,05) свидетельствовало об истощении гормональной функции плаценты.
- При доношенном сроке гестации были родоразрешены 91,1% беременных с ГСД, через естественные родовые пути 61,6% пациенток. Риск преждевременных родов повышался при патологической прибавке массы тела с 22 по 32 неделю гестации, превышающей 75П уровень (р<0,0001), уровне глюкозы крови на протяжении 10 недель беременности 75П (р0,0001), присоединении гестоза средней тяжести (p=0,002) и наличии выраженной ДФ у плода по данным УЗИ (р0,005).
- ДФ была выявлена у 32,4% новорожденных, при этом у 8,4% детей – в тяжелой форме. Прогностически неблагоприятными признаками развития ДФ являлись: количество факторов риска ГСД 4 (р=0,006), впервые выявленная гипергликемия натощак 7,5 ммоль/л (р=0,02), медиана гликемии натощак более 5,3 (4,56,2) ммоль/л (р0,000001) и через час после еды более 5,3 (4,35,9) ммоль/л (р0,001), гликемия 50 П уровня почасового суточного норматива (р0,001), а также прибавка в массе тела 50 П в течение беременности. Выраженные признаки ДФ развиваются при систематическом превышении гликемии 75П уровня почасового суточного норматива (p=0,001), начале лечения ГСД в группе высокого риска после 26 недели беременности (р0,05) и концентрации ПЛ, превышающей 75П уровень (р=0,005).
- Частота макросомии у пациенток с ГСД составила 35,6%. Наиболее значимыми предикторами ее развития являются: гипергликемия натощак, выявленная до 27 недель беременности (p=0,0007), отсроченная постановка диагноза (5 недель от момента появления гипергликемии) (р=0,01), а также гликемия 75П уровня почасового суточного норматива, начиная с 16 недель беременности (р=0,02). Наиболее ранними УЗ маркерами прогноза развития макросомии плода являются ДЖ 75П с 2728 недель беременности (р=0,001) и снижение коэффициента пропорциональности телосложения БПР/ДЖ 0,92 с 2526 недель (р=0,002).
- На тяжесть поражения ЦНС плода наиболее значимое негативное влияние оказывают прегравидарный ИМТ матери 27,9 кг/м2 (р0,002), гликемия в течение беременности 75П уровня (р0,0001) и выраженность признаков ДФ у новорожденного (р=0,005).
- Частота развития манифестных форм СД у пациенток с ГСД при наблюдении в течение 12 лет составила 14,6%.
- Для пациенток, у которых после родов развился СД 1 типа, были характерны: низкий прегравидарный ИМТ – 26 кг/м2 (p=0,00001), возраст 30 лет (р0,001), СД 1 типа у ближайших родственников (р0,05), выраженные клинические симптомы диабета, которые сопровождались снижением массы тела (р0,05), появление гипергликемии и глюкозурии 24 недели гестации (р0,001), гликемия в течение беременности 75П уровня, необходимость инсулинотерапии для коррекции нарушений углеводного обмена (р0,05), появление УЗ признаков макросомии плода с 26 недели беременности и выраженные признаки ДФ у новорожденных.
- Для пациенток с выявленным после родов СД 2 типа были характерны такие факторы риска, как возраст 30 лет (р0,005), выраженное ожирение (ИМТ 34,2 кг/м2) (р0,001), СД 2 типа у ближайших родственников (р0,005), ГСД, роды крупным плодом (р0,005), репродуктивные потери (р0,005) и тяжелые формы гестоза (р0,05) в анамнезе, артериальная гипертензия и СПКЯ (р0,05). В данную беременность для них были характерны наиболее высокая частота гестоза легкой степени тяжести и гестоза средней тяжести - 47,4% (р0,001), а также преждевременных родов – 18,4% (р0,001) и родоразрешения путем ЭКС– 23,7% (р0,05).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
- Для женщин, имеющих такие факторы риска, как ожирение, артериальная гипертензия или СПКЯ необходимо проводить прегравидарную подготовку с целью минимизации влияния этих факторов риска на течение беременности (подбор гипотензивной терапии, нормализация веса и режима двигательной активности, коррекция гиперандрогении).
- При первом посещении врача акушера-гинеколога (или врача другого профиля – терапевта, эндокринолога) в женской консультации беременная, в соответствии с наличием у нее клинико-анамнестических данных о факторах риска, должна быть отнесена к группе высокого, среднего или низкого риска развития ГСД и, в зависимости от этого, разработана оптимальная тактика ее обследования и лечения (см. алгоритм).
- Первое появление у беременной патологических симптомов или показателей, таких как: симптомы диабета, патологическая прибавка в весе, глюкозурия или УЗ признаки макросомии и/или ДФ у плода требуют незамедлительного исключения диагноза ГСД (глюкоза венозной плазмы, ПГТТ), независимо от срока гестации и принадлежности пациентки к группе риска ГСД.
- Одной из возможностей профилактики тяжелых осложнений беременности при ГСД и выраженных признаков ДФ, помимо строгой компенсации нарушений углеводного обмена, является снижение массы тела до беременности и контроль прибавки массы тела во время беременности (табл.4).
- Для профилактики развития ДФ и макросомии плода, а также тяжелых осложнений гестации у беременных с ГСД при коррекции нарушений углеводного обмена целесообразно придерживаться более жестких критериев компенсации (гликемия, соответствующая 50 П уровню почасового суточного норматива (табл. 2).
- Для своевременного выявления макросомии необходимо с момента выявления ГСД проводить УЗ биометрию плода с обязательной перцентильной оценкой полученных показателей. Показаниями к назначению инсулинотерапии при ГСД являются не только отсутствие компенсации на фоне диеты, но и появление УЗ признаков макросомии плода (ДЖ75П) и снижение коэффициента пропорциональности телосложения ниже 0,92, независимо от уровня материнской гликемии.
- Учитывая полученные данные об истощении гормональной функции плаценты в 38-39 недель беременности, оптимальным сроком родоразрешения у пациенток с ГСД, даже при отсутствии признаков ДФ, является 3738 недель гестации.
- Новорожденные от матерей с ГСД относятся к группе высокого риска по перинатальному поражению ЦНС и срыву процессов адаптации в раннем неонатальном периоде. Тщательное наблюдение за ребенком в первые часы жизни позволяет выявить у него респираторные нарушения, признаки поражения ЦНС, гипогликемию, нарушение в содержании электролитов и наличие врожденных пороков развития.
9. Пациентки, перенесшие ГСД, являются группой высокого риска по его развитию и в последующие беременности, а также манифестного СД в последующие годы жизни, и, следовательно, должны находиться под тщательным контролем со стороны эндокринолога и акушера-гинеколога.
*В группе риска по развитию СД 1 типа находятся пациентки 30 лет без ожирения, с выраженными клиническими симптомами диабета, ранним (24 недель гестации) развитием гипергликемии и глюкозуриии и необходимостью инсулинотерапии для коррекции гипергликемии. У беременных с подозрением на манифестацию СД 1 типа целесообразно проводить обследование на уровень антител к островковым клеткам и глутаматдекарбоксилазе для окончательной верификации диагноза и разработки оптимальной тактики послеродовой наблюдения.
*Предикторами развития СД 2 типа у беременных с ГСД являются такие факторы риска, как возраст 30 лет, выраженное ожирение, СД 2 типа у ближайших родственников, ГСД, роды крупным плодом, тяжелые формы гестоза и привычное невынашивание в анамнезе, артериальная гипертензия и СПКЯ, а также тяжелые формы гестоза, преждевременные роды и родоразрешение путем ЭКС в данную беременность.
Список работ, опубликованных по теме диссертации
Статьи в рецензируемых научных изданиях, рекомендованных ВАК РФ
- Laricheva I.P., Budykina T.S., Burumkulova F.F., Petrukhin V.A., Gurieva V.M. Thyreoid gland function the pregnant woman with diabetes mellitus //Journal of obstetrics and women’disease (book of abstracts The VII-th Baltic Sea Congress on Obstetrics and Gynecology – 1999. – Т.XL. – V.VIII. – С.96.
- Краснопольский В.И., Федорова М.В., Петрухин В.А., Ларичева И.П., Титченко Л.И., Левашова И.И., Гришин В.Л., Витушко С.А., Бурумкулова Ф.Ф., Котов Ю.Б. Мониторинг беременных, страдающих сахарным диабетом //Вестник Российской ассоциации акушеров-гинекологов. – 1999. – №4. – С.119125.
- Ларичева И.П., Будыкина Т.С., Бурумкулова Ф.Ф., Петрухин В.А., Гурьева В.М. Функция щитовидной железы у беременных с сахарным диабетом //Вестник Российской ассоциации акушеров-гинекологов. – 2000. – №2. – С.1619.
- Федорова М.В., Князев Ю.А., Петрухин В.А., Титченко Л.И., Гришин В.Л., С.А.Витушко, Бурумкулова Ф.Ф., Котов Ю.Б., Гурьева В.М., Коваленко Т.С. Оптимизация тактики ведения беременных, страдающих сахарным диабетом //Российский вестник акушера-гинеколога. 2002. – №3. – С.6972.
- Логутова Л.С., Петрухин В.А., Бурумкулова Ф.Ф., Будыкина Т.С., Новикова С.В., Котов Ю.Б., Куликов И.А. Коррекция аутоиммунных нарушений при гестационном сахарном диабете //Российский вестник акушера-гинеколога. – 2003. – Т.3. - №3. – С. 7680.
- Краснопольский В.И., Логутова Л.С., Петрухин В.А., Аксенов А.Н., Башакин Н.Ф., Троицкая М.В., Бурумкулова Ф.Ф., Будыкина Т.С., Витушко С.А., Шидловская Н.В., Котов Ю.Б., Нестеренко О.С. Динамическое наблюдение за детьми, родившимися у матерей с различной эндокринной патологией //Российский вестник акушера-гинеколога. - 2005. – Т.5. №1. – С.7480.
