Гестационный сахарный диабет (эндокринологичeские, акушерские и перинатальные аспекты) 14. 01. 01 Акушерство и гинекология 14. 01. 02 Эндокринология
| Вид материала | Автореферат |
- Ооловна акушерские и перинатальные исходы у беременных с хронической фетоплацентарной, 304.06kb.
- "Сахарный диабет. Синдром диабетической стопы", 66.36kb.
- Что такое диабет?, 30.26kb.
- Сахарный диабет мелких домашних животных, 130.15kb.
- Новицкая Наталья Александровна Течение беременности и перинатальные исходы после экстракорпорального, 304.17kb.
- Сахарный диабет 2 типа, 89.86kb.
- Сахарный диабет у детей, 89.39kb.
- Подпрограмма «Сахарный диабет на 2012 2014 годы» Паспорт Подпрограммы, 71.38kb.
- Сахарный диабет у детей: причины возникновения, симптомы и признаки, диагностика, лечение, 107.19kb.
- Министерство внутренних дел российской федерации главный военный клинический госпиталь, 1637.93kb.
Материалы и методы исследования
Обследование и наблюдение беременных проводилось на базе МОНИИАГ (директор – член-корр. РАМН, профессор Краснопольский В.И.), общеклиническое обследование в клинико-диагностической лаборатории (руководитель д.м.н. Будыкина Т.С.), определение гормональных показателей и УЗ-исследования в лаборатории перинатальной диагностики (руководитель лаборатории – д.м.н., профессор Титченко Л.И.) Оценка течения раннего неонатального периода проведена совместно со ст.н.с. отделения неонатологии к.м.н. Троицкой М.В (руководитель отделения к.м.н. Аксенов А.Н.).
В процессе выполнения работы были обследованы 1201 беременная. На первом этапе работы изучено течение беременности у 453 пациенток с ГСД, поступивших под наблюдение в МОНИИАГ в период с 1998 по 2009 гг, а также оценено состояние 450 их новорожденных (два случая прерывания беременности по медицинским показаниям в сроки 2324 недели по поводу врожденных пороков развития плода (ВПР) и неразвивающейся беременности и один случай антенатальной гибели плода) на момент рождения и в течение раннего неонатального периода. Возраст беременных находился в диапазоне от 17 до 48 лет 30 (2635) лет*. Среди гинекологических заболеваний ведущее место занимали псевдоэрозия и эрозия шейки матки 171 (37,8%), воспалительные заболевания матки и придатков 98 (21,6%) наблюдений. Первичное бесплодие в анамнезе встречалось в 31 (6,8%), вторичное бесплодие – в 24 (5,3%) случаев.
В зависимости от выраженности признаков ДФ у новорожденных беременные были ретроспективно разделены на группы: 1-я группа 305 (67,6%) пациенток, у которых дети не имели признаков ДФ, 2-я группа 108 (23,9%) беременных, у которых дети имели только фенотипические признаки ДФ, и 3-я группа 38 (8,4%) пациенток, родивших детей с тяжелой ДФ, которая, в свою очередь, была разделена на подгруппу 3А 29 детей (6,4%), с гепатомегалией и подгруппу 3Б 9 (2%) детей с гепато-, спленомегалией и кардиопатией. Наиболее частыми фенотипическими признаками у обследованных нами новорожденных были пастозность мягких тканей (100%), кушингоидное телосложение (56,4%), гипертрихоз (20,5%), ярко-розовые кожные покровы (20,5%).
___________________________
* Здесь и далее результаты представлены в виде M (q1-q2) – медиана и верхний и нижний квартили.
Диагностика прегравидарного ожирения проводилась по критериям ВОЗ (1997) на основании расчета индекса массы тела (ИМТ). Также проводился динамический контроль прибавки массы тела в течение беременности, всего были произведены 3172 измерения веса. Оценка тяжести гестоза проводилась по шкале Goekе в модификации Г.М. Савельевой (Савельева Г.М. и др., 2000).
Гормональная функция фетоплацентарного комплекса (ФПК) оценивалась по содержанию в сыворотке плацентарного лактогена (ПЛ), прогестерона (Пр), эстриола (Э3), кортизола (К) и эмбрионального белка альфа-фетопротеина (АФП); исследования проводились с помощью иммуноферментных методов наборами фирмы DRG (Швейцария) и Siemens (Германия) на аппаратах SUNRISE и IMMULITE 2000. Всего проведено 4077 исследований. Для оценки гормональных показателей ФПК проводилось построение норматива на перцентильной основе с учетом гестационного срока по данным обследования 7512 беременных, не страдавших ГСД.
Ультразвуковые исследования (УЗИ) проводили на аппарате Voluson 730 (Kretz, Австрия). Определяли основные фетометрические параметры (бипариетальный размер головки (БПР), диаметр груди (ДГ), диаметр живота (ДЖ) плода, толщина подкожно-жирового слоя в области животика, размеры печени, селезенки, толщина межпредсердной и межжелудочкой перегородки сердца), а также локализацию, толщину, стадию структурности плаценты и проводили оценку количества околоплодных вод. Число УЗИ (фетометрия и плацентометрия) у одной пациентки колебалось от 2 до 8, всего проведено 1467 исследований.
Оценка состояния новорожденных проводилась сразу после рождения с целью установления доношенности, зрелости, наличия ДФ и степени ее выраженности. Для оценки показателей их физического развития использовались перцентильные таблицы (Дементьева Г.М., 1999).
На втором этапе работы был изучен отдаленный катамнез 453 пациенток с ГСД, родоразрешенных в МОНИИАГ, который собирался с помощью письменного анкетирования, телефонного опроса и поиска пациенток по Государственному областному регистру больных с СД.
На третьем этапе работы в течение 20082009 гг. был проведен сплошной скрининг на ГСД среди 748 беременных, постоянно проживающих в г. Клин МО (согласно рекомендациям Дедова И.И. и др., 2007). При выявлении ГСД беременные наблюдались как в женской консультации по месту жительства, так и в акушерских клиниках МОНИИАГ.
Для статистической обработки использованы методы непараметрической статистики (УилкоксонаМаннаУитни, Смирнова, точный критерий Фишера, Хи-квадрат) и пакет оригинальных программ, разработанных ведущим научным сотрудником ИПМ им. М.В. Келдыша РАН д.м.н. Котовым Ю.Б (2004).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Согласно современным рекомендациям диагностика ГСД должна базироваться на определении факторов риска его развития и применении ПГТТ либо у всех беременных, либо в группах среднего и высокого рисков (Дедов И.И. и др., 2009; Hod M. и соавт., 2003, 2006). При этом роль отдельных предикторов развития ГСД неоднозначна и зависит от этнических, экономических, социальных и ряда других показателей. В своей работе мы проанализировали распространенность и значимость наиболее известных и доказанных факторов риска ГСД у обследованных беременных. В возрасте старше 30 лет была 251 (55,4%) пациентка. Наиболее часто этот фактор риска встречался у беременных 2-й группы (60,2%) по сравнению с 1-й (54,4%) и 3-й (52,6%) группами (р=0,001). Отягощенная по СД наследственность имела место у 211 (46,6%) беременных, при этом в 2,5 раза чаще болели родственники по женской линии, чем по мужской. Этот фактор риска встречался с практически одинаковой частотой во всех группах (46,6%, 47,2 и 47,4%). По мнению большинства авторов, ожирение является одним из ключевых факторов риска развития ГСД (Innes K.E., 2002; ссылка скрыта. и соавт., 2010). В целом, ожирением страдали 135 (29,8%) пациенток, причем наиболее часто встречалось ожирение 1 степени (18,5%). ИМТ≥27 кг/м2 установлен у 223 (49,2%) беременных, при этом во 2-й и 3-й группе пациенток с таким ИМТ было достоверно больше (р0,05), чем в 1-й группе (52,6% и 53,7% против 47,5%). Самый низкий ИМТ был у женщин 1-й группы 27,2 (22,932,1) кг/м2, а самый высокий – у женщин подгруппы 3Б 35,1 (2737,9) кг/м2 (p=0,03).
Повышенный уровень глюкозы крови натощак (как фактор риска) был выявлен у 238 (52,5%) беременных, при этом в 1-й группе у 45,2%, что было достоверно реже (р0,001), чем у беременных 2-й и 3-й групп (66,7% и 73,7%, соответственно). Наиболее низкий уровень глюкозы крови 7,5 (6,18,7) ммоль/л имел место в 1-й группе по сравнению со 2-й 7,6 (6,49,8) ммоль/л (р0,05), а максимальных значений он достигал в подгруппе 3Б 8,8 (7,210,9) ммоль/л (p=0,02). Наиболее часто тощаковая гипергликемия выявлялась в III триместре беременности (47,1%), однако у 15,9% пациенток гипергликемия была выявлена уже в I триместре. Отсутствие диабетической настороженности у врачей женских консультаций привело к тому, что у беременных с гипергликемией, выявленной в I триместре, от момента ее выявления до установки диагноза проходило в среднем 21,5 нед., а максимальный промежуток составил 30,4 нед. У 5,5% пациенток, исходно относящихся к группе высокого риска развития ГСД, гипергликемия впервые была выявлена после 36 недель гестации при обследовании по поводу крупного плода и/или УЗ признаков ДФ, что свидетельствует о запоздалой диагностике ГСД.
Определение глюкозы в утренней порции мочи относится к рутинным методам обследования беременных в женской консультации и не требует никаких дополнительных финансовых затрат. Глюкозурия (как фактор риска) установлена у 134 (29,6%) пациенток, при этом она достоверно чаще выявлялась у беременных 3-й группы (68,4%) по сравнению с 1-й (24,3%) и 2-й группами (31,5%), р=0,001. Достоверно чаще этот патологический лабораторный тест отмечался в III триместре беременности (53,7%), однако у 7,5% пациенток он был выявлен уже в I триместре. Наиболее рано глюкозурия была зафиксирована в подгруппе 3Б 14,3 (12,719,7) нед. по сравнению с 1-й 26,8 (20,130,8) нед. (p=0,01), 2-й 26,8 (19,930,9) нед. группами (p=0,01) и подгруппой 3А – 26,8 (19,930,9) нед. (р=0,001). Появление глюкозурии автоматически относит беременную к группе высокого риска по развитию ГСД, однако от момента ее выявления до установки диагноза проходило в среднем 2,3 нед., а максимальный промежуток составил 22 нед.
Клинические симптомы, ассоциированные с гипергликемией, отмечались у 57 (12,6%) пациенток, при этом они значительно чаще (р0,001) встречались у беременных 3-й группы (26,3%) по сравнению с пациентками 1-й и 2-й групп (10,2% и 14,8%, соответственно). Артериальной гипертензией (АГ) до беременности страдали 114 (25,2%) пациенток, причем практически с одинаковой частотой в 1-й и 3-й группах (26,6% и 26,3%), а во 2-й группе в 21,3% случаях. У беременных с АГ ИМТ был значительно выше (р0,0001), чем у пациенток с нормальным АД 34 (28,137,8) кг/м2 по сравнению с 25,8 (22,430,4) кг/м2. Синдром поликистозных яичников (СПКЯ) в анамнезе отмечался у 69 (15,2%) беременных с ГСД, причем частота этого фактора риска практически не отличалась во всех группах (15,1%, 15,7% и 15,1%). ИМТ у беременных с СПКЯ также был значительно выше (p0,0001), чем у остальных женщин 32,0 (26,637,3) кг/м2 по сравнению с 26,6 (22,631,2) кг/м2.
Роды крупным плодом в анамнезе были у 84 (18,5%) беременных. Среди данного контингента пациенток отмечался высокий процент патологических родов (10,7%) и родового травматизма (6%). Частота перинатальных потерь у женщин с крупными плодами в анамнезе составила 10,8%, причем в структуре перинатальной смертности преобладала антенатальная гибель плода, что, в принципе, характерно для беременных со всеми типами СД. Крупный плод в предыдущие беременности наиболее часто встречался у беременных 3-й группы (34,2%), тогда как в 1-й группе этот фактор риска был только у 14,1%, а во 2-й у 26,9% пациенток (р0,005). ГСД в предыдущую беременность был выявлен только у 35 (7,7%) пациенток, что почти в 2,5 раза меньше, чем количество пациенток с крупными плодами в анамнезе (18,5%). Таким образом, более чем у половины пациенток с крупными плодами в анамнезе, ГСД остался невыявленным в связи с несовершенством его диагностики и отсутствием диабетологической настороженности у врачей разных специальностей. ГСД в предыдущую беременность практически в 2 раза чаще встречался у пациенток 2-й и 3-й групп (11,1% и 13,2%) по сравнению с пациентками 1-й группы 5,9% (р0,005). Привычное невынашивание в анамнезе отмечались у 22 (13,1%) пациенток. В целом же, отягощенный акушерский анамнез (ВПР, ранние репродуктивные потери и перинатальная смертность) отмечался у 72 (15,9%) беременных с ГСД. Этот фактор риска примерно в 1,5 раза чаще имел место у пациенток 3-й группы (23,7%) по сравнению с пациентками 1-й и 2-й групп (15,1% и 15,7%, соответственно). ТГ в предыдущие беременности отмечался у 16 (3,5%) пациенток, причем во 2-й и 3-й группах практически с одинаковой частотой – в 2,8% и 2,6% случаях, соответственно, тогда как в 1-й группе в 3,8% случаев (р0,05). Многоводие и макросомия плода (как фактор риска) в данную беременность встречалась в 47 (10,4%) и 38 (8,4%) случаях, соответственно. Наиболее часто (р0,05) они отмечались во 2-й группе (13% и 17,6%), а наименее редко в 1-й группе (9,5% и 5,2%). Все остальные факторы (редицивирующие кольпиты, повторная инфекция мочевыводящих путей) встречались в равной степени в 7 (1,5%) случаев и, по-видимому, не имеют важного практического значения для диагностики ГСД, что соответствует данным Rizk D.E и др. (2001).
Из обследованных нами беременных только у 3 (0,7%) не было ни одного фактора риска и, наоборот, ≥3 фактора риска имели подавляющее число пациенток 398 (87,8%), что связано с тем, что под наше наблюдение поступали пациентки с наиболее выраженными вариантами течения ГСД. У 52 (11,5%) беременных имелись 1-2 фактора риска. Наибольшее количество факторов риска в сумме имели беременные подгруппы 3Б 6,5 (5,57), тогда как в 1-й группе их было меньше всего 4 (35). При этом, по количеству факторов риска женщины 1-й группы достоверно отличались как от 2-й группы 5 (3,55), p=0,001, так и от подгруппы 3А – 5 (46), (p=0,02) и подгруппы 3Б 6,5 (5,57) (p0,001). Аналогичные различия по сумме факторов риска отмечались также между 2-й группой и подгруппами 3А (p=0,04) и 3Б (p=0,006).
Учитывая отсутствие системного подхода к выявлению ГСД в нашей стране и различные рекомендации по проведению ПГТТ, в нашей работе мы использовали данные теста с 75 или 100 г глюкозы с оценкой результатов согласно разработанных для них критериев (Hod M. и соавт., 2004). У 325 (71,7%) беременных диагноз ГСД был установлен на основании ПГТТ, у 128 (28,3%) на основании явной гипергликемии натощак и/или УЗ признаков макросомии или ДФ плода. Основное количество ПГТТ (96,6%) было проведено во IIIII триместрах гестации.
Среди обследованных нами беременных к группе высокого риска по развитию ГСД относились 276 (60,9%) пациенток. Было выявлено, что ПГТТ в этой группе проводился со значительным опозданием и несвоевременно 28,7 (2432,9) нед. При этом, только у 37,9% беременных высокого риска показанием к проведению теста послужили прегравидарные факторы риска (однако сроки проведения теста не всегда соответствовали рекомендуемым), а в остальных случаях тестирование проводилось уже после выявления макросомии или появления патологических лабораторных показателей (например, глюкозурии).
ГСД в I триместре был диагностирован у 16 (3,5%) обследованных женщин, во II триместре – у 127 (28,1%) и в III триместре – у 310 (68,4%) беременных. В целом, раннее выявление заболевания (24 недель) имело место в 106 (23,4%) наблюдениях. При этом, у этих пациенток значительно чаще (р<0,05) встречаются такие факторы риска, как отягощенный семейный анамнез (46,2% и 3,3%), ожирение (57,5% и 46,7%), гипергликемия натощак (65,1% и 48,7%), симптомы диабета (20,8% и 10,1%), репродуктивные потери (20,8% и 9,2%) и ГСД в анамнезе (11,3% и 6,6%) в сравнении с пациентками с более поздним выявлением ГСД. В дальнейшем было установлено, что у 28% пациенток с ранним дебютом ГСД после родов диагностировали манифестные формы СД.
Коррекция нарушений углеводного обмена у наших пациенток начиналась с момента выявления ГСД. Однако необоснованно длительное наблюдение пациенток 3-й группы по месту жительства, поступление под наблюдением в МОНИИАГ после 2835 нед. гестации и отсроченное начало инсулинотерапии в конечном итоге привели к более неблагоприятным исходам беременности. Лечение ГСД начиналось с подбора индивидуальной диетотерапии и режима умеренных физических нагрузок. Показаниями к переводу на инсулинотерапию считались уровень глюкозы цельной капиллярной крови натощак 5,0 ммоль/л, через 1 час после еды 7,8 ммоль/л и через 2 часа после еды 6,7 ммоль/л, а также выявленная при УЗИ макросомия плода (ДЖ75П) и/или признаки ДФ (утолщение и отек подкожно-жирового слоя, гепато-, спленомегалия) и впервые выявленное или нарастающее многоводие при подтвержденном диагнозе ГСД, независимо от показателей материнской гликемии (Дедов И.И. и др., 2010; Hod M. и соавт., 2004, 2006). Для уточнения необходимости в инсулинотерапии также проводилось суточное мониторирование глюкозы (CGMS), что по данным ряда авторов, значительно повышает точность оценки компенсации заболевания (ссылка скрыта. и соавт., 2006; ссылка скрыта. и соавт., 2007).
У 256 (56,5%) пациенток ГСД был компенсирован только диетой, 197 (43,5%) получали инсулинотерапию, при этом 107 (23,6%) инсулином короткого или ультракороткого действия (12 (1218) ЕД), при этом максимальная суточная доза инсулина составила 32 ЕД, а 90 (19,9%) пациенток находились на базис-болюсной инсулинотерапии (30 (2440) ЕД), максимальная суточная доза инсулина 136 ЕД. Мы не выявили связи вида терапии с прегравидарным ИМТ женщины, темпами прибавки в весе во время беременности и показателями глюкозы крови при проведении ПГТТ. В то же время, обращает на себя внимание тот факт, что у пациенток, получавших инсулинотерапию, суммарное количество факторов риска было достоверно больше, чем у пациенток только на диете 4 (35) против 5 (46), р=0,00001.
Также было установлено, что уровень впервые выявленной гипергликемии натощак был достоверно выше (p0,0001) у беременных, которым в дальнейшем была назначена инсулинотерапия 9,3 (7,211,9) ммоль/л по сравнению с беременными только на диете 7,5 (6,18,4) ммоль/л. Кроме того, инсулинотерапию получали 64,2% беременных с ранним (24 недели гестации) выявлением ГСД по сравнению с 37,1% женщин с более поздним выявлением ГСД (p<0,005). В базис-болюсной инсулинотерапии нуждались 40,6% пациенток с ранним выявлением ГСД по сравнению с 13,5% с поздним выявлением заболевания (p<0,005).
Самый низкий уровень глюкозы крови в течение беременности отмечался у пациенток на диете 5,2 (4,56) ммоль/л, а самый высокий - у женщин на базис-болюсной инсулинотерапии – 5,8 (4,57,1) ммоль/л (p0,0001) (табл.1).
Таблица 1.
Концентрация глюкозы крови (медиана) у пациенток с ГСД и вид терапии ГСД
-
Вид терапии
Диета
Инсулин короткого/ультракороткого действия
Базис-болюсная инсулинотерапия
Количество измерений
3895
2018
3594
Глюкоза крови (ммоль/л)
5,21
(4,5-6)
5,3
(4,5-6,4)
5,82
(4,9-7,1)
1 р0,0001 по сравнению с инсулином короткого/ультракороткого действия, р0,0001 по сравнению с базис-болюсной инсулинотерапией; 2р0,0001 по сравнению с инсулином короткого/ультракороткого действия.
В нашей работе было доказано, что для профилактики тяжелых форм ДФ необходимы «жесткие» критерии контроля гликемии во время беременности. Так, в целом, наиболее высокие показатели глюкозы крови были в 3-й группе – 6,2 (57,4) ммоль/л, что достоверно отличало их от 2-й группы – 5,7 (4,76,9) ммоль/л (p0,001), а самые низкие показатели отмечены в 1-й группе 5,4 (4,56,2) ммоль (в сравнении со 2-й группой p0,001).
В настоящее время большинство авторов считают, что постпрандиальный уровень глюкозы крови оказывает более сильное влияние на формирование макросомии при ГСД, нежели препрандиальный (De Veciana M. и соавт., 1995; Ben-Haroush A. и соавт., 2004). Медиана глюкозы крови натощак у беременных 1-й группы была равна 5,3 (4,56,2) ммоль/л, что достоверно (p<0,000001) отличало их от пациенток 2-й группы 5,6 (4,76,5) ммоль/л, а самый высокий уровень гликемии был в 3-й группе 6,2 (5,17,4) ммоль/л (p<0,001 по сравнению со 2-й группой). Уровень глюкозы через час после еды у пациенток 1-й группы составляла 5,3 (4,35,9) ммоль/л, у пациенток 2-й группы 5,8 (4,87,9) ммоль/л (р<0,005 по сравнению с 1-й группой). В 3-й группе также был самый высокий уровень гликемии 7,5 (6,59,3) ммоль/л, что достоверно отличало их от пациенток 2-й и 3-й групп (р<0,001). Через 2 часа после еды достоверно более низкий уровень глюкозы отмечался у беременных 1-й группы 5,5 (4,76,2) ммоль/л, а наиболее высокий в 3-й группе 6,3 (4,98,2) ммоль/л (p=0,0001). Уровень глюкозы у беременных 2-й группы достоверно не отличался от показателей у беременных 1-й группы 5,7 (4,86,9) ммоль/л, но был достоверно ниже, чем в 3-й группе (р=0,005). Таким образом, тяжесть ДФ у беременных с ГСД наиболее сильно зависела от уровня глюкозы крови натощак и через 1 час после еды, что соответствует данным большинства авторов (Ben-Haroush A. и соавт., 2004; Leipold H. и соавт., 2004).
Для выявления более тонких различий между группами на основании 9507 измерений была создана суточная почасовая перцентильная шкала гликемии (табл. 2).
Таблица 2.
Суточная почасовая перцентильная шкала гликемии у пациенток с ГСД
-
часы
3,01
10,01
25,01
50,01
75,01
90,01
97,01
7
2,08
2,86
3,71
4,66
5,57
6,35
7,09
8
2,14
2,93
3,78
4,72
5,63
6,41
7,13
9
2,27
3,1
3,98
4,95
5,89
6,68
7,42
10
2,46
3,33
4,27
5,3
6,28
7,11
7,89
11
2,66
3,6
4,59
5,68
6,71
7,59
8,41
12
2,85
3,83
4,87
6,01
7,09
8,01
8,86
13
2,98
3,99
5,06
6,23
7,34
8,27
9,14
14
3,03
4,05
5,12
6,29
7,39
8,33
9,19
15
3
4
5,05
6,19
7,27
8,18
9,02
16
2,92
3,88
4,89
5,98
7,01
7,88
8,68
17
2,82
3,73
4,69
5,73
6,71
7,53
8,29
18
2,73
3,61
4,53
5,52
6,46
7,24
7,96
19
2,7
3,56
4,46
5,43
6,34
7,1
7,81
20
2,75
3,63
4,53
5,51
6,42
7,19
7,9
21
2,89
3,79
4,73
5,75
6,7
7,49
8,22
22
2,95
3,88
4,83
5,85
6,81
7,62
8,35
23
2,9
3,8
4,73
5,73
6,66
7,44
8,15
24
2,78
3,64
4,52
5,47
6,35
7,09
7,76
Течение диабета у пациенток на диете в основном было компенсированное, гликемия в течение всей беременности не превышала 59 П уровень. У пациенток, которые получали инсулин только короткого или ультракороткого действия, гликемия находилась уже в более высоком диапазоне, при этом максимальный уровень 81 П отмечался в начале беременности (эффект рано выявленного ГСД). Далее на фоне начала инсулинотерапии гликемия снижалась до 56 П уровня, однако отмечались два небольших ее подъема - в 22 и 28 нед. (76 П и 69 П, соответственно), а с 30 нед. беременности данный показатель находился в диапазоне 41-44 П. У пациенток на базис-болюсной инсулинотерапии гликемия в течение всей беременности находилась в гораздо более высоком диапазоне – стабильно 75П уровня (максимальные значения в I триместре достигали 9099П), при этом только с 30 нед. беременности уровень гликемии начинал снижаться (эффект госпитализации в стационар для инсулинотерапии), однако не ниже 6067 П.
При анализе динамики гликемии у беременных с ГСД (рис.1) было выявлено, что в 1-й группе кривая концентрации глюкозы в крови была практически параллельна оси абсцисс, слабо нарастая с 5 (3,56,5) ммоль/л в начале беременности до 5,4 (4,56,4) ммоль/л к моменту родов. Во 2-й группе уровень глюкозы крови прогрессивно повышался до 22 нед. беременности с 4,8 (3,85,7) ммоль/л до 6,0 (4,87,1) ммоль/л и на этом уровне сохранялся до 28 нед. беременности, далее понижаясь до 5,5 (4,26,8) ммоль/л к 38 нед. Довольно быстрое снижение гликемии в этой группе связано с установлением диагноза и началом интенсивного лечения (инсулинотерапия). Активная терапия (хотя и проведенная с опозданием) не позволила развиться выраженным признакам ДФ у новорожденных этой группы.
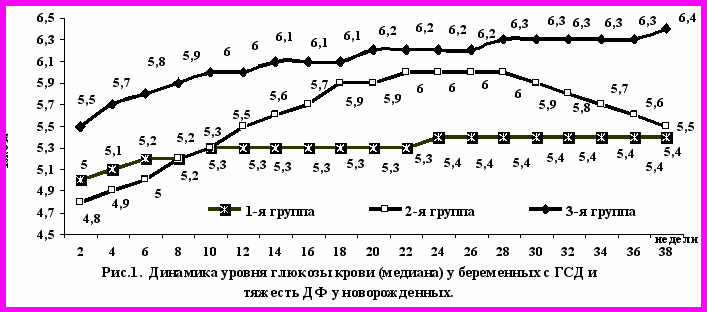
Напротив, в 3-й группе уровень глюкозы крови постоянно нарастал (без периодов снижения) и был на протяжении всего срока гестации значительно выше, чем в других группах (р0,0001). При этом наиболее низкие значения медианы глюкозы соответствовали 5,5 (4,16,9) ммоль/л (в начале беременности), а максимальные – 6,4 (5,17,6) ммоль/л (к концу беременности).
Наиболее наглядно влияние уровня глюкозы в крови беременной при ГСД на тяжесть ДФ можно увидеть при анализе динамики перцентильных значений глюкозы в течение беременности. В группе пациенток, у которых новорожденные не имели признаков ДФ (1-я группа), течение ГСД на протяжении всего срока беременности можно охарактеризовать как компенсированное (50 П). При этом, у 64,9% беременных 1-й группы компенсация нарушений углеводного обмена была достигнута диетой, в 35,1% случаях назначалась инсулинотерапия. Во 2-й группе максимальных значений гликемия достигала дважды: на 14 и 24 нед. – до 99 П, а, начиная с 25-26 нед. гестации на фоне лечения отмечалось довольно быстрое снижение гликемии, которая к 38 нед. беременности достигла 44 П уровня. В этой группе 41,7% беременных находились на диете, а 58,3% получали инсулинотерапию. В 3-й группе с 16 до 31 недели гестации гликемия находилась на самом высоком уровне – 8899 П, при этом максимальный ее уровень определялся дважды: в 20 (96 П) и в 26 (99 П) нед. После 31 нед. гликемия плавно снижалась, но, тем не менее, не достигала 50 П уровня даже к моменту родоразрешения. В 3-й группе наибольшее количество беременных (65,8%) требовали назначения инсулинотерапии. Снижение гликемии в 3-й группе до 6270 П уровня после 3233 недели беременности связано с началом интенсивного лечения. Аналогичное снижение гликемии во 2-й группе (но до более низких уровней – 4451 П) начиналось гораздо раньше, со срока 25-26 нед. беременности, что и привело к более благоприятному перинатальному исходу.
Таким образом, это позволило нам прийти к выводу, что прогностически неблагоприятными признаками для рождения ребенка с ДФ являются среднесуточный уровень гликемии 50 П (4,76,3 ммоль/л), а выраженные признаки ДФ развиваются при среднесуточном уровне гликемии 75П уровня (5,67,4 ммоль/л) (p=0,001) и начале коррекции гипергликемии после 26 нед. беременности в группах высокого риска по развитию ГСД. Аналогичные данные были получены при анализе CGMS у здоровых беременных, который продемонстрировал, что пик постпрандиальной гликемии у них не превышает 6,1±0,9 ммоль/л (Hod M. и соавт., 2006). Преимущество строгой компенсации было также установлено в исследовании HAPO-study, где частота макросомии при проведении интенсивного лечения снизилась с 21% до 10%, а частота преэклампсии с 48 до 12% (Metzger B. и соавт., 2009).
Акушерские осложнения были отмечены у 93% беременных, страдающих ГСД, причем, во всех случаях, они были сочетанными. Наиболее часто встречалась угроза прерывания беременности 53,9% женщин, что было несколько больше, чем по данным отечественных авторов – от 30% до 48% (Павлюкова С.А. 2007; Новикова В.А. и др., 2010). Наиболее характерно оно было для беременных 3-й группы 60,5% по сравнению с 52,1% и 57,4% случаев в 1-й и 2-й группах, соответственно (р<0,005) (табл.3). Ряд авторов установили взаимосвязь между невынашиванием беременности при ГСД и неудовлетворительной компенсации углеводного обмена (Kalter H., 1987, Miodovnic M. и соавт., 1990), однако мы не выявили подобной корреляции.
Таблица 3.
