Гестационный сахарный диабет (эндокринологичeские, акушерские и перинатальные аспекты) 14. 01. 01 Акушерство и гинекология 14. 01. 02 Эндокринология
| Вид материала | Автореферат |
СодержаниеМетод родоразрешения при срочных и преждевременных родах у пациенток с различной тяжестью ДФ новорожденных Поражение ЦНС у детей от матерей с ГСД и тяжесть ДФ (N=450) |
- Ооловна акушерские и перинатальные исходы у беременных с хронической фетоплацентарной, 304.06kb.
- "Сахарный диабет. Синдром диабетической стопы", 66.36kb.
- Что такое диабет?, 30.26kb.
- Сахарный диабет мелких домашних животных, 130.15kb.
- Новицкая Наталья Александровна Течение беременности и перинатальные исходы после экстракорпорального, 304.17kb.
- Сахарный диабет 2 типа, 89.86kb.
- Сахарный диабет у детей, 89.39kb.
- Подпрограмма «Сахарный диабет на 2012 2014 годы» Паспорт Подпрограммы, 71.38kb.
- Сахарный диабет у детей: причины возникновения, симптомы и признаки, диагностика, лечение, 107.19kb.
- Министерство внутренних дел российской федерации главный военный клинический госпиталь, 1637.93kb.
Метод родоразрешения при срочных и преждевременных родах у пациенток с различной тяжестью ДФ новорожденных
-
37 недели
СР ПКС ЭКС
37 и > недель
СР ПКС ЭКС
1-я группа, n (%)
4
(1,3)
6
(2)
4
(1,3)
203
(66,6)
48
(15,7)
39
(12,8)
2-я группа, n (%)
7
(6,5)
5
(4,6)
2
(1,9)
53
(49,1)
27
(25)
14
(13)
3-я группа, n (%)
0
4
(10,5)
8
(21,1)
11
(29)
11
(29)
5
(13,2)
Всего, n (%)
11
15
14
267
86
58
При сроке беременности 37 недель во всех группах преобладало оперативное родоразрешение, при этом частота ЭКС была наибольшей в 3-й группе, достигая 21,1%.
При анализе факторов, влияющих на метод родоразрешения, мы не выявили корреляции между способом родоразрешения и сроком беременности на момент первого выявления глюкозурии или гипергликемии натощак, а также сроком беременности, при котором был выявлен ГСД.
В то же время, самый низкий ИМТ был у пациенток, родивших через естественные родовые пути 26,6 (22,330,5) кг/м2, что достоверно отличало этих беременных от родоразрешенных оперативным путем: ПКС 29,1 (23,535,2) кг/м2 (p=0,02) и ЭКС 29,7 (24,736,2) кг/м2 (p=0,0003). Между беременными, родоразрешенными путем ЭКС или ПКС, по этому показателю не было достоверных отличий.
У женщин, родивших через естественные родовые пути, ИМТ в течение всей беременности находился ниже 50 П уровня, что достоверно отличало их от родоразрешенных оперативным путем (р=0,007). У женщин, родоразрешенных путем ПКС, ИМТ также практически все время находился в пределах популяционной нормы, достигая максимального значения в сроке 28 недель гестации 77 П. У женщин, родоразрешенных путем ЭКС, отмечался резкий подъем ИМТ в сроки с 18 до 20 нед. беременности – до 79 П, далее динамика ИМТ имела характер, сходный с женщинами с ПКС, отличия по набору веса между ними были статически недостоверными.
При анализе динамики глюкозы крови в зависимости от метода родоразрешения было выяснено, что у беременных с СР, уровень глюкозы крови до 28 нед. беременности находился в диапазоне от 53 П до 55 П уровня и только в 28 нед. отмечался небольшой подъем до 69 П с последующим снижением к 38 нед. до 50 П (рис.11).
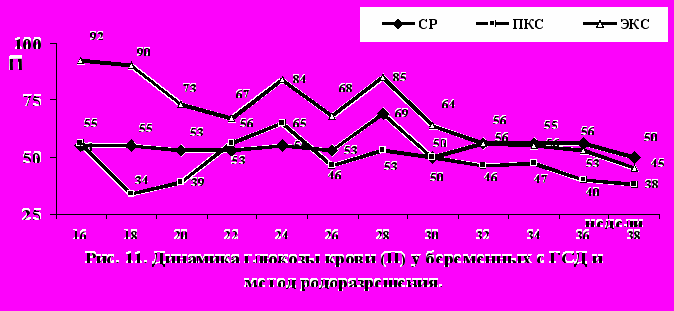
У беременных, родоразрешенных путем ПКС, динамика глюкозы крови имела также довольно плавный характер с одним пиком гликемии в 24 нед., когда она была достоверно выше, чем у беременных 1-й группы (р0,005). В то же время, динамика глюкозы крови у беременных, родоразрешенных в экстренном порядке, имела совершенной другой характер. До 30 нед. гестации гликемия находилась на очень высоком уровне – от 93 П до 85 П , после чего плавно начинала снижаться (эффект активного лечения и госпитализации в стационар), достигая 45 П только к 38 нед. гестации. До 30-31 нед. гестации различия по уровню глюкозы крови имели высокий уровень достоверности (р0,001).
При анализе структуры родового травматизма было выявлено, что наиболее часто он отмечался у детей 3-й группы, где отмечались выраженные признаки ДФ (45,5% по сравнению с 2,5% и 1,7% в 1-й и 2-й группах, соответственно (р0,0001). Обращает на себя внимание тот факт, что затруднение выведения плечиков достоверно чаще встречалось во 2-й и 3-й группах (3% и 27,3%, соответственно) в сравнении с 1-й группой (0,5%) (р0,05).
По данным литературы, основной причиной повышенной частоты индукции родов, родового травматизма и ЭКС при ГСД является макросомия (Oral E. и соавт., 2001; Batallan A., 2002), под которой подразумевается рождение ребенка с весом ≥4000 г или 90П по перцентильной шкале, разработанной для конкретной популяции (Дементьева Г.М., 1999). Роды крупным плодом произошли у 48 (10,6%) беременных, при этом СР произошли в 43,8%, ПКС – в 35,4%, ЭКС в 20,8% наблюдений. Наибольшее количество крупных плодов было во 3-й группе – 13 (34,2%), что в 8,8 раза больше, чем в 1-й группе 12 (3,9%) и в 1,6 раза по сравнению со 2-й группой – 23 (21,3%), р0,05. С весом 90 П родилось 160 (35,6%) детей. Среди женщин, родивших детей с макросомией, срочные роды произошли в 138 (86,3%), преждевременные – в 22 (13,7%) случаях. При этом, у 90 (56,2%) женщин, родивших детей с макросомией, произошли СР, у 44 (27,5%) было произведено ПКС и у 26 (16,3%) – ЭКС. Дети с явлениями макросомии также встречались во всех сравниваемых группах, однако наименьшее их число отмечалось в 1-й группе 49 (16,1%), р0,005. Во 2-й группе она была выявлена у 75 (69,4%) новорожденных, а в 3-й группе макросомия имела место у абсолютного большинства детей 36 (94,7%).
Было установлено, что у беременных на монотерапии диетой родилось 78 (30,5%) детей с макросомией, а у пациенток на инсулинотерапии – 82 (41,6%), соответственно. Мы не выявили связи между исходным ИМТ пациентки и рождением ребенка с макросомией как у беременных на диете, так и у беременных на инсулинотерапии, хотя в литературе имеются данные о наличии положительной корреляции между этими параметрами (Voldner N. и соавт., 2009; ссылка скрыта. и соавт., 2009). В то же время, несмотря на более раннее выявление гипергликемии натощак у женщин на диете, родивших детей с макросомией (27 (15,432,7) нед.) по сравнению с женщинами на диете, родившими детей без макросомии (31,4 (27,135,8) нед.) (p=0,0007), диагноз у них был установлен значительно позже (33,2 (28,635,6) нед.) по сравнению с 29,9 (25,4-34,7) нед. (p=0,01). Таким образом, поздняя постановка диагноза и ограниченные сроки для начала активного лечения не позволили обеспечить пациенткам своевременное начало инсулинотерапии в полном объеме.
Наши исследования подтвердили тот факт, что для профилактики макросомии плода у пациенток с ГСД необходимы достаточно «жесткие» критерии контроля гликемии (Walkinshaw, S.A., 2004). Так, в целом, медиана гликемии у женщин, родивших детей с макросомией, была достоверно выше (р0,0001), чем у женщин, родивших детей с весом 90П – 5,8 (4,86,9) и 5,3 (4,56,2) ммоль/л, соответственно.
При динамическом исследовании было выявлено, что уже с 1516 нед. беременности гликемия в группе женщин, родивших детей с макросомией, значительно превышала аналогичный уровень в группе женщин, родивших детей с нормальным весом – 5,6 (56,4) и 6,0 (5,17,6) ммоль/л, соответственно, (р=0,02). В 24 нед. беременности это различие становится еще более значимым – 5,7 (4,87,1) и 7,2 (5,410) ммоль/л, соответственно (р=0,005). Кроме того, у женщин, родивших детей с весом 90П, кривая гликемии с 1618 нед. имеет практически ровный монотонный характер без выраженных «пиков» гипергликемии, не превышая 5,1 ммоль/л (4,36,1) к доношенному сроку гестации. У женщин, родивших детей с макросомией, отмечались два выраженных «пика» гипергликемии (в 24 нед. – 7,2 (5,410) ммоль/л и в 28 нед. – 6,5 (5,87,4) ммоль/л), причем даже после достижения достаточно стабильного течения диабета, медиана гликемии до конца беременности не опускалась ниже 5,7 (4,77,2) ммоль/л.
Аналогичные различия были получены при анализе динамики перцентилных показателей глюкозы крови в течение беременности (рис.12).
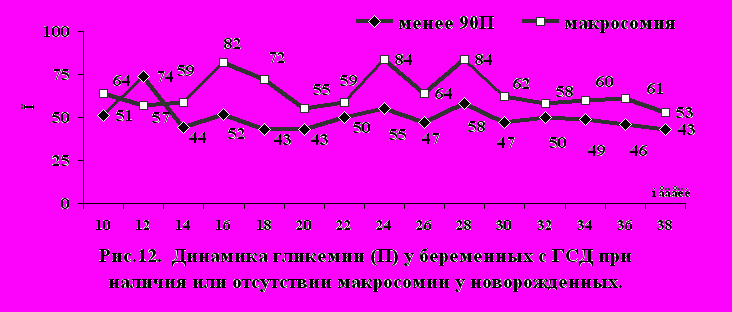
Так, если у женщин, родивших детей с весом 90П, примерно с 14-16 нед. беременности гликемия находилась в пределах от 44 до 50 П уровня с небольшим подъемом в 24 и 28 нед. до 55 и 58 П, то в группе женщин, родивших детей с макросомией, гликемия в течение беременности стабильно превышала 50 П уровень, c тремя пиками подъема гликемии (16, 24 и 28 нед.) 75 П уровня. С 30 нед. беременности в группе женщин с макросомией новорожденных наблюдалось снижение уровня гликемии, однако она по-прежнему стабильно превышала 50 П уровень.
Было установлено, что наибольший интерес при диагностике макросомии представляет перцентильная оценка фетометрических данных. Так, БПР головки плода независимо от наличия или отсутствия макросомии в течение всего периода гестации практически не превышал 75 П уровень, однако с 32 нед. у беременных с макросомией плода данный показатель начинал достоверно превышать аналогичный показатель в группе без макросомии – 67 (45,884,1) П и 44,1 (31,857,1) П, соответственно (р=0,0008).
ДГ плодов без макросомии в течение всей беременности не превышал 75 П, находясь в диапазоне от 70 (4573) П в 22 нед. до 44 (3164) П в 38 нед. гестации. В то же время, у плодов с макросомией уже в 2223 нед. беременности ДГ впервые достигал 75 П, а с 28 нед. стойко его превышал, находясь в диапазоне от 80 (6393) П в 28 нед. до 77 (6190) П в 34 нед., далее незначительно снижаясь до 72 П (4581) к 38 нед. При этом, начиная с 31 нед. эти различия носили статистически достоверный характер (р=0,002).
ДЖ плодов без макросомии в течение всей беременности находился в диапазоне от 47 (3459) П до 58 (4170) П, а с макросомией плода – прогрессивно увеличивался с 22 до 38 нед. (рис.13).
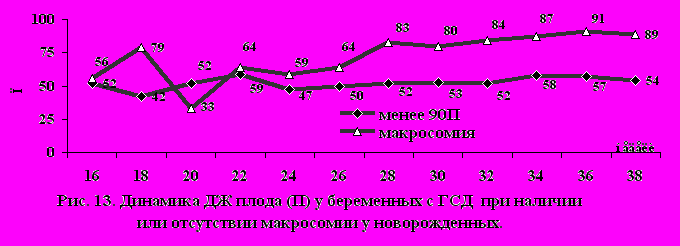
Статистически достоверные различия по ДЖ в зависимости от наличия или отсутствия макросомии выявлялись довольно рано, с 27-28 нед. гестации – 83 П (80,288,9) и 52 П (35,877,2), соответственно (р=0,001). Следует отметить, что уже с 28 нед. беременности ДЖ у плодов с макросомией стабильно превышал 75П, что считается показанием для начала инсулинотерапии, независимо от уровня гликемии у матери (Hod M., и соавт., 2006).
Также установлено, что уже с 31 нед. гестации появлялись статистически достоверные различия в коэффициенте «длина бедренной кости/ДЖ» между беременными с макросомией плода и всеми остальными беременными (р=0,0004), что свидетельствует о формировании у них ассиметричной формы макросомии. Однако, наиболее ранним и информативным в отношении прогноза развития макросомии оказался расчет отношения БПР/ДЖ, при этом достоверные различия по данному показателю в зависимости от наличия или отсутствия макросомии появлялись уже начиная с 25-26 нед. беременности (р=0,002) (рис.14).
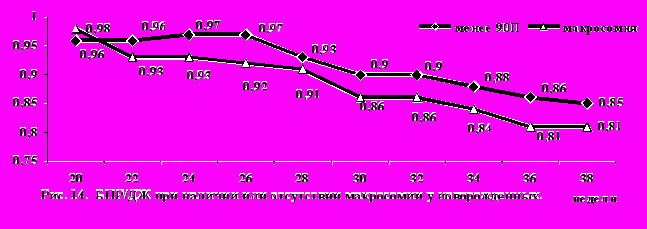
Таким образом, наши результаты показывают, что формирование макросомии плодов у части пациенток с ГСД возможно уже с ранних сроков беременности и может быть установлено при УЗИ уже в 25-26 нед. гестации, что согласуется с данными Баевой И.А. (2010). Столь ранний прогрессивный рост плода, по-видимому, связан с наличием СД до беременности и скрытой, не диагностированной, а следовательно, и некоррегированной гипергликемией в первой половине беременности. Поэтому ранний УЗ скрининг с перцентильной оценкой полученных результатов и расчетом коэффициентов пропорциональности развития плода, направленный на выявление макросомии в группах высокого риска по развитию ГСД, позволяет провести своевременную профилактику связанных с ним осложнений беременности и предотвратить развитие ДФ.
Многочисленные исследования показывают, что дети больных СД матерей составляют группу высокого риска развития патологии ЦНС (Федорова М.В. и др., 2001; Килина А.В., 2008; Будыкина Т.С. 2010). Показатель частоты асфиксии среди новорожденных от матерей с ГСД (34,7%) в 6-7 раз превышал частоту асфиксий новорожденных в общей популяции (1,5-7%) (Эзутаган С. Г., 2000). При детальном изучении течения раннего неонатального периода у 450 родившихся живыми новорожденных было установлено, что даже удовлетворительная компенсация углеводного обмена и отсутствие ДФ у новорожденного не исключает наличия неврологических нарушений в раннем неонатальном периоде.
В работе было применено условное разделение новорожденных и их матерей на пять групп с выраженными различиями в клиническом состоянии и проявлениями поражения ЦНС, а также разными исходами раннего неонатального периода (табл. 7).
Группа А - 252 (56%) новорожденных, родившихся в удовлетворительном состоянии, с неосложненным течением раннего неонатального периода. В этой группе детей, родившихся без фенотипических признаков ДФ (1-я группа), было достоверно больше в сравнении с новорожденными 2-й и 3-й групп (p=0,002).
Группа В – 102 (22,7%) новорожденных с легким и среднетяжелым поражением ЦНС при рождении. В течение раннего неонатального периода у этих детей была положительная динамика состояния, и все они были выписаны домой. В этой группе преобладали дети 2-й группы (р0,001).
Таблица 7.
Поражение ЦНС у детей от матерей с ГСД и тяжесть ДФ (N=450)
-
Степень поражения ЦНС
1-я группа
(n=304)
2-я группа
(n=108)
3-я группа
(n=38)
Группа А
205 (67,4%)*
44 (40,7%)
2 (5,2%)
Группа В
61 (20%)
32 (29,6%)**
8 (21,1%)
Группа С
10 (3,3%)***
21 (19,5%)
6 (15,8%)
Группа D
24 (7,9%)
11 (10,2%)
21 (55,3%)****
Группа E
2 (0,7%)
-
1 (2,6%)
