Автореферат диссертации на соискание ученой степени
| Вид материала | Автореферат диссертации |
СодержаниеРезультаты исследования и их обсуждение Популяционный состав лимфоцитов периферической крови и функция адгезии мононуклеаров периферической крови беременных женщин. |
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 298.92kb.
- Автореферат диссертации на соискание ученой степени, 500.38kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Секреция и экспрессия тканью плаценты на разных сроках беременности факторов, контролирующих ее развитие. При морфологическом исследовании плацент на сроках 9-11 недель и 38-39 недель при физиологически протекающей беременности отмечали нормальное строение ткани. При гестозе на сроке 38-39 недель в плацентах отмечали нарушение формирования и ветвления ворсин, инволютивно-дистрофические изменения, мононуклеарные инфильтраты с преобладанием лимфоцитов. Для оценки влияния различных факторов на формирование ткани плаценты в норме и при гестозе оценивали их секрецию и экспрессию клетками плаценты.
Таблица 1. Секреция тканью плаценты bFGF.
| Цитокины | Группы | Концентрация в пикограммах в 1мл кондиционированной среды | Концентрация в пикограммах в пересчете на 1мг ткани |
| bFGF | 9-11 недель (n=15) | 1309,3±239,1* | 12,7±1,7** |
| 38-39 недель (n=30) | 655,3±76,5 | 5,9±0,5 | |
| гестоз, 38-39 недель (n=35) | 545,4±22,4◙◙ | 5,6±0,3◙◙◙ |
Достоверность различий между группами: группа «9-11 недель» отличается от группы «38-39 недель» * – р<0,05; ** – р<0,01; группа «гестоз, 38-39 недель» отличается от группы «9-11 недель» ◙◙ – р<0,01; ◙◙◙ – p<0,001.
Секреция bFGF тканью плаценты на сроке 9-11 недель была в два раза выше, чем на сроке 38-39 недель (Таблица 1). Экспрессия bFGF в ткани плаценты на ранних и поздних сроках беременности не различалась (Таблица 2). Статистически значимых различий между уровнями секреции bFGF на сроке 38-39 недель и при гестозе не обнаружено. При гестозе выявлена статистически недостоверная тенденция к снижению секреции bFGF тканью плаценты. В тоже время, экспрессия bFGF клетками плацент беременных с гестозом была достоверно ниже (Таблица 2), чем клетками плацент здоровых беременных на сроке 38-39 недель, что подтверждает данные, полученные нами при анализе секреции bFGF тканью плацент и отражает нарушение процессов ангиогенеза.
Ангиогенин обнаружен в высоких концентрациях как при физиологической беременности, так и при гестозе. Статистически значимых различий в секреции ангиогенина между группами не выявлено, однако медианный тест показал тенденцию к повышению секреции ангиогенина клетками плаценты к третьему триместру физиологически протекающей беременности и в большей степени при гестозе (Рисунок 1).
VEGF принимает активное участие в контроле всех этапов формирования сосудистого русла плаценты [Clark D.E., 1998]. Однако VEGF не был обнаружен нами в надосадочных жидкостях, полученных после культивирования эксплантов плацент. В то же время, при помощи метода иммуногистохимического анализа нами обнаружена экспрессия VEGF в ткани плаценты (Таблица 2). Полученные данные можно объяснить способностью VEGF связываться с экстрацеллюлярным матриксом [Brewster L.P., 2008].
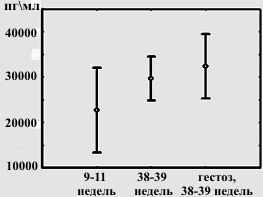
Рисунок 1. Концентрация ангиогенина в кондиционированных средах, полученных после культивирования эксплантов плацент, медианный тест.
Экспрессия VEGF-R3, PDGF, MMP-2, TSP-1, TGFβ, TGFβ-R1, CD105 плацент беременных на сроке 38-39 недель была ниже (Таблица 2), чем экспрессия этих факторов клетками плацент на сроке 9-11 недель. На ранних этапах развития локализация указанных факторов в ткани плаценты и проангиогенный цитокиновый профиль отражают активацию процессов ангиогенеза и формирование сосудистой сети. Снижение секреции проангиогенных и антиангиогенных факторов тканью плаценты в третьем триместре свидетельствует о завершении формирования ткани плаценты. Экспрессия VEGF-R3, bFGF, MMP-2, TGFβ-R1, CD105 клетками плацент беременных с гестозом была ниже, а экспрессия PDGF, TSP-1, TGFβ была выше (Таблица 2), чем экспрессия этих факторов клетками плацент здоровых беременных на сроке 38-39 недель. Сниженная экспрессия проангиогенных факторов при гестозе может являться причиной нарушения процессов ангиогенеза в плаценте, и отражает нарушение функций клеток плаценты. Увеличенная экспрессия антиангиогенных факторов TSP-1 и TGFβ и их локализация при гестозе отражают нарушение регуляции формирования ткани плаценты.
Приведенные результаты показывают, что для ранних и поздних этапов развития плаценты характерен определенный баланс между проангиогенными и антиангиогенными цитокинами. Нарушение такого равновесия у беременных с гестозом может приводить к снижению жизнеспособности клеток плаценты. В то же время, снижение экспрессии TGFβ-R1 и CD105 клетками плаценты при гестозе по сравнению с физиологически протекающей беременностью свидетельствует о компенсаторной реакции в ответ на действие антиангиогенных факторов. Дополнительно при гестозе повышенная продукция PDGF и ангиогенина в плаценте обеспечивает поддержание жизнеспособности клеток.
Таблица 2. Экспрессия факторов и рецепторов, контролирующих ангиогенез в ткани плаценты на разных этапах ее развития в норме и при гестозе.
| Маркеры | Площадь экспрессии маркера в ткани плаценты (%) | ||
| в 9-11 недель (n=15) | в 38-39 недель, физиологически протекающая беременность (n=10) | в 38-39 недель, гестоз (n=10) | |
| VEGF | 21,33±2,7 | 3,11±0,49*** | 0,58±0,13◙◙ |
| VEGF-R3 | 14,43±1,9 | 4,88±1,1** | 2,31±0,47◙◙ |
| bFGF | 5,39±0,59 | 5,2±0,52 | 2,0±1,01◙ |
| PDGF | 15,33±2,11 | 2,67±0,3*** | 6,2±0,32◙◙ |
| MMP-2 | 27,02±6,7 | 11,60±0,19* | 6,91±0,74◙◙◙ |
| TSP-1 | 1,76±0,24 | 0,08±0,01*** | 0,61±0,05◙ |
| TGFβ | 25,52±5,2 | 0,69±0,33*** | 4,55±0,65◙ |
| TGFβ-R1 | 7,42±2,95 | 0,96±0,25** | 0,21±0,02◙ |
| CD105 | 21,87±4,65 | 9,35±0,76* | 3,1±0,63◙ |
Достоверность различий между группами: группа «38-39 недель, физиологически протекающая беременность» отличается от группы «9-11 недель» ** – р<0,01; *** - p<0,001; группа «гестоз, 38-39 недель» отличается от группы «38-39 недель, физиологически протекающая беременность» ◙◙ – р<0,01.
Продукция тканью плаценты sVE-cadherin на сроке 9-11 недель не обнаружена. При гестозе повышалась продукция sVE-cadherin тканью плаценты в сравнении с физиологически протекающей беременностью (Таблица 3). В сыворотке sVE-cadherin не обнаружен ни в одной из групп. Продукция тканью плаценты sVE-cadherin при гестозе указывает на нарушение функций эндотелиальных клеток плаценты и на гибель клеток трофобласта.
Продукция тканью плаценты sVEGF-R1 была ниже на сроке 38-39 недель, чем на сроке 9-11 недель, что может быть связано с активным контролем ангиогенеза клетками трофобласта на ранних этапах развития плаценты. При гестозе повышалась секреция sVEGF-R1 тканью плаценты в сравнении с физиологически протекающей беременностью (Таблица 3), что может свидетельствовать об активной секреции sVEGF-R1 клетками плаценты, повышенной активности протеолитических ферментов и усиленной гибели клеток, экспрессирующих этот рецептор. Концентрация sVEGF-R1 в сыворотке женщин с физиологически протекающей беременностью и при гестозе была одинаковой, то есть повышенная секреция sVEGF-R1 тканью плаценты при гестозе не оказывала существенного влияния на концентрацию этих молекул в сыворотке крови беременных с гестозом.
Таблица 3. Продукция секреторных вариантов поверхностных рецепторов тканью плаценты.
| Секреторные молекулы | Группы | Концентрация в 1мл кондиционированной среды, пг\мл | Концентрация в пересчете на 1мг ткани, пг\мл |
| sVE-cadherin (sCD144) | 9-11 недель (n=15) | 0,1±0,1 | 0,001±0,001 |
| 38-39 недель (n=30) | 307,4±117,5** | 2,75±1,0* | |
| гестоз, 38-39 недель (n=35) | 665,2±155,2◙◙◙ ‡ | 6,98±1,63◙◙◙ ‡ | |
| sVEGF-R1 | 9-11 недель (n=15) | 77000,0±527,68 | 996,6±68,9 |
| 38-39 недель (n=30) | 28513,6±305,9*** | 313,7±25,7*** | |
| гестоз, 38-39 недель (n=35) | 40779,3±400,6 ◙◙◙ ‡ | 490,9±54,2 ◙◙◙ ‡ |
Достоверность различий между группами: группа «9-11 недель» отличается от группы «38-39 недель» * – р<0,05; ** – р<0,01; *** – р<0,001; группа «38-39 недель» отличается от группы «гестоз, 38-39 недель» ‡ – р<0,05; группа «гестоз, 38-39 недель» отличается от группы «9-11 недель» ◙◙◙ – p<0,001.
Продукция тканью плаценты sICAM-1 на сроке 38-39 недель при гестозе (3351,4±613,3 пг\мл) и при физиологически протекающей беременности была одинаковой (3362,7±546,1 пг\мл). Концентрация sICAM-1 в сыворотках здоровых беременных (22800±450 пг\мл) не отличалась от таковой в сыворотках здоровых небеременных женщин (21500±350 пг\мл). Концентрация sICAM-1 в сыворотках беременных с гестозом (40370±420 пг\мл) была достоверно выше, чем в сыворотках здоровых беременных (p <0,05). Обнаруженное нами при гестозе увеличение концентрации в сыворотке крови sICAM-1 подтверждается данными литературы [Kim S., 2004] и может быть следствием системной дисфункции эндотелиальных клеток или активации лейкоцитов.
Обнаружено достоверное снижение секреции IL-8 клетками плаценты к третьему триместру физиологически протекающей беременности (Таблица 4). При отсутствии статистически значимых различий секреции IL-8 клетками плацент женщин с физиологическим течением беременности на 38-39 неделе и с гестозом, медианный тест показал тенденцию к повышению секреции IL-8 клетками плаценты в последнем случае. Очевидно, при физиологическом течении беременности на ранних этапах IL-8 участвует в контроле процессов ангиогенеза, а повышение его продукции при гестозе свидетельствует об его участии в реализации воспалительной реакции.
При отсутствии статистически значимых различий в уровнях секреции хемокинов IP-10, MCP-1, RANTES тканью плаценты выявлена тенденция к повышению их секреции клетками плаценты к третьему триместру и снижению при гестозе. Продукция MIG снижалась к третьему триместру при физиологически протекающей беременности и при гестозе. Отмечена положительная корреляционная зависимость между IP-10 и MCP-1, IP-10 и MIG, а также ангиогенином и RANTES (p<0,01) при гестозе. Изменение секреции тканью плаценты хемокинов отражает различную степень активности плацентарных и децидуальных макрофагов, эндотелиальных клеток плаценты в динамике физиологического течения беременности и при гестозе.
Таблица 4. Секреция тканью плаценты цитокинов.
| Цитокины | Группы | Концентрация в пикограммах в 1мл кондиционированной среды | Концентрация в пикограммах в пересчете на 1мг ткани |
| IL-8 | 9-11 недель (n=15) | 17837,9±5345,5* | 294,3±109,7* |
| 38-39 недель (n=30) | 6445±833 | 61,1±7,8 | |
| гестоз, 38-39 недель (n=35) | 7437±1482◙ | 66,8±13,4◙ | |
| IFNγ | 9-11 недель (n=15) | 113,3±6,6* | 2,0±0,4 |
| 38-39 недель (n=30) | 151,5±13,6 | 1,8±0,2 | |
| гестоз, 38-39 недель (n=35) | 164,0±14,7◙ | 1,7±0,2 | |
| IL-2 | 9-11 недель (n=15) | 32,6±1,7* | 0,6±0,08 |
| 38-39 недель (n=30) | 45,8±4,2 | 0,5±0,07 | |
| гестоз, 38-39 недель (n=35) | 48,8±5,0◙ | 0,5±0,07 | |
| IL-4 | 9-11 недель (n=15) | 25,1±1,2* | 0,4±0,07 |
| 38-39 недель (n=30) | 36,2±3,4 | 0,4±0,06 | |
| гестоз, 38-39 недель (n=35) | 37,5±3,0◙ | 0,39±0,04 | |
| IL-5 | 9-11 недель (n=15) | 12,1±0,5** | 0,2±0,03 |
| 38-39 недель (n=30) | 16,6±1,2 | 0,19±0,03 | |
| гестоз, 38-39 недель (n=35) | 16,9±1,1◙◙ | 0,18±0,02 | |
| IL-6 | 9-11 недель (n=15) | 3496,5±767,3** | 51,5±11,4** |
| 38-39 недель (n=30) | 1013,9±144,1 | 17,9±6,4 | |
| гестоз, 38-39 недель (n=35) | 2479,0±592,1 | 44,2±7,6◙ | |
| IL-10 | 9-11 недель (n=15) | 26,8±1,4* | 0,5±0,1 |
| 38-39 недель (n=30) | 33,8±2,4 | 0,39±0,06 | |
| гестоз, 38-39 недель (n=35) | 34,0±2,2◙ | 0,35±0,04 |
Достоверность различий между группами: группа «9-11 недель» отличается от группы «38-39 недель» * – р<0,05; ** – р<0,01; группа «38-39 недель» отличается от группы «гестоз, 38-39 недель» ‡ – р<0,05; группа «гестоз, 38-39 недель» отличается от группы «9-11 недель» ◙ – р<0,05; ◙◙ – р<0,01; ◙◙◙ – p<0,001.
В полученных после культивирования эксплантов плацент надосадочных жидкостях IL-12p70 не был выявлен ни в одной из групп. Достоверных различий концентраций IL-1β не было обнаружено. При отсутствии статистически значимых различий секреции TNFα при физиологически протекающей беременности на 9-11 неделе и на 38-39 неделе, медианный тест показал тенденцию к повышению его секреции клетками плаценты в последнем случае. Секреция IFNγ, IL-2, IL-4, IL-5, IL-10 тканью плаценты при физиологически протекающей беременности на сроке 38-39 недель была достоверно выше, чем секреция указанных цитокинов на сроке 9-11 недель (Таблица 4). Секреция IL-6 тканью плаценты при физиологически протекающей беременности на сроке 38-39 недель была достоверно ниже, чем его секреция на сроке 9-11 недель (Таблица 4). С отмеченным повышением секреции цитокинов IL-10 и IL-4 к третьему триместру при физиологически протекающей беременности можно связать компенсаторное усиление их антиапоптотической роли в отношении клеток плаценты и участие в ингибиции активности цитотоксических лимфоцитов.
Достоверных различий между уровнями секреции IL-1β, TNFα IFNγ, IL-2, IL-4, IL-6, IL-5 и IL-10 при физиологически протекающей беременности на сроке 38-39 недель и при гестозе на сроке 38-39 недель не обнаружено. Таким образом, от первого к третьему триместру физиологически протекающей беременности наблюдалось увеличение секреции тканью плаценты IFNγ, IL-4 и IL-10, а также IL-2, IL-5 и TNFα. При гестозе в третьем триместре по сравнению с физиологически протекающей беременностью уровень их секреции не изменялся. Эта закономерность подтверждается положительными коэффициентами корреляции между концентрациями указанных цитокинов (p<0,01). Увеличение секреции тканью плаценты указанных цитокинов от первого к третьему триместру физиологически протекающей беременности сопровождалось снижением экспрессии ангиогенных и антиангиогенных факторов, что указывает на роль этих цитокинов в формировании плаценты. Наблюдаемое по результатам медианного теста увеличение секреции тканью плаценты IL-6 при гестозе на сроке 38-39 недель по сравнению с физиологически протекающей беременностью на сроке 38-39 недель, может отражать описанную ранее активацию плацентарных макрофагов, а также участие IL-6 в воспалительных реакциях в ткани плаценты. Увеличение при гестозе секреции тканью плаценты IL-6 и IL-8 и сохранение уровня секреции IFNγ, IL-10 может отражать нарушение формирования к третьему триместру сбалансированной цитокиновой сети.
Секреция и экспрессия апоптогенных и антиапоптогенных факторов тканью плаценты на разных сроках ее развития при физиологически протекающей беременности и при гестозе. Исследование срезов ткани плаценты при помощи TUNEL-метода показало одинаковую интенсивность процессов апоптоза в первом триместре (3,31%±1,68% (n=15)), в третьем триместре (5,29%±2,43% (n=10)) физиологически протекающей беременности, при беременности с гестозом (4,22%±1,86% (n=10)). Локализация апоптоза на ранних сроках выражена в трофобласте, а при доношенной беременности - в синцитиотробласте ворсин, что соответствует стратегии развития плаценты. При гестозе преимущественная локализация апоптоза в синцитиотрофобласте ворсин, а также повышенная экспрессия апоптогенного фактора TSP-1 в синцитиотрофобласте ворсин, строме ворсин и вокруг эндотелиальных клеток плодовых сосудов сопровождалась нарушением строения ткани плаценты и уменьшением количества плодовых сосудов.
Экспрессия FasL (CD95L), TRAIL, каспазы-2, каспазы-9, Mcl-1 клетками плацент беременных на сроке 38-39 недель была ниже, а экспрессия каспазы-3 была выше (Таблица 5), чем экспрессия этих факторов клетками плацент на сроке 9-11 недель. Экспрессия Fas (CD95), каспазы-8 в ткани плаценты на ранних и поздних сроках беременности не различались (Таблица 5).
Таблица 5. Экспрессия факторов и рецепторов, контролирующих апоптоз в ткани плаценты на разных этапах ее развития.
| Молекулы | Площадь экспрессии молекулы в ткани плаценты (%) | ||
| в 9-11 недель (n=15) | в 38-39 недель, физиологически протекающая беременность (n=10) | в 38-39 недель, гестоз (n=10) | |
| Fas (CD95) | 13,85±4,07 | 13,79±1,33 | 5,41±0,47◙◙ |
| FasL (CD95L) | 12,75±3,81 | 3,82±1,46*** | 3,96±0,31 |
| TRAIL | 20,39±3,46 | 3,14±1,11*** | 16,32±1,32◙◙ |
| Каспаза-2 | 12,75±3,81 | 3,82±1,46*** | 1,58±0,36 |
| Каспаза-3 | 5,78±0,57 | 8,29±1,31* | 2,23±0,2◙◙ |
| Каспаза-8 | 7,47±0,99 | 6,75±1,71 | 2,36±0,16◙◙ |
| Каспаза-9 | 17,15±3,26 | 6,37±2,01** | 3,97±1,09 |
| Mcl-1 | 16,12±3,75 | 2,72±0,27*** | 1,45±0,65 |
Достоверность различий между группами: группа «38-39 недель, физиологически протекающая беременность» отличается от группы «9-11 недель» * – р<0,05; ** – р<0,01; *** - p<0,001; группа «гестоз, 38-39 недель» отличается от группы «38-39 недель, физиологически протекающая беременность» ◙◙ – р<0,01.
Отсутствие различий экспрессии Fas (CD95) клетками плаценты на ранних и поздних сроках физиологически протекающей беременности свидетельствует о сбалансированном механизме контроля апоптоза. Снижение экспрессии FasL (CD95L) к третьему триместру физиологически протекающей беременности и его экспрессия в синцитиотрофобласте и фибробластах стромы ворсин указывает на снижение роли Fas-FasL взаимодействий в индукции апоптоза, с чем связано поддержание жизнеспособности клеток плаценты. Экспрессия TRAIL клетками плаценты очевидно способствует их защите от цитотоксических эффектов лимфоцитов на ранних сроках физиологически протекающей беременности. Экспрессия каспазы-2, каспазы-3, каспазы-8 и каспазы-9 в развивающейся и зрелой плацентах соответствовала локализации апоптоза в ткани плаценты. Полученные результаты могут свидетельствовать о регулируемом блокировании апоптотического сигнала от каспазы-2 и каспазы-9 к эффекторным каспазам за счет экспрессии Mcl-1. Незначительное увеличение экспрессии каспазы-3 и снижение экспрессии каспазы-2, каспазы-9 и Mcl-1 к концу беременности свидетельствует о снижении роли блокирующих антиапоптотических стимулов при передаче сигнала от каспазы-2 и каспазы-9 к эффекторным каспазам в условиях завершения формирования ткани плаценты.
Таблица 6. Продукция секреторных вариантов поверхностных молекул тканью плаценты.
| Секреторные молекулы | Группы | Концентрация в 1мл кондиционированной среды, пг\мл | Концентрация в пересчете на 1мг ткани, пг\мл |
| sFas (sCD95) | 9-11 недель (n=15) | 298,8±40,1 | 3,98±0,68 |
| 38-39 недель (n=30) | 277,8±15,6 | 3,0±0,19 | |
| гестоз, 38-39 недель (n=35) | 331,3±19,4 ‡ | 3,4±0,18 | |
| sFasL (sCD95L) | 9-11 недель (n=15) | 50,9±9,3 | 0,61±0,1 |
| 38-39 недель (n=30) | 16,78±3,5*** | 0,18±0,03*** | |
| гестоз, 38-39 недель (n=35) | 26,0±4,68◙ | 0,27±0,05◙◙ |
Достоверность различий между группами: группа «9-11 недель» отличается от группы «38-39 недель» *** – р<0,001; группа «38-39 недель» отличается от группы «гестоз, 38-39 недель» ‡ – р<0,05; группа «гестоз, 38-39 недель» отличается от группы «9-11 недель» ◙ – р<0,05; ◙◙ – р<0,01.
Экспрессия Fas (CD95), каспазы-3, каспазы-8, клетками плацент беременных с гестозом была ниже, а экспрессия TRAIL была выше (Таблица 5), чем экспрессия этих факторов клетками плацент здоровых беременных на сроке 38-39 недель. Экспрессия FasL (CD95L), каспазы-2, каспазы-9, Mcl-1 в ткани плаценты при физиологически протекающей беременности и при гестозе не отличались (Таблица 5). Таким образом, в плаценте при гестозе апоптоз активно управляется при помощи TRAIL при одновременном снижении роли Fas-FasL взаимодействий. Обнаруженное нами при гестозе снижение экспрессии каспазы-3 и каспазы-8, при неизменном уровне интенсивности апоптоза, экспрессии каспазы-2, каспазы-9 и Mcl-1 в сравнении с физиологически протекающей беременностью свидетельствует в пользу компенсаторного защитного действия ангиогенина и PDGF, продукция которых тканью плаценты увеличивалась при гестозе.
Концентрация sFas (sCD95) в надосадочных жидкостях, полученных после культивирования плацент здоровых беременных, была одинаковой как на сроке 38-39 недель, так и на сроке 9-11 недель (Таблица 6). Концентрация sFas (sCD95) в надосадочных жидкостях при гестозе была выше, чем при физиологически протекающей беременности. Молекула sFas не обнаружена в сыворотках крови, что свидетельствует о роли этой молекулы в местной регуляции процессов апоптоза.
Продукция тканью плаценты sFasL при физиологически протекающей беременности была ниже на сроке 38-39 недель, чем на сроке 9-11 недель (Таблица 6). При отсутствии статистически значимых различий медианный тест показал, что при гестозе происходило незначительное повышение секреции sFasL тканью плаценты в сравнении с физиологически протекающей беременностью. Повышенная секреция клетками плаценты sFasL при гестозе по сравнению с физиологически протекающей беременностью свидетельствует об активированном состоянии клеток плаценты и компенсаторном механизме, позволяющем клеткам плаценты избегать апоптотических сигналов за счет индукции апоптоза цитотоксических лимфоцитов. В сыворотке крови sFasL не обнаружен ни в одной из групп. Сохранение способности sFasL связываться с лигандами на поверхности клеток, в том числе лимфоцитов матери, снижает вероятность появления sFasL в кровотоке. Таким образом, продукция sFas и sFasL тканью плаценты является местным механизмом защиты против цитотоксического действия лимфоцитов матери.
Популяционный состав лимфоцитов периферической крови и функция адгезии мононуклеаров периферической крови беременных женщин. Относительное содержание популяций лимфоцитов периферической крови у здоровых небеременных, здоровых беременных и у женщин с гестозом находилось в пределах физиологической нормы (Таблица 7). У здоровых беременных содержание CD3+\CD4+ T-лимфоцитов хелперов (50,4%±2,2%) было выше содержания CD3+\CD8+ цитотоксических лимфоцитов (35,5%±1,6%, p<0,001) (Таблица 7). Относительное содержание CD3+\CD4+ лимфоцитов (42,7%±2,7%) и CD3+\CD8+ лимфоцитов (42,1%±2,4%) у беременных женщин с гестозом находилось на одинаковом уровне. Отмечено снижение соотношения CD3+\CD4+ лимфоцитов к CD3+\CD8+ лимфоцитам у беременных с гестозом по сравнению со здоровыми беременными (Таблица 7). У беременных с гестозом количество CD3+\CD4+ лимфоцитов было ниже, а количество CD3+\CD8+ лимфоцитов выше, чем у здоровых беременных. Также отмечено, что у беременных с гестозом количество активированных T-лимфоцитов CD3+\HLA-DR+, натуральных киллеров CD3–\CD16+\CD56+ и NKT-лимфоцитов CD3+\CD16+\CD56+ было выше (Таблица 7) по сравнению со здоровыми беременными. Общее количество CD3+ лимфоцитов, CD19+ B-лимфоцитов и CD3+\CD4+\CD8+ T-лимфоцитов у беременных с гестозом не отличалось от такового у здоровых беременных женщин.
Таблица 7. Соотношение популяций лимфоцитов периферической крови у небеременных, здоровых беременных женщин и у беременных женщин с гестозом.
| Популяции лимфоцитов | Содержание лимфоидных клеток с различным фенотипом | |||
| здоровые небеременные женщины, % | здоровые беременные женщины, % (M±m, n=30) | беременные женщин с гестозом, % (M±m, n=30) | ||
| по данным производителя; указано минимальное и максимальное значение | по собственным данным (M±m, n=100) | |||
| CD3+ | 62,8-85,0 | 75,2±0,6 | 81,1±1,8 | 77,1±2,8 |
| CD19+ | 7,1-23,3 | 10,1±0,4 | 8,6±0,7 | 7,2±0,8 |
| CD3+\CD4+ | 31,4-56,7 | 46,3±0,9 | 50,4±2,2 | 42,7±2,7* |
| CD3+\CD8+ | 18,9-47,9 | 38,4±0,8 | 35,5±1,7 | 42,06±2,4* |
| CD3+\CD4+\CD8+ | 0-3,2 | 2,8±0,4 | 1,8±0,6 | 2,5±0,9 |
| CD3+\HLA-DR+ | 3,6-25,9 | 6,9±0,6 | 3,93±0,6 | 8,00±1,7* |
| CD3–\CD16+\CD56+ | 6,7-33,5 | 14,4±0,6 | 10,47±1,0 | 17,6±2,9* |
| CD3+\ CD16+CD56+ | 3,1-8,1 | 6,6±0,4 | 1,11±0,1 | 6,29±0,9*** |
| Отношение CD3+\CD4+ к CD3+\CD8+ | 0,6-3,0 | 1,3±0,04 | 1,49±0,1 | 1,11±0,1* |
* - достоверность отличия группы беременных женщин с гестозом от группы здоровых беременных женщин p<0,05; *** - достоверность отличия группы беременных женщин с гестозом от группы здоровых беременных женщин p<0,001.
Таким образом, обнаруженное нами увеличение содержания цитотоксических лимфоцитов в периферической крови и очаги мононуклеарных инфильтратов с преобладанием лимфоцитов в ткани плаценты подтверждают данные литературы о развитии цитотоксического иммунного ответа у беременных с гестозом.
Гестоз сопровождается активацией эндотелиальных клеток сосудистого русла матери. Мы предположили, что снижение количества CD4+\CD8+ Т-лимфоцитов хелперов в периферической крови у беременных с гестозом по сравнению со здоровыми беременными может быть связано с повышением их способности к адгезии. Для проверки этой гипотезы мы оценивали функцию адгезии различных популяций мононуклеаров периферической крови небеременных и беременных женщин.
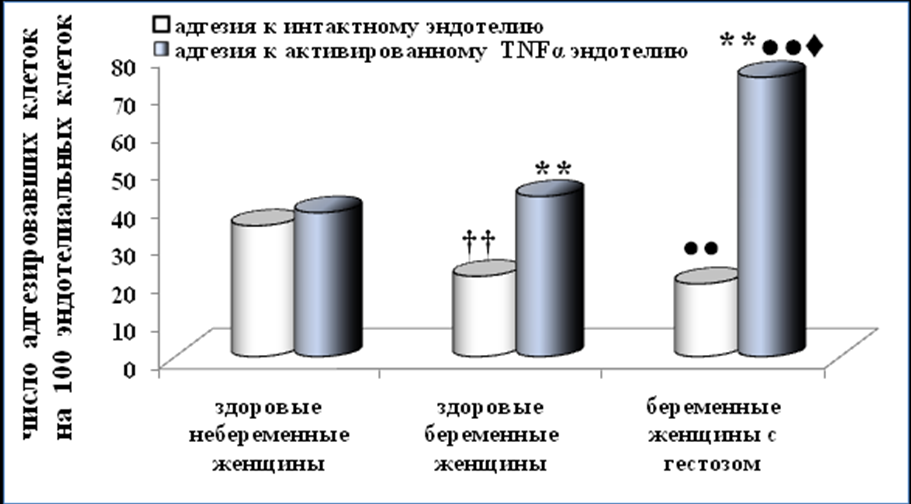
Рисунок 2. Количество лимфоцитов периферической крови женщин адгезировавших к эндотелиальным клеткам линии EA.Hy926. ** - p<0,01 (достоверность различий между показателем адгезии к интактному эндотелию и показателем адгезии к активированному TNFα эндотелию); †† - p<0,01 (достоверность различий между группой здоровых небеременных и здоровых беременных женщин); ●● - p<0,01 (достоверность различий между группой здоровых небеременных и беременных женщин с гестозом); ♦ - p<0,05 (достоверность различий между группой здоровых беременных и беременных женщин с гестозом).
Адгезия лимфоцитов (Рисунок 2) здоровых небеременных женщин к интактному и активированному TNFα эндотелию была одинаковой. Адгезия лимфоцитов здоровых беременных к активированному TNFα эндотелию превышала адгезию к интактному эндотелию в два раза, а у беременных с гестозом – в четыре раза. Количество адгезировавших лимфоцитов к интактному эндотелию у здоровых беременных и у беременных с гестозом была в 1,5 раза меньше, чем у здоровых небеременных женщин. Количество адгезировавших лимфоцитов к активированному TNFα эндотелию у беременных с гестозом была в 2 раза больше, чем у здоровых небеременных и у здоровых беременных женщин. Оценка популяционного состава лимфоцитов (CD3+\CD4+, CD3+\CD8+, CD16+/CD56+), адгезировавших к интактному и активированному TNFα эндотелию, у небеременных и беременных женщин показала незначительные различия в их составе.
Адгезия моноцитов (Рисунок 3) здоровых небеременных женщин к интактному и активированному TNFα эндотелию также была одинаковой. Адгезия моноцитов здоровых беременных и беременных с гестозом к активированному TNFα эндотелию превышала в два раза адгезию к интактному эндотелию. Количество адгезировавших моноцитов к интактному эндотелию у здоровых беременных была в 1,3 раза больше, а у беременных с гестозом была в 2 раза больше, чем у здоровых небеременных женщин. Количество адгезировавших моноцитов к активированному TNFα эндотелию у здоровых беременных было в 2 раза больше, чем у здоровых небеременных женщин. Оценка популяционного состава моноцитов (CD14+\CD16–, CD14+\CD16+), адгезировавших к интактному и активированному TNFα эндотелию, у небеременных и беременных женщин показала незначительные различия в их составе. При этом количество адгезировавших моноцитов к активированному TNFα эндотелию у беременных женщин с гестозом была в 2 раза больше, чем у здоровых небеременных и в 1,3 раза больше, чем у здоровых беременных женщин.
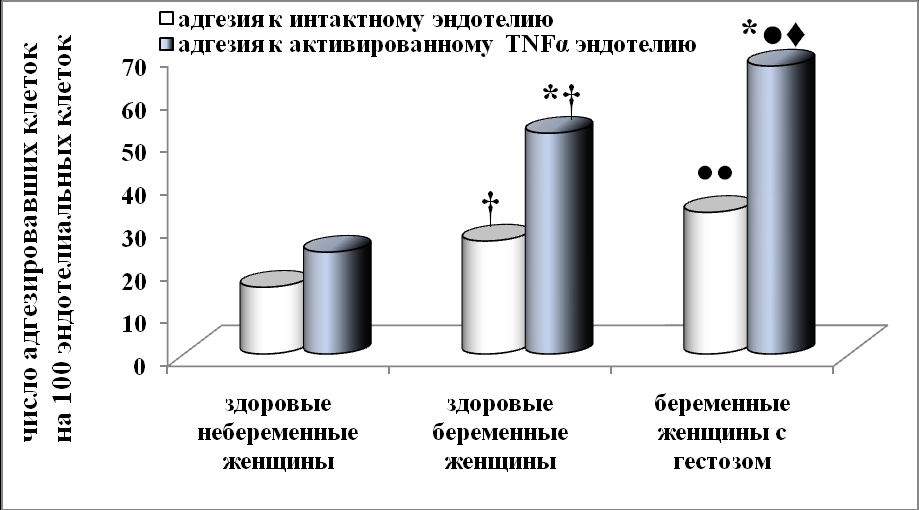
Рисунок 3. Количество моноцитов периферической крови женщин адгезировавших к эндотелиальным клеткам линии EA.Hy926. * - p<0,05 (достоверность различий между показателем адгезии к интактному эндотелию и показателем адгезии к активированному TNFα эндотелию); † - p<0,05 (достоверность различий между группой здоровых небеременных и здоровых беременных женщин); ● - p<0,05; ●● - p<0,01 (достоверность различий между группой здоровых небеременных и беременных женщин с гестозом); ® - p<0,05 (достоверность различий между группой здоровых беременных и беременных женщин с гестозом).
Таким образом, у здоровых небеременных женщин лимфоциты и моноциты одинаково адгезируют к интактному и активированному эндотелию. Напротив, как лимфоциты, так и моноциты здоровых беременных и беременных женщин с гестозом адгезируют к активированному эндотелию значительно интенсивнее. При этом, по сравнению с небеременными, адгезия лимфоцитов беременных к интактному эндотелию снижена, в то время как адгезия к активированному эндотелию при нормальной беременности увеличивается и носит еще более выраженный характер при гестозе. Адгезия моноцитов к интактному и активированному эндотелию увеличивается при нормальной беременности и еще более при гестозе.
Суммируя полученные нами данные необходимо отметить, что изменения в степени адгезии проанализированных нами популяций лимфоцитов и моноцитов не зависят от их фенотипической принадлежности к определенной популяции, но, возможно, определяются их функциональным состоянием и экспрессией адгезионных молекул. Снижение в периферической крови количества CD4+\CD8+ Т-лимфоцитов хелперов у беременных с гестозом по сравнению со здоровыми беременными не связано с повышением их способности к адгезии. Следует отметить, что значительное увеличение степени адгезии мононуклеаров женщин с гестозом по сравнению со здоровыми небеременными и беременными женщинами к активированному эндотелию может свидетельствовать об их изначально активированном состоянии и потенциально высокой экспрессии адгезионных молекул. При этом моноциты женщин с физиологическим течением беременности и беременных с гестозом, в отличие от лимфоцитов, также обладали повышенной адгезией к интактным эндотелиальным клеткам, что может указывать на определенную роль моноцитов в индукции эндотелиальной дисфункции. Таким образом, местная воспалительная реакция в ткани плаценты при гестозе, а также повышенное содержание в периферической крови беременных с гестозом цитотоксических лимфоцитов и повышенная функция адгезии лимфоцитов и моноцитов периферической крови к эндотелию позволяет рассматривать гестоз беременных как иммунопатологическое состояние.
Поглощение липидов моноцитами периферической крови и эндотелиальными клетками линии EA.Hy926 из сыворотки крови женщин с физиологически протекающей беременностью и беременных с гестозом. Гестоз сопровождается нарушением обмена липидов и изменением функциональной активности моноцитов периферической крови и эндотелиальных клеток. Это определило необходимость изучения влияния сывороток крови беременных на интенсивность поглощения липидов моноцитами периферической крови и эндотелиальными клетками.
Мы установили, что значения атерогенного индекса, концентраций триглицеридов, ЛПВП, ЛПНП, ЛПНОП, холестерина в сыворотках крови беременных с гестозом, не отличались от таковых в сыворотках здоровых беременных и здоровых небеременных женщин. Вместе с тем, поглощение липидов моноцитами/макрофагами периферической крови из аутологичной сыворотки, полученных от беременных с гестозом было выше, чем поглощение липидов моноцитами/макрофагами периферической крови из аутологичной сыворотки, полученных от здоровых беременных и небеременных женщин (Таблица 8). Поглощение липидов из эмбриональной телячьей сыворотки моноцитами\макрофагами периферической крови у здоровых беременных и у беременных с гестозом было одинаковым.
Таблица 8. Поглощение липидов моноцитами периферической крови.
| Группы женщин | Средняя площадь (%) липидных включений при культивировании моноцитов периферической крови в присутствии культуральной среды (500 мкл) с добавлением 500 мкл: | Средняя разница между контролем и опытом, % | |
| эмбриональной телячьей сыворотки (контроль) | аутологичной сыворотки крови (опыт) | ||
| Доноры (n=20) | 14,61±1,97 | 17,1±2,66 | 2,49±1,07 |
| с физиологически протекающей беременностью (n=20) | 17,52±1,51 | 19,36±1,58 | 1,84±0,48 |
| беременные с гестозом (n=20) | 19,78±1,58 | 32,6±1,74●●●‡‡‡ | 12,85±1,3***‡‡‡ |
Достоверность различий между группами: *** - p<0,001 - группа женщин с физиологически протекающей беременностью отличается от группы беременных женщин с гестозом; ‡‡‡ - p<0,001 - группа здоровых небеременных женщин отличается от группы беременных женщин с гестозом; ●●● - p<0,001 - достоверность отличия культивирования в присутствии эмбриональной телячьей сыворотки от культивирования в присутствии аутологичной сыворотки крови.
Поглощение липидов эндотелиальными клетками из сыворотки крови беременных с гестозом (площадь экспрессии 6,35%±0,55% (n=30)) была выше, чем из сыворотки крови здоровых беременных (площадь экспрессии 2,43%±0,28% (n=20), p<0,01), и здоровых небеременных женщин (2,7%±0,49% (n=10), p<0,01). Поглощение липидов эндотелиальными клетками из эмбриональной телячьей сыворотки было незначительным (0,68%±0,28% (n=20).
Таким образом, усиленное поглощение липидов из сывороток больных с гестозом вело к образованию пенистых клеток из эндотелиальных клеток и из моноцитов периферической крови. Сыворотки здоровых беременных не вызывали такого эффекта. Следует отметить, что мы не определяли содержание модифицированных и окисленных ЛПНП и ЛПОНП в составе липидной фракции сыворотки крови. Вместе с тем, результаты исследования можно объяснить повышенным содержанием в сыворотке крови беременных с гестозом модифицированных или окисленных ЛПНП или ЛПОНП, что ранее описано в литературе [Wang Y.P., 1991; Belo L, 2004]. Полученные нами данные также можно объяснить наличием в сыворотке крови беременных с гестозом факторов, способствующих поглощению липидов эндотелиальными клетками или моноцитами\макрофагами. Выявленное нами повышенное поглощение липидов эндотелиальными клетками и моноцитами\макрофагами может способствовать развитию дисфункции эндотелиальных клеток беременной женщины, что в конечном итоге может приводить к таким патологическим проявлениям гестоза, как отеки и гипертензия.
Суммируя полученные данные, необходимо отметить, что физиологическое развитие ткани плаценты контролируется сбалансированной системой клеточных взаимодействий, ангиогенных, антиангиогенных, апоптогенных, антиапоптогенных факторов, провоспалительных и противовоспалительных цитокинов, а также растворимыми формами различных поверхностных рецепторов (Рисунок 4). Физиологическое течение беременности и успешное формирование ткани плаценты связано с подавлением цитотоксического иммунного ответа. Ведущую роль в этом подавлении приписывают экспрессии молекул локуса HLA-G клетками трофобласта [Rajagopalan S., 2006]. Однако существуют и другие защитные механизмы. Формирование структуры плаценты связано с активацией процессов ангиогенеза и апоптоза. В результате апоптотической гибели клеток плаценты в кровоток матери могут поступать антигены плода [Huppertz B., 2004]. Однако при физиологически протекающей беременности активации цитотоксических лимфоцитов не происходит. Вероятно, это связано с деятельностью плацентарных макрофагов, поглощающих апоптотический материал, что сопровождается усилением секреции этими клетками TGFβ и IL-10 [Duffield J.S., 2001]. Обнаруженное нами усиление секреции IL-10 тканью плаценты к третьему триместру физиологически протекающей беременности отражает усиление активности плацентарных макрофагов. Нами установлено, что в первом триместре беременности клетки плаценты секретируют большие количества TGFβ, что может компенсировать сниженную по сравнению с третьим триместром беременности продукцию IL-10 и IL-4 клетками плаценты. Нами показано, что к концу физиологически протекающей беременности происходит усиление продукции тканью плаценты IFNγ, TNFα, IL-2, IL-5, активирующих цитотоксические клетки, при параллельном снижении продукции TGFβ. Обнаруженное нами усиление секреции IFNγ к третьему триместру физиологически протекающей беременности может быть связано с повышением активности NK-клеток к концу беременности. Следовательно, при физиологически протекающей беременности клетки трофобласта успешно справляются с подавлением цитотоксических эффектов лимфоцитов в условиях нарастания концентраций IFNγ и TNFα и снижения концентрации TGFβ. На ранних этапах формирования плаценты ограничение активности цитотоксических клеток матери может обеспечиваться обнаруженным нами высоким уровнем экспрессии TRAIL клетками трофобласта.
Нами установлено, что в динамике от первого к третьему триместру физиологически протекающей беременности в ткани плаценты сохраняется преимущественная продукция ангиогенных факторов. От первого к третьему триместру физиологически протекающей беременности снижалась секреция как ангиогенных факторов, так и антиангиогенных факторов и экспрессия их рецепторов. Вместе с тем происходило усиление секреции ангиогенина, который может поддерживать жизнеспособность клеток плаценты в конце беременности в условиях снижения секреции других ангиогенных факторов, а также подавляет пролиферацию активированных лимфоцитов [Matousek J., 1995]. Роль ограничителей ангиогенеза при физиологически протекающей беременности выполняют sVEGF-R1, TGFβ, TSP-1, продукция которых снижалась от первого триместра к третьему. Экспрессия клетками плаценты TGFβ-R1, CD105, TRAIL и секреции sFasL также снижалась от первого к третьему триместру физиологически протекающей беременности. Снижение экспрессии проангиогенных, антиангиогенных, проапоптогенных и антиапоптогенных факторов в ткани плаценты свидетельствует о стабилизации структуры плаценты в третьем триместре. Однако при помощи TUNEL-метода нам удалось показать одинаковую выраженность процессов апоптоза как в первом, так и в третьем триместре физиологически протекающей беременности. При этом локализация апоптоза была различной. На ранних этапах развития плаценты апоптотической гибели подвергаются преимущественно клетки инвазивного трофобласта, что подтверждает активную перестройку ткани плаценты. Экспрессия Fas (CD95) на ранних этапах развития плаценты в синцитиотрофобласте и в цитотрофобласте также свидетельствует об активной перестройке трофобласта при его инвазии в эндометрий. Защите от избыточных апоптотических сигналов на ранних этапах формирования плаценты способствует экспрессия клетками плаценты Mcl-1. При доношенной беременности локализация апоптоза выражена преимущественно в синцитиотробласте ворсин, что может свидетельствовать об усилении активности цитотоксических клеток матери в условиях снижения экспрессии клетками плаценты ангиогенных факторов. Экспрессия Fas (CD95) на поздних сроках беременности в синцитиотрофобласте и в строме ворсин способствует стабилизации структуры плаценты.
Физиологическое развитие ткани плаценты протекает на фоне продукции IFNγ при участии NK-клеток и цитотоксических лимфоцитов матери. Нами показано, что на протяжении физиологически протекающей беременности клетки плаценты ингибируют цитотоксическую активность лимфоцитов матери за счет экспрессии TRAIL, FasL, секреции TGFβ, IL-4, IL-10. Параллельно клетки плаценты создают зону маточно-плацентарного контакта, обеспечивающую достаточный уровень обмена веществ плода. Это достигается продукцией факторов, контролирующих ангиогенез и апоптоз, которые, действуя слаженно, обеспечивают рост ткани плаценты. Несмотря на выявленное нами снижение экспрессии и секреции клетками плаценты ангиогенных факторов к третьему триместру физиологически протекающей беременности усиления цитотоксических реакций и массовой апоптотической гибели клеток плаценты не происходит. Полученные нами данные позволяют предположить, что это связано с параллельным снижением экспрессии тканью плаценты как ангиогенных, так и апоптогенных и антиангиогенных факторов и объясняется необходимостью выполнения плацентой биологической функции поддержания жизнеспособности плода вплоть до родов. Вероятно, этот процесс контролируют плацентарные макрофаги, которые на ранних этапах физиологически протекающей беременности стимулируют продукцию клетками плаценты ангиогенных факторов, а в конце физиологически протекающей беременности тормозят ангиогенез за счет продукции TSP-1. Это подтверждается полученными нами данными: в третьем триместре TSP-1 экспрессирован в ткани плаценты диффузно и в особенности вокруг плодовых сосудов. За счет зафиксированного нами усиления продукции IL-10 тканью плаценты в конце беременности плацентарные макрофаги могут повышать жизнеспособность клеток трофобласта [Moreau P., 1999]. Поддержание жизнеспособности клеток плаценты также может обеспечивать ангиогенин, секреция которого, как установлено нами, повышается к концу физиологически протекающей беременности.
В третьем триместре беременности, осложненной гестозом, нами обнаружена высокая интенсивность апоптоза в клетках синцитиотрофобласта. Это может быть связано с нарушением механизмов, ответственных за подавление активности цитотоксических лимфоцитов матери. О реализации воспалительной реакции в ткани плаценты при гестозе свидетельствует обнаруженное нами наличие мононуклеарных инфильтратов. Документированное нами при гестозе по сравнению с физиологически протекающей беременностью повышение экспрессии тканью плаценты TGFβ, увеличение секреции тканью плаценты IL-6 и IL-8, сохранение уровня секреции IL-2, IL-5, IFNγ и TNFα, также свидетельствуют о реализации воспалительной реакции. Повышение активности цитотоксических клеток матери, кроме того, может быть обусловлено снижением экспрессии клетками трофобласта молекул локуса HLA-G или продукции их секреторных вариантов [Goldman-Wohl D.S., 2000], снижением фагоцитарной активности плацентарных макрофагов [Voll R.E., 1997], нарушением толерантности в системе мать – плод [Visser N., 2007]. Важным патогенетическим фактором гестоза представляется выявленное нами нарушение секреции проангиогенных и антиангиогенных факторов в плаценте, приводящее к нарушению строения ткани плаценты, гипоксии, нарушению активности антиокислительной системы в ткани плаценты, продукции кислородных радикалов, повышению гибели клеток трофобласта. Это подтверждается обнаруженным нами при гестозе снижением экспрессии в ткани плаценты VEGF, bFGF, MMP-2 и рецептора VEGF-R3, сопровождающимся увеличением экспрессии антиангиогенных факторов TSP-1 и TGFβ и секреции sVEGF-R1. Увеличение экспрессии TSP-1 вокруг плодовых сосудов плаценты свидетельствует о вовлечении плацентарных макрофагов в воспалительный процесс в ткани плаценты при гестозе.
Нами обнаружено, что при гестозе в ткани плаценты запускаются некоторые компенсаторные механизмы защиты против цитотоксических эффектов лимфоцитов матери. Увеличение секреции PDGF и ангиогенина повышает жизнеспособность клеток плаценты в условиях сниженной секреции bFGF, VEGF, экспрессии VEGF-R3 и повышенной секреции sVEGF-R1. Снижение экспрессии TGFβ-R1 и CD105 обеспечивает снижение апоптогенных эффектов TGFβ в условиях его повышенной продукции. Повышение продукции TGFβ может обеспечивать снижение активности цитотоксических лимфоцитов матери. Интенсивная экспрессия рецептора TRAIL клетками трофобласта при одновременном слущивании рецепторов Fas и FasL обеспечивает снижение значимости Fas-FasL взаимодействий в индукции апоптоза и является основным механизмом подавления цитотоксических лимфоцитов при гестозе.
Инвазия трофобласта
| Цитокиновая сеть плаценты на сроке 38-39 недель |
| Увеличение продукции в ткани плаценты IL-4, IL-10, IFNγ. Снижение продукции ангиогенных и антиангиогенных факторов при сохранении равновесия между проангиогенными и антиангиогенными факторами, а также между проапоптогенными и антиапоптогенными факторами |
| Процессы апоптоза ограничивают рост ткани плаценты, нет выраженных очагов апоптоза в ткани плаценты |
| Цитокиновая сеть плаценты на сроке 9-11 недель |
| Преимущественная продукция в ткани плаценты IL-4, IL-6, IL-10. Соблюдается равновесие между проангиогенными и антиангиогенными факторами, а также между проапоптогенными и антиапоптогенными факторами |
| Ангиогенез и апоптоз обеспечивают нормальное формирование ткани плаценты |
Активация NK-клеток эндометрия