Окисление и галогенирование действием галогенов и галогенидов: экспериментальное и теоретическое исследование реакций, новые методы синтеза вицинальных ди-, поликарбонильных соединений и арилгалогенидов 02. 00. 03 органическая химия
| Вид материала | Исследование |
Содержание5.3 Синтез и исследование строения арилдиазоний тозилатов Взаимное расположение о-нитро-фенилдиазония и тозилат-аниона в кристалле Основное содержание работы изложено в следующих публикациях |
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Теоретическое и экспериментальное изучение взаимодействия комплексов металлов, 374.68kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Рабочая программа дисциплины органическая химия, 654.51kb.
- Реферат Галогенирование кислород- и азотсодержащих соединений, 486.33kb.
- Образовательная программа 240100 Химическая технология и биотехнология Дисциплина Химия, 54.66kb.
- Химия и технология основного и тонкого органического синтеза, 51.12kb.
- Рабочая программа спецкурса «Методы органического синтеза» для специальности 020101, 103.25kb.
- Рабочая программа по дисциплине ен. Ф. 04 «Органическая химия», 320.1kb.
5.3 Синтез и исследование строения арилдиазоний тозилатов
Описанные в разделах 4.2.1-4.2.3 реакции диазотирования-иодирования с использованием толуолсульфокислоты должны проходить через промежуточное образование соответствующих арилдиазоний тозилатов. Однако в литературе нет указаний на возможность диазотирования аминов под действием p-TsOH. Некоторые из солей ArN2+TsO- известны довольно давно и тогда же был установлен их невзрывоопасный характер. Синтезировали эти соединения лишь методами ионного обмена из арилдиазоний хлоридов, а изучение свойств ограничено реакциями азосочетания с получением красителей. В то же время, учитывая безопасность данных диазониевых солей, представляется очень важным разработать общие методы синтеза и найти пути их использования в органическом синтезе. Эти обстоятельства заставили нас провести специальные исследования данного типа диазониевых солей.
Мы впервые показали, что разнообразные арилдиазоний тозилаты (44-54) легко образуются при диазотировании ароматических аминов нитритом натрия под действием 2-3 кратного избытка п-толуолсульфокислоты. Данные соли выделяются из растворов AcOH осаждением эфиром, однако совместно с ними осаждается и часть образующегося тозилата натрия, очистка от которого значительно снижает выходы целевых соединений.
Как известно, альтернативой нитриту натрия для диазотирования выступают алкилнитриты, но они дороги и обладают рядом отрицательных свойств. Мы получили принципиально иной, не содержащий натрия диазотирующий агент полимерной природы на основе доступной анионообменной смолы АВ-17. Метод синтеза данного реагента чрезвычайно прост и состоит в насыщении гранул смолы водным раствором NaNO2. В результате получается нитритная форма анионообменной смолы («Поли-NO2»), содержащая 3.5 ммоль нитрит-ионов в 1г смолы. Данный полимерный реагент стабилен, не теряет активности при хранении в течение 3 месяцев (в отличие от алкилнитритов), способен легко диазотировать ароматические амины в воде или АсОН и легко отделяется фильтрованием из реакционных смесей. С помощью разработанного реагента был получен широкий ряд диазоний тозилатов (44-54) (табл. 5.4), большинство из которых, ранее не были известны.
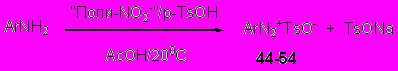

R=I (44), R = NO2 (49), R = NO2 (52), (54)
CN (45), NO2 (46), Me (50), Me (53)
Me (47), OMe (48) OMe (51)
Таблица 5.4. Синтез и свойства солей диазония, полученных при использовании системы «Поли-NO2-»/TsOH/AcOH, 20°С°, 20 мин
| Ar-N2+OTs- | Выход, % | Тпл., °С | Тразл., °С | ∆Нразл., Дж/г | N≡N, см-1 | δCipso, м.д. (DMSO-d6) |
| 44 | 60a | 124-126 | 115.22 | -245.5 | 2290 ср | 115.12 |
| 45 | 32a 97б | 113 | 124 | -332.4 | 2314 ср. | 121.11 |
| 46 | 39a 84б | 132 | 129.68 | -340.0 | 2308 ср. | 112.60 |
| 47 | 49a 86б | 120 | 176.59 | 20.07 | 2288 сл | 128.76 |
| 48 | 32a 79б | 118-120 | 156.25 | 33.31 | 2242 сл. | 123.86 |
| 49 | 35a 95б | 155 | 139.75 | -323.0 | 2303 ср. | 112 |
| 50 | 51a | 182 | 184.24 | 76.27 | 2300 сл. | 120.27 |
| 51 | 51a | 149-151 | 151.05 | 79.00 | 2296 сл. | 120.27 |
| 52 | 54a 85б | 134 | 132.42 | -389.8 | 2307 ср. | 118.27 |
| 53 | 42a 72б | 158-161 | 162.86 | 73.55 | - | 131.49 |
| 54 | 39a 84б | 152 | 130.96 | -184.7 | 2310 сл. | 112.60 |
Примечание: мольные соотношение амин/ поли-NO2-/p-TsOH: a 1:1:1; б 1:3:3
ввремя реакции 5 мин
Полученные соли, представляют собой слабоокрашенные кристаллические соединения, хорошо растворимые в воде и полярных растворителях, они стабильны при хранении даже на прямом солнечном свету. Строение солей (44-54) однозначно доказано методами ИК, ЯМР 1Н, 13С, а для некоторых из них - рентгеноструктурным анализом. Все синтезированные соли тестировались с помощью интегрированного ДТА/ТГА/ДСК метода, подтвердившего их невзрывоопасный характер (табл. 5.4).
Анализ данных таблицы 4.4 свидетельствует о том, что структура соединений с электроноакцепторными заместителями (44-46, 49, 52, 54), в большей степени отвечает ионному характеру [ArN≡N]+[SO3Ar’]- (в области 2290 – 2314 см-1 наблюдаются полосы поглощения, относящиеся к валентным колебаниям тройных связей N≡N, в то время как в ИК-спектрах солей с электронодонорными заместителями (47-48, 50-51, 53) максимумы поглощения сдвинуты в длинноволновую область и имеют пониженную интенсивность. Это может указывать на ковалентный тип связи в таких субстратах (Ar-N=N-OSO2-Ar’). Высказанному предположению не противоречат и данные ЯМР. В случае солей (44-46, 49, 52, 54) химические сдвиги атомов углерода, соединенного с группой N2 (Cipso) лежат в области типичной для солей диазония (111-118 м.д.), при этом находятся в более сильных полях, чем для соединений с электронодонорными заместителями (47-48, 50-51, 53) (120 и выше м.д.). При однотипном же строении (ионном или ковалентном) изученных соединений донорные заместители должны были бы сдвигать сигнал Cipso в сильные поля, а акцепторные – в слабые.
ДТА/ТГА/ДСК анализ также обнаружил принципиальные различия между диазониевыми солями (44-46, 49, 52, 54) и соединениями (47-48, 50-51, 53). Так, термическое разложение для всех веществ с электроноакцепторными заместителями происходит при более низких температурах (115-140°С) и имеет экзотермический характер (∆Нразл < 0), в то время как соли с электронодонорами разлагаются при температурах 150-190°С с поглощением тепла. При этом потеря массы для экзотермических процессов приближенно соответствует потере молекулы N2, ожидаемой при разложении диазониевых солей. Потеря массы вещества для эндотермических реакций существенно больше, что указывает на глубокий распад этих соединений, соответствующий поведению обычных ковалентных веществ при термическом разложении.
Таким образом, полученные нами данные не противоречат ни одному из высказанных ранее утверждений о строении «диазониевых солей» p-TsOH (Саундерс, Кикоть, Казицина, Порай-Кошиц и др.), однако они значительно уточняют их: указанные соединения с электроноакцепторными заместителями ионизированы и существуют в виде ([ArN≡N]+[p-TsO]-), соединения же с электронодонорными заместителями являются, скорее всего, ковалентными.
Строение солей (44-54) впервые доказано также с помощью рентгеноструктурного анализа. Данные исследования позволили обнаружить уникальные черты строения арилдиазоний тозилатов в твердом состоянии. Как видно из рис. 5.1, группа –SO3- аниона не взаимодействует прямо с диазониевой функцией, т.е. связывание между анионной и катионной частью солей [ArN≡N]+[p-TsO]- обеспечивается силами Ван-дер-Ваальса, водородными связями и, возможно, донорно-акцепторными взаимодействиями. При этом собственно диазониевая группа катиона остается свободной, не экранированной анионом. Это в принципе отличает строение арилдиазоний тозилатов от известных солей диазония ArN2+X-.
Несмотря на высокую устойчивость, арилдиазоний тозилаты показали и высокую реакционную способность, что продемонстрировано на ряде примеров. Так, в водных растворах при комнатной температуре они почти количественно за 5-30 мин превращаются в арилиодиды при добавлении KI
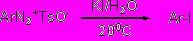
Ar = p-NO2C6H4 (98%); o-NO2C6H4 (85%); p-MeC6H4 (80%); 2,4,6-Br3C6H2 (97%)
На примере соли (45) показано также, что в растворах ДМСО с KBr за 1ч происходит бромирование (препаративный выход 4-бромнитробензола 80%), а с NaNO2 за 30 мин образуется 1,4-динитробензол (74%). Эти реакции идут при комнатных температурах и, что очень важно, без добавления солей меди, как в классических реакциях Зандмейера.
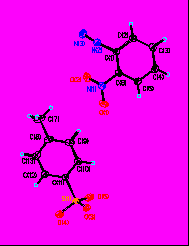
Рис. 5. 1 Взаимное расположение о-нитро-фенилдиазония и тозилат-аниона в кристалле
Таким образом, легкость получения арилдиазоний тозилатов, их устойчивость, безопасность, и высокая химическая активность делают эти соединения очень перспективными для органического синтеза.
5.4 Синтез ароматических полииодидов
Комбинация разработанных методов прямого и косвенного иодирования была использованы для получения ди-, три- и тетраиодаренов, представляющих интерес для органического синтеза, получения металлорганических соединений, медицинских препаратов и диагностикумов. Методы основаны на последовательном электрофильном иодировании аминов и последующей замены амино-группы через диазотирование на иод. Электрофильное иодирование проводилось известными методами с использованием реагентов (ICl, Me4NI+Cl2-, NIS, I2/HIO3). Синтетические процедуры были оптимизированы для конкретных соединений, что в результате позволило получить как моно-, так и диидпроизводные аминов с высокими выходами. Замена NH2-группы на иод проводилась с использованием разработанной нами системы NaNO2/KI/p-TsOH в ацетонитриле (раздел 5.2.1). В результате был получен широкий ряд полииодаренов как с донорными, так и акцепторными заместителями в кольце (табл. 5.5). 3,4,5-Трииодацетофенон и 1,4-диид-2-фторбензол были синтезированы нами впервые.
Таблица 5.5 Получение полииодсодержащих соединений реакцией иодо-дезаминирования ароматических аминов под действием системы NaNO2/KI/p-TsOH в MeCN (20°С, соотношение субстрат:NaNO2:KI:p-TsOH 1:2:2.5:3)
| Субстрат | Время, мин | Продукт, % |
| 2,4,6-Трииоданилин | 120 | 1,2,4,6-Тетраиодбензол, 50 |
| 2,6-Дииод-4-нитроанилин | 60 | 3,4,5-Трииоднитробензол, 70 |
| 4-Иод-2-нитроанилин | 90 | 2,4-Дииоднитробензол, 90 |
| 4,6-Дииод-2-нитроанилин | 90 | 3,5,6-Трииоднитробензол, 60 |
| 3,5-Дииод-4-аминоацетофенон | 120 | 3,4,5-Трииодацетофенон, 60 |
| 2-Иод-4-нитроанилин | 60 | 3,4-Дииоднитробензол, 73 |
| 1-Амино-2-иодантрахинон | 60 | 1,2-Дииодантрахинон, 48 |
| 1,3-Дииод-2-аминоантрахинон | 120 | 1,2,3-Трииодантрахинон, 68 |
| 4-Иод-2-фторанилин | 60 | 1,4-Дииод-2-фторбензол, 68 |
Выводы
1. Разработаны эффективные методы синтеза карбонильных и вицинальных дикарбонильных соединений окислением алкенов, алкинов, насыщенных углеводородов, спиртов, их сложных эфиров галогенами и галогенидами в ДМСО и серной кислоте. Установлены препаративные возможности и ограничения этих окислительных реакций. Полученные дикетоны являются ценными мономерами и полупродуктами органического синтеза.
2. Установлен механизм реакций окисления алкенов и алкинов до дикарбонильных соединений под действием брома, иода и HBr в ДМСО. Показано, что основной маршрут этих окислительных трансформаций непредельных соединений реализуется через образование вицинальных дигалогенидов, которые либо медленно взаимодействуют с ДМСО с образованием карбонильных соединений.
3. Открыта реакция «индуцированного» окисления моноалкилбромидов под действием ДМСО до вицинальных ди- и поли-карбонильных соединений и предложен подход к получению ранее неизвестных полимерных 1,2-дикетонов.
4. Разработан новый суперэлектрофильный иодирующий агент Alk4N+ICl2- в серной кислоте или присутствии Ag2SO4, способный эффективно иодировать дезактивированные арены и являющийся хорошей альтернативой токсичному и высоко коррозионному хлориду иода.
5. Предложены удобные и эффективные методы косвенного иодирования аренов через реакции иодо-дебромирования и диазотирования-иодирования, позволяющие синтезировать широкий ряд арилиодидов, в том числе, иодсодержащие соединения, которые не могут быть получены прямым иодированием. Разработанные методы представляют практический интерес в синтезе иодсодержащих радиофармпрепаратов, металлорганических соединений и рентгеноконтрастных диагностикумов.
6. Предложены новые, эффективные и экологически безопасные методы электрофильного иодирования аренов и диазотирования-иодирования ароматических аминов в отсутствие растворителя, отвечающие требованиям «Зеленой химии». Разработан принципиально новый метод синтеза медицинского препарата «Йодантипирин» в отсутствие растворителя в условиях механической активации.
7. Впервые проведено комплексное теоретическое исследование реакций электрофильного иодирования в различных средах. С использованием неэмпирического метода DFT B3LYP/6-311G* впервые определены параметры реакционной способности иодирующих агентов и ароматических субстратов; установлены структурные и термодинамические характеристики реагентов, продуктов, интермедиатов и переходных состояний иодирования в сравнении с хлорированием; вычислены профили поверхностей потенциальных энергий хлорирования и иодирования.
8. Разработан одностадийный метод синтеза широкого ряда арилдиазоний тозилатов диазотированием аминов в присутствии п-толуолсульфокислоты; впервые проведено их комплексное структурное исследование (ИК, ЯМР, DTA/TGA/DSC и рентгенокристаллографически). Установлено, что арилдиазоний тозилаты с электроноакцепторными заместителями ионизированы и существуют в виде ([ArN≡N]+[p-TsO]-), соединения же с электронодонорными заместителями являются ковалентными Ar-N=N-OTs. Данные соединения невзрывоопасны, устойчивы при хранении, обладают повышенной стабильностью, не свойственной обычным диазониевым солям. В то же время они обладают высокой активностью в реакциях галогенирования и нитрования.
Основное содержание работы изложено в следующих публикациях:
1. Юсубов М.С., Краснокутская Е.А., Филимонов В.Д. Раствор брома в серной кислоте - новый экономичный реагент окисления стильбена до бензила. // ЖОрХ. – 1992. – Т.28, Вып. 4. – С. 869-870.
2. Филимонов.В.Д., Юсубов М.С., Краснокутская Е.А. Практичный синтез ароматических 1,2-дикетонов из диарилэтиленов и диарилацетиленов с помощью новых реагентов. / Бюлл. РИОР. – 1992. – Т.8. – С. 16.
3. Юсубов М.С., Краснокутская Е.А., Филимонов В.Д., Ковалева Л.Ф. Окисление, бромирование и метиленирование карбазола и Е-3-(2-фенилэтенил)-карбазола действием HBr/ДМСО. // ХГС. – 1992. -№ 11. – С. 1477- 1480.
4. Yusubov M.S., Krasnokutskya E.A ., Vasilyeva V.P., Filimonov V.D., Ki-Whan Chi. DMSO-based reagents for the Oxidation of Alkenes and Alkynes to 1,2-diketones. // Bull. Korean Chem.Soc. – 1995. - № 2. - P. 86-88.
5. Юсубов М.С., Ки Ван Чи, Краснокутская Е.А., Филимонов В.Д., Васильева В.П. Использование новых реагентов на основе ДМСО в окислении двойных и тройных связей и синтезе 1,2-дикетонов. // ЖОрХ. – 1995. – Т.31, Вып. 11. – С. 1675-1678.
6. Краснокутская Е.А., Юсубов М.С., Филимонов В.Д., Хабихер В. Новая практичная реакция окисления 1,2-диарилэтенов и 1,2-диарил-1,2-ди-бромэтанов до 1.2-диарилкетонов под действием реагентов на основе серной кислоты. // ЖОрХ. – 1996. – Т.32, Вып. 7. – С. 1041-1044.
7. Краснокутская Е.А., Хабихер В, Юсубов М.С., Филимонов В.Д. Исследование окисления терминальных непредельных соединений реагентами на основе ДМСО. // ЖОрХ. – 1997. Т.32, Вып. 2. – С. 179-183.
8. Краснокутская Е.А., Кузнецова Ю.А., Юсубов М.С., Филимонов В.Д. Окисление спиртов диметилсульфоксидом. Сравнение путей активации окислителя и субстрата. // ЖОрХ. – 1998. – Т34, Вып. 1. – С. 43-45.
9. Филимонов В.Д., Чайковский В.К., Краснокутская Е.А. Новые методы иодирования аренов и функционализации кратных связей органических соединений. // Изв. Вузов. Химия и хим. технол. - 2000. – Т.43, Вып. 3. – С. 34-42.
10. Краснокутская Е.А., Дьякова А.С., Филимонов Ф.Д., Голодков О.Н., Белов Г.П. Селективное окисление сополимера пропилена и СО диметилсульфоксидом. Синтез полимерных 1,2-дикетонов. // Изв. Вузов. Химия и хим. технол. - 2002. – Т.45, Вып. 3. – С. 51-52.
11. Краснокутская Е.А., Дьякова А.С., Филимонов Ф.Д., Ки-Ван Чи. Удобный одностадийный метод окисления аценафтена до аценафтенхинона N-бромсукцинимидом и ДМСО. // Изв. Вузов. Химия и хим. технол. – 2002. – Т.45, Вып. 3. – С. 52-54.
12. Краснокутская Е.А., Филимонов В.Д.. Лесина Ю.А. Генерирование электрофильного иода из хлорида иода в нейтральных средах. Иодирование и протодеиодирование карбазола. //ЖОрХ. – 2003. – Т.39, Вып. 6. – С. 924-929.
13. Krasnokutskaya Е.А., Filimonov V.D., Poleshchuk O.Kh. The Study of electronic structure and reactivity of iodinating agents by ab initio and the DFT methods. // Chimia (Switzerland). – 2005. - № 7-8. – P. 430-431.
14. Краснокутская Е.А., Филимонов В.Д., Лесина Ю.А., Горлушко Д.А. Сравнительное изучение активности иодирующих агентов в растворе и твердой фазе. // ЖОрХ. – 2005. - Т.41, Вып. 6. - С. 876-880.
15. Краснокутская Е.А., М.Е. Трусова, В.Д. Филимонов. Иодирование аренов системой иод-фенилиодозодиацетат в твердой фазе. // ЖОрХ. – 2005. – Т.41, Вып. 12. – С. 1788-1789.
16. Е.А. Краснокутская, М.Е. Трусова, Н.С. Гиберт, В.Д. Филимонов. Синтез 4-йодантипирина йодированием без растворителя в условиях механической активации. // Хим.-Фарм. журн. – 2007. - Т.41, № 3. – С. 112-113.
17. Филимонов В.Д., Краснокутская Е.А., Полещук О.Х., Лесина Ю.А., Чайковский В.К. Изучение методом функционала плотности электронного строения и реакционной способности иодирующих агентов в газовой фазе и растворах. // Изв. АН Cер. хим. – 2006. - №8. – C. 1280-1288.
18. Krasnokutskaya E.A., Semenischeva N.I., Filimonov V.D., Knochel P. A new, one-step, effective protocol for iodation of aromatic and heterocyclic compounds via aprotic diazotization of aminoarenes. // Synthesis – 2007. - № 1. – P. 81-84.
19. Yusubov M.S., Tveryakova E.N., Krasnokutskaya E.A., Perederyna I.A., Zhdankin V. Solvent-Free Iodination of Arenes Using Iodine - Silver Nitrate Combination. // Synth. Comm. – 2007. - № 37. - P. 1259-1265.
20. Патент РФ № 2289577 (приоритет от 20.12.2006). Способ получения (1-фенил-2,3-диметил-4-иодпиразолона-5) (Йодантипирина). / Краснокутская Е.А., Филимонов В.Д.
21. Филимонов В.Д. Юсубов М.С., Краснокутская Е.А. Иод в диметилсульфоксиде как новый общий реагент в окислении. // Материалы Всесоюзной конф. «Селективное окисление углеводородов и ресурсосбережение углеводородного сырья». – Харьков. – 1991. – С. 23-24.
22. Юсубов М.С., Краснокутская Е.А., Филимонов В.Д. Препаративные воз-можности и механизм действия HBr/ДМСО и I2/ДМСО, как новых реагентов синтеза 1,2-дикетонов. // Материалы Всесоюзного совещания «Механизмы реакций нуклеофильного замещения и присоединения». – Донецк. – 1991. – С. 42.
23. Юсубов М.С., Краснокутская Е.А., Филимонов В.Д., Васильева В.П. Селективные реагенты окисления двойных и тройных связей и синтез 1,2-дикетонов. // Материалы VII Международного совещания. по хим реактивам. - Уфа- Москва. – 1994. – С. 42.
24. Филимонов В.Д., Юсубов М.С., Краснокутская Е.А. Передерина И.А., Рогачев В.О. Реагенты на основе ДМСО, серной кислоты, нитратов в новых синтезах поликарбонильных соединений, нитроолефинов, сультонов. // Материалы I-ой Научно-технической конф. «Фаберовские чтения-96». – Ярославль. – 1996. – С. 64-66.
25. Филимонов В.Д., Юсубов М.С., Краснокутская Е.А., Чайковский В.Д. Новые реакции и реагенты для тонкого органического синтеза. // Материалы Семинара РФФИ «Каталитические процессы, катализаторы и инновации». – Томск. – 1998. – С. 63.
26. Krasnokutskaya E. A., Kuznetsova J.A. First successful examples of oxidation of antracene and acenaphtene witch using reagents on base of dimethylsulfoxide. // Proceedings of the II Russian-Korean international symposium on science and technology. KORUS’98. – Tomsk. – 1998. – P. 126-128.
27. Филимонов В.Д., Юсубов М.С., Краснокутская Е.А., Кулманакова Ю.Ю., Передерина И.А., Рогачев В.О. Новые методы функционализации алкенов, алкинов, вицинальных диолов, дигалогенидов, эпоксидов, аренов. // Материалы Международной конф. «Органический синтез и комбинаторная химия». - Москва, Звенигород. – 1999. - Л-19.
28. Krasnokutskaya E.A., D’jakova A.S., Chi Ki-Whan. Convenient one-pot oxidation of acenaphtene to acenaphthenequinone by DMSO. // Proceedings of the III Russian-Korean international symposium on science and technology. KORUS’2000. – Ulsan, Republic of Korea. – 2000. – P. 182-184.
29. Krasnokutskaya E.A., Lesina Y.A., Filimonov V.D., Diakonova E. New methods of generation of electrophilic iodine in neutral and weakly acidic mediums. // Proceedings of the IV Russian-Korean international symposium on science and technology. KORUS’2002. – Novosibirsk. – 2002. – P. 314-316.
30. Лесина Ю.А., Краснокутская Е.А., Демидко Е.В. Удобный вариант синтеза иодаренов из соответствующих бромпроизводных в присутствии солей меди. // Материалы II Всероссийской научной конф. «Химия и химическая технология на рубеже тысячелетий». – Томск. – 2002. – С. 245.
31. Лесина Ю.А., Краснокутская Е.А., Дьяконова Е.Н. Перегруппировки в ряду иодкарбазолов в сильнокислотных средах. // Материалы II Всероссийской научной конф. «Химия и химическая технология на рубеже тысячелетий». – Томск. – 2002. – С. 246.
32. Филимонов В.Д., Краснокутская Е.А., Лесина Ю.А. Синтез и практическое использование новых полимерных материалов, содержащих ацилгипоиодидные функциональные группы. // Материалы II Всероссийской научной конф. «Химия и химическая технология на рубеже тысячелетий». – Томск. – 2002. – С. 316.
33. Filimonov V.D., Krasnokutskaya E.A., Polechuk O.Kh., Chaikovskii V.K., Lesina Y.A. Structure and reactivity of same iodinating regents by DFT study. // Proceedings of the XI International congress of Quantun chemistry. – Bonn, Germany. 2003. - B 46-47.
34. Филимонов В.Д., Чайковский В.К., Краснокутская Е. А., Лесина Ю.А., Скороходов В.И. Возможности, ограничения и перспективы прямого иодирования ароматических и гетероароматических соединений. // Материалы IV Междунардного симпозиума по органическому синтезу. – Москва-Углич. – 2003. – С. 174-176.
35. Filimonov V.D., Chaikovski V.K., Krasnokutskaja E.A., Lesina Yu.A., SkorohodovV.I. Scopes and perspectives iodination of aromatic and heteroaromatic compounds. // Proceedings of the V Russian-Korean international symposium on science and technology. KORUS’2003. – Ulsan, Republic of Korea. – 2003. – P. 170-172.
36. Lesina Yu.A.,Filimonov V.D.,Poleshuk O.Kh, Krasnokutskaja E.A. Stady of transition states of electrophilic substitution reaction by DFT methods. // Proceedings of the Inernational Conf. «Modelling and Understanding in Theoretical Chemistry». – Lucca, Italy. – 2004. P. - 26.
37. Дьякова А.С., Краснокутская Е.А. Исследование действия Br2/ДМСО и HBr/ДМСО на связь C=N азометинов. // Материалы III Всероссийской научной конф. «Химия и химическая технология на рубеже тысячелетий». – Томск. – 2004. – С. 59.
38. Краснокутская Е.А., Лесина Ю.А., Горлушко Д.А., Трусова М.Е. Изучение процессов иодирования в условиях механохимической активации в твердой фазе. // Материалы III Всероссийской научной конф. «Химия и химическая технология на рубеже тысячелетий». – Томск. – 2004. – С. 66-68.
39. Чайковский В.К., Скороходов В.И., Краснокутская Е.А., Харлова Т.С., Огородников В.Д. Исследование взаимодействия иодимидов с серной кислотой методом ЯМР 13С. // Материалы III Всероссийской научной конф. «Химия и химическая технология на рубеже тысячелетий». – Томск. – 2004. – С. 107.
40. Филимонов В.Д., Краснокутская Е.А., Горлушко Д.А., Семенищева Н.И. Прогрессивные методы синтеза иодсодержащих органических соединений. // Материалы Международной конф. по органической химии «Органическая химия от Бутлерова и Бейльштейна до современности». - Санкт-Петербург. -2006. –С. 173-174.
41. Краснокутская Е.А., Семенищева Н.И., Горлушко Д.А, Трусова М.Е. Новый подход к синтезу иодсодержащих органических соединений в условиях механической активации без растворителя. // Материалы Международной научной конф. «Химия, химическая технология и биотехнология на рубеже тысячелетий». – Томск. – 2006. – С. 309-310.
42. Gorlushko D., Filimonov V., Krasnokutskaya E., Ko B., Hwang Ho-yoon, Cha E., Chi Ki-W. Solvent- and strong acid-free iodination of aromatic amines via stable aryldiazonium tosylate salts in a paste form. // Eighth Tetrahedron Symposium “Challenges in Organic Chemistry”. –Berlin. – 2007. – P.
