Экспериментальное изучение эффективности клеточной трансплантации при посттравматической патологии сетчатки 14. 00. 08 глазные болезни 14. 00. 16 патологическая физиология
| Вид материала | Автореферат диссертации |
- Патогенетические обоснования стратегии и тактики лечения миастении 14. 00. 16 патологическая, 781.52kb.
- Клинико-патогенетическое обоснование комбинированного лазерно-медикаментозного лечения, 270.48kb.
- Изучение эффективности комбинированного метода лечения макулярного отека при сосудистых, 325.64kb.
- Патофизиологическое обоснование применения препаратов метаболического типа действия, 308.49kb.
- Применение озонотерапии в реабилитационном периоде у больных, оперированных по поводу, 334.42kb.
- Пояснительная записка к учебной дисциплине Эпизоотология и инфекционные болезни животных, 166.41kb.
- Пояснительная записка Учебно-методический комплекс по курсу «Патологическая физиология», 140.7kb.
- Роль экстраокулярной патологии в патогенезе близорукости у детей и ее комплексное лечение, 325.32kb.
- Методы оценки и клиническое значение биомеханических свойств роговицы (клинико-экспериментальное, 429.56kb.
- Состояние сетчатки у больных сахарным диабетом тип 2 после перевода на инсулинотерапию, 228.28kb.
На правах рукописи
Купрашвили Иосиф Тамазович
Экспериментальное изучение эффективности клеточной трансплантации при посттравматической патологии сетчатки
14.00.08 – глазные болезни
14.00.16 – патологическая физиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2009
Работа выполнена в ФГУ «Московский научно-исследовательский институт глазных болезней имени Гельмгольца Росмедтехнологий» (директор – доктор медицинских наук, профессор, Заслуженный деятель науки РФ Нероев Владимир Владимирович).
Научные руководители:
доктор медицинских наук, профессор Ченцова Екатерина Валериановна
доктор биологических наук, профессор Зуева Марина Владимировна
Официальные оппоненты:
доктор медицинских наук Саакян Светлана Владимировна
доктор биологических наук Белкина Людмила Михайловна
Ведущая организация: ГУ НИИ Глазных болезней РАМН.
Защита состоится 12 мая 2009 г. в 14 часов на заседании диссертационного совета Д 208.042.01 при ФГУ «МНИИ глазных болезней им. Гельмгольца Росмедтехнологий»
(105062, Москва, ул. Садовая - Черногрязская, 14/19)
С диссертацией можно ознакомиться в научной библиотеке
ФГУ «МНИИ глазных болезней им. Гельмгольца Росмедтехнологий»
Автореферат разослан « ___ » апреля 2009 года.
Ученый секретарь
диссертационного совета
доктор медицинских наук Филатова И.А
Общая характеристика работы.
Актуальность проблемы.
Несмотря на постоянные поиски и усовершенствование медикаментозной терапии, появление лазерного и современных хирургических методов лечения, патология сетчатки остается одной из ведущих причин необратимого снижения зрения, в основе которого лежит снижение обменных и восстановительных процессов, нарушение микроциркуляции, нарушение структурной организации сетчатки. В связи с этим, поиск новых патогенетически обоснованных методов лечения заболеваний сетчатки является актуальным. В последние годы появился кардинально новый подход к лечению заболеваний сетчатки на основе клеточных технологий, что во многом обусловлено активным изучением стволовых клеток (СК), как более перспективного клеточного материала для трансплантации. Целью трансплантаций СК является: замещение нефункционирующей или дефектной ткани или клеточной популяции; стимуляция собственных СК организма и усиление репаративной регенерации; адресная доставка генетических конструкций, биомолекул и лекарственных средств. В экспериментах показано, что небольшое количество высокоспециализированных клеток может компенсировать функцию поражённого органа. Будучи трансплантированными, стволовые клетки способны приживляться и дифференцироваться в зависимости от микроокружения. Эти клетки способны значительно повысить адаптивные возможности организма за счет усиления процессов физиологической и репаративной клеточной регенерации (Сухих Г.Т., 1998). При соблюдении определенных условий, трансплантация стволовых клеток не вызывает иммунных реакций, направленных на отторжение донорских клеток. Это подразумевает возможность применения трансплантационных клеточных технологий для лечения стволовыми клетками без использования иммуносупрессивной терапии.
Представляется важной с медицинской точки зрения способность низкодифференцированных клеток тормозить, а в некоторых случаях реверсировать, развитие грубоволокнистой соединительной ткани. Такое торможение создает важные дополнительные предпосылки для эффективного восполнения клеточных потерь организма новыми функционально-полноценными клетками (Fawcett J.W., 1998;). Отсюда следует перспективность и целесообразность попыток использования клеточных технологий в лечении целого ряда заболеваний, обусловленных старением организма. Трансплантация низкодифференцированных стволовых клеток может способствовать восстановлению кровотока в ишемизированных органах и тканях. (Murohara et al.,2000; Fuch et al., 2001).
Среди множества методов и направлений, наиболее перспективной для внедрения в клинику, на наш взгляд, является трансплантация аутологичных (собственных) стволовых/прогениторных клеток пациента, выделенных из разных тканей и органов.
Одним из самых перспективных видов аутологичного материала для клеточной терапии и тканевой инженерии считаются мезенхимальные стволовые клетки костного мозга человека (МСПК) и нейрональные стволовые клетки (НСПК), выделенные из обонятельной области слизистой оболочки носа взрослого человека. Опубликованные работы свидетельствующие, что при определенной подготовке МСПК могут быть успешно трансплантированы RCS крысам: встраиваясь в сетчатку реципиента, клетки дифференцируются в зрелые нейроны, выделяя характерные маркеры: виментин, калбиндин, родопсин, GFAP. Обонятельный эпителий является доступным и, на сегодняшний день, единственным источником аутологических нейрональных стволовых, прогениторных и обкладочных глиальных клеток, трансплантация которых открывает новые перспективы в лечении патологии сетчатки, а также ряда дегенеративных заболеваний центральной и периферической нервной системы человека.
Цель работы: изучить влияние трансплантации мультипотентных мезенхимальных стволовых/прогениторных клеток костного мозга (МСПК) и нейрональных стволовых/прогениторных клеток (НСПК), выделенных из обонятельной области слизистой оболочки носа взрослого человека, на процессы репарации, регенерации и сохранность функциональной активности сетчатки после ее повреждения в эксперименте.
Задачи:
1. Определить способы и дозы введения клеточных культур с последующей оценкой безопасности трансплантации СК в глаза кроликов.
2. Изучить воздействие МСПК на модели лазерного повреждения сетчатки у кроликов с помощью клинических, электрофизиологических и гистологических методов исследования.
3. Определить эффективность трансплантации НСПК на моделях лазерного повреждения сетчатки и ретинальной ишемии у кроликов с использованием клинических, электрофизиологических и гистологических методов исследования.
4. Провести анализ полученных результатов с оценкой перспективности внедрения в клиническую офтальмологию.
Научная новизна:
1. Определены безопасные и наиболее эффективные дозы и способы введения нейрональных СК, выделенных из обонятельной области слизистой носа и культивированных мезенхимальных СК, выделенных из костного мозга.
2. На фоне лазеркоагуляции сетчатки супрахориоидальная трансплантация МСПК и НСПК ведет к статистически достоверному уменьшению размера очагов лазерного поражения сетчатки, а также суммарного (среднего) размера зон первичного лазерного поражения. Меньшая площадь повреждения в опытных глазах при одинаковых условиях лазеркоагуляции доказывает, что супрахориоидальная трансплантация СК стимулирует репаративные процессы в сетчатке и защищает ее от развития вторичных дистрофических изменений.
3. При моделировании очагового повреждения сетчатки лазерной коагуляцией характерна большая выраженность угнетения функции фоторецепторов, чем пострецепторных нейронов. Динамика ЭРГ на стимулы различной интенсивности свидетельствует, что этот факт может быть связан с нарушением кинетики регенерации зрительных пигментов, которое выражено значительно в меньшей степени при супрахориоидальном введении МСПК.
4. Сравнительный анализ результатов исследований показал схожие закономерности в развитии влияния на электрогенез сетчатки супрахориоидальной трансплантации СК различного происхождения – мезенхимальных и обкладочных, которые состоят в защите функции и структуры нейронов сетчатки – нейропротекторном эффекте – в ранний период развития ретинальной патологии и в ускорении процесса восстановления ретинальной функции в отдаленном периоде наблюдения.
5. На ранних сроках после моделирования лазерного повреждения нейропротекторный эффект при трансплантации МСПК наиболее выражен для функции фоторецепторов, а при введении НСПК – не только для функциональной активности фоторецепторов, но и клеток Мюллера.
Практическая значимость:
1. Показано, что для повышения репаративной и функциональной активности сетчатки при ее патологии различного генеза целесообразно применение культивированных нейрональных СК, выделенных из обонятельной области слизистой носа и культивированных мезенхимальных СК, выделенных из костного мозга.
2. Установлено, что оптимальным методом трансплантации СК является их введение в супрахориоидальное пространство в количестве 500 тыс. в 0,02 мл физиологического раствора.
3. Использование МСПК и НСПК может служить основой для разработки новых перспективных стратегий в офтальмотравматологии, и целесообразно дальнейшее изучение их возможностей в качестве средств нейропротекции или альтернативных терапевтических приемов при лечении последствий заболеваний сетчатки.
Основные положения, выносимые на защиту:
1. Оптимальным методом трансплантации культивированных нейрональных СК, выделенных из обонятельной области слизистой носа (НСПК) и культивированных мезенхимальных СК, выделенных из костного мозга (МСПК), является их введение в супрахориоидальное пространство в количестве 500 тыс. в 0,02 мл физиологического раствора.
2. Супрахориоидальная трансплантация СК стимулирует репаративные процессы в сетчатке и защищает ее от развития вторичных дистрофических изменений при лазерном повреждении, что выражается меньшей площадью повреждения и меньшей степенью нарушения электрогенеза сетчатки по сравнению с контрольной группой.
3. В результате комплексных электроретинографических и гистологических исследований установлено, что супрахориоидальное введение НСПК и МСПК в указанных дозах оказывает нейропротекторное воздействие, наиболее выраженное для функции фоторецепторов и клеток Мюллера в ранние сроки после моделирования лазерного повреждения сетчатки кроликов или ретинальной ишемии. На отдаленных сроках трансплантация стволовых/прогениторных клеток способствует ускорению процесса восстановления функции сетчатки. Большая степень возрастания амплитуды ЭРГ и РЭРГ коррелирует с данными гистологических исследований
Апробация работы:
Основные положения диссертации доложены и обсуждены на научно-практических конференциях: «Федоровские чтения» (Москва, 2007 и 2008), VII симпозиуме международного общества по глазной травме (Рим, Италия, 2006), II Всероссийской научной конференции молодых ученых (Москва, 2007), объединенном конгрессе SOE/AAO (Вена, Австрия, 2007), в Британском посольстве на конференции «Стволовые клетки: законодательство, исследования и инновации. Международные перспективы сотрудничества», 2007, на Ученом Совете МНИИ ГБ, май 2007, VIII симпозиуме международного общества по глазной травме (Вёрсбург, Германия, 2008).
Публикации:
По теме диссертации опубликовано 12 работ, из них 2 в центральной печати и 4 в зарубежной литературе. Получено положительное решение о выдаче патента на изобретение от 01.04.09. по заявке №2008121546/14 (приоритет от 29.05.08.).
Структура и объем диссертации.
Работа изложена на 125 страницах машинописи, иллюстрирована 47 рисунками, 4 таблицами. Список литературы включает 121 источника, из них 40 отечественных и 81 иностранных.
Содержание работы
Характер экспериментального материала.
Костный мозг получали из трубчатых костей во время реконструктивных вмешательств на конечностях. Брали 10-20 мл аспирата костного мозга по классическим методикам. Методом градиентного центрифугирования выделяли мононуклеарную фракцию клеток костного мозга. Полученную суспензию клеток рассевали в пластиковые чашки в ростовой среде DMEM/F12, содержащей 20% ЭТС, селектированной для выращивания клеток в низкой плотности, 2 мл L-глутамина и антибиотики. Плотность посева первичной клеточной суспензии составляла в среднем 100-300 тысяч в 1 мл. Культивировали клетки в стандартных условиях. Через 10-14 дней культивирования отбирали однородные плотные колонии мелких клеток с высокой степенью гомогенности и с негранулированной цитоплазмой. Отобранные клеточные колонии пассировали, проводя не более 6-8 пассажей, и использовали для исследований.
Морфологию полученных клеток оценивали визуально с помощью фазово-контрастной микроскопии. Проведенный морфологический анализ выявил наличие трех типов клеток: маленьких веретенообразных клеток (d 10-15 мкм) с гомогенной цитоплазмой и с низким ядерно-цитоплазматическим соотношением, округлой формы большего размера (d 15-20 мкм) с гомогенной цитоплазмой и смещенным к одному краю клетки ядром и клеток с фибробластоподобной морфологией, крупных размеров (около 60 мкм) с многочисленными выростами цитоплазмы. Таким образом, исследуемые клетки имели морфологию, характерную для МСПК человека. Время удвоения МСПК из костного мозга составляло 56-60 час. Клетки характеризовались низким митотическим индексом, который равнялся 31‰. При направленной дифференцировке в стандартных условиях, описанных для дифференцировки МСПК из костного мозга, наблюдалась хондрогенная, остеогенная и адипогенная дифференцировка, что доказывало мультипотентность используемой культуры. В течение длительного культивирования популяции МСПК показывали способность к самообновлению и сохранению своего первоначального фенотипа.
Источником первичной культуры НПСК являлась слизистая обонятельной области носа взрослого человека, которую брали во время эндоскопической ЛОР операции. Диссоциированные клетки (ферментативно-механическим методом) культивировали как монослой в чашках d=30 мм или в 6-ти луночных плашках при +37°С в СО²- инкубаторе в посевной концентрации 100-200 тысяч клеток в 1 мл в ростовой среде DMEM/F12 (содержащей 3% фетальной телячьей сыворотки) с добавлением фактора роста фибробластов 20 нг/мл, эпидермального фактора роста, гепарина, ИТС и 3-5% ЭТС. Пассированные культуры НПСК слизистая обонятельной области носа взрослого человека представляли собой активно пролиферирующие прикрепленные колонии мелких эпителиальных клеток, в которых содержание нестин/виментин положительных клеток составляло не менее 60%. Другие клетки экспрессировали GFAP и b-тубулин. При переводе культур на бессывороточную среду наблюдалось образование характерных нейросфер, которые продолжали пролиферировать в суспензионной культуре. Для трансплантации использовали клетки после 6-8 пассажей.
Для визуализации трансплантированных клеток в дальнейших гистологических исследованиях, перед трансплантацией клетки окрашивали ядерным люминесцентным красителем бисбензимидом.
Экспериментальные модели.
Для изучения влияния трансплантации мультипотентных мезенхимальных и нейрональных стволовых/прогениторных клеток использованы две модели повреждения сетчатки: модель очагового повреждения сетчатки и модель острой ишемии сетчатки.
Для получения первой модели проводилась лазерная коагуляция сетчатки обоих глаз с помощью аргоновой лазерной установки Visulas Argon II (Karl Zeiss, Германия). Коагуляты наносились в нижнем квадранте глазного дна, количеством 300 коагулятов. Средняя мощность излучения составляла 300 мВт, длительность экспозиции 0,1сек, диаметр пятна 200 мкм.
С целью создания острой ишемии сетчатки проводилась лазерная коагуляция артерий и вен первого порядка с помощью той же аргоновой лазерной установки. Средняя мощность излучения составляла 600-800 мВт, длительность экспозиции - 0,1сек, диаметр пятна - 300 мкм, количество коагулятов -100. Проводилась коагуляция всех видимых сосудов в 1\2 PD от диска зрительного нерва на всем их протяжении. Эксперимент проведен совместно с сотрудником отдела травм органа зрения и реконструктивной хирургии МНИИ ГБ им. Гельмгольца, д.м.н. Ивановым А.Н.
Работа проводилась на 86 кроликах (172 глаза) породы Шиншилла, в трех сериях экспериментов:
I серия. Изучение безопасности трансплантации МСПК и НСПК при различных способах и дозах трансплантации.
II серия. Трансплантация МСПК на модели лазеркоагуляции сетчатки.
III серия. Изучение воздействия НСПК на модели лазерного повреждения и ишемии сетчатки.
Методы исследования.
Полученные результаты оценивали с помощью биомикроскопии, офтальмоскопии и фоторегистрации, электроретинографических и гистологических методов.
С целью объективной оценки степени и характера изменений функциональной активности различных клеточных элементов сетчатки, проводили электроретинографические исследования на двух установках:
(1) ЭРГ и РЭРГ на 30 Гц выполняли с помощью электрофизиологической мини-системы для животных EYE Handheld ERG Unit (ERG system) Mjolner (Ephios, Швеция) до и через 10 и 18 суток после лазеркоагуляции и супрахориоидального введения стволовых клеток. Интенсивность вспышек составляла от 0 до 1.2 log (0 log = 1.8 кд сек м-2).
(2) Регистрировали ганцфельд ЭРГ (5 кд сек м-2) и ритмическую ЭРГ (РЭРГ) на частоту стимуляции 12 и 32 Гц (1.8 кд сек м-2) с помощью электрофизиологической системы “Ретинограф” (Инфобиотек – Россия). Исследования проводили до, через 25, 30 и 40 суток после лазеркоагуляции и трансплантации СК.
Гистологическое исследование проводили через 7, 14, 30 и 60 суток после трансплантации СК. Глаза подопытных кроликов фиксировали с помощью транскардиальной перфузии 4% раствором параформальдегида на физиологическом растворе и фосфатном буфере (рН=7,4). Глаза фиксировали в том же фиксаторе в холодильнике (+4Сº) в течение 12–15 часов. После этого заключали в парафин через спирты обычным способом. Изготавливали вертикальные срезы всего глаза толщиной 10 мкм. Каждый 50-й срез наклеивали на предметное стекло, депарафинировали и окрашивали красителем Гимза (Giemsa) и через спирты заключали в среду DPX. Каждый 100-й срез подвергали морфометрическому микроскопическому анализу. В случае наличия на срезе дегенеративных поражений сетчатки изготавливали цифровые микрофотографии участков сетчатки, содержащих поражения. Для оценки воздействия трансплантации НСПК на степень дегенерации сетчатки после лазеркоагуляции с помощью программы “Image Tool” проводили измерения линейных размеров участков сетчатки, на которых полностью отсутствовали фоторецепторы. Морфометрические измерения (II- III серии) были проведены на 30- 40 срезах, содержащих лазерное поражение, от каждого из 10 глаз подопытных кроликов (более 900 измерений). С помощью программы “Image Tool” измеряли линейный размер участков сетчатки, на которых полностью отсутствовали отсутствовал наружный ядерный слой и фоторецепторы. Далее вычисляли средние транссекционные размеры поражений. Статистическая обработка полученных данных производилась с помощью Теста Стьюдента (Student's Test). Для выявления трансплантированных клеток использовали иммуногистхимическую методику.
Результаты.
I серия. Изучение безопасности трансплантации МСПК и НСПК при различных способах и дозах введения(16 кроликов 32 глаза). Животные были разделены на 4 подгруппы: 1-ая подгруппа - введение МСПК, НСПК в дозах 500тыс. и 1млн. клеток (4 кролика, 8 глаз); 2-ая подгруппа - ретробульбарное введение МСПК, НСПК в количестве 1.5 и 5 млн. (4 кролика, 8 глаз); 3-я подгруппа - интравитреальное введение в дозах 200 и 500 тыс. МСПК и НСПК (4 кролика, 8 глаз); 4-ая подгруппа - супрахориоидальное введение 200 и 500 тыс. клеток МСПК и НСПК (4 кролика, 8 глаз).
Во всех 4-х подгруппах по результатам биомикроскопических офтальмологических наблюдений, трансплантация МСПК и НСПК в выбранных дозах не вызвала каких-либо воспалительных и аллергических реакций. При интравитреальной трансплантации МСПК и НСПК (3-я подгруппа) в течение первых 10-ти дней отмечалась пролиферация и миграция введенных клеток от места трансплантации по всему стекловидному телу, что выражалось в увеличении количества трансплантированных клеток. При введении МСПК выявлялась более активная пролиферация и миграция по стекловидному телу, в то время как НСПК преимущественно располагались в нижней части стекловидного тела в виде скоплений округлой формы. К концу 30-го дня количество клеток в стекловидном теле заметно уменьшалось и для МСПК и для НСПК. Спустя 60 дней после трансплантации клетки в виде взвеси в стекловидном теле не просматривались, обнаруживались лишь единичные скопления в нижней части глаза.
Таким образом, по данным клинических исследований НСПК и МСПК вводимые всеми выше перечисленными способами, в выбранных дозах не оказывали токсического действия на ткани глаза. Однако, в связи с наличием множества барьеров для эффективного воздействия субконъюнктивальной и ретробульбарной трансплантации МСПК и НСПК на патологические процессы в сетчатке, а также для визуализации клеток их миграции и более подробного изучения последствий трансплантации, были выбраны интравитреальный и супрахориоидальный способы введения клеток. Дозы трансплантируемых клеток были определены на основании уже проведенных ранее исследований.
II серия. Трансплантация МСПК на модели лазеркоагуляции сетчатки (30кроликов 60 глаз, 2 подгруппы). В 1-ой подгруппе (10 кроликов, 20 глаз), на следующий день после лазерного повреждения, в опытные глаза интравитреально вводили МСПК в дозе 200 тыс. клеток в 0,1 мл СФР. Во 2-ой подгруппе (20 кроликов, 40 глаз), на следующий день после моделирования повреждения МСПК трансплантировали в супрахориоидальное пространство в дозе 500тыс. клеток на 0,02 мл. СФР. В контроле в парный глаз вводили такой же объем СФР.
При исследовании с помощью биомикроскопии, офтальмоскопии (1,2-я подгруппа) у большинства кроликов наблюдалась аналогичная картина, как и при трансплантации СК без моделирования повреждения сетчатки. Достоверной разницы в динамике пигментации лазеркоагулятов между контрольными и опытными глазами при офтальмоскопии не отмечалось. В 2-х из 10 глаз животных, спустя две недели после интравитреальной трансплантации МСПК, в стекловидном теле (1-ая подгруппа) появились пленчатые помутнения с фиброзом и васкуляризацией, что возможно связано с сочетанием высокой пролиферативной активности МСПК, массивным повреждающим действием лазера и способом введения. В связи с этим, а также накопленным опытом эффективной трансплантации СК в супрахориоидальное пространство, мы сочли целесообразным использовать только супрахориоидальный способ трансплантации в дальнейших исследованиях. Однако, анализируя некоторые положительные результаты, полученные в ходе эксперимента (данные ЭФИ), возможно метод интравитреальной трансплантации СК требует более подробного изучения с подбором минимальной эффективной дозы клеток и оптимальных сроков введения после повреждения сетчатки.
В III серии производилась трансплантация НПСК на моделях лазерного повреждения и ишемии сетчатки (40 кроликов. 80 глаз, 3 подгруппы). В 1-ой подгруппе (10 кроликов, 20 глаз), НПСК на модели лазерного повреждения сетчатки трансплантировали интравитреально в дозе 200 тыс. в 0.1 мл СФР. Во 2-ой подгруппе (20 кроликов, 40 глаз), НСПК трансплантировали в супрахориоидальное пространство в количестве 500тыс. на 0,02мл СФР. В 3-ей подгруппе (10 кроликов, 32 глаз), НСПК вводили супрахориоидально на модели ишемии сетчатки - 500тыс. клеток на 0.02мл СФР.
За все время наблюдения, во всех группах со стороны переднего отрезка глаза в опыте и в контроле патологических изменений и воспалительных явлений не наблюдалось.
После интравитреальной трансплантации НСПК на модели лазеркоагуляции сетчатки (1подгруппа), так же как и в предыдущих сериях наблюдалась характерная пролиферация трансплантированных клеток с образованием клеточных скоплений разной величины. На глазном дне после трансплантации НСПК отмечалась более быстрая (в среднем на 4 дня) интенсивная пигментация лазеркоагулятов по сравнению с контрольными глазами.
При офтальмоскопии после моделирования ишемии (3 подгруппа), отмечалось сужение всех сосудов с полной или почти полной остановкой кровотока, и развитием ишемии в слоях сетчатой оболочки. В дальнейшем отмечалось медленное восстановление кровотока в ретинальных сосудах, развитие коллатералей с появлением на периферии участков некроза сетчатки и дистрофических хориоретинальных очагов разной величины. В опытной группе выявлялось меньшее количество дистрофических очагов сетчатки, чем в контрольных глазах, однако провести количественное их сравнение не представлялось возможным из-за вариабельности размеров и форм очагов.
Электроретинография: динамика функциональной активности сетчатки.
1. Трансплантация МСПК на модели лазерного повреждения сетчатки.
Интравитреальное введение МСПК (II серия, 1-ая подгруппа).
В контрольной группе без введения МСПК на следующий день после лазеркоагуляции все биопотенциалы снижались на 20-30% от исходных значений. В большей степени отмечалось угнетение функциональной активности фоторецепторов, чем нейронов внутренней сетчатки. В результате этого возрастал коэффициент Кb/a, вычисляемый по отношению амплитуд b-волны и a-волны ЭРГ.
На фоне введения МСПК, через 2 суток также снижалась функциональная активность фоторецепторов и нейронов внутреннего ядерного слоя. Однако угнетение ЭРГ и РЭРГ было менее выраженным, чем в контрольных глазах. Наиболее значимые различия отмечены для b-волны ЭРГ и РЭРГ на 32 Гц. Амплитуды a- и b-волн общей ЭРГ и ритмической ЭРГ на низкую частоту стимуляции (12 Гц) снижались до 43-80, 91-99 и 82-85% от исходных значений соответственно. Высокочастотная РЭРГ (на 30 и 40 Гц), напротив, регистрировалась супернормальной либо нормальной величины. Через 1 месяц на фоне МСПК амплитуда РЭРГ на 12 Гц несколько возрастала. В общей ЭРГ сохранялось угнетение амплитуды a- и b-волн, менее выраженное при введении МСПК (рис.1, 2).
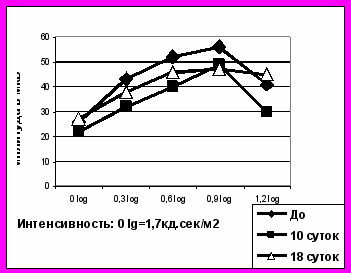
 Рис.1. Динамика а-волны ЭРГ после лазеркоагуляциии сетчатки и интравитреальной трансплантации МСПК (слева), СФР(справа)
Рис.1. Динамика а-волны ЭРГ после лазеркоагуляциии сетчатки и интравитреальной трансплантации МСПК (слева), СФР(справа) 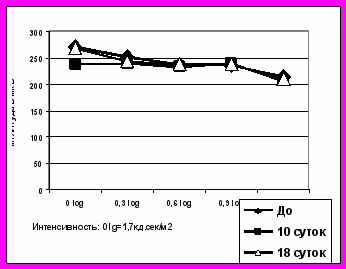
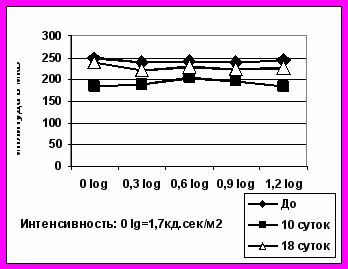
Рис.2. Динамика b-волны ЭРГ после лазеркоагуляциии сетчатки и интравитреальной трансплантации МСПК (слева), СФР(справа)
Выявленные изменения, вероятно, можно расценивать как определенный положительный эффект трансплантации МСПК на функцию нейронов сетчатки после ее лазерного повреждения. Однако при офтальмоскопии в 2-х случаях выявили витреоретинальные очаги и на ЭФИ резкое снижение глиального индекса Кг, рассчитываемого по отношению амплитуд b-волны ЭРГ и РЭРГ на 12 Гц. При средней норме 2,8 относит. ед. он редуцировался до 1,9 относит. ед., что может свидетельствовать об угнетении функции глиальных клеток Мюллера и их вовлечении в пролиферативный процесс.
Супрахориоидальное введение МСПК после лазеркоагуляции сетчатки
(II серия, 2-ая подгруппа).
В ранние сроки (10 суток) в контроле после лазеркоагуляции развивалось умеренное угнетение функциональной активности, характер которого объективно отражал локализацию повреждения сетчатки. В т.н. «максимальной» ЭРГ (на стимул 1,2 log ед. от интенсивности стандартной вспышки), оно было наиболее выраженным для a-волны, отражая угнетение функции фоторецепторов, а также для РЭРГ частотой 30 Гц, в генерации которой принимают значительное участие колбочковые фоторецепторы. Амплитуды этих биопотенциалов снижались в среднем до 56,8% и 79% от их значений до лазеркоагуляции. Амплитуда b-волны максимальной ЭРГ незначительно отличалась от данных до моделирования повреждения сетчатки, что подтверждает результаты гистологических исследований о меньшей степени вовлечения в патологический процесс внутреннего ядерного слоя при выбранных нами условиях лазерного воздействия.
Однако в ЭРГ на стимул минимальной яркости (0 log ед. = 1,7 кд·сек/м2) амплитуда b-волны ЭРГ угнеталась в значительно большей степени, чем амплитуда a-волны (соответственно, в среднем до 73 и 91% от исходных значений). Соответственно коэффициент b/a при минимальной яркости вспышек составлял около 10-11 относительных единиц, а при максимальной яркости – только 5,2-5,6, т.е. 48-50% от его значений для более слабого стимула. Через 10 суток после лазеркоагуляции коэффициент b/a снижался в среднем на 1,8 относительных единиц для слабого стимула и возрастал почти на такую же величину для максимального ЭРГ ответа. Большая степень угнетения амплитуды b-волны ЭРГ (по сравнению с a-волной) на стандартную вспышку, обратная тенденция для стимулов насыщающих энергий, и специфика динамики коэффициента b/a указывают, что через 10 суток после лазеркоагуляции сетчатки, наиболее вероятно, нарушается кинетика регенерации зрительных пигментов. Световая чувствительность оставшихся неповрежденными фоторецепторов, по-видимому, существенно не изменяется.
При супрахориоидальном введении МСПК, через 10 суток после лазеркоагуляции отмечалась аналогичная тенденция изменений a- и b-волн ЭРГ и РЭРГ при градуальном изменении интенсивностей стимуляции. Однако существенным отличием являлась значительно меньшая степень изменений амплитуд всех биопотенциалов по сравнению с нормой. Коэффициент b/a практически не отличался от нормы для ЭРГ на стандартную вспышку и возрастал от 5,24 до 6,7 относительных единиц в ответе на максимально яркий стимул. Следовательно, повреждение фоторецепторов и нарушение кинетики регенерации зрительных пигментов выживших зрительных клеток при лазерном повреждении сетчатки и трансплантации МСПК было выражено в значительно меньшей степени, чем в контроле (рис.3).

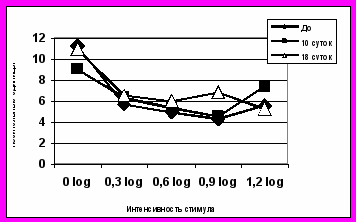
Рис.3. Динамика коеффициента b/a после лазеркоагуляциии сетчатки и интравитреальной трансплантации МСПК (слева), СФР (справа)
В опытных глазах с МСПК характерным также было повышение амплитуды РЭРГ на 12 и 30 Гц на 20-55% от исходных значений через 25 суток эксперимента, которое свидетельствовало о существенном возрастании функциональной активности нейронов сетчатки. К 40 дню наблюдения величина низкочастотной РЭРГ несколько снижалась, оставаясь, однако, супернормальной, а высокочастотная РЭРГ угнеталась до слабо субнормальных значений (до 90% N). Через 1 месяц амплитуда низкочастотной РЭРГ возрастала по сравнению с исходными значениями и в парных контрольных глазах. Угнетение амплитуды a- и b-волн ЭРГ в опытных глазах на всех сроках наблюдения было менее выраженным, чем на парных. Амплитуда a- и b-волн ЭРГ составляла соответственно 87-61% и 93-90% в опытных; и 69-52% и 85-86% в контрольных глазах.
Выявленные изменения ретинального электрогенеза можно расценивать как положительный эффект супрахориоидального введения МСПК на фоне лазерного повреждения сетчатки.
2. Трансплантация НСПК на моделях повреждения сетчатки.
Интравитреальное введение НСПК (III серия, 1-ая подгруппа).
Модель очаговой патологии.
Через 10 суток после интравитреальной трансплантации НСПК на фоне лазеркоагуляции сетчатки динамика a-волны ЭРГ и 30Гц-РЭРГ не различалась на опытных и контрольных глазах. Однако амплитуда b-волны ЭРГ в глазах с НСПК не только превышала таковую в контрольных левых глазах, но даже превосходила собственные исходные значения b-волны ЭРГ, зарегистрированной до лазерного воздействия, то есть от интактной сетчатки (рис.4).
Большая чувствительность b-волны по сравнению с ритмической ЭРГ к введенным интравитреально НСПК может отражать активизацию метаболизма клеток Мюллера в первые 1-2 недели после трансплантации, подтверждая роль ретинальной глии в проведении эффектов стволовых клеток в сетчатке. Однако, поскольку изменения на глазном дне свидетельствовали о развитии витреохориоретинальной пролиферации, в данном случае данные электроретинографии свидетельствуют скорее о развитии реактивного глиоза, как серьезного побочного эффекта, который, несмотря на ярко выраженную положительную динамику электрогенеза, свидетельствует не в пользу интравитреального введения НСПК (рис.5).
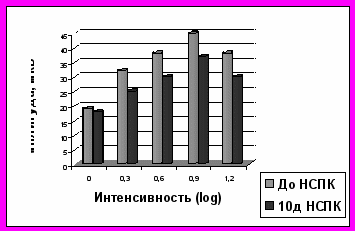
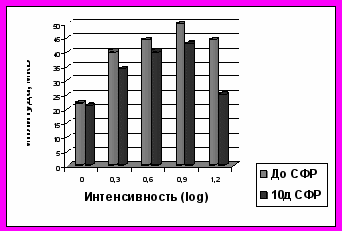
Рис.4. Динамика a-волны ЭРГ после лазеркоагуляциии сетчатки и интравитреальной трансплантации НСПК (опыт), СФР((контроль)
Рис.5. Динамика b-волны ЭРГ после лазеркоагуляциии сетчатки и интравитреальной трансплантации НСПК (опыт), СФР((контроль)
Супрахориоидальное введение НСПК(III серия, 2-ая подгруппа).
Через 1-2 недели амплитуда a- и b-волн ЭРГ в опытных глазах составляла в среднем 111 и 113% от исходных величин, а в контрольных глазах – угнеталась до 38-85% от нормы соответственно. Амплитуда РЭРГ на низкую частоту стимуляции (12 Гц) была умеренно супернормальной в обоих глазах, превышая исходные показатели на 20-30%, а РЭРГ на 30 Гц - субнормальной. У большинства кроликов через месяц отмечалась тенденция к восстановлению биопотенциалов. Несмотря на лучшую степень восстановления ретинальной функции на опытных глазах, значительная вариабельность данных, не позволила выявить статистическую достоверность различий на ранних сроках, но для позднего периода после лазерного повреждения сетчатки (1 месяц) различия оказались достоверны при p<0.05.
Модель ретинальной ишемии (II серия, 3-я подгруппа).
В первые сутки после лазерной коагуляции сосудов сетчатки (I–III порядка), у трети животных на обоих глазах наблюдалось снижение функциональной ретинальной активности, у остальных - развивалась выраженная гиперреакция сетчатки. В среднем по группе амплитуда a-волны ЭРГ, источником генерации которой являются фоторецепторные клетки, через сутки составляла 133 и 129% от исходных значений для опытных и контрольных глаз соответственно. Гиперреакция сетчатки, вероятно, связана с послеожоговой воспалительной реакцией сосудов и окружающей их ретинальной ткани, которая приводит к последующей окклюзии артерий 1 порядка и ишемии сетчатки. В среднем по группе, через сутки после лазеркоагуляции амплитуда b-волны при введении СФР практически не отличалась от исходных значений, но в глазах с НСПК резко возрастала: до 138%. В последующие 1-4 недели динамика электрогенеза сетчатки глаз с супрахориоидальным введением НСПК и СФР различалась еще более существенно.
В контрольных глазах (СФР) амплитуды всех биопотенциалов через 1 неделю снижались у разных животных на 25-70%. Наибольшему угнетению подвергалась a-волна ЭРГ. В течение последующих 2-х недель при введении СФР на фоне ретинальной ишемии происходило медленное восстановление биоэлектрической активности сетчатки, что соответствовало наблюдаемой при офтальмоскопическом обследовании тенденции к нормализации кровотока. Неравномерный калибр сосудов, сохранение застойных явлений в ретинальных венах и наличие дистрофических очагов коррелировало с динамикой ЭРГ, и даже в конце периода наблюдения амплитуды a-, b-волн ЭРГ и 30Гц-РЭРГ в контрольных глазах составляли только 80, 96 и 70% соответственно. В зависимости от интенсивности вспышки, амплитуда РЭРГ в контрольных глазах угнеталась, как правило, на 25-40%, при этом амплитуда 30Гц-РЭРГ не восстанавливалась до конца срока наблюдения. ЭРГ свидетельствовали о прогрессировании патологических изменений в сетчатке. При фоторегистрации глазного дна выявлено появление дистрофических очагов в зоне коагуляции сосудов.
В опытных глазах после моделирования ретинальной ишемии и введения НСПК через 7 дней у 2/3 животных амплитуды a- и b-волн ЭРГ резко превышали свои исходные значения, а у 1/3 - оставались в пределах нормальных или умеренно сниженных. В среднем, значения a-, b-волн ЭРГ и РЭРГ через неделю достигали 90, 118 и 82% от исходных соответственно. Через 14 дней амплитуды волн ЭРГ в опытных глазах умеренно превышали норму, и гиперреакция сетчатки сохранялась до конца срока наблюдения. Наиболее резко возрастала b-волна ЭРГ (до 153%), что, может отражать активизацию глиальных клеток Мюллера, возможно компенсаторно-приспособительного характера. Через месяц наблюдения средняя по группе амплитуда a- и b-волн ЭРГ составляла 133 и 140% от нормы. Амплитуда РЭРГ соответствовала нормальным значениям. При моделировании ретинальной ишемии, в отдаленные сроки наблюдения в обоих глазах ритмическая ЭРГ на 30 Гц практически всегда имела субнормальные значения. На фоне лечения НСПК, через месяц амплитуда РЭРГ в опытных глазах соответствовала норме (108% от исходной), но в контрольных глазах она оставалась сниженной на 30% (рис.6).


Рис.6. На рисунках представлена динамика ЭРГ для опытных и контрольных глаз кроликов после моделирования ишемии и трансплантации НСПК супрахориоидально
Таким образом, в ранние сроки после лазерного воздействия трансплантация НСПК способствовала сохранению ретинальной функции и меньшей выраженности изменений на глазном дне. В более поздние сроки (3-4 недели), когда в обоих глазах происходило частичное восстановление кровообращения сетчатки, введение НСПК способствовало лучшей динамике восстановления электрогенеза сетчатки. В ранние сроки, отмеченные положительные эффекты НСПК на функцию сетчатки, выявлялись не у всех животных и не в одинаковой степени. В 40-45% случаев по разным группам эксперимента не выявлялось никаких различий в опыте и контроле. Однако для периода наблюдения 1 сутки и 1 месяц различия достоверны ( p<0,05).
Гистологические исследования.
I серия. При гистологическом исследовании в глазах животных после субконъюнктивального ретробульбарного и супрахориоидального введения МСПК и НСПК (на 7-, 14, 30-, и 60-день), не выявлено каких-либо дегенеративных воспалительных явлений во всех тканях. После интравитреальной трансплантации (3-я подгруппа) МСПК на 7-й день в стекловидном теле найдено большое количество мелких клеток округлой формы диаметром 5-8 микрометров. Некоторые из них располагались непосредственно на внутренней поверхности сетчатки. Кроме того, внутри ткани сетчатки на уровне слоя ганглиозных клеток, а также (реже) на уровне внутреннего сетчатого слоя, локализовались необычные для данного места округлые мелкие (5-8мкм), нетипично расположенные относительно слоев сетчатки клетки. Вид этих клеток, а также характер их расположения позволяют предположить, что часть инъецированных интравитреально МСПК мигрировала в ткань сетчатки. Спустя 30 дней после интравитреального введения МСПК с уменьшением числа клеток в стекловидном теле, количество нетипичных клеток в слоях сетчатки увеличилось.
У животных с интравитреальным введением НСПК спустя 7 дней после трансплантации единичные клетки и редкие группы клеток располагались в стекловидном теле на внутренней поверхности сетчатки и в непосредственной близости от нее. Эктопически расположенных нетипичных клеток внутри ткани сетчатки не наблюдали. В стекловидном теле обнаруживались плотные скопления клеток диаметром до 200 микрометров. Спустя 30 и 60 дней крупные скопления клеток в стекловидном теле отсутствовали, количество единичных клеток в виде взвеси также уменьшилось.
Таким образом, данные световой микроскопии гистопрепаратов в I серии свидетельствуют об отсутствии воспалительной и аллергической реакции тканей глаз кроликов на ксенотрансплантацию культуры СК.
Во II-III сериях, после супрахориоидальной трансплантации МСПК и НСПК со стороны тканей глаза патологические изменения не выявлены. На разных сроках трансплантации в зоне введения в супрахориоидальное пространство СК было обнаружено скопление трансплантированных клеток с сохранностью жизнеспособности клеток до30 дней.
При исследовании срезов сетчатки подопытных кроликов в опытных и контрольных глазах наблюдали участки дегенерации, соответствующие нанесенным лазеркоагулятам. Дегенеративные очаги представляли собой нарушение архитектоники всех слоев сетчатки, сопровождающееся разрушением и дезорганизацией фоторецепторного слоя, большинства нейронов в наружном и внутреннем ядерном слоях. В 2-х случаях интравитреального введения МСПК (II серия, 1-ая подгруппа), произведенного через 24 часа после лазерного поражения сетчатки, наблюдали разной степени воспалительную инфильтрацию стекловидного тела в зависимости от сроков исследовании (7, 30 суток), а также интенсивную фиброзную пролиферацию. В связи с этим мы сочли целесообразным использовать супрахориоидальный способ трансплантации в дальнейших исследованиях.
Морфометрические измерения были проведены на 30-й день после супрахориоидальной трансплантации и лазеркоагуляции сетчатки во II-III сериях. При измерении линейных размеров лазеркоагулятов сетчатки (II серия, 2-ая подгруппа), на которых полностью отсутствовали фоторецепторы, средние их размеры в опытных глазах с МСПК были статистически достоверно меньше, чем в контрольных (опыт-334мкм, контроль -568мкм. Р ≤0,05). При проведении отдельного анализа для мелких (менее 300 микрометров) первичных очагов лазерной дегенерации, средние размеры в опытных глазах, также не превышали таковые в контрольных (144 мкм-опыт, 164 мкм-контроль) Различия средних размеров зон дегенерации между опытными и контрольными глазами были статистически достоверны (Р ≤0,05). При измерении линейных размеров лазеркоагулятов после супрахориоидальной трансплантации НСПК(III cерия, 2-ая подгруппа) на модели лазерного повреждения сетчатки (2-ая группа) средние размеры в опытных глазах были меньше, чем в контрольных (опыт-184 мкм. контроль – 281 мкм.). После исключения из опытных и контрольных групп зон дегенерации размером более 300 микрометров, средние размеры в опытных глаза также не превышали таковые в контрольных: опыт-128 мкм, контроль-155 мкм (рис.7).

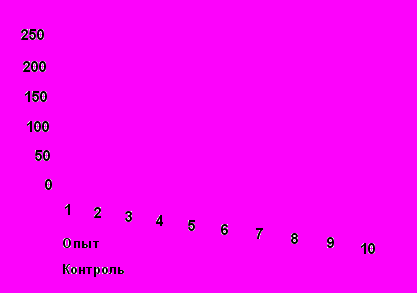
Рис.7. Средний размер зон дегенерации опытных и контрольных глазах, после лазеркоагуляции сетчатки и супрахориоидальной трансплантации А) МСПК, Б) НСПК.
Таким образом, гисто - морфометрические исследования свидетельствуют, что трансплантация СК не вызывает каких-либо воспалительных и аллергических реакций. Введённые интравитреально клетки пролиферируют в стекловидном теле, сохраняют жизнеспособность до 30 дней. Трансплантация супрахориоидально МСПК и НСПК стимулирует репаративные процессы в сетчатке и защищает ее от развития вторичных дистрофических изменений при лазерном повреждении, что выражается в виде меньшей площади повреждения в опытных глазах при одинаковых условиях лазеркоагуляции.
Выводы:
1. Для повышения репаративной и функциональной активности сетчатки при ее патологии различного генеза целесообразно применение культивированных мезенхимальных СК, выделенных из костного мозга (МСПК) и нейрональных СК (НСПК), выделенных из обонятельной области слизистой носа. Оптимальным методом трансплантации СК является их введение в супрахориоидальное пространство в количестве 500 тыс. в 0,02 мл физиологического раствора.
2. Трансплантация МСПК и НСПК в соответствующих дозах субконъюнктивально, ретробульбарно и супрахориоидально не вызывает каких-либо воспалительных и аллергических реакций. При интравитреальном введении происходит миграция МСПК в ткань сетчатки с сохранением их жизнеспособности до 30 дней после инъекции.
3. По данным гистологических исследований трансплантация МСПК и НСПК супрахориоидально ведет к статистически достоверному уменьшению размеров очагов лазерного поражения сетчатки и суммарного размера зон первичного лазерного поражения, то есть, стимулирует репаративные процессы и защищает сетчатку от развития вторичных дистрофических изменений.
4. Трансплантация СК интравитреально на модели лазерного повреждения сетчатки оказывает защитный эффект на функцию ретинальных нейронов: умеренно выраженный для МСПК и статистически значимый для НСПК. Однако наличие витреоретинальной пролиферации и реактивного глиоза в единичных случаях можно рассматривать как побочный эффект трансплантации, что ограничивает применение интравитреального способа введения СК и требует дальнейшего его изучения.
5. По данным электроретинографии, при супрахориоидальном введении МСПК побочные эффекты отсутствуют. Более того, на ранних сроках после лазеркоагуляции МСПК защищают функцию нейронов сетчатки, а в отдаленном периоде способствуют лучшему ее восстановлению.
6. Установлено положительное влияние супрахориоидальной трансплантации НСПК на сохранность функции и структуры сетчатки при моделировании лазерного повреждения и ретинальной ишемии. НСПК обладают нейропротекторным эффектом с наиболее выраженным положительным влиянием на функцию фоторецепторов и клеток Мюллера. В ранние сроки после трансплантации НСПК способствуют лучшей сохранности функции сетчатки, а в отдаленном периоде – более быстрому и полному восстановлению ее электрогенеза.
7. Сравнительный анализ эффективности МСПК и НСПК при супрахориоидальном введении показал аналогичный характер их воздействия, который состоит в защите нейронов сетчатки и ускорении восстановления их функции, при более выраженном действии НСПК. Результаты свидетельствуют о перспективности дальнейших исследований возможностей их клинического применения в качестве средств нейропротекции при лечении тяжелой патологии сетчатки.
Практические рекомендации:
1. Учитывая доказанное нейропротекторное действие трансплантации стволовых клеток (МСПК и НСПК) на моделях лазеркоагуляции и лазерной ишемии сетчатки, можно рекомендовать данную методику для клинической апробации при заболеваниях сетчатки различного генеза, особенно при последствиях посттравматической патологии дистрофического характера.
2. Для повышения репаративной и функциональной активности сетчатки целесообразно введение МСПК и НСПК в супрахориоидальное пространство в количестве 500 тыс. в 0,02 мл СФР. Рекомендуемые дозы и способы трансплантации являются безопасными для структуры и функции сетчатки при отсутствии аллергических и воспалительных реакций.
Список опубликованных работ:
- Влияние ксенотрансплантации нейральных/прогениторных клеток из обонятельного эпителия на функциональную активность сетчатки после моделирования ишемии / Е.В.Ченцова, И.Т. Купрашвили, М. В. Зуева, И.В. Цапенко, И.Н. Сабурина, В.С. Репин, А.В. Ревищин // Клеточная трансплантология и тканевая инженерия. – 2007. – T.2. - №4. – C. 47-51.
- Динамика электроретинограммы при интравитреальном введении мезенхимальных стромальных прогениторных клеток на модели лазерного повреждения сетчатки кролика / Е.В. Ченцова, И.Т. Купрашвили, А.Н. Иванов, М.В. Зуева, И.В. Цапенко, И.Н.Сабурина // Матер. научно–практич. конф. «Молодые ученые». – Москва, 2007. - С. 404-406.
- Воздействие трансплантации обкладочных клеток эктодермального происхождения на регенерацию сетчатки в эксперименте / Е.В. Ченцова, И.Т. Купрашвили, А.Н. Иванов, И.А. Сабурина, А.В. Ревищин, В.С. Репин // Матер. научно–практич. конф. «Федоровские чтения».М.,2007.- С.261-262.
- Эффект трансплантации мезенхимальных стволовых клеток при лазерном повреждении сетчатки в эксперименте / Е.В. Ченцова, И.Т. Купрашвили, А.Н. Иванов, И.А. Сабурина, А.В. Ревищин, В.С. Репин // Матер. научно–практич. конф. «Новые технологии в пластической хирургии придаточного аппарата при травмах глаза и орбиты в условиях чрезвычайных ситуаций и катастроф». М., 2007. – С. 196-198.
- Стволовые клетки нейрального происхождения в лечении лазерного ожога сетчатки в эксперименте / Е.В.Ченцова, И.Т. Купрашвили, М.В.Зуева, И.В.Цапенко, И.Н.Сабурина, А.В. Ревищин // «Поражения органа зрения» – мат. юбилейной научной конф., посвящ. 190-летнему юбилею основания каф. офтальмологии Военно-мед. акад. – С-Петерб., 2008.- С.173-174.
- Перспективы применения аутологичных прогениторных клеток при травме сетчатки / Е.В.Ченцова, И.Т. Купрашвили, М.В.Зуева, И.В. Цапенко, И.Н. Сабурина, А.В. Ревищин // В сб. научно-практич. конф. «Российский общенациональный офтальмологический форум». М., 2008. – С. 251-254.
- Влияние ксенотрансплантации мультипотентных мезенхимальных стволовых клеток костного мозга на восстановление структурной организации и функциональной активности сетчатки при ее повреждении / Р.А. Гундорова, Е.В.Ченцова, И.Т. Купрашвили, М.В. Зуева, И.В. Цапенко, И.Н. Сабурина, В.С. Репин, А.В. Ревищин // Вестник офтальмологии – 2008. – Т. 124, №3. - С. 14-18.
- Трансплантация аутологичных нейральных стволовых/прогениторных клеток при травме сетчатки / Е.В. Ченцова, И.Т. Купрашвили, М.В. Зуева, И.В. Цапенко, И.Н. Сабурина, А.В. Ревищин // Матер. научно-практич. конф. «Федоровские чтения». – Москва, 2008. – С. 331-332.
- Human mesenchimal stem cells transplantation into laser damaged rabbit retina E. Chentsova, I. Kuprashvili, R.Gundorova, M. Zueva, I. Tsapenko, L. Korochkin, A. Revishchin, I. Saburina, V. Repin, //. 7th Symp. on Ocular Trauma - Rome, 2006. – p. 34
- The effect of neural stem cell transplants on retina regeneration in experiment / Е. Chentsova, V. Neroev, R. Gundorova, N. Pak, M. Zueva, I. Tsapenko, I. Kuprashvili, R. Poltavtseva, G. Sukhikh // Stem cells: Policy, research, and Innovations. European Union – Russian Federation Perspectives. British-Russian Workshop in Association with the European Commission 2007. – P. 12-14.
- Human mesenchymal stem cells transplantation into laser damaged retina / E. Chentsova, I.Kuprashvili, M. Zueva, I. Tsapenko, A. Revishchin, I. Saburina, V. Repin // SOE/AAO. - Vienna, 2007. - P.41-42.
- The Effect of OECs xenotransplantation on post-trauma reparation and functional activity of the retina / E. Chentsova, I. Kuprashvili, M. Zueva, I. Tsapenko, L. Korochkin, A. Revishchin, I. Saburina, V. Repin // 8th Symp. on Ocular Trauma. Wurzburg, 2008. – Р. 8.
Положительное решение о выдаче патента на изобретение: «Способ повышения функциональной активности сетчатки при ее патологии различного генеза» от 01.04.09. по заявке №2008121546/14 (приоритет от 29.05.08.). Авторы Ченцова Е.В., Купрашвили И.Т., Зуева М.В., Цапенко И.В.
Список сокращении.
СК - стволовых клеток.
МСПК - мезенхимальные стволовые /прогениторные клетки.
НСПК - неирональные стволовые/прогенитоные клетки.
СФР - сбалансированный физиологический раствор.
ЭРГ – элекрторетинограмма.
РЭРГ - ритмическая электроретинограмма.
