Патофизиологическое обоснование применения препаратов метаболического типа действия при индуцированном опухолевом росте кожи (экспериментальное исследование) 14. 03. 03 патологическая физиология
| Вид материала | Исследование |
- Патофизиологическое обоснование применения нормобарической гипоксии для патогенетической, 277.28kb.
- Чичило Олег Сергеевич Обоснование лечения пародонтита на фоне артрита с применением, 308.22kb.
- Патофизиологическое обоснование использования интервальной гипоксической тренировки, 541.29kb.
- Токсикологическая оценка и экспериментальное обоснование применения полиферментных, 621.59kb.
- «Московский государственный медико-стоматологический университет Росздрава», 303.29kb.
- На правах рукописи, 315.53kb.
- Пояснительная записка Учебно-методический комплекс по курсу «Патологическая физиология», 140.7kb.
- Обоснование применения пармелии в комплексной терапии экземы (клинико-экспериментальное, 349.46kb.
- Программа научно-практической конференции, 105.1kb.
- Патофизиологический анализ влияния факторов риска образовательной среды на функциональное, 816.71kb.
На правах рукописи
Демидов Денис Владимирович
ПАТОФИЗИОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ
ПРЕПАРАТОВ МЕТАБОЛИЧЕСКОГО ТИПА ДЕЙСТВИЯ
ПРИ ИНДУЦИРОВАННОМ ОПУХОЛЕВОМ РОСТЕ КОЖИ
(экспериментальное исследование)
14.03.03 – патологическая физиология
Автореферат диссертации на соискание ученой степени кандидата
медицинских наук
Саранск – 2012
Работа выполнена на кафедре патологии с курсом патологической
физиологии ФГБОУ ВПО «Мордовский государственный университет имени Н.П. Огарева»
| ^ Научный руководитель: | доктор медицинских наук, профессор Плотникова Надежда Алексеевна |
| Официальные оппоненты: | доктор медицинских наук, профессор ^ Мосина Лариса Михайловна (ФГБОУ ВПО «Мордовский государственный университет имени Н.П. Огарева», г. Саранск) доктор медицинских наук, профессор ^ Малышев Вадим Геннадьевич (ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И.Н. Ульянова», г. Ульяновск) |
| | |
Ведущая организация: ГОУ ВПО «Российский университет дружбы народов»,
г. Москва.
Защита диссертации состоится «17» февраля 2012 года в 14.00 часов на
заседании диссертационного совета Д 212.117.08 при ФГБОУ ВПО «Мордовский государственный университет имени Н.П. Огарева» (430032, г. Саранск, ул. Ульянова, 26).
С диссертацией можно ознакомиться в научной библиотеке ФГБОУ ВПО «Мордовский государственный университет имени Н.П. Огарева» (430005, г. Саранск, ул. Большевистская, д. 68), с авторефератом – на официальном сайте Минобрнауки.
Автореферат разослан «___»___________2012 г.
Ученый секретарь
диссертационного совета,
кандидат медицинских наук, доцент А.Г. Голубев
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Предложение использовать препараты, обладающие антиоксидантными свойствами в качестве онкопротектров основано на свободнорадикальной теории опухолевого роста. Свободные радикалы, образующиеся в результате различных окислительных реакций в организме, оказывают множественные повреждающие эффекты на макромолекулы (нуклеиновые кислоты и белки), вызывая их деградацию. Это теория объясняет не только механизмы опухолевого роста, но и широкий круг связанных с ним патологических процессов (Harman D., 2004).
То обстоятельство, что продукты взаимодействия активных форм кислорода с макромолекулами постоянно обнаруживается в органах и тканях организма, свидетельствует о том, что системы антиоксидантной защиты не достаточно эффективны и что клетки постоянно подвергаются окислительному стрессу. Противодействие ему может играть существенную роль в механизме онкостатического действия эндогенных и экзогенных антиоксидантов (Анисимов В.Н., 2008).
На основании имеющихся теорий канцерогенеза онкостатические препараты обладают различным механизмом действия и сопоставление данных об их влиянии на развитие неоплазий и на показатели окислительно-антиокислительного статуса позволяет глубже понять патогенез опухолевого роста (Анисимов В.Н., 2008).
Наиболее информативным является определение промежуточного продукта перекисного окисления липидов – малонового диальдегида и показателей антиоксидантной ферментной защиты – активность каталазы и супероксиддисмутазы. Определенный интерес при опухолевом процессе представляет изучение содержания церулоплазмина – белка плазмы крови, обладающего антиоксидантным действием и оксидазной активностью (Ковтунова М.Е. и др., 2003), а также молекул средней массы, как показателей, отражающих процессы эндогенной интоксикации организма.
Мелатонин является одним из сильнейших эндогенных поглотителей свободных радикалов (Комаров Ф.И. и соавт., 2004). В литературе имеются данные об антиокислительном действии антидиабетических бигуанидов (Claustrat В. et al., 2005), их прямом действии на митохондрии (Анисимов В.Н., Арутюнян А.В., 2007).
В связи с этим, проблема коррекции мелатонином и метформином (препаратами, обладающими антиоксидантной активностью), опухолевого роста на бенз(а)пиреновой модели неоплазий приобретает особую актуальность.
^ Цель исследования. Изучение патофизиологических механизмов онкостатического действия мелатонина и метформина на морфофункциональную характеристику экспериментального опухолевого роста кожи, индуцированного бенз(а)пиреном у мышей.
^ Основные задачи исследования.
- Оценить динамику некоторых показателей перекисного окисления липидов в сыворотке крови и опухолевой ткани у мышей в условиях индуцированного опухолевого роста кожи и при коррекции мелатонином и метформином.
- Исследовать влияние мелатонина и метформина на показатели собственной антиоксидантной защиты в сыворотке крови и опухолевой ткани кожи у экспериментальных животных на фоне воздействия бенз(а)пирена.
- Определить содержание молекул средней массы в сыворотке крови экспериментальных животных, как показателя выраженности эндогенной интоксикации, при коррекции индуцированного опухолевого роста мелатонином и метформином.
- Изучить влияние мелатонина и метформина на частоту развития опухолей кожи, индуцированных бенз(а)пиреном у мышей.
- Выявить динамику морфологических изменений экспериментальных неоплазий в условиях бенз(а)пиренового опухолевого роста при коррекции мелатонином и метформином.
^ Научная новизна. В работе дана оценка динамики некоторых показателей перекисного окисления липидов в плазме крови и гомогенатах опухолевой ткани при коррекции мелатонином и метформином в условиях экспериментального опухолевого роста кожи мышей, индуцированного бенз(а)пиреном.
Показано и проанализировано влияние мелатонина и метформина при введении в разных сочетаниях на процессы перекисного окисления липидов, состояние собственной антиоксидантной защиты и показатели эндогенной интоксикации на модели экспериментальных новообразований.
Продемонстрировано онкостатическое действие изучаемых препаратов на развитие опухолей кожи (показано достоверное снижение абсолютного числа новообразований; уменьшение процессов эндогенной интоксикации и перекисного окисления липидов). Показано, что мелатонин и метформин, как препараты, обладающие антиоксидантной активностью, способствуют протекции и восстановлению собственной антиоксидантной защиты.
^ Научно-практическая значимость. Полученные результаты могут служить экспериментальным обоснованием для дальнейшего изучения онкостатического потенциала мелатонина и метформина, разработки научно обоснованных рекомендаций по применению данных препаратов с целью профилактики злокачественных новообразований.
Результаты выполненной работы подтверждают целесообразность дальнейших клинических исследований в этой области с целью возможного использования препаратов с антиоксидантной активностью в профилактике и комплексном лечении неоплазий.
^ Основные положения, выносимые на защиту.
- Введение животным канцерогена (бенз(а)пирена) сопровождается активацией процессов перекисного окисления липидов как в сыворотке крови, так и в ткани опухолей; использование мелатонина и метформина уменьшает, а в ряде случаев полностью нивелирует эти изменения.
- В условиях злокачественного опухолевого роста на фоне угнетения антиоксидантной защиты происходит активация прооксидантных систем организма, баланс которых в ходе проводимой коррекции мелатонином и метформином и воздействия компенсаторных механизмов постепенно начинает восстанавливаться.
- Коррекция мелатонином и метформином индуцированного опухолевого роста приводит к существенному снижению содержания молекул средней массы в плазме крови как маркера эндогенной интоксикации, что свидетельствует о снижении проявлений интоксикационного синдрома.
- Применение данных препаратов, обладающих антиоксидантной активностью, в качестве онкостатиков сопровождается положительной динамикой морфологических критериев канцерогенного эффекта бенз(а)пирена
^ Внедрение результатов исследования в практическую деятельность. Работа выполнялась в соответствии с научной тематикой кафедры патологии с курсом патологической физиологии Мордовского государственного университета им. Н.П. Огарева «Изучение антиканцерогенного действия антиоксидантов. Использование антиоксидантов с целью лечения онкологических заболеваний и профилактики побочных эффектов химиотерапии злокачественных опухолей». Номер государственной регистрации 01200004102.
Результаты исследования внедрены в научно-исследовательскую работу и учебный процесс кафедры патологии с курсом патологической физиологии Мордовского государственного университета им. Н.П. Огарева.
^ Апробация работы. Результаты работы были доложены и обсуждены на VIII, IX, X, XI Международной научно-практической конференции «Здоровье и образование в XXI веке» (Москва, 2007, 2008, 2009, 2010); VII, VIII, IX, X Всероссийской научно-практической конференции с международным участием «Отечественные противоопухолевые препараты» (Москва, 2008, 2009, 2010, 2011); XII, XIII, XIV, XV, XVI научной конференции молодых ученых, аспирантов и студентов Мордовского государственного университета им. Н.П.Огарева (Саранск, 2007, 2008, 2009, 2010, 2011); XXXV, XXXVI, XXXVII, XXXVIII, XXXIX Огаревских чтениях (научно-практической конференции Мордовского государственного университета им. Н.П.Огарева, Саранск, 2007, 2008, 2009, 2010, 2011); 4-й, 5-й и 6-ой Российской конференции по фундаментальной онкологии «Петровские чтения» (Санкт-Петербург, ФГУНИИ онкологии Росмедтехнологий им. Н.Н. Петрова, 2008, 2009, 2010); XVI межрегиональной научной конференции памяти академика Н.И. Бурденко «Актуальные вопросы современного практического здравоохранения» (Пенза, 2008).
Публикации. По теме диссертационного исследования имеется 28 публикаций в отечественных и зарубежных изданиях, в том числе, 3 из них – в изданиях, рекомендованных ВАК РФ.
^ Структура и объем диссертационной работы. Диссертация изложена на 132 страницах компьютерного текста, документирована 25 таблицами и иллюстрирована 23 рисунками. Работа состоит из введения, обзора литературы (глава 1), описания материалов и методов исследования (глава 2), изложения собственных результатов (глава 3), обсуждения полученных результатов, выводов, практических рекомендаций, библиографического указателя, включающего в себя 259 источников, в том числе 80 отечественных и 179 иностранных.
^ ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент проведен на 220 самках нелинейных белых мышей. 200 мышей в возрасте 3 месяца были рандомизированно поделены на четыре группы по 50 мышей, оставшиеся 20 мышей (5-я группа) служили интактным контролем и не подвергались каким-либо воздействиям. Животные содержались в стандартных условиях вивария, при режиме освещения: 12 часов свет, 12 часов темнота. Мыши получали воду и гранулированный корм без ограничений. Эксперимент проводили в соответствии с правилами проведения работ с использованием экспериментальных животных.
Животным четырех экспериментальных групп на предварительно выбритый участок кожи спинки диаметром 1,5-2 см (межлопаточная область) два раза в неделю наносили бенз(а)пирен (Fluka, Busch, Швейцария) в концентрации 0,05%, растворенный в ацетоне в дозе 0,2 мл на мышь.
Мыши 1-ой группы составили контрольную группу по канцерогену и получали питьевую воду без добавления мелатонина и метформина. Со следующего после введения канцерогена дня животные 2-ой группы получали с питьевой водой в ночные часы мелатонин в концентрации 2 мг/л. Животные 3-ей группы получали с питьевой водой в течение всего дня метформин в концентрации 200 мг/л. Животные 4-ой группы получали с питьевой водой в течение всего дня метформин в концентрации 200 мг/л и в ночные часы мелатонин в концентрации 2 мг/л.
Длительность эксперимента составила 26 недель. Оставшиеся в живых мыши забивались путем декапитации под действием эфирного наркоза. У всех интактных мышей и у особей из каждой экспериментальной группы животных, подвергшихся воздействию канцерогена, брали кровь и ткань кожи для гистологического и биохимического исследований. Все декапитированные животные вскрывались и подвергались патоморфологическому исследованию. Гистологические срезы окрашивали гематоксилином и эозином и исследовали микроскопически. Неоплазии классифицировались согласно рекомендациям Международного агентства по исследованию рака (МАИР).
В опытных и контрольных группах экспериментальных животных изучали выраженность процессов перекисного окисления липидов (малоновый диальдегид и Fe-индуцированный малоновый диальдегид), состояние собственной антиоксидантной защиты организма (активность супероксиддисмутазы и каталазы, концентрация церулоплазмина) в сыворотке крови и в гомогенатах опухолевой ткани, а также изменение показателей эндогенной интоксикации в сыворотке крови.
Полученные при исследовании данные обрабатывали вариационно-статистическими методами. Для всех параметров определяли минимальное (Min) и максимальное (Max) значение. Вычисляли среднюю арифметическую выборочной совокупности (М) и ошибку средней арифметической (m). Достоверность различий между рядами вариант определяли с помощью критерия критерия t Стьюдента, с использованием пакетов прикладных программ Microsoft Office 2003, «МедСтатистика» и «Биостат» (вычисления производили на CPU 1900 MHz «Intel Pentium-4»). В качестве статистически значимого порогового уровня было принято значение р≤0,05 (при уровне вероятности большим 95%).
^ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Влияние мелатонина и метформина на патоморфологию опухолей кожи у мышей
Процесс развития неоплазий сопровождается различными нарушениями клеточного, тканевого и иммунного гомеостаза, нарушениями нервно-эндокринной регуляции деятельности различных органов. Развитие подобных изменений зависит от специфической чувствительности клеток, тканей и органов к действию различных канцерогенов, от дозы и времени экспозиции.
Общая частота опухолей кожи в экспериментальных группах составила: 67,4% в контрольной группе; 53,2% животных, получавших мелатонин; 61,2% животных, получавших метформин и 44,4% животных, получавших метформин и мелатонин, различия достоверны (p< 0,01). Данные представлены на рисунке 1.
По данным гистологического исследования относительная частота плоскоклеточных ороговевающих карцином кожи в контрольной группе составила 50,0%; 34,0% – в группе мышей, получавших мелатонин; 36,7% и 24,4% (p< 0,01), в группах, получавших метформин и мелатонин совместно с метформином, соответственно. Число животных с гистологически верифицированными папилломами кожи составило в контроле – 16 (34,8%). При коррекции мелатонином число папиллом составило 13 (27,7%). В группе животных, получавших метформин, количество папиллом кожи – 14 (28,6%). При совместном применении метформина и мелатонина число животных с папилломами составляет 12 (26,7%). Показатели существенно не отличаются от группы контроля (р>0,05). Данные представлены на рисунке 2 и 3.
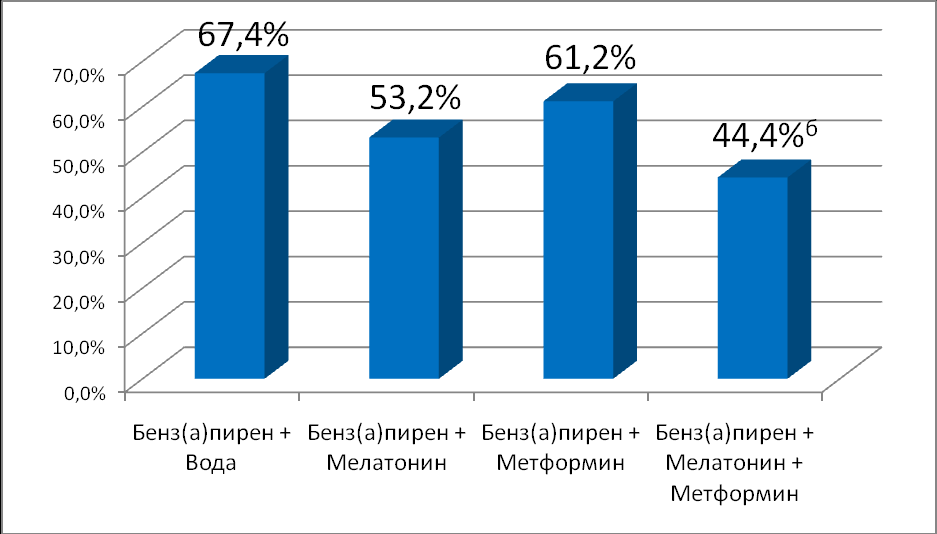
Рис. 1. Влияние мелатонина и метформина на частоту развития опухолей кожи у мышей
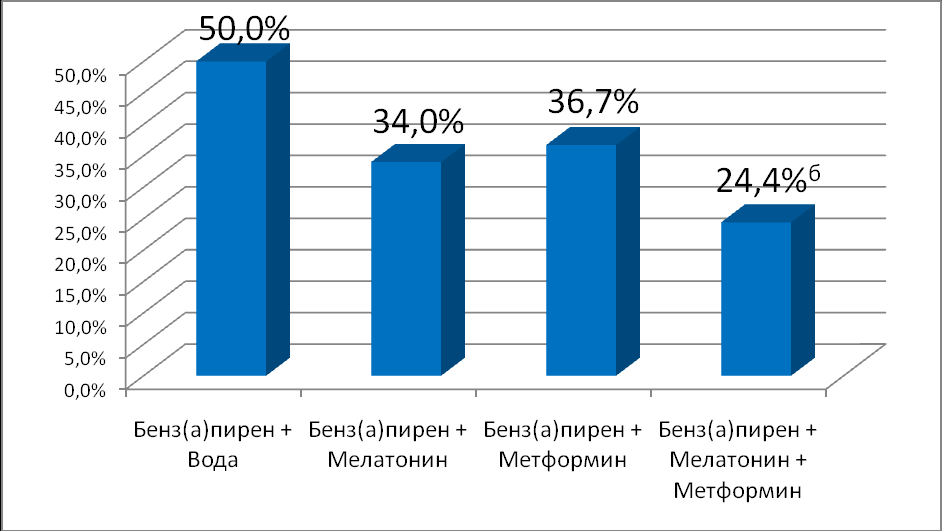
Рис. 2. Влияние мелатонина и метформина на количество злокачественных новообразований кожи у мышей
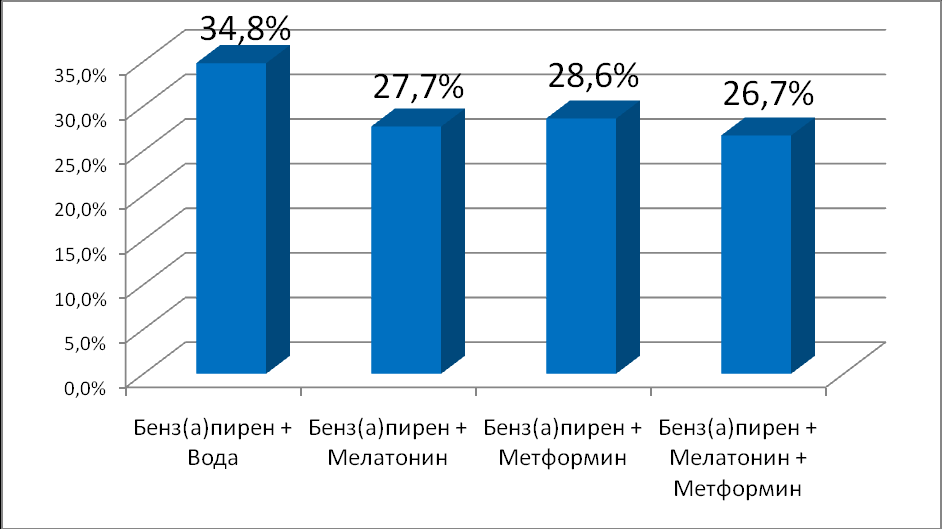
Рис. 3. Влияние мелатонина и метформина на количество папиллом кожи у мышей
Число животных с метастазами в легкие в группе контроля составило 2 (6,5%), в группе мышей, получавших мелатонин – 1 (4%). При коррекции метформином и совместно с мелатонином метастазы в легкие выявлены не были.
В среднем через 85 суток от начала аппликаций бенз(а)пиреном у мышей экспериментальных групп сформировались узелки в месте воздействия канцерогена. По своей структуре опухолевидные образования были округлой или округло-овальной формы, размером не более 2 мм, выступающие над поверхностью неизмененных кожных покровов, плотно-эластической консистенции.
В динамике узлы теряли подвижность, становились не смещаемыми и увеличивались в размерах, изъязвлялись с формированием язв с подрытыми плотными краями и западающим дном.
На заключительных этапах эксперимента опухолевые узлы достигали максимальных размеров (до 5 см в диаметре), и язвенные дефекты занимали большую часть поверхности спинки мыши. Кроме того, наблюдались вторичные изменения в тканях опухолей с явлениями нагноения и распада.
При микроскопическом исследовании опухолевидных образований кожи мышей экспериментальных групп наблюдалась гистологическая картина, характерная для папиллом кожи и плоскоклеточного ороговевающего и неороговевающего рака.
На ранних этапах канцерогенеза отмечается диффузное разрастание покровного эпителия и его дериватов. Впоследствии появляются атипические разрастания, имеющие склонность к ороговению в центре. Из подобных очаговых пролифератов возникают сформировавшиеся опухоли.
Микроскопически плоскоклеточный рак кожи представлен атипичными опухолевыми клетками разной степени дифференцировки. В подавляющем большинстве случаев это плоскоклеточный ороговевающий рак. Процессы ороговения характеризуются формированием типичных для этого вида рака «жемчужин» из рогового вещества.
^ Влияние мелатонина и метформина на динамику перекисного окисления липидов в сыворотке крови и ткани опухолей кожи у экспериментальных животных
При использовании эндогенного гормона мелатонина для коррекции индуцированного канцерогенеза содержание малонового диальдегида в сыворотке крови достоверно ниже в 2,6 раза (р<0,05) по сравнению с интактными животными и в 5,5 раз меньше (р<0,001) по сравнению с группой контрольных животных.
Уровень Fe-индуцированного малонового диальдегида в сыворотке крови ниже в 1,6 раза по сравнению с интактными животными и в 3,1 раз меньше по сравнению с группой контрольных животных.
По сравнению с контрольной группой отмечается достоверное снижение показателей малонового диальдегида в 4,9 раза (р<0,001) в сыворотке крови и в 1,8 раза (р<0,01) в гомогенатах опухолевой ткани при применении метформина.
Применение метформина привело к снижению уровня Fe-индуцированного малонового диальдегида в сыворотке крови в 1,25 раза относительно интактных животных (р<0,01) и в 2,4 раза (р<0,01) ниже по сравнению с группой контроля.
Применение метформина совместно с мелатонином привело к снижению уровня малонового диальдегида в сыворотке крови в 3,5 раза (р<0,001) и в 1,9 раза (р<0,01) в опухолевой ткани.
Основные результаты представлены в таблицах 1 и 2.
Таблица 1
Содержание малонового диальдегида в сыворотке крови и ткани опухоли у интактных животных, экспериментальных животных в контроле и при коррекции мелатонином и метформином
| № группы | Воздействие | Малоновый диальдегид, ммоль/л; М±m | |
| ^ Сыворотка крови | Ткань опухоли | ||
| 1 | Интактный контроль | 4,05 ± 1,35 | 4,17 ± 0,19 |
| 2 | Бенз(а)пирен + вода | 8,42 ± 1,05 | 9,62 ± 0,94 |
| 3 | Бенз(а)пирен + мелатонин | 1,53 ± 0,14 | 6,56 ± 1,14 |
| 4 | Бенз(а)пирен + метформин | 1,72 ± 0,15 | 5,40 ± 0,78 |
| 5 | Бенз(а)пирен + мелатонин + метформин | 2,40 ± 0,44 | 5,14 ± 0,90 |
| Достоверность различия между группами, p | Р1-2<0,05 Р1-3<0,05 Р2-3<0,001 Р2-4<0,001 Р2-5<0,001 Р3-5<0,001 Р4-5<0,001 | Р1-2<0,01 Р2-4<0,01 Р2-5<0,01 Р3-4<0,01 Р4-5<0,01 | |
Таблица 2
Содержание Fe-индуцированного малонового диальдегида в сыворотке крови и ткани опухоли у интактных животных, экспериментальных животных в контроле и при коррекции мелатонином и метформином
| № группы | Воздействие | Fe-индуцированный малоновый диальдегид, ммоль/л; М±m | |
| ^ Сыворотка крови | Ткань опухоли | ||
| 1 | Интактный контроль | 3,90 ± 0,05 | 2,62 ± 1,6 |
| 2 | Бенз(а)пирен + вода | 7,60 ± 0,21 | 3,10 ± 1,92 |
| 3 | Бенз(а)пирен + мелатонин | 2,47 ± 0,61 | 2,96 ± 0,97 |
| 4 | Бенз(а)пирен + метформин | 3,12 ± 0,09 | 2,58 ± 2,03 |
| 5 | Бенз(а)пирен + мелатонин + метформин | 2,15 ± 0,06 | 2,27 ± 0,16 |
| Достоверность различия между группами, p | Р1-2<0,05 Р1-4<0,01 Р2-4<0,01 Р4-5<0,05 | Р1-2<0,05 Р1-4<0,05 Р2-5<0,001 Р3-4<0,001 | |
Влияние мелатонина и метформина на показатели собственной антиоксидантной защиты в сыворотке крови и ткани опухолей кожи у экспериментальных животных
При индуцированном опухолевом росте в контроле показатель активности супероксиддисмутазы в сыворотке крови у мышей ниже нормы на 44% (р<0,05). Данный показатель в ткани опухолей кожи ниже значений, полученных у интактных мышей, на 51%.
Данные представлены в таблицах 3, 4 и 5.
Таблица 3
Содержание церулоплазмина в сыворотке крови и ткани опухоли у интактных животных, экспериментальных животных в контроле и при коррекции мелатонином и метформином
| № группы | Воздействие | Церулоплазмин, мг%; М±m | |
| ^ Сыворотка крови | Ткань опухоли | ||
| 1 | Интактный контроль | 27,0 ± 0,44 | 23,6 ± 1,09 |
| 2 | Бенз(а)пирен + вода | 67,55 ± 1,03 | 48,67 ± 1,11 |
| 3 | Бенз(а)пирен + мелатонин | 56,36 ± 0,65 | 42,06 ± 0,05 |
| 4 | Бенз(а)пирен + метформин | 54,29 ± 0,16 | 38,24 ± 0,17 |
| 5 | Бенз(а)пирен + мелатонин + метформин | 34,42 ± 0,12 | 31,04 ± 0,35 |
| Достоверность различия между группами, p | Р1-2<0,05 Р1-3<0,01 Р2-3<0,01 Р2-4<0,05 Р2-5<0,001 Р3-4<0,01 | Р1-2<0,001 Р1-5<0,01 Р2-3<0,05 Р2-5<0,05 Р3-4<0,01 | |
Таблица 4
Активность каталазы в сыворотке крови и ткани опухоли у интактных животных, экспериментальных животных в контроле и при коррекции мелатонином и метформином
| № группы | Воздействие | Активность каталазы, мкКат/л, М±m | |
| ^ Сыворотка крови | Ткань опухоли | ||
| 1 | Интактный контроль | 1,97 ± 0,11 | 2,73 ± 0,03 |
| 2 | Бенз(а)пирен + вода | 3,03 ± 1,13 | 2,52 ± 0,11 |
| 3 | Бенз(а)пирен + мелатонин | 1,83 ± 0,15 | 2,06 ± 0,08 |
| 4 | Бенз(а)пирен + метформин | 1,94 ± 0,08 | 2,17 ± 0,15 |
| 5 | Бенз(а)пирен + мелатонин + метформин | 1,70 ± 0,10 | 2,14 ± 0,11 |
| Достоверность различия между группами, p | | Р1-3<0,001 Р1-4<0,05 Р1-5<0,01 Р2-3<0,01 Р2-5<0,05 Р3-4<0,01 | |
Экспериментально показано, что при применении мелатонина активность супероксиддисмутазы несколько повышалась относительно контроля на 32,9% (р<0,001), но достоверно была ниже исходных данных на 25,8%. Супероксиддисмутазная активность в ткани опухолей кожи на фоне коррекции мелатонином достоверно превышала контроль на 44,5% (р<0,01). Но показателей, полученных у интактных мышей, не достигала на 29% (р<0,01).
В группе животных, получавших мелатонин уровень церулоплазмина в сыворотке крови достоверно выше в 2 раза (р<0,01) по сравнению с группой интактных животных. При сравнении с группой контроля концентрация церулоплазмина снизилась в 1,5 раза (р<0,01) в сыворотке крови и в 1,2 раза – в опухолевой ткани (р<0,05).
Коррекция индуцированного опухолевого роста метформином привела к снижению уровня церулоплазмина в сыворотке крови экспериментальных животных в 1,2 раза (р<0,05). По сравнению с интактными животными содержание церулоплазмина в плазме крови при использовании метформина оставалось выше в 2 раза. В гомогенатах тканей опухолей кожи превышает данный показатель у интактных животных в 1,6 раза.
Исследования показали, что при применении мелатонина и метформина совместно супероксиддисмутазная активность в сыворотке крови экспериментальных животных превосходила контроль на 27,3% (р<0,01), достоверно не отличаясь от данных интактного контроля. При применении и мелатонина и метформина активность супероксиддисмутазы в ткани опухолей кожи была выше контроля на 49,7%.
Таблица 5
Активность супероксиддисмутазы в сыворотке крови и ткани опухоли у интактных животных, экспериментальных животных в контроле и при коррекции мелатонином и метформином
| № группы | Воздействие | Активность СОД, усл. ед., М±m | |
| ^ Сыворотка крови | Ткань опухоли | ||
| 1 | Интактный контроль | 2,67 ± 0,09 | 13,84 ± 0,70 |
| 2 | Бенз(а)пирен + вода | 1,49 ± 0,06 | 6,83 ± 0,36 |
| 3 | Бенз(а)пирен + мелатонин | 1,98 ± 0,11 | 9,87 ± 0,38 |
| 4 | Бенз(а)пирен + метформин | 2,03 ± 0,11 | 10,17 ± 0,59 |
| 5 | Бенз(а)пирен + мелатонин + метформин | 2,47 ± 0,09 | 12,74 ± 0,61 |
| Достоверность различия между группами, p | Р1-2<0,05 Р1-3<0,05 Р2-3<0,001 Р2-4<0,001 Р2-5<0,01 Р3-5<0,001 | Р1-2<0,01 Р1-3<0,01 Р1-4<0,01 Р2-3<0,01 Р2-4<0,01 Р4-5<0,01 | |
Влияние мелатонина и метформина на показатели эндогенной интоксикации в сыворотке крови у экспериментальных животных
У животных контрольной группы содержание молекул средней массы превышало норму на 103% и 125% (р<0,05), соответственно.
Уровень содержания молекул средней массы на фоне коррекции мелатонином достоверно уменьшался на 33% и 27% (р<0,01), соответственно, по сравнению с контрольной группой.
Установлено, что при применении метформина удельный вес молекул средней массы (λ=254 нм и λ=280 нм), оставаясь выше показателей интактных мышей на 51% и 88% (р<0,05), достоверно уменьшался по сравнению с контролем на 26% и 16% (р<0,001 и р<0,05), соответственно.
На фоне коррекции мелатонином и метформином показатели молекул средней массы достоверно не отличались от исходных данных у интактных мышей, превышая показатели, полученные при исследовании сыворотки крови интактных мышей на 30% и 64%, достоверно ниже показателей контрольной группы на 57% и 37% (р<0,001 и р<0,01), соответственно.
При совместной коррекции индуцированного опухолевого роста мелатонином и метформином содержание молекул средней массы (λ=254 нм) на 14,0% меньше (р<0,001), по сравнению с показателями у животных, получавших только метформин. Уровень молекул средней массы (λ=280 нм) достоверно ниже при использовании мелатонина на 12,7%, чем при применении метформина (р<0,01). Данные представлены в таблице 6.
Проведенные исследования показали высокую эффективность совместного использования изучаемых препаратов с целью коррекции нарушений обмена при экспериментальных опухолях кожи и купировании синдрома эндогенной интоксикации.
Таблица 6
Содержание молекул средней массы в сыворотке крови у интактных животных, экспериментальных животных в контроле и при коррекции мелатонином и метформином
| № группы | Воздействие | Молекулы средней массы, усл. ед.; М±m | |
| При λ=254 нм | При λ=280 нм | ||
| 1 | Интактный контроль | 0,343 ± 0,02 | 0,361 ± 0,03 |
| 2 | Бенз(а)пирен + вода | 0,698 ± 0,05 | 0,811 ± 0,04 |
| 3 | Бенз(а)пирен + мелатонин | 0,465 ± 0,03 | 0,592 ± 0,01 |
| 4 | Бенз(а)пирен + метформин | 0,518 ± 0,03 | 0,678 ± 0,03 |
| 5 | Бенз(а)пирен + мелатонин + метформин | 0,445 ± 0,02 | 0,593 ± 0,02 |
| Достоверность различия между группами, p | Р1-2<0,05 Р1-4<0,05 Р2-3<0,01 Р2-4<0,001 Р2-5<0,001 Р4-5<0,001 | Р1-2<0,05 Р1-4<0,05 Р2-3<0,01 Р2-4<0,05 Р2-5<0,01 Р3-4<0,01 | |
В механизме антиканцерогенного действия мелатонина и метформина особенно большое значение придают их антиоксидантной (Reiter R.J., 2001; Vijayalaxmi C.C. et al., 2002) и антимутагенной (Musatov S.A. et al., 1998) активности. Это позволяет предположить, что наблюдаемый угнетающий эффект исследуемых препаратов на развитие указанных неоплазий связан, по крайней мере, частично, со способностью понижать интенсивность процессов ПОЛ. Подобный механизм был продемонстрирован на моделях рака толстой кишки (Анисимов В.Н., Забежинский М.А., Попович И.Г., 2000; Anisimov V.N., 2001a) и канцерогенеза кожи, индуцированного аппликациями бенз(а)пирена и кротонового масла (Kumar А.С., Das U.N., 2000). Также имеются данные, что некоторые антиоксиданты подавляют канцерогенез, индуцированный уретаном и бенз(а)пирена (Веснушкин Г.М., 2007; Klaunig J.E., Kamendulis L.M., 2004; Tamimi R.M. et al., 2002).
Резюмируя вышесказанное, следует отметить, что в условиях моделирования бенз(а)пиренового опухолевого роста тонкой кожи у мышей, наиболее выраженным онкостатическим действием среди нами использованных препаратов с антиоксидантной активностью обладает совместное применение мелатонина и метформина.
ВЫВОДЫ
- Введение животным канцерогена (бенз(а)пирена) сопровождается активацией процессов перекисного окисления липидов, как в сыворотке крови, так и в ткани опухолей; использование мелатонина и метформина уменьшает, а в ряде случаев нивелирует эти изменения, что подтверждается снижением содержания продуктов перекисного окисления липидов в сыворотке (плазме) крови и опухолевой ткани кожи мышей.
- При коррекции мелатонином и метформином индуцированных эпидермальных неоплазий отмечен онкостатический эффект, что подтверждается ограничением интенсивности процессов свободнорадикального окисления липидов при восстановлении собственного антиоксидантного потенциала в тканях и в сыворотке крови.
- Коррекция мелатонином и метформином индуцированного опухолевого роста кожи приводит к снижению содержания молекул средней массы в плазме крови как маркеров эндогенной интоксикации, что свидетельствует о снижении проявлений интоксикационного синдрома.
- На модели экспериментального опухолевого роста, индуцируемого аппликациями бенз(а)пирена у мышей, установлено, что мелатонин и метформин оказывают выраженный онкостатический эффект, проявляемый в уменьшении на 26% общей частоты развития опухолей кожи (папиллом и карцином).
- Применение мелатонина и метформина (препаратов, обладающих антиоксидантной активностью) сопровождается достоверным онкостатическим эффектом на модели бенз(а)пиреного опухолевого роста, о чем свидетельствует уменьшение частоты гистологически верифицированных злокачественных новообразований кожи на 52%.
^ ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Полученные результаты могут служить экспериментальным обоснованием для дальнейшего изучения онкостатического потенциала мелатонина и метформина, разработки научно обоснованных рекомендаций по применению данных препаратов с целью профилактики и комплексного лечения злокачественных новообразований.
^ Список работ, опубликованных по теме диссертации.
- Демидов Д.В. Изучение онкопротекторного действия мелатонина в условиях экспериментального канцерогенеза / Демидов Д.В., Маньчева Т.А., Плотникова Н.А. // Здоровье и образование в XXI веке: Материалы VIII Международной научно-практической конференции. Москва: Изд-во РУДН, 2007. С. 234-235.
- Маньчева Т.А. Онкопротекторное действие антидиабетического бигуанида – метформина / Маньчева Т.А., Демидов Д.В., Плотникова Н.А. // Здоровье и образование в XXI веке: Материалы VIII Международной научно-практической конференции. Москва: Изд-во РУДН, 2007. С. 411-412.
- Демидов Д.В. Противоопухолевый эффект мелатонина в условиях экспериментального бенз(а)пиренового канцерогенеза / Демидов Д.В., Маньчева Т.А., Плотникова Н.А. // XXXVI Огаревские чтения. Материалы научной конференции в 3-х частях. Часть 2 естественные науки. Саранск. Изд-во Морд. ГУ, 2008. С. 92-93.
- Плотникова Н.А. Влияние мелатонина и метформина на развитие опухолей кожи, индуцируемых бенз(а)пиреном у мышей / Плотникова Н.А., Маньчева Т.А., Демидов Д.В., Харитонова Т.В., Кемайкин С.П., Харитонов С.В., Анисимов В.Н. // Вопросы онкологии. Научно-практический журнал. Тезисы 4-й Российской конференции по фундаментальной онкологии. 2008. – Том 54, №2. С. 20.
- Демидов Д.В. Антиканцерогенное действие мелатонина в условиях экспериментального опухолевого роста. Актуальные проблемы патофизиологии / Демидов Д.В., Маньчева Т.А., Плотникова Н.А., Харитонова Т.В. // Тезисы XIV Межгородской конференции молодых ученых. СПб.: Изд-во СПбМАПО, 2008. С. 36-37.
- Маньчева Т.А. Изучение влияния антидиабетического бигуанида метформина на процессы опухолевого роста / Маньчева Т.А., Демидов Д.В., Харитонова Т.В. // Актуальные проблемы патофизиологии. Тезисы XIV межгородской конференции молодых ученых. СПб.: Изд-во СПбМАПО, 2008. С. 58-59.
- Демидов Д.В. Динамика процессов канцерогенеза, индуцируемого бенз(а)пиреном под влиянием мелатонина / Демидов Д.В., Маньчева Т.А., Плотникова Н.А., Кемайкин С.П., Харитонов С.В., Харитонова Т.В. // Российский биотерапевтический журнал. №1. Том 7. М.: Изд. группа РОНЦ, 2008. С. 8-9.
- Маньчева Т.А. Изучение влияния метформина на процессы морфогенеза опухолей дермы в условиях экспериментального опухолевого роста / Маньчева Т.А., Демидов Д.В., Плотникова Н.А., Кемайкин С.П., Харитонов С.В., Харитонова Т.В. // Российский биотерапевтический журнал. №1. Том 7. М.: Изд. группа РОНЦ, 2008. С. 9.
- Демидов Д.В. Изучение влияния мелатонина на процессы экспериментального бенз(а)пиренового опухолевого роста / Демидов Д.В., Маньчева Т.А., Плотникова Н.А., Харитонов С.В., Кемайкин С.П., Харитонова Т.В. // Материалы XVI межрегиональной научной конференции памяти академика Н.И. Бурденко «Актуальные вопросы современного практического здравоохранения». Пенза, 2008. С. 83.
- Маньчева Т.А. Мелатонин и метформин как противоопухолевые препараты в условиях экспериментального канцерогенеза / Маньчева Т.А., Демидов Д.В., Плотникова Н.А. // Материалы XVI межрегиональной научной конференции памяти академика Н.И. Бурденко «Актуальные вопросы современного практического здравоохранения». Пенза, 2008. С. 95.
- Демидов Д.В. Геропротекторный и антиканцерогенный эффект мелатонина и метформина в условиях экспериментального канцерогенеза / Демидов Д.В., Маньчева Т.А., Плотникова Н.А. // Здоровье и образование в XXI веке: Материалы IX Международной научно-практической конференции. Москва: Изд-во РУДН, 2008. С. 201.
- Демидов Д.В. Изучение влияния мелатонина на процессы уретанового и бенз(а)пиренового канцерогенеза в эксперименте / Демидов Д.В., Маньчева Т.А., Плотникова Н.А. // Материалы XIII научной конференции молодых ученых, аспирантов и студентов Мордовского государственного университета им. Н.П. Огарева: в 3ч. Ч.2: Естеств. науки. Саранск, 2008. С. 42-44.
- Маньчева Т.А. Исследование влияния метформина на динамику морфофункциональных изменений опухолей кожи в условиях экспериментального канцерогенеза / Маньчева Т.А., Демидов Д.В., Плотникова Н.А. // Материалы XIII научной конференции молодых ученых, аспирантов и студентов Мордовского государственного университета им. Н.П. Огарева: в 3ч. Ч.2: Естеств. науки. Саранск, 2008. С. 49-51.
- Демидов Д.В. Морфофункциональная характеристика дермы экспериментальных животных. Актуальные проблемы патофизиологии / Демидов Д.В., Маньчева Т.А., Харитонова Т.В., Кемайкин С.П., Харитонов С.В., Плотникова Н.А. // Тезисы XV Межгородской конференции молодых ученых. СПб.: Изд-во СПбМАПО, 2009. С. 32-33.
- Демидов Д.В. Влияние эндогенного гормона мелатонина на модели экспериментального канцерогенеза, индуцируемого уретаном и бенз(а)пиреном у мышей / Демидов Д.В., Маньчева Т.А., Харитонова Т.В, Плотникова Н.А., Кемайкин С.П., Харитонов С.В. // Российский биотерапевтический журнал. №2. Том 8. М.: Изд. группа РОНЦ, 2009. С. 7-8.
- Демидов Д.В. Морфометрическая динамика опухолей кожи у мышей в эксперименте / Демидов Д.В., Маньчева Т.А., Харитонова Т.В, Плотникова Н.А., Кемайкин С.П., Харитонов С.В. // Сборник научных трудов студентов и молодых ученых Всероссийской конференции с международным участием (Актуальные вопросы медицинской науки). Ярославль, 2009. С. 43-44.
- Маньчева Т.А. Ингибирующее влияние некоторых антиоксидантов на динамику опухолевого роста при экспериментальных неоплазиях / Маньчева Т.А., Демидов Д.В., Анисимов В.Н., Плотникова Н.А. // Здоровье и образование в XXI веке: Материалы X Международной научно-практической конференции. Москва: Изд-во РУДН, 2009. С. 1255.
- Демидов Д.В. Геропротекторный эффект метформина и мелатонина в условиях экспериментального канцерогенеза кожи у мышей / Демидов Д.В., Маньчева Т.А., Плотникова Н.А. // Пушковские чтения. Тезисы докладов IV научно-практической геронтологической конференции с международным участием, посвященной памяти Э.С. Пушковой. / Под ред. В.Н. Анисимова, А.Л. Арьева. – СПб., 2008. С. 202-204.
- Маньчева Т.А. Оценка противоопухолевой активности ряда антиоксидантов на модели экспериментальных неоплазий / Маньчева Т.А., Демидов Д.В., Анисимов В.Н., Плотникова Н.А., Харитонова Т.В, Харитонов, С.В., Кемайкин С.П. // Морфологические ведомости. Международный морфологический журнал. № 3-4. Москва, 2009. С. 92-96.
- Демидов Д.В. Использование мелатонина и метформина в качестве онко- и геропротекторов в условиях экспериментального канцерогенеза / Демидов Д.В., Маньчева Т.А. // Актуальные проблемы экспериментальной и клинической медицины: Материалы 67-й открытой научно-практической конференции молодых ученых и студентов с международным участием. – Волгоград, 2009. С. 219-220.
- Демидов Д.В. Влияние мелатонина на частоту, множественность и размеры опухолей кожи у мышей в условиях экспериментального канцерогенеза / Демидов Д.В., Маньчева Т.А., Плотникова Н.А., Анисимов В.Н. // Вопросы онкологии. Научно-практический журнал. Тезисы 5-й Российской конференции по фундаментальной онкологии. 2009. – Том 55, №2. С. 16.
- Демидов Д.В. Некоторые клинико-морфологические показатели экспериментальных неоплазий / Демидов Д.В., Маньчева Т.А., Харитонова Т.В. // III Международный молодежный медицинский конгресс. Санкт-Петербургские научные чтения – 2009. Тезисы докладов. СПб., 2009. С. 192.
- Маньчева Т.А. Влияние мелатонина и метформина на процессы перекисного окисления липидов при экспериментальных новообразованиях / Маньчева Т.А., Демидов Д.В., Анисимов В.Н., Плотникова Н.А., Харитонова Т.В. // Российский биотерапевтический журнал. №1. Том 9. М.: Изд. группа РОНЦ, 2010. С. 74.
- Демидов Д.В. Динамика показателей перекисного окисления липидов при канцерогенезе кожи у мышей, индуцируемом бензо(а)пиреном: влияние мелатонина и метформина / Демидов Д.В., Маньчева Т.А., Плотникова Н.А., Пашкевич И.В., Анисимов В.Н. // Вопросы онкологии. Научно-практический журнал. Тезисы 7-й Российской конференции по фундаментальной онкологии. 2011. – Том 57, №2. С. 22-23.
- Маньчева Т.А. Мелатонин и метформин подавляют пролиферативную активность и процессы ангиогенеза при канцерогенезе кожи, индуцируемом бензо(а)пиреном у мышей / Маньчева Т.А., Демидов Д.В., Плотникова Н.А., Анисимов В.Н. // Вопросы онкологии. Научно-практический журнал. Тезисы 7-й Российской конференции по фундаментальной онкологии. 2011. – Том 57, №2. С. 46-47.
- Маньчева Т.А. Мелатонин и метформин угнетают канцерогенез кожи и перекисное окисление липидов, индуцируемые бенз(а)пиреном у самок мышей / Маньчева Т.А., Демидов Д.В., Плотникова Н.А., Харитонова Т.В., Пашкевич И.В., Анисимов В.Н. // Бюллетень экспериментальной биологии и медицины. 2011. – Том 151, № 3. С. 339-343.
- Mancheva T.A. Morphological and functional patterns of melatonin and metformine oncostatic actions in experimental tumors / Mancheva T.A., Demidov D.V., Plotnikova N.A.// University of Northern California, Biomedical engineering, Santa Rosa. Collection of Pappies by conference «The Biology of Cancer: Microenvironment, Metastasis & Therapeutics meeting». 2011. – P. 123-127.
- Демидов Д.В. Динамика перекисного окисления липидов под воздействием препаратов антиоксидантного типа действия в условиях экспериментального опухолевого роста / Демидов Д.В., Плотникова Н.А.// Современные технологии в медицине. 2011. – №4. С 14-17.
