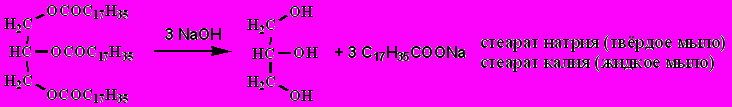1. Изомерия и номенклатура
| Вид материала | Документы |
Содержание2. Методы получения. 3. Химические свойства. Отношение к нагреванию Кислоты ароматического ряда Синтетические волокна Непредельные карбоновые кислоты 2-метилпропеновая кислота |
- Название документа, 76.51kb.
- Домашнее задание Примечание 37. Спирты: классификация, номенклатура, изомерия. Коллекция, 162.61kb.
- Номенклатура полимеров и сополимеров, 89.7kb.
- Номенклатура органических соединений. Номенклатура – совокупность правил составления, 82.43kb.
- Лекция 1 систематическая номенклатура (ганча-видмана) моноциклических соединений. Номенклатура, 342.04kb.
- Разграфка и номенклатура карт разграфка карт, 55.1kb.
- Методические рекомендации по применению номенклатуры дел Южного федерального университета, 60.7kb.
- Порядок составления номенклатуры дел, 135.26kb.
- А14 Теория строения органических соединений. Изомерия структурная и пространственная., 56.23kb.
- 1. Номенклатура медицинских услуг (далее Номенклатура) представляет собой перечень, 6016.43kb.
Карбоновые кислоты
1. Изомерия и номенклатура.
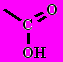 CnH2n+1COOH
CnH2n+1COOHкарбоксильная
Муравьиная кислота С1 HCOOH – метановая
Уксусная С2 CH3COOH – этановая
Пропионовая С3
Масляная С4
Валериановая С5
Капроновая С6
Строение карбоксильной группы
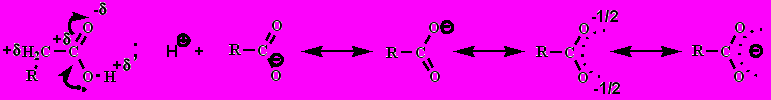
Водородная связь прочнее, чем в спиртах
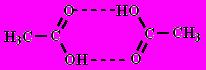 НСООН tкип = 101С, CH3COOH tкип = 118С
НСООН tкип = 101С, CH3COOH tкип = 118С2. Методы получения.
- Окисление органических соединений:
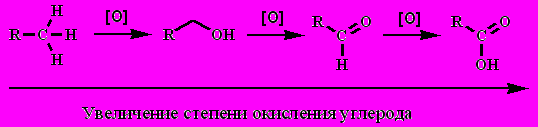
(спирты, альдегиды, кетоны – их окисление дает кислоту)
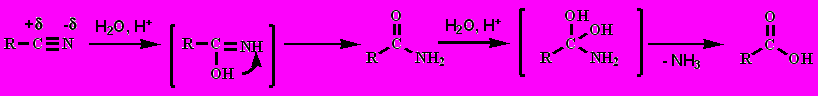
- Гидролиз нитрилов:
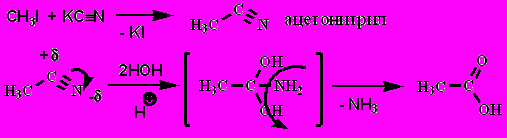
Гидролиз соединений следующего типа (где X, Y, Z – любые гетероатомы при гидролизе дают кислоты)
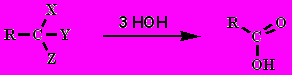
- Действие СО2 на Mg-органические соединения
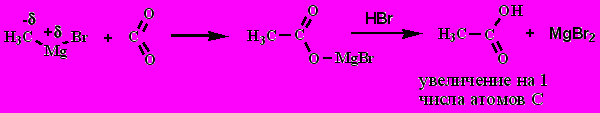
3. Химические свойства.
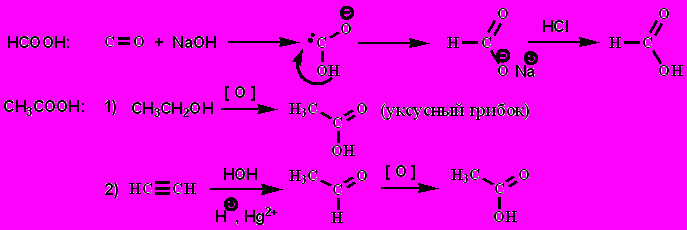
- Солеобразование
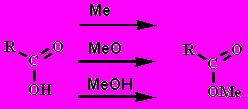
2. Этерификация
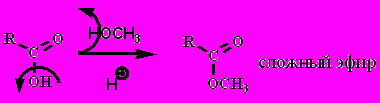
3. Действие галогенирующих агентов: PX3; PX5; SOCl2 – галогенангидриды кислоты (алкакоил галогениды)
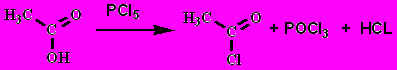
4. При нагревании аммонийных солей получаются амиды
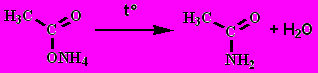
5. Ангидриды кислот образуются при нагревании смеси галогенангидрида и соли кислоты
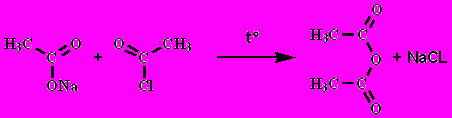
6. Пиролиз солей щелочных металлов
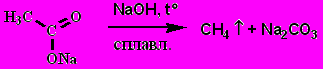
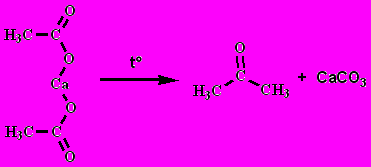
7. Сухая перегонка кальциевых и бариевых солей (кроме муравьиной кислоты) дает кетоны
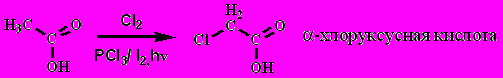
8. Галогенирование в - положение ( Гель- Вольфгард- Зелинский)
9. Окисление: в основном устойчивы к действию окислителей (кроме муравьиной, и если в -положении есть третичный атом углерода)
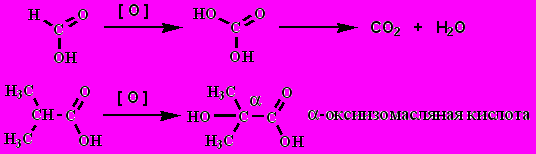
В природе окисление происходит в основном в -положение. В организме больных диабетом:
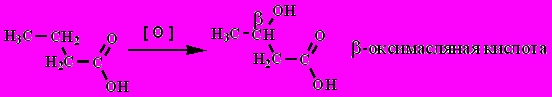
10. Декарбоксилирование:
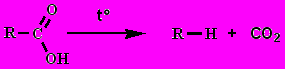
Отдельные представители:
Свойства производных карбоновых кислот
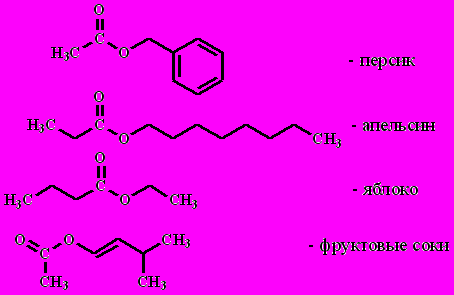
1. Эфиры
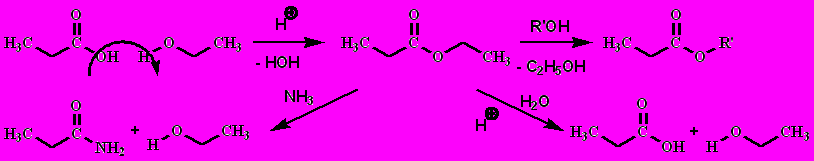
Эфиры легче получать из ангидридов кислот или хлорангидридов.
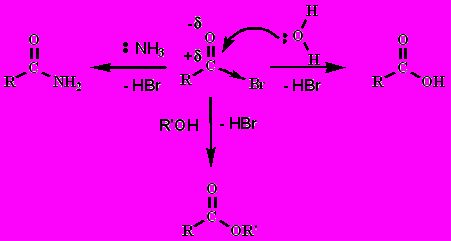
2. Галогенангидриды
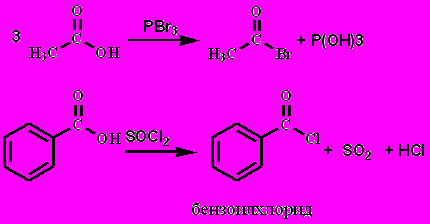
Связь С-Hal сильнополяризована, поэтому легко реагирует с многими нуклеофилами:
3. Ангидриды
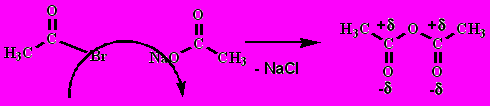
здесь С-О тоже сильнополяризована – активно реагирует с нуклеофилами:
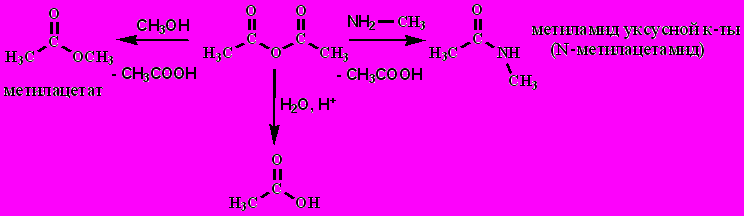
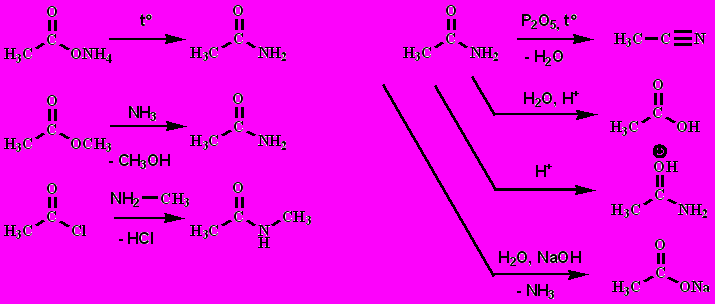
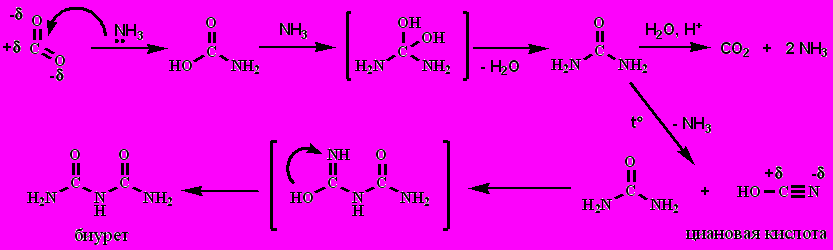
4. Амиды
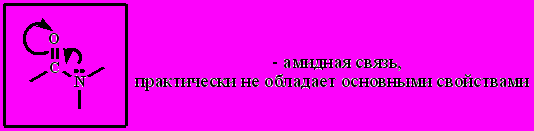
Мочевина - диамид угольной кислоты
5. Нитрилы
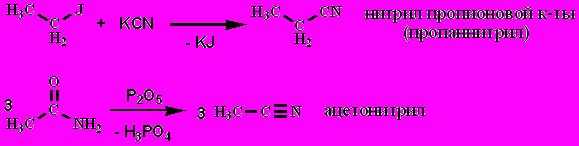
Нитрилы - еще более слабые основания, чем амиды:
Дикарбоновые кислоты
HOOC-COOH- щавелевая
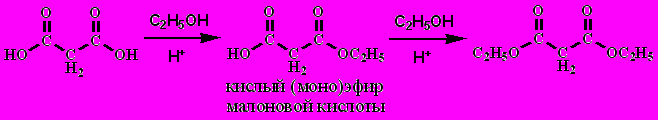
HOOC-CH2-COOH- малоновая
-(CH2)2- янтарная
-(CH2)3- глутаровая
-(CH2)4- адипиновая
Отношение к нагреванию
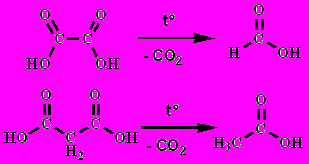
Щавелевая и малоновая кислоты при нагревании легко теряют CO2 (декарбоксилируются):
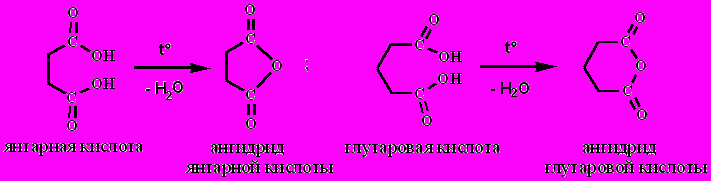
Янтарная (С4) и глутаровая (С5) кислоты при нагревании теряют воду, давая циклические ангидриды:
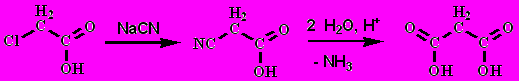
Общий метод синтеза дикарбоновых кислот:
окисление циклических кетонов, или оксикислот:
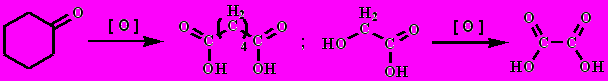
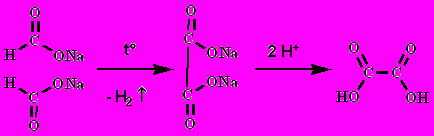
щавелевую:
Кислоты ароматического ряда
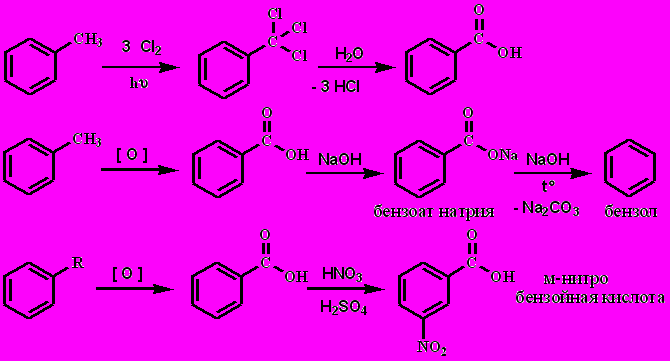
Бензол – хороший антисептик; бензоат натрия используется при консервировании.
Фталевая кислота:
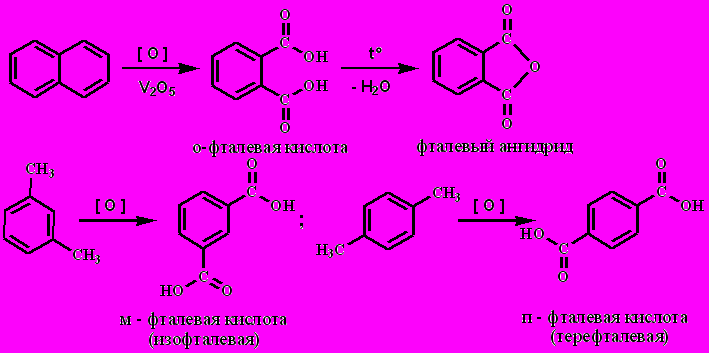
Синтетические волокна
(полиамиды натуральные – шерсть, шёлк)
синтетические аналоги.
Найлон 6,6 (анид): адипиновая кислота и гексаметилендиамин
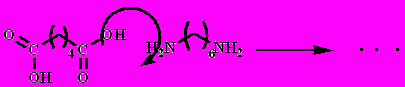
Капрон (перлон): поликонденсация -аминокапроновой кислоты
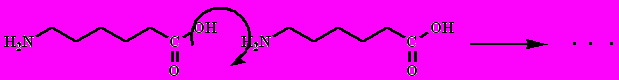
Лавсан (терилен – анг., дакрон – США): терефталевая кислота и этиленгликоль (эфир):
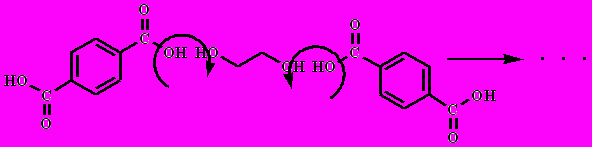
Непредельные карбоновые кислоты
Простейшая: акриловая (пропеновая)
Получение:
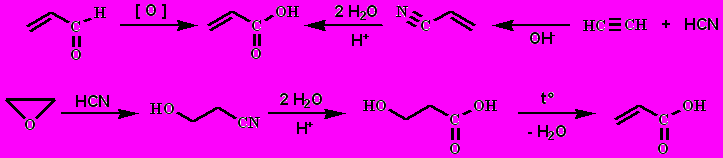
Акриловая кислота легко полимеризуется с образованием полиакриловой кислоты, из акрилонитрила образуется полиакрилонитрил (заменитель шерсти).
2-метилпропеновая кислота (метакриловая)
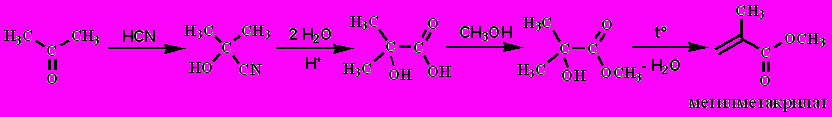
При полимеризации метилметакрилата образуется полимер имеющий распространённое название плексиглас или оргстекло.
малеиновая и фумаровая кислоты:
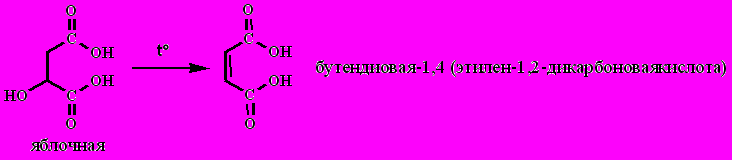
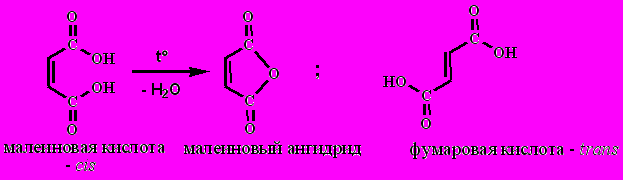
Непредельные ароматические кислоты
Цис- и транс- коричная (-фенилакриловая, 3-фенилпропеновая)
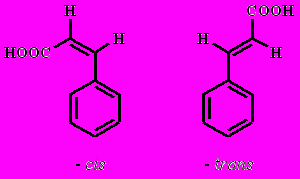
Липиды-
к ним относят жиры и жироподобные вещества растительного и животного происхождения; простые липиды жиры; сложные липиды фосфатиды при гидролизе дают глицерин, карбоновую кислоту и фосфорную кислоту
Жиры: природные животные и растительные жиры (растительные обычно называют маслами) состоят главным образом из глицеридов:
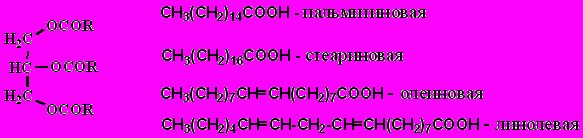
R разные или одинаковые; в природе большинство жиров содержит 2 или 3 различных остатка карбоновых кислот.
Химические свойства
- Гидролиз
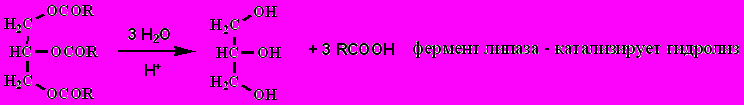
- Реакции присоединения: