Разработка технологий минимизации техногенного воздействия на окружающую среду предприятий по добыче и переработке рудного золота
| Вид материала | Автореферат |
| Интенсификация процесса гальванохимической деструкции токсичных органических соединений при фото- и сонохимической активации рад |
- Горнорудный комплекс как основной фактор техногенного воздействия на окружающую среду, 175.33kb.
- Доклад заместителя министра, 39.11kb.
- Областной экологический конкурс «эко-предприятие 2011» (далее − Конкурс) проводится, 53.78kb.
- Общие требования в области охраны окружающей среды при эксплуатации предприятий, 375.47kb.
- «Экологическое воздействие производственных процессов на окружающую среду», 44.68kb.
- «Воздействие техносферы на окружающую среду», 66.84kb.
- Предупреждение хищений и незаконного оборота золота при его добыче и переработке, 307.41kb.
- Справка о результатах деятельности ОАО «Новолипецкий металлургический комбинат», 30.79kb.
- Третья нефтегазовая конференция «экобезопасность 2012», 209.68kb.
- Вторая нефтегазовая конференция «экобезопасность 2011», 135.77kb.
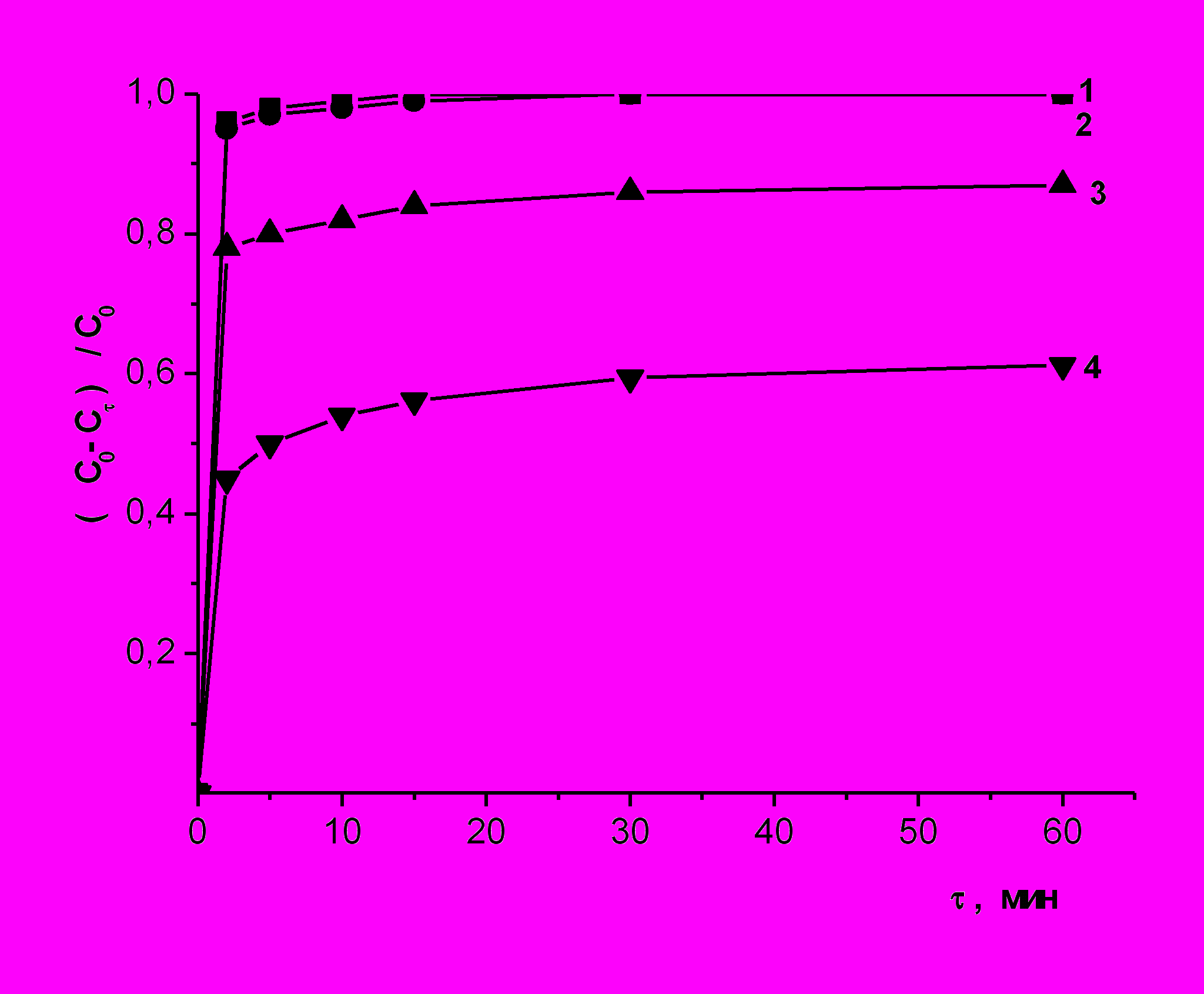
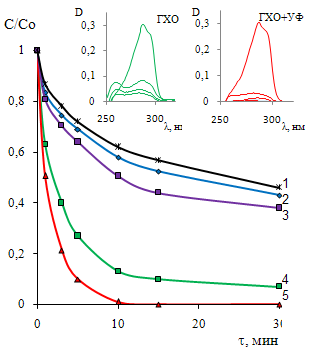
Выявлена роль наиболее распространенных в составе сточных вод неорганических анионов (хлоридов и сульфатов) на процессы ГХО. Совокупность полученных экспериментальных данных свидетельствует о возможности реализации процесса гальванохимического окисления в среде близкой к нейтральной (рН 5,8) с сохранением высокой степени конверсии исходного субстрата (96-100%) в присутствии хлорид- ионов в обрабатываемом растворе (рис.6). Интенсификация окислительных процессов обусловлена, прежде всего, формированием при электрохимических превращениях частиц активного хлора, повышением электропроводности раствора и увеличением степени диспропорционирования пероксида водорода, а также вследствие активации процессов окисления анодной составляющей загрузки с образованием локальных кислых областей на ее поверхности.
Впервые показана целесообразность снижения продолжительности обработки методом ГХО в гальванокоагуляционном реакторе за счет инерционности протекания реакций радикально-цепного окисления без контакта с железоуглеродной загрузкой, так называемого постэффекта (рис.6). При увеличении времени основного процесса ГХО с 1 до 5мин реализуются оптимальные условия для глубокой конверсии фенола в менее кислых средах (рН=5.8). По данным ВЭЖХ исходный фенол спустя 30 минут не обнаружен (рис.7, кривая 3).Технологически это позволит значительно увеличить производительность устройства для реализации метода ГХО или уменьшить размеры гальванокоагуляционного модуля за счет снижения времени контакта с активной загрузкой.
 |  |
| Рис.6. Деструкция фенола при одноминутной обработке (1,3) и соответствующий постэффект (2,4) при различных рН: 1, 2–без добавок, 3, 4 – в присутствии хлорид-ионов, 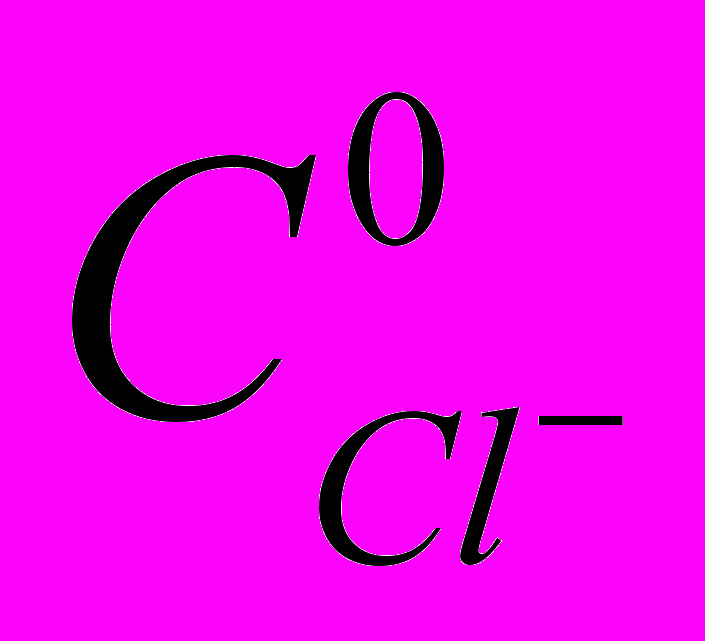 = 1,71 ммоль/л, tп/эфф.=30 мин. = 1,71 ммоль/л, tп/эфф.=30 мин. | Рис.7. Хроматограммы растворов фенола - исходного (1), после пятиминутной обработки (2) и с последующим отстаиванием в течение 30 мин (3), 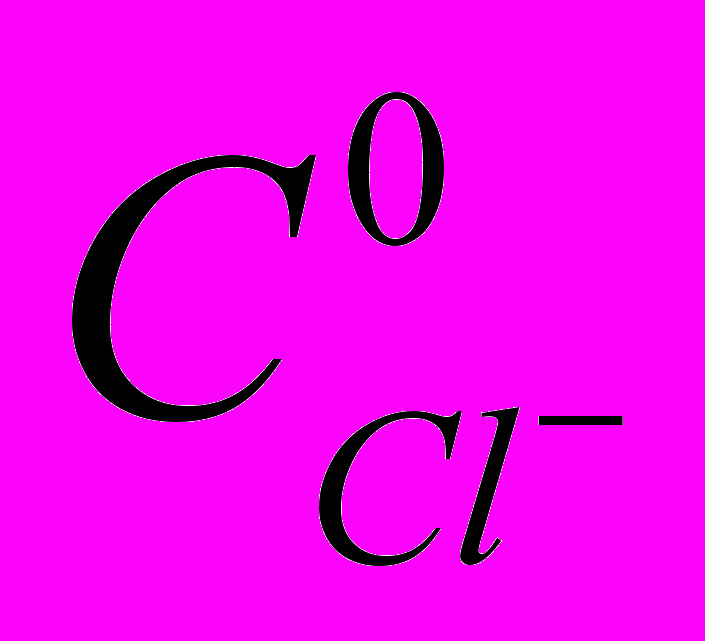 = 1,71 ммоль/л, рНисх 5,8 = 1,71 ммоль/л, рНисх 5,8 |
Фотоактивация процесса ГХО способствует повышению скорости окисления фенолов и степени их конверсии. При этом происходит дополнительное образование активных форм кислорода, преимущественно гидроксильных радикалов, как за счет разложения пероксида водорода, так и за счет восстановления Fe3+из неактивных Fe3+-интермедиатов.
Практически полное окисление происходит при молярном соотношении СПВ: С2-ХФ≈ 3:1, что составляет 22 % от стехиометрически необходимого для полной минерализации. По эффективности рассмотренные окислительные системы можно выстроить в следующий ряд: УФ/ГХО> ГХО>>УФ (рис.8,9). Сочетание УФ - облучения и ГХО приводит к возникновению синергического эффекта и увеличению начальной скорости реакции окисления ХФ почти в два раза. По начальной скорости и степени конверсии в рассматриваемых окислительных системах фенолы можно выстроить в следующий ряд: 2-ХФ ≥ 4-ХФ > 2,4-ДХФ > Фенол. Это согласуется с имеющимися литературными данными о величинах констант скоростей реакции взаимодействия гидроксильных радикалов с фенолами.
Для увеличения эффективности использования УФ излучения и осуществления процессов в динамических условиях разработано устройство для осуществления комбинированных процессов фотогальванохимического окисления стойких органических соединений в проточном трубчатом фото-реакторе пленочного типа.
 |  | |
| Рис. 8. Сравнительная оценка окислительных методов. С0 = 0,156 мМ, СПВ=0,468мМ, рНисх 3, T= 20oC, время обработки 15 минут | Рис. 9. Деструкция 2,4-ДХФ с использованием различных окислительных систем в проточном трубчатом реакторе пленочного типа: 1 - УФ-облучение (УФ), 2 – ПВ, 3 – УФ+ПВ, 4 – ГХО, 5 – ГХО+УФ. С0=0,12 мМ, СПВ=0,36 мМ, рНисх 3. | |
Таким образом, разработанный нами новый способ очистки от хлорированных фенолов, позволяющий реализовать эффективное окисление при минимальном расходе окислителя за счет интенсификации процесса, обеспечиваемой дополнительным УФ-облучением, может быть рекомендован для использования в процессах очистки сточных вод от трудноокисляемых органических загрязнителей.
Для интенсификации процессов окислительной деструкции в условиях низконапорной гидродинамической кавитации (НГДК) использовали генератор гидродинамических колебаний струйного типа (рис.10).
 | 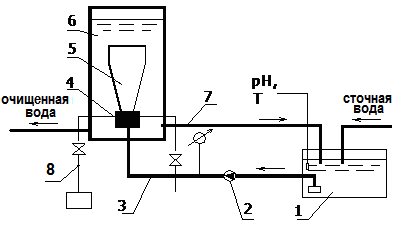 |
| Рис.10. Схема работы устройства для очистки производственных сточных вод: 1- усреднитель; 2- подающий насос; 3- подающая линия; 4- гидродинамический кавитатор струйного типа; 5- реактор со взвешенным слоем гальванокоагуляционной загрузки; 6- реакционная зона аппарата; 7- циркуляционный контур; 8- подача окислителя. | |
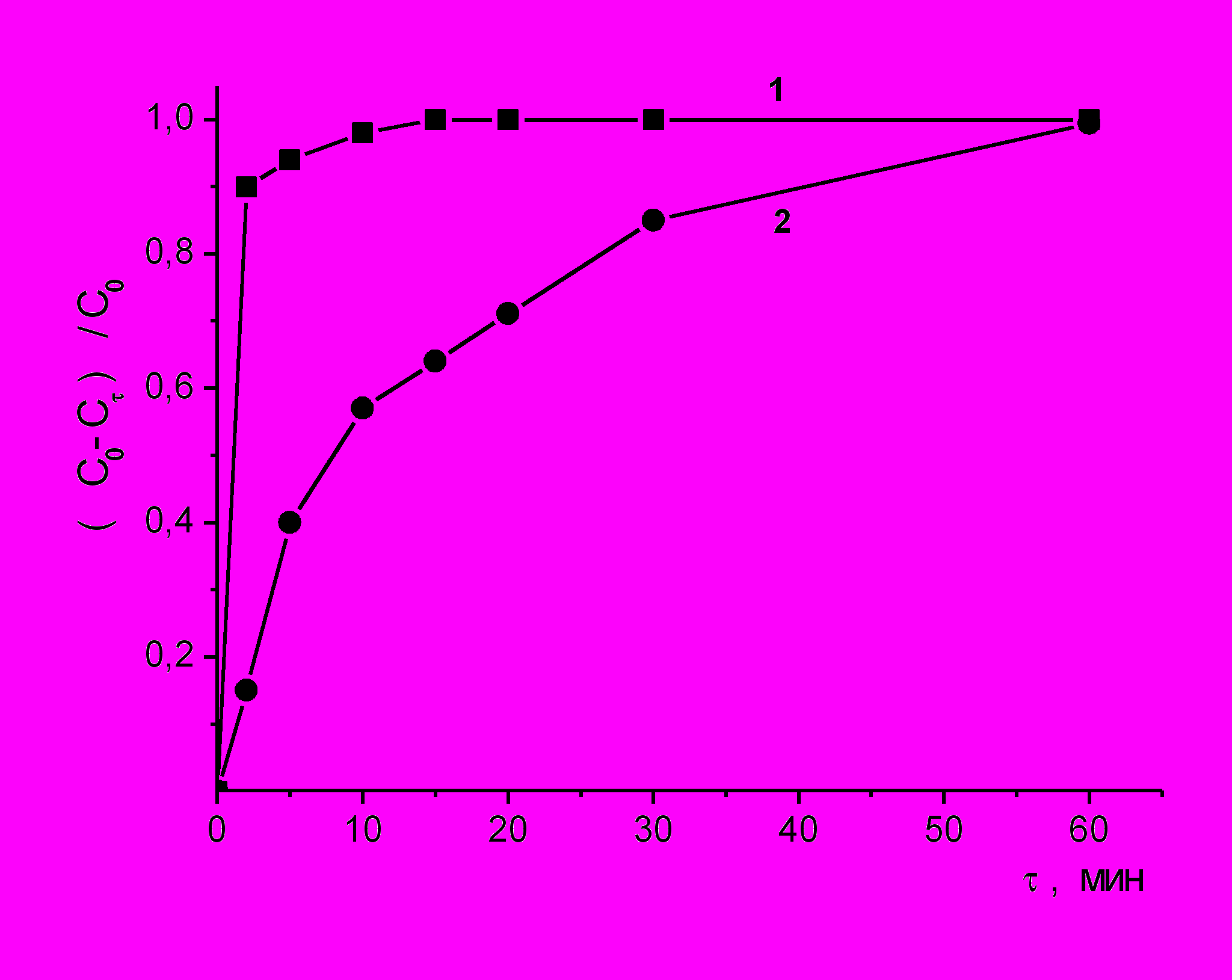
При осуществлении комбинированного метода окисления (ГХО + кавитация) скорость окисления возрастает в 1.6 раза и в течение первых пяти минут в условиях развитой кавитации (P=2.5 атм, число кавитации σ=0.47) при стехиометрическом соотношении [Ph]:[Н2О2]=1:14 достигается полная конверсия фенола (рис. 11). При расходе окислителя 50 % от стехиометрически необходимого полная конверсия субстратов достигается в течение 10 минут.
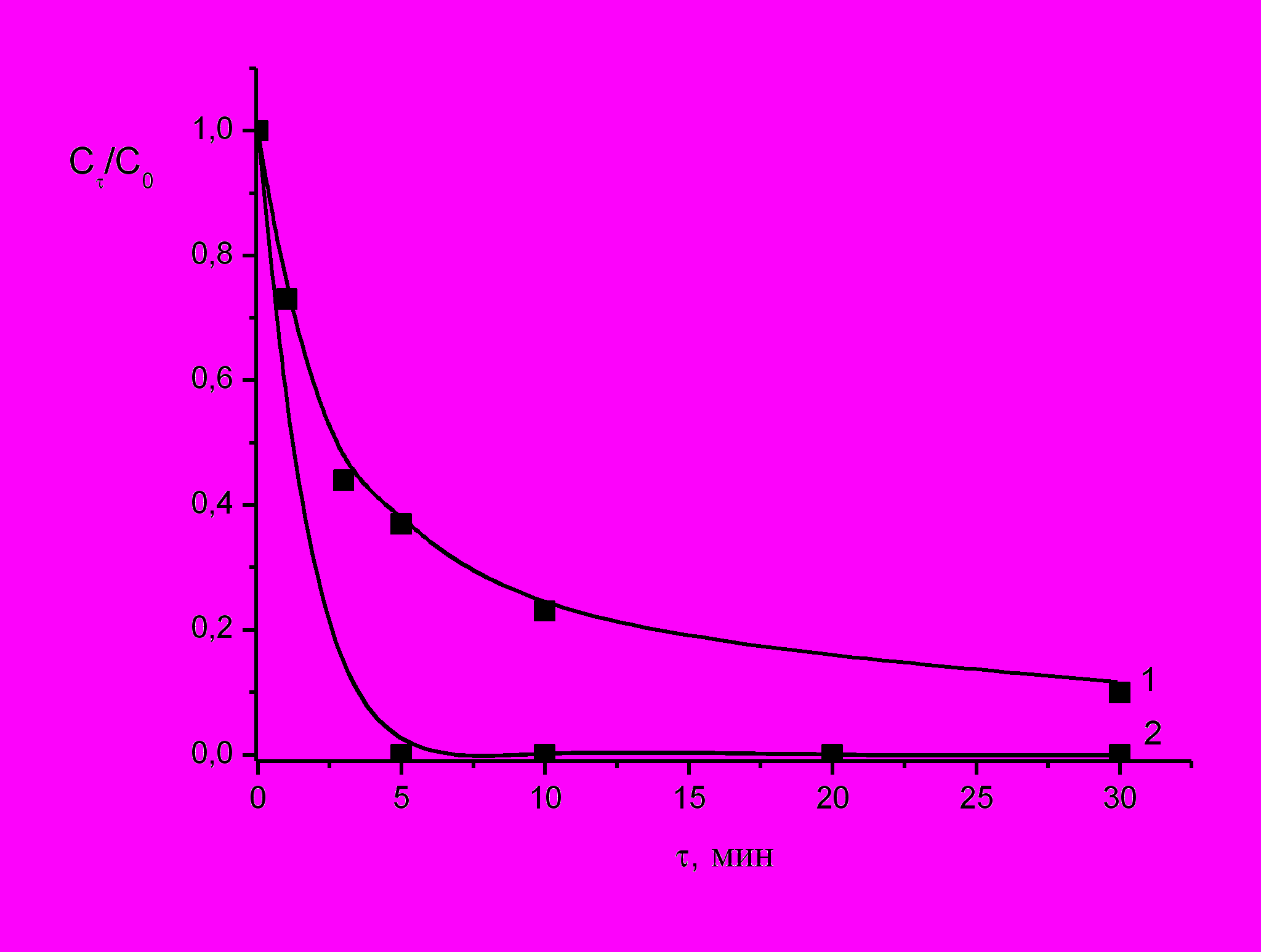 | Рис. 11. Кинетические кривые изменения концентрации фенола в условиях ГХО (1) и ГХО в кавитирующем потоке (2): С0= 2,13∙10-4 моль·л-1, СН2О2 =3∙10-3 моль·л-1, рНисх4, Т=20˚С. |
Кавитация сопровождается ростом давления и температуры на границе жидкости и микрополостей (кавитационных пузырьков) при их схлопывании, которые приводят к возникновению синергического эффекта, обусловленного активацией молекул субстратов, смеси пероксида водорода и ионов железа, образованием дополнительных активных частиц при прямом разложении воды. Дополнительное образование ОН-радикалов в условиях НГДК экспериментально подтверждено методом химической дозиметрии с использованием реакции гидроксилирования бензола в кислой среде.
К тому же кавитация способствует непрерывному обновлению диффузионного пограничного слоя путем создания нестационарной гидродинамической обстановки на границе раздела фаз и увеличению эффективности массообменных процессов, что в случае ГХО предотвращает пассивацию и обеспечивает высокую интенсивность окисления железосодержащей составляющей загрузки. По результатам экспериментальных работ впервые предложен способ реализации гальванохимического окисления органических примесей в кавитирующем потоке со взвешенным слоем активной загрузки.
Разработка метода каталитической деструкции серосодержащих соединений оборотных и сточных вод (на примере тиоцианатов, тиосульфатов) в присутствии пероксида водорода
Тиоцианаты SCN- (роданиды) содержатся в сточных водах предприятий, использующих цианидную технологию извлечения золота из сульфидных руд или флотоконцентратов. Особенностью тиоцианатов является их токсичность для аквасистем (ПДКрыб.-хоз. = 0.1 мг/л) и устойчивость к разложению большинством методов, применяемых для обезвреживания цианидов. С учетом того, что до 50% цианида безвозвратно теряется за счет образования тиоцианатов, проблема регенерации цианида из тиоцианатных растворов носит не только экологический, но и экономический характер.
Из комбинированных методов для практической реализации весьма привлекательной и перспективной является окислительная деструкция пероксидом водорода, в присутствии катализаторов - металлов переменной валентности (Fe3+, Cu2+) реализуются условия для проведения редокс-каталитических процессов окисления тиоцианатов. В кислой среде возможно реализовать процесс «деструкция – регенерация»: окисление тиоцианатов с выделением из раствора цианистого водорода и дальнейшим его поглощением щелочами. Окисление SCN- при избытке Н2О2 в кислой среде (рН ≤ 4) описывается суммарной реакцией:
3Н2О2 + SCN- = HSO4- + HCN + 2H2O
Сравнительное изучение кинетики окисления тиоцианатов пероксидом водорода в присутствии ионов железа (II,III) показало, что скорость окисления SCN- в присутствии Fe3+ в среднем в 1,5 раза выше, чем в экспериментах с использованием Fe2+ в качестве катализатора (рис. 12).
Полученные данные по скоростям окисления тиоцианатов пероксидом водорода в присутствии Fe2+ и Fe3+, а также отсутствие индукционного периода на кинетических кривых, позволяют сделать вывод о том, что окисление SCN- происходит не по «классической» схеме с участием реагента Фентона, а через образование промежуточных комплексных соединений.
Установлены оптимальные условия полной конверсии тиоцианатов до стадии образования цианистоводородой кислоты в присутствии ионов Fe3+: рН≤ 3, мольные соотношения [H2O2]:[SCN-]:[Fe3+]=3:1:0.2.
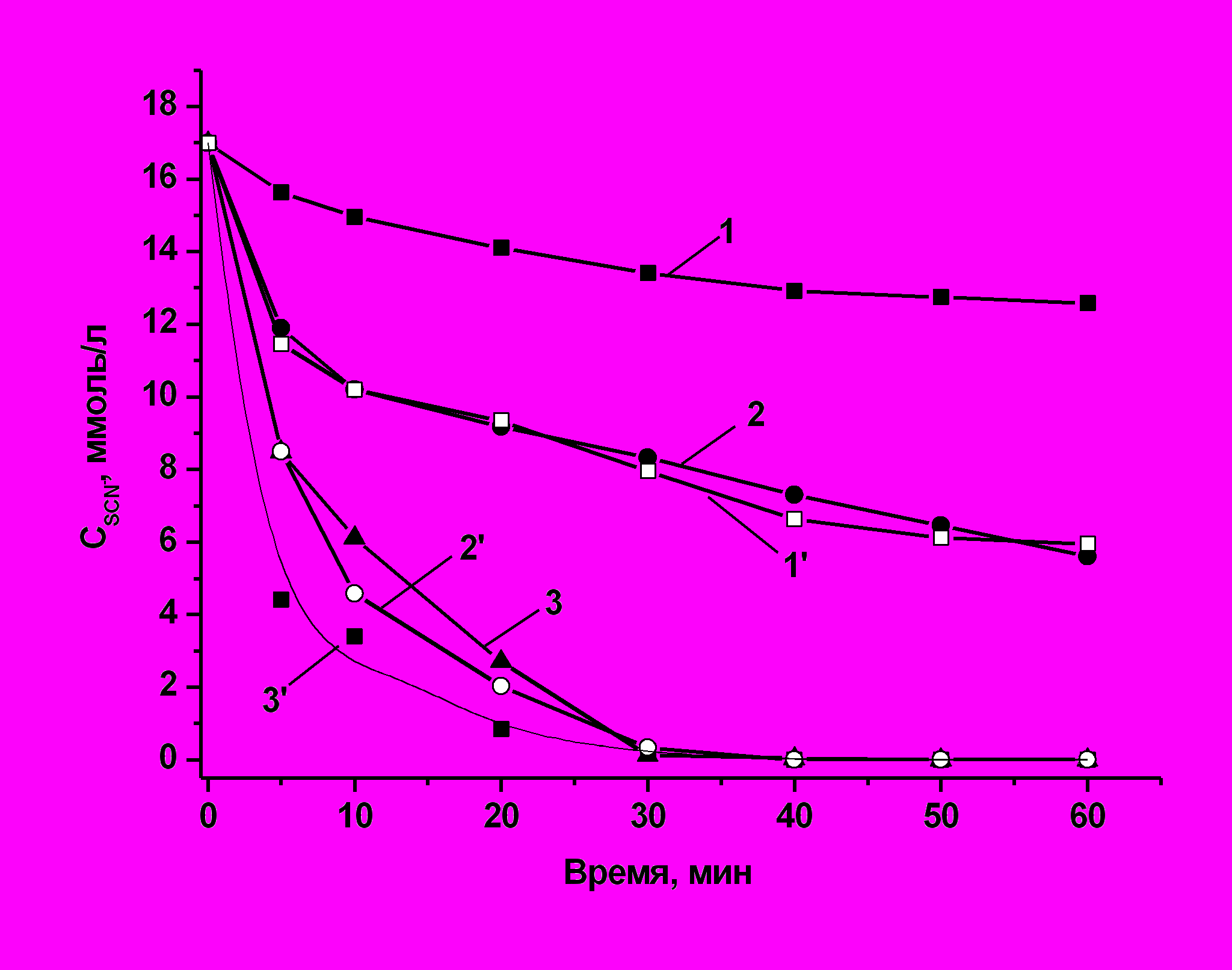 | Рис. 12. Кинетические кривые окисления SCN- пероксидом водорода при pH = 2.8 в присутствии ионов Fe2+ и Fe3+; [SCN-]0 = 17 ммоль/л, [H2O2]0 = 51 ммоль/л. 1, 2, 3 – [Fe2+] = 0.36, 1.8, 3.6 ммоль/л, соответственно; 1`, 2`, 3` – [Fe3+] = 0.36, 1.8, 3.6 ммоль/л, соответственно. |
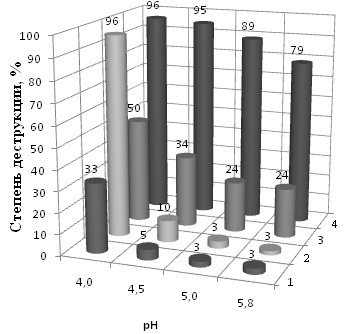
Мешающее влияние на скорость окисления тиоцианатов оказывают тиосульфаты, обычно присутствующие в отработанных технологических растворах и сточных водах цианирования сульфидных руд в заметных количествах (рис.13). Более полного и быстрого окисления SCN- в растворе, содержащем S2O32-, можно добиться, увеличивая концентрацию окислителя в реакционной смеси, либо вводя в состав катализатора ионы Cu2+, блокирующие мешающее влияние тиосульфатов (табл. 3).
| ||
| |
Поскольку тиосульфаты в присутствии ионов Fe3+ и Cu2+ окисляются с высокой скоростью и достаточно полно, можно утверждать, что лимитирующей стадией в данной системе{(SCN- + S2O32-) + H2O2}, как было определено и в рассмотренной цианидсодержащей - {(SCN- + CN-)+ H2O2}, является реакция окисления тиоцианатов.
Таблица 3
Зависимость начальной скорости реакции и эффективности окисления SCN- в присутствии S2O32-от концентрации Fe3+
| Условия | [Fe3+], ммольл-1 | W0, ммоль л-1мин-1 | [S2O32-], ммольл-1 | Эффективность окисления, % | |
| SCN- | S2O32- | ||||
| [SCN-]o= 17.2 ммольл-1 [Cu2+]= 0.78 ммоль·л-1 pH = 2.8 | 0 | 0.2 | 4.5 | 9.5 | |
| 2.7 | 1.8 | 94.0 | 95.5 | ||
| 3.6 | 2.4 | 100 | 100 | ||
| 4.5 | 2.6 | 100 | 100 | ||
| 3.6 | 1.6 | 9.0 | 88 | 85.9 | |
Прим.: эффективность процесса рассчитана через 30 мин. обработки.
Согласно полученным данным оптимальными условиями можно считать: рН<3, мольные соотношения [H2O2]:[SCN-]=3:1, [SCN-]:[Fe3+]: [Cu2+]=5:1:0,2. Сравнение процессов окисления серосодержащих соединений SCN- и S2O32- при их совместном присутствии пероксидом водорода с использованием катализаторов Fe3+, Cu2+ и каталитической системы {Fe3++ Cu2+}, а также расчет синергического индекса свидетельствует о высокой эффективности применения комбинированного окислительного метода, заключающегося в обработке воды пероксидом водорода в присутствии ионов железа (III) и меди (II) для обезвреживания серосодержащих соединений сточных или оборотных вод ЗИФ.
К числу перспективных комбинированных железопероксидных методов окисления тиоцианатов можно отнести и разработанный нами метод гальванохимического окисления. Механизм ГХО тиоцианатов пероксидом водорода в кислой среде в большей степени определяется рассмотренными выше особенностями взаимодействия SCN- и Н2О2 в присутствии ионов железа. Окисление тиоцианатов в процессе ГХО также наиболее эффективно протекает в кислой среде, при оптимальном рН≤ 3 эффективность окисления достигает 100%.
При увеличении исходной концентраций тиоцианатов степень конверсии SCN- в процессе ГХО снижается вследствие того, что в системе Н2О2 - Fe2+ГХО(Fe3+ГХО) – SCN- с увеличением исходных значений [SCN-] концентрации генерированных ионов железа недостаточно (рис.14). Сравнительные эксперименты по окислению тиоцианатов в различных железопероксидных системах показали, что при прочих равных условиях при ГХО наблюдается резкий рост начальной скорости окисления, что приводит к существенному снижению продолжительности окисления SCN- по сравнению с окислением в гомогенной системе {Fe3+ -H2O2} (рис.15). Это объясняется спецификой введения катализатора в реакционную смесь, т.к. гальванопара железо-кокс при контакте с водой и воздухом одновременно активирует восстановление кислорода и непрерывно генерирует ионы Fe (II) и (III), а также может косвенно свидетельствовать о дополнительном генерировании пероксида водорода за счет двухэлектронного восстановления растворенного кислорода, что согласуется с литературными данными по непрямому электрохимическому окислению тиоцианатов.
|
На основании проведенных исследований разработан способ очистки тиоцианатсодержащих сточных и оборотных вод, заключающийся в пропускании воды с предварительно введенным пероксидом водорода через гальванокоагуляционную загрузку, представляющую собой смесь из равных объемных частей железной стружки и кокса, с одновременной подачей кислорода воздуха. Анализ полученных результатов свидетельствует о том, что метод гальванохимического окисления позволяет реализовать процесс эффективной деструкции тиоцианатов в концентрационном диапазоне CSCN- ≤ 100 мг/л.
- Разработка и внедрение комплексной технологии обезвреживания жидких отходов гидрометаллургической переработки золотосодержащих концентратов с регенерацией из растворов ценных компонентов позволяют повысить экономическую эффективность производства и обеспечить стабильность основных технологических процессов.
Анализ литературных данных и патентных источников, посвященных проблемам очистки циансодержащих растворов золотоперерабатывающих предприятий, свидетельствует о перспективности комплексных технологий, включающих комбинацию регенерационных и деструктивных методов очистки сточных вод. При этом, применение на первом этапе регенерационной технологии, включающей, как правило, AVR-процесс, выгоднее, чем технологии полной окислительной деструкции токсичных примесей.
На основании полученных результатов разработана комплексная технология обезвреживания оборотных растворов цианидного выщелачивания золота из сульфидных флотоконцентратов с реализацией AVR- процесса. Система регенерации цианидов из оборотных растворов ЦГМ (рис.16) включает их подкисление серной кислотой, отдувку HCN в ЦБА, поглощение цианистого водорода щелочным раствором в ЦБА второй ступени и отделение образовавшихся при подкислении растворов осадков соединений тяжелых металлов. После извлечения цианидов в виде HCN и ионов тяжелых металлов в виде осадков комплексных соединений вода может быть доочищена одним из окислительных методов.
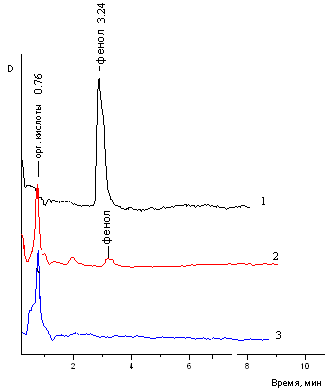
Результаты регенерационного извлечения NaCN из оборотных растворов процесса выщелачивания золотосодержащих флотоконцентратов методом AVR показали, что при отдувке в ЦБА из подкисленных до значений pH ~ 2.8 – 3.6 растворов удается удалить практически полностью цианиды в виде HCN (93-97%), но при этом тиоцианаты удаляются лишь частично.
В тех случаях, когда в обработанных по AVR-методу растворах в значительных количествах остаются тиоцианаты более выгодно проводить процесс «деструкция-регенерация» с получением дополнительного количества цианида. Конверсию тиоцианатов можно осуществить разработанным нами методом каталитического окисления пероксидом водорода. Если раствор после AVR-процесса содержит незначительные концентрации тиоцианатов (≤ 100 мг/л), но в нем присутствуют остаточные концентрации цианидов и ионов металлов (никеля, меди и серебра), то он может быть направлен на гальванокоагуляционную доочистку.
 |
| Рис. 16. Система регенерации цианида: 1 – промежуточная емкость; 2 – насос; 3 – насос-дозатор; 4 – бак для кислоты; 5 – смеситель; 6 – pH-метр; 7 – ЦБА-десорбер; 8 – ЦБА-абсорбер; 9 – вентилятор; 10 – вакуум-насос; 11 – гидравлический затвор; 12 – бак для щелочного абсорбента; 13 – тонкослойный отстойник; 14 – фильтр-пресс |
С учетом полученных результатов, свидетельствующих о значительной интенсификации массообменных процессов в ЦБА при реализации AVR-процесса и высокой эффективности процесса каталитической деструкции тиоцианатов пероксидом водорода, было предложено два варианта принципиальной технологической схемы обезвреживания растворов цианирования – с финишным окислением пероксидом водорода (рис.17) или гипохлоритом кальция. На руднике «Холбинском» ОАО «Бурятзолото» (Восточные Саяны, Бурятия) были проведены производственные испытания предлагаемых к полномасштабному внедрению вариантов технологической схемы. Для реализации AVR-процесса использовали два ЦБА (ЦБА 2–6 T - десорбер и ЦБА 3-6T -абсорбер) производительностью по обезвреживаемому раствору 2,5 м3/час каждый. По результатам производственных испытаний в среднем из каждого метра кубического оборотной воды ЦГМ было получено до 1- 1,2 кг NaCN. Цианистый водород в течение всего времени производственных испытаний поглощался 4-6% раствором NaOH. Каталитическое окисление тиоцианатов после проведения AVR процесса позволяет вернуть в производство дополнительное количество NaCN и полностью отказаться от применения гипохлорита кальция на последней стадии обезвреживания. Однако, для того, чтобы полностью задействовать всю цепь аппаратов имеющейся в ЦГМ аварийной системы обезвреживания для финишной доочистки растворов был принят метод щелочного хлорирования, с применением гипохлорита кальция. По результатам производственных испытаний институтом «Сибгипрозолото» (г. Новосибирск) выполнен рабочий проект реконструкции ЦГМ.
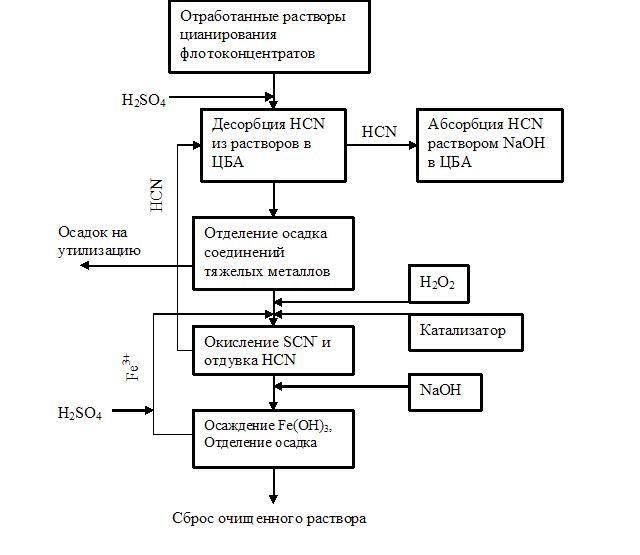 | |
| Рис. 17.Технологическая схема обезвреживания оборотной воды ЦГМ с отдувкой HCN в ЦБА и финишным окислением пероксидом водорода | |
 | Рис. 18. Отделение обезвреживания цеха гидрометаллургии рудника «Холбинский» ОАО «Бурятзолото» производительностью 500 м3/сут, узел отдувки – поглощения цианида в ЦБА. |
В 2005 году осуществлено полномасштабное внедрение технологии обезвреживания оборотных растворов ЦГМ с отдувкой и поглощением HCN и финишным окислением остаточных цианидов и роданидов гипохлоритом кальция производительностью 20 м3/час (рис. 18). Расчет эксплуатационных затрат на обезвреживание цианидсодержащих растворов по двум схемам: стандартной, включающей щелочное хлорирование, и схеме, предусматривающей перед хлорированием извлечение и абсорбцию цианистого водорода, показал, что введение процесса регенерации цианида в стандартную технологическую схему обезвреживания с использованием гипохлорита кальция позволяет сократить эксплуатационные затраты в 3,2 раза.