Тема 12. Методика изучения темы
| Вид материала | Учебник |
- Закон и периодическая система химических элементов Д. И. Менделеева" Значение и место, 131.75kb.
- Методика преподавания урока, 146.26kb.
- Темы курсовых работ по методике преподавания информатики на 2006-2007 уч год, 16.24kb.
- Методика изучения учебной мотивации по итогам обучения в 1-м классе 1 Методика изучения, 417.39kb.
- Методика изучения темы: «Элементы статистики, комбинаторики и теории вероятностей, 1031.61kb.
- Вводный курс лекций москва Российский университет дружбы народов 2006 Коллектив, 2202.03kb.
- Проекты уроков по методике преподавания литературы, 278.64kb.
- Теория и методика обучения и воспитания (литература), 40.79kb.
- Методика проведения урока Подготовка и проведение урока Виды анализа урока Анализ проведения, 1966.65kb.
- Методика изучения мотивов участия школьников в деятельности, 1409.71kb.
Тема 12. Методика изучения темы
"Теория электролитической диссоциации".
1. Место и значение темы в курсе химии
В настоящее время выбор учебников по химии, рекомендованных и допущенных Министерством образования Российской Федерации для обучения учащихся школ, достаточно велик. Авторы каждого из этих учебников предлагают свои подходы к изучению темы в школьном курсе химии.
Гузей Л.С., Суровцева Р.П. в своих учебниках на изучение темы "Вода. Водные растворы" отводят 6/11 ч. в 8 классе. Тема "Теория электролитической диссоциации" изучается в 9 классе в объеме 10/15 часов.
Согласно авторской программе и учебнику Минченкова Е.Е. и др. изучение темы в 8-9 классах не предусмотрено.
Согласно авторской программе и учебнику Н.Е. Кузнецовой с соавторами тема "Электролитическая диссоциация" изучается в 9 классе, на тему отводится 12/16 часов.
Согласно авторской программе и учебнику О.С. Габриеляна тема "Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции" изучается в конце курса восьмого класса и состоит из десяти параграфов, изучается в течение 18 часов. В рамках этой темы рассматриваются вопросы теории электролитической диссоциации. Завершает тему и весь курс 8 класса химический практикум "Свойства электролитов" – 4 часа.
Значение темы переоценить трудно. Во-первых, происходит углубление и развитие понятий об основных классах неорганических веществ (соли, кислоты, основания), изучаются механизмы реакций между электролитами в растворах, вводится большое число новых понятий, расширяются ранее изученные.
Во-вторых, тема является теоретической базой для понимания химических свойств отдельных элементов и их соединений и служит основой для дальнейшего их изучения в разрезе отдельных групп химических элементов.
В-третьих, тема имеет огромный потенциал для дальнейшего развития учащихся на основе эксперимента и постановки проблемных вопросов.
В-четвертых, продолжается формирование научного мировоззрения, которое поможет учащимся объяснять многие явления действительности.
2. Основные понятия темы
Основные понятия темы рассмотрим на примере учебника О.С. Габриеляна. Автор в каждом параграфе дает ряд новых понятий, а также использует ранее изученные термины для закрепления. Так, в § 34 "Растворение. Растворимость веществ в воде" впервые дается 15 понятий, это: растворы, растворенное вещество, растворение, физическая теория растворов, диффузия, гидраты, кристаллогидраты, медный купорос, гидратная теория, насыщенный раствор, ненасыщенный раствор, пересыщенный раствор, глауберова соль, растворимость. В этом параграфе рассматриваются и изучаются процессы растворимости, количественные оценки растворимости на примере кривой растворимости.
В § 35 "Электролитическая диссоциация" изучается 10 новых понятий, такие как: электролитическая диссоциация, электролиты, неэлектролиты, диссоциация, диполь, ассоциация, степень диссоциации, сильные и слабые электролиты. Целью параграфа является усвоение новых понятий и механизма диссоциации веществ с разным типом химической связи.
В § 36 "Основные положения электролитической диссоциации" впервые рассматривается 12 понятий, это: положительные и отрицательные ионы, простые и сложные ионы, гидратированные и негидратированные ионы, катион, анион, электронейтральный раствор, кислоты-электролиты, основания- электролиты, ступенчатая диссоциация. Целью параграфа является усвоение основных понятий теории электролитической диссоциации, классификации ионов по заряду и по наличию водной оболочки.
В § 37 "Ионные уравнения" введено 6 новых понятий: ионные реакции, ионные уравнения, молекулярные уравнения реакций, сокращенное ионное уравнение реакций, реакция нейтрализации, реакции ионного обмена. Целью параграфа является изучение реакций обмена, идущих до конца, различные виды ионных уравнений, формирование понятий о реакциях нейтрализации.
В § 38 "Кислоты, их классификация и свойства" изучается 6 новых понятий: летучесть кислот, устойчивость кислот, стабильность кислот, нелетучесть кислот, нестабильность кислот, слабые нестойкие кислоты, рассматривается понятие кислота в свете электролитической диссоциации, изучаются также свойства кислот на примере НСl и H2SO4.
В § 39 "Основания, их классификация и свойства" включено 2 новых термина: однокислотные и двухкислотные основания. Целью этих двух параграфов является изучение кислот и оснований с точки зрения электролитической диссоциации, их классификация по различным признакам, а также учение о реакциях характерных для кислот, щелочей и нерастворимых оснований.
§ 40 "Оксиды, их классификация и свойства" включает 7 новых понятий: жидкие оксиды, твердые и газообразные оксиды, солеобразующие и несолеобразующие оксиды, кислотный оксид, оснóвный оксид. Цель параграфа: изучение физических и химических свойств оксидов.
В § 41 "Соли, их классификация и свойства" изучается 6 важнейших понятий: средние, кислые, оснóвные соли; малахит, вытеснительный ряд металлов. Целью параграфа является изучение классификации солей, химические взаимодействия солей, повторение электролитического ряда напряжения металлов.
§ 42 "Генетическая связь между классами веществ" включает 3 новых понятия: генетическая связь между классами, генетический ряд металлов, генетический ряд неметаллов. Целью параграфа является рассмотрение понятия о генетической связи и генетических рядах металлов и неметаллов.
В § 43 "Окислительно-восстановительные реакции" вводится 9 новых понятий: признаки и различия реакций по фазе, направлению, по числу, характеру реагирующих веществ, процесс восстановления, окисления, окислитель, восстановитель, электронный баланс, отдача электронов. Целью параграфа является изучение определения степеней окисления элементов, образующих вещества различных классов; реакции окислительно-восстановительные; процесс окисления, восстановления.
Таким образом, в материал темы включено изучение около 80 химических терминов. Кроме того, в процессе обучения помимо химических терминов используется ряд других, относящихся к другим наукам. Естественно, что при таком объеме научной информации необходимо очень ответственно и тщательно разрабатывать и внедрять в учебный процесс методику изучения рассматриваемой темы.
3. Межпредметные и внутрикурсовые связи при изучении темы
Физика – электрический ток (упорядоченное движение электронов, проводники первого рода и т.д.).
Химия – Периодический закон и система химических элементов; Строение вещества; Виды химической связи; Типы кристаллических решеток; Состав и характерные свойства солей, кислот, оснований и оксидов.
4. Планирование темы
Примерное планирование на основе лекционно-семинарской системы и крупноблочного изучения материала с учетом возможностей и возрастных особенностей учащихся представлено в таблице.
| № | Тема урока |
| 1 | Растворение как физико-химический процесс. Массовая доля компонентов раствора. Растворимость. Типы растворов. |
| 2 | Электролитическая диссоциация |
| 3 | Основные положения теории электролитической диссоциации |
| 4 | Ионные уравнения реакции |
| 5 | Урок-семинар. Обобщение темы: "Растворение. Растворимость, типы растворов, электролитическая диссоциация, теория электролитической диссоциации" |
| 6 | Кислоты в свете ТЭД, классификация и свойства |
| 7 | Основания в свете ТЭД, классификация и свойства |
| 8 | Урок-семинар. Закрепление темы: "Кислоты и основания в свете ТЭД" |
| 9 | Соли в свете ТЭД, их свойства |
| 10 | Оксиды, классификация и свойства |
| 11 | Урок-семинар. Закрепление темы: Соли и оксиды в свете ТЭД |
| 12 | Генетическая связь между классами неорганических веществ |
| 13 | Урок-семинар. Генетическая связь между классами неорганических веществ |
| 14 | Окислительно-восстановительные реакции |
| 15 | П/Р №6 Ионные реакции |
| 16 | П/Р №7 Реакции между растворами электролитов |
| 17 | П/Р №8 Свойства кислот, оснований, солей, оксидов |
| 18 | П/Р №9 Решение экспериментальных задач |
| 19 | Обобщение и систематизация знаний по теме |
| 20 | Контрольная работа № 4 |
| 21 | Анализ контрольной работы |
| 22 | Резерв |
Данный подход к планированию позволяет выделить отдельные специализированные уроки передачи и усвоения новых знаний и уроки учета и контроля знаний учащихся. Следует подчеркнуть, что уроки-лекции – это не монологи учителя в течение всего урока, а объяснение нового материала на основе демонстрационных и лабораторных опытов, постановки и решения проблемных вопросов, эвристической беседы с широким применением наглядности и новейших средств обучения.
5. Наглядность и эксперимент
Наглядность и эксперимент - это неотъемлемые средства обучения при изучении химии в школе
Для проведения эксперимента по теме необходим прибор для определения электропроводимости веществ (ПЭВ). К сожалению, приборы заводского изготовления небезопасны в эксплуатации из-за возможности поражения человека электрическим током. Поэтому лучше изготовить самодельные приборы по следующим схемам.
1. Прибор для регистрации электропроводности веществ с помощью измерительной шкалы. Работа этого прибора осуществляется следующим образом. Перед тем как погрузить электроды в исследуемый раствор нужно убедиться в том, что шкала прибора правильно отрегулирована. Для этого нажимаем на кнопку и устанавливаем стрелку на нуль. Затем кнопку отпускаем и помещаем электроды в раствор. Стрелка начинает отклоняться, и мы фиксируем ее значение. Если стрелка показывает от нуля до пяти, то это хороший проводник или сильный электролит (например, металлы, раствор NaCl и др.). Если стрелка показывает значение от шести до восьми - слабый электролит. Если стрелка показывает значение от десяти до двадцати, то это вещество не является электролитом.
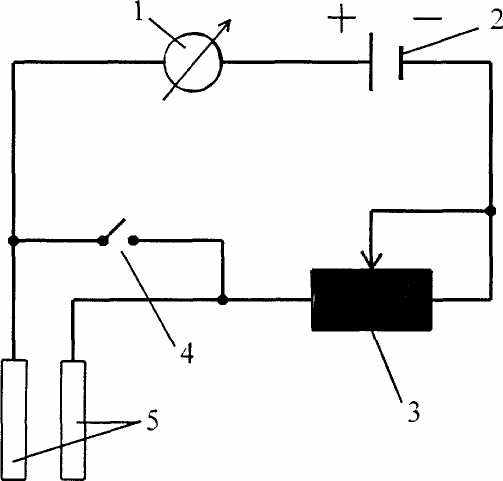
Прибор 1 для регистрации электропроводности веществ
с помощью измерительной шкалы.
1 - измерительный прибор (гальванометр); 2 - источник питания постоянного тока (батарейка типа Panasonic); 3 - резистор; 4 - кнопка-выключатель; 5 – электроды.
2. Более простым прибором для регистрации электропроводности веществ является прибор с чувствительным светодиодом.
Он имеет следующую схему:
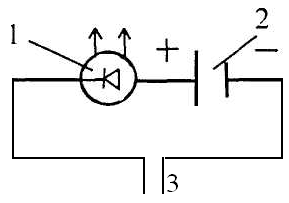
Прибор II.
1 – чувствительный светодиод; 2 – источник питания (батарейка); 3 – электроды.
Прибор позволяет вещества разделить на электролиты, то есть проводящие электрический ток и неэлектролиты - непроводящие электрический ток. При помещении электродов в исследуемый раствор электролита загорается лампочка, не загорается - неэлектролит. Недостаток этого прибора в том, что он не способен определять сильные или слабые электролиты.
3. При отсутствии светодиода можно воспользоваться в качестве индикатора электрической проводимости лампочкой на 6-12 вольт (прибор III). Лучший эффект наглядности могут дать приборы, позволяющие одновременно определять электропроводность нескольких веществ (растворов) – приборы IV и V.
-

Прибор III.
1 – штеккер (вилка) для подключения прибора к источнику электрического тока; 2 – электроды; 3 – электролампочка.
-

Прибор IV.
Прибор для одновременного определения электропроводимости нескольких веществ (1 вариант).
1 – штеккер (вилка) для подключения прибора к источнику электрического тока; 2 – электроды; 3 – электролампочка; 4 – выключатели.
-

Прибор V.
Прибор для одновременного определения электропроводимости нескольких веществ (2 вариант).
1 – штеккер (вилка) для подключения прибора к источнику электрического тока; 2 – электроды; 3 – электролампочка; 4 – подвижный контакт.
Для изготовления приборов используют мягкие изолированные медные провода; электроды вставляют в два корпуса шариковых ручек, которые связывают между собой так, чтобы расстояние между ними составляло примерно 1-2 см. Выходы проводов (около 1 см) из нижних концов авторучек оголяют (снимают изоляцию). Приборы лучше всего для обеспечения полной безопасности работы с ними подключать к источнику тока 6-12 вольт; в соответствие с этим подбирают лампочку. Вместе с лампочкой можно подключить в схему электроизмерительный прибор. При отсутствии в лаборатории понижающего трансформатора можно в качестве источника использовать электробатарейки, к которым подбираются лампочки. Не исключается возможность изготовления ПЭВ и под сеть напряжением 220 вольт, однако в этом случае следует особо неукоснительно соблюдать правила техники безопасности; допускать учащихся до работы в этом случае категорически запрещается. После каждого тестирования электропроводности вещества электроды необходимо промывать водой и протирать насухо (обязательно при отключенном от сети приборе).
Опыт 1. Определение электропроводности твердых веществ. С помощью ПЭВ установите, проводят ли электрический ток неметаллы (сера, графит и др.), металлы (железо, алюминий и др.), сложные вещества (пластмассы, древесина, стекло, сахар, поваренная соль и др.). Оформите ваши наблюдения в виде таблицы и обсудите результаты эксперимента.
Опыт 2. Определение электропроводности воды и растворов. Определите с помощью ПЭВ, проводят ли электрический ток дистиллированная вода, водный раствор сахара, водный раствор иодида калия, ацетон, водный раствор ацетона, раствор иодида калия в ацетоне, ледяная уксусная кислота, водный раствор уксусной кислоты и др. Оформите ваши наблюдения в виде таблицы и обсудите результаты эксперимента в зависимости от природы растворенного вещества и полярности растворителя.
Опыт 3. Определение электропроводности расплава. В фарфоровую чашку насыпьте сухой нитрат калия массой 20-30 г, установите на кольцо лабораторного штатива и нагрейте до плавления соли (334 оС). Проверьте электропроводность расплава, не дожидаясь разложения соли при дальнейшем ее нагревании. Вместо нитрата калия для данного опыта можно взять другие легкоплавкие вещества: NaOH (температура плавления 326 оС); NaNO3 (307 оС); удобно воспользоваться некоторыми кристаллогидратами, которые при нагревании плавятся в кристаллизационной воде при весьма низких температурах: Na2SO3S5H2O (56 оС); Na2SO410H2O (33 оС); различные квасцы и др.
Опыт 4. Зависимость электропроводности (степени диссоциации) от природы электролитов. Для опыта удобно воспользоваться ПЭВ для одновременного определения электропроводности нескольких веществ. Налейте в стаканчики растворы H2SO4, H3PO4, Na2SO4, NaOH одинаковой концентрации, проверьте их электропроводность, о которой можно судить (относительно) по яркости свечения лампочки. Однако, лучший результат в обучении достигается при подключении к установке электроизмерительного прибора. Опишите результаты наблюдений и обсудите результаты эксперимента.
Опыт 5. Зависимость электропроводности (степени диссоциации) от концентрации электролита. Приготовьте три стакана с растворами слабого электролита (CH3COOН, NH3H2O и др.) и три стакана с растворами сильного электролита (H2SO4, NaOH, NaCl и др.) различной концентрации. Проверьте их электропроводность, как указано в опыте 4. Опишите результаты наблюдений и обсудите результаты эксперимента.
Опыт 6. Зависимость электропроводности (степени диссоциации) от температуры раствора электролита. Приготовьте два стакана с растворами слабого электролита (CH3COOН, NH3H2O и др.) и два стакана с растворами сильного электролита (H2SO4, NaOH, NaCl и др.) одинаковой концентрации. По одному стакану с раствором каждого электролита нагрейте до 60-70 оС. Проверьте электропроводность всех растворов, как указано в опыте 4. Опишите результаты наблюдений и обсудите результаты эксперимента.
Опыты 7-8. Движение ионов в электрическом поле. Вариант 1. Стеклянное предметное стекло или пластмассовую пластинку размером 3х10 см обверните несколькими слоями фильтровальной бумаги. С помощью резиновых колечек прикрепите поперек пластинки на расстоянии 2 см два графитовых электрода (можно вынуть из круглых отработанных батареек). Подсоедините электроды к источнику постоянного тока напряжением 12-24 вольт. Обильно смочите фильтровальную бумагу между электродами раствором сульфата натрия (20 %).
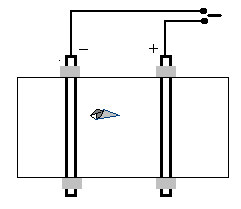
Движение ионов в электрическом поле (вариант I).
Далее на бумагу между электродами положите 1-3 крупных кристаллов KMnO4 или другой окрашенной соли. Включите ток и наблюдайте образование окрашенных в виде язычков зон, которые тянутся в сторону соответствующего электрода.
Вариант 2. Приготовьте концентрированный раствор сахара, растворите в нем сульфат меди и хромат калия (до 5%). Налейте раствор в U-образную стеклянную трубку; поверх этого раствора осторожно прилейте раствор сульфата натрия (15-20%) так, чтобы между растворами была ясно видна граница раздела.
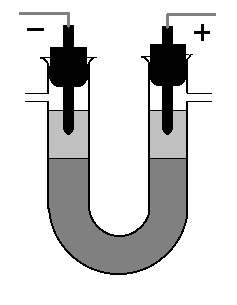
Движение ионов в электрическом поле (вариант II).
Опустите в U-образную трубку графитовые электроды, чтобы они не доходили до окрашенного раствора на 2-3 см. Подключите к электродам постоянный электрический ток напряжением 12-24 вольт. Опишите результаты наблюдений и обсудите результаты эксперимента.
Опыты 9-16. Гидролиз солей. Соли, образованные с участием слабой кислоты или слабого основания, подвергаются гидролизу, то есть частичному или полному их разложению под действием воды. Растворите в стаканчиках небольшие порции нитрата калия, карбоната калия, сульфата алюминия, карбоната аммония, сульфида алюминия. Наблюдаются ли внешние изменения при растворении этих веществ? Определите с помощью универсальных индикаторных бумажек величину рН растворов и сделайте соответствующие выводы. Запишите уравнения реакций гидролиза, где они имеют место:
KNO3 + H2O гидролиза нет
Al2(SO4)3 + 2H2O
 2AlOH2+ + 2Н+ + 3SO42-
2AlOH2+ + 2Н+ + 3SO42-(NH4)2СО3 + H2O
 2NH3·H2O + Н2CO3
2NH3·H2O + Н2CO3Al2S3 + 6H2O 2Al(OH)3 + 3H2S (гидролиз идет необратимо).
Для установления зависимости гидролиза солей от температуры и концентрации проведите следующие опыты. Раствор ацетата натрия (2%) испытайте раствором фенолфталеином (1-2 капли). Отметьте цвет раствора при обычной температуре, затем при нагревании и последующем охлаждении.
Пример полного гидролиза можно показать при растворении сульфида магния в горячей воде, который можно получить следующим образом. Поместите в ступку около 1 г порошка магния, добавьте избыток порошка серы (2 г), смесь перемешайте и пересыпьте в пробирку. Поверх смеси насыпьте немного порошка серы (для уменьшения вероятности окисления магния кислородом воздуха). Укрепите пробирку вертикально в штативе и нагрейте, предварительно положив на стол под пробиркой асбестовый лист. Нагрейте смесь в пробирке, наблюдайте яркую экзотермическую реакцию. После того, как пробирка остынет, разбейте ее, образовавшийся твердый продукт (MgS) измельчите и положите в чистую сухую пробирку. Добавьте в пробирку немного воды и смесь нагрейте. Происходит полный гидролиз соли по уравнению:
MgS + H2O = Mg(OH)2 + H2S.
Выделение сероводорода устанавливают по почернению фильтровальной бумажки, смоченной раствором соли свинца (II). Жидкость в пробирке остается мутной, вследствие образования очень малорастворимого гидроксида магния. Чтобы показать зависимость степени гидролиза от реакции раствора и от концентрации соли, растворите немного хлорида олова (II) в минимальном количестве воды. Соль подвергается гидролизу:
SnCl2 + H2O
 SnОНCl + Н+ + Cl-.
SnОНCl + Н+ + Cl-.Равновесие сильно смещено вправо, поэтому раствор получится мутным вследствие выпадения в осадок гидроксохлорида олова. Подкислите раствор несколькими каплями соляной кислоты до полного растворения соли. Добавьте затем к раствору избыток воды, вновь выпадает осадок. Опишите ваши наблюдения и сделайте выводы.
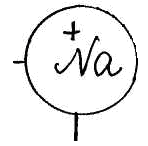
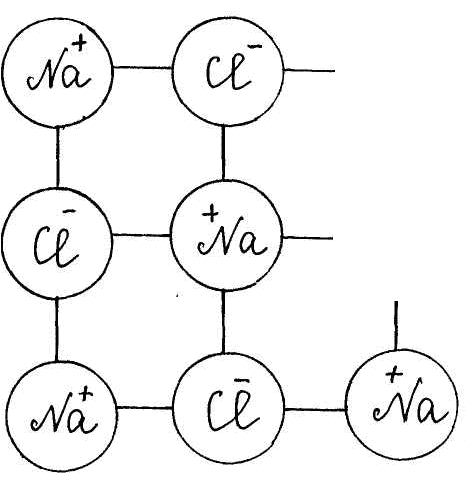
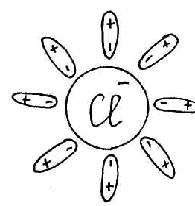
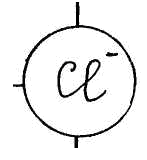
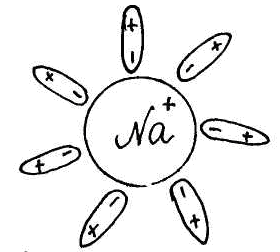
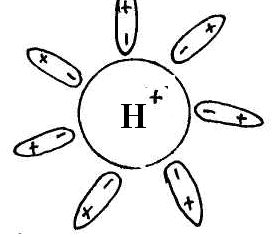
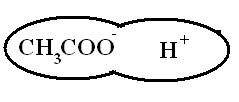
Для изучения темы "Электролитическая диссоциация" предлагается динамическая модель с помощью, которой учитель с большой точностью и наглядностью может объяснить механизм диссоциации. Динамическая модель представляет собой магнитную доску и ряд карточек. На карточках, которые крепятся к доске с помощью магнитов, изображены схемы веществ, подвергающиеся диссоциации. Это схемы поваренной соли, ее кристаллической решетки и молекулы уксусной кислоты или хлороводорода; набор карточек с изображением схем молекул воды, то есть диполи, которые во время процесса диссоциации окружают ионы и молекулы, и отрывают их из кристаллической решетки. Подвижные ионы Na+, Сl-, окруженные диполями воды уходят из кристаллической решетки, а молекула уксусной кислоты также разрывается на СН3СОО- и Н+ с образованием гидратированных ионов.

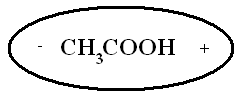

Карточки-схемы динамической модели
"Механизм электролитической диссоциации"
6. Методика изучения отдельных понятий темы с использованием учебного эксперимента и постановки проблемы.
Фрагменты урока "Электролитическая диссоциация"
Цель урока: расширить знания учащихся об электропроводности, усвоить следующие понятия "электролит", "неэлектролит", "гидратированный ион", "электролитическая диссоциация", "механизм диссоциации"; расширить представления о веществах и химических реакциях на основе знаний об электропроводности, реакциях ионного обмена; о зависимости свойств веществ от их состава и строения; научить учащихся правильному обращению с различными веществами и работе с приборами по определению электропроводности веществ.
Задачи урока:
-образовательная: вооружить учащихся знаниями о сущности процесса электролитической диссоциации, обучить основным понятиям темы, сформировать понятие о механизмах и условиях протекания процесса, используя понятия электролит, неэлектролит.
-развивающая: изучаемая тема создает теоретическую базу для дальнейшего изучения химии, служит для переосмысления уже пройденной части курса. Тема углубляет и расширяет знания о свойствах веществ на ионном уровне.
-воспитательная: сформировать научное мировоззрение по вопросам строения и свойствам веществ, диссоциирующих на разноименно заряженные ионы. Раскрыть идею развития в познании физико-химических процессов по мере накопления новых фактов и на основе эксперимента.
Метод урока: объяснение с элементами беседы на основе демонстрационного эксперимента.
Оборудование: прибор для определения электропроводности, вода, сухая соль NaCl, сахар, ледяная уксусная кислота, металлы, неметаллы, стаканчики, сухая салфетка, динамическая модель "Механизм электролитической диссоциации".
Ход урока:
- Организационный момент.
- Объяснение нового материала.
Учитель начинает урок с вопросов.
Ребята, что такое электрический ток?
Каковы условия прохождения электрического тока?
Получив ответы на эти вопросы, учитель ставит следующий вопрос.
Как определить: проводит вещество электрический ток или нет? Учитель объясняет устройство прибора и технику работы с ним.
Чтобы определить электропроводность веществ в лабораторных условиях необходим прибор, измеряющий электропроводность. Прибор, измеряющий электропроводность представляет собой 2 электрода, подсоединенных к гальванометру и источнику тока. При помощи кнопки мы можем регистрировать значение электропроводности. Для проведения опыта возьмем следующие вещества: металл, неметалл, дистиллированную воду, соль NaCl твердую и ее водный раствор, а также СН3СООН ледяную и ее раствор, а также раствор NaCl в СН3СООН. Результаты опыта занесем в таблицу:
Электропроводность веществ
| Вещества | Электропроводность |
| 1. Металл | да |
| 2. Неметалл | нет |
| 3. Н2О диет. | нет |
| 4. NaCl (тверд.) | нет |
| 5. NaCl (раствор) | да |
| 6. Сахар (тверд.) | нет |
| 7. Сахар (раствор) | нет |
| 8. СН3СООН (лед.) | нет |
| 9. СН3СООН (раствор) | да |
| 10. NaCl в СН3СООН | нет |
Учитель анализирует совместно с учащимися результаты опытов. Итак, мы посмотрели опытным путем, что некоторые вещества, например, металлы, NaCl (раствор), СН3СООН (раствор) проводят электрический ток, а остальные – не проводят электрический ток. Тем самым мы разделили вещества на 2 большие группы - проводящие и непроводящие электрический ток.
Еще в 19 веке М. Фарадей, занимаясь этим вопросом, разделил вещества на электролиты и неэлектролиты.
Электролиты - вещества, растворы которых проводят электрический ток. К ним относят: (NaCl, CH3COOH и др. - проводники 2 рода, металлы - это проводники 1 рода).
Неэлектролиты - вещества, растворы которых не проводят электрический ток (сахар, этиловый спирт).
Учитель ставит проблемный вопрос. А как вы считаете, почему одни вещества проводят в растворе электрический ток, а другие не проводят?
Логическая цепочка рассуждений может быть следующей. Давайте вспомним условия прохождения тока?
- Наличие свободных электронов.
Какие вещества имеют в кристаллической решетке свободные электроны?
- Металлы.
Значит, причину прохождения тока у металлов мы выяснили - это наличие свободных электронов. А как же другие вещества? По какой причине они проводят электрический ток и являются электролитами.
- Имеются другие заряженные частицы?
Да, переносчиками заряда являются ионы.
А почему NaCl (тверд.) не проводит электрический ток, ведь NaCl состоит из ионов?
- ионы есть, но они находятся в узлах кристаллических решеток, поэтому перемещаться свободно не могут.
А как же в водном растворе ведут себя ионы NaCl?
Вероятно, ионы поваренной соли в водном растворе могут свободно перемещаться и переносить заряды, то есть ионные вещества в растворе распадаются на ионы, что позволяет проводить электрический ток.
Почему же раствор хлорида натрия в уксусной кислоте не проводит электрический ток?
В растворе уксусной кислоты соль не распадается на ионы.
Что из этого следует?
Вода обладает особыми свойствами; воздействуя на ионные соединения, они распадаются на ионы. Уксусная кислота такими свойствами не обладает.
Учитель подводит промежуточный итог рассуждения. Наличие электропроводности у растворов ионных соединений можно объяснить исходя из строения этих веществ и особых свойств воды как растворителя. Учитель просит обсудить электропроводность уксусной кислоты.
Является ли уксусная кислота ионным соединением?
Нет, уксусная кислота соединение молекулярного строения, поэтому это вещество не проводит электрический ток.
Какой можно было бы сделать прогноз?
- СН3СООН - неэлектролит.
А почему же раствор СН3СООН проводит электрический ток? Ведь молекулы не могут быть переносчиками заряда, тогда как же переносится заряд в растворе уксусной кислоты?
Значит, возникновение электропроводности в водном растворе определяется опять-таки влиянием воды. В водном растворе образуются ионы водорода и кислотного остатка. Именно вода принимает участие в образовании ионов.
Учитель с помощью динамической модели с изображением кристаллической решетки поваренной соли NaCl, рассматривает механизм диссоциации ионных соединений под действием молекул воды. К узлам кристаллической решетки, где находятся ионы Na+, C1-, к ионам подходят диполи молекул воды противоположно заряженным полюсом и отрывают их от кристаллической решетки, относят в сторону, окружая со всех сторон с образованием гидратированных ионов:

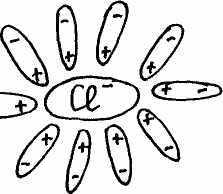
Далее с помощью динамической модели с изображением молекулы уксусной кислоты учитель рассматривает механизм диссоциации полярных ковалентных соединений под действием молекул воды.
Следующий этап объяснения включает уточнение механизма диссоциации, ознакомление с уравнениями электролитической диссоциации, определением перечня электролитов и неэлектролитов и т.д.
Для закрепления темы проводится блиц-опрос. Учитель задает вопросы и получает немедленный ответ на него.
- Как называют вещества, проводящие электрический ток?
- Как называют вещества, не проводящие электрический ток?
- Почему ионные соединения, состоящие из заряженных частиц, в
кристаллическом виде не проводят электрический ток?
- Соединения, с каким видом связи, являются электролитами в расплавленном и растворенном состоянии?
- Как диссоциируют ионные соединения?
- Какой тип кристаллической решетки характерен для электролитов?
- Какие классы неорганических соединений относятся к электролитам?
- Что называют электролитической диссоциацией?
- Назовите известные вам неэлектролиты?
- Влияет ли температура на электропроводность веществ?
- Почему различные металлы по-разному проводят электрический ток?
- Являются ли металлы электролитами?
- Как опытным путем доказать проводимость электролита?
После опроса подводятся итоги, выставляются оценки за участие на уроке.
Домашнее задание: § 35 (учебник О.С.Габриеляна) упр. 1-6.
7. Тестовый контроль усвоения темы
Для проведения контроля знаний учащихся и степени усвоения ими учебного материала, наряду с традиционными формами используют тесты.
1. В приведенном перечне веществ (поваренная соль, карбонат кальция, сахар, глицерин, пальмитиновая кислота, хлорид серебра, кремниевая кислота, сульфат серебра) число соединений, практически нерастворимых, малорастворимых и хорошо растворимых в воде, соответственно равно:
а)4, 1,3; б) 4, 4,0; в) 3,1, 4; г) 1,4,3.
2. При растворении гидроксида натрия в воде температура раствора повышается в результате:
а) гидратации ионов;
б) электролитической диссоциации;
в) разрушения кристаллической решетки;
г) химического взаимодействия веществ.
3. Степень диссоциации одноосновной кислоты в растворе с концентрацией 0,2 моль/л равна 0,15. Рассчитайте массу ионов водорода в растворе объемом 2 л:
а) 6 г; б) 0,6 г; в) 0,06 г; г) 60 г.
4. В результате электролиза водного раствора хлорида меди получают:
а) медь, водород, кислород; в) соляную кислоту, медь;
б) хлор, медь; г) водород, кислород.
5. При электролизе водного раствора сульфата натрия получают:
а) натрий, водород, серу; в) натрий, серу;
б) серную кислоту; г) водород, кислород.
8. Расчетные задачи
В курсе химии для развития и закрепления знаний по изучаемой теме предлагаются расчетные задачи.
Задача 1. Имеется насыщенный при 10 °С раствор сульфата магния массой 500 г. Какую навеску этой же соли можно растворить дополнительно, если раствор нагреть до 40 °С?
Решение:
Находим по справочнику, что растворимости сульфата магния при 10 и 40 °С соответственно равны 30 г и 48 г соли на 100 г воды.
- Определим массу воды в исходном растворе:
В (100 + 30 г) раствора - 30 г (MgSO4)
В 500 г раствора - х г (MgSO4)
х = 500 • 30 /130 • 115,4 (г)
3. Определим массу воды в исходном растворе:
500-115,4 ≈ 385 (г)
4. Определим массу соли, необходимую для получения насыщенного при 40 °С раствора в порции воды массой 385 г:
100г(H2O)-48г(MgSO4)
385г(H2O)-x г(MgSO4)
х = 385 • 48 /100 =184,8 (г)
5. Определим массу соли, которую можно растворить дополнительно:
184,8-115,4 = 69,4 (г) Ответ: 69,4 г.
Задача 2. Содержание ионов водорода в растворе равно 5,2 г/л. Выразите концентрацию ионов в молях на литр.
Решение:
Молярная масса ионов водорода равна 1 г/моль, следовательно, можно определить молярную концентрацию раствора.
с (Н+) = 5,2 г/л / 1 г/моль = 5,2 моль/л. Ответ: 5,2 моль/л.
Задача 3. Массовая доля хлороводорода в концентрированном растворе соляной кислоты при 0 °С достигает 45,15 %, а плотность раствора равна 1,22 г/мл. Определите растворимость этого газа в расчете на 100 г воды и молярную концентрацию этого раствора.
Решение:
1. Определим растворимость газа в воде.
45,15 г (НС1) растворяется в (100 - 45,15) г (Н2О)
х г (НС1) растворяется в 100 г (Н2О)
х = 45,15 • 100/100-45,15 = 82,3 (г)
2. Определим массу 1 л раствора:
m (раствор) = 1000 • 1,22 = 1220 (г)
3. Определим массу хлороводорода в 1 л раствора:
m (HC1) = 1220 / 100 • 45,15 = 551 (г)
4. Определим молярную концентрацию раствора:
М (НС1) = 36,5 г/моль; с (НС1) = 551 / 36,5 = 15,1 (моль/л)
Ответ: 82,3 г; 15,1 моль/л.
ВОПРОСЫ И ЗАДАНИЯ
1. Каково значение темы для развития и воспитания учащихся?
2. Применим ли при изучении данной темы метод историзма как дидактический прием?
3. Какие основополагающие выводы должны (получить) сделать ученики после изучения данной темы?
4. Каковы преимущества использования эксперимента при объяснении темы?
5. Каковы достоинства динамических схем и моделей в объяснении нового материала?
6. Проанализируйте тесты и задачи; что дополнительно дает их применение в учебно-воспитательном процессе?
