Внутриутробные инфекции, клинико-морфологическая оценка современной специфической диагностики
| Вид материала | Автореферат диссертации |
- Н. С. Титова Внутриутробные инфекции у новорожденных Учебное пособие, 872.72kb.
- 1. Вводная информация Оценка положения дел в сфере вич-инфекции с гендерной точки зрения, 2038.62kb.
- План лекций по неврологии и медицинской генетике для студентов 4 курса педиатрического, 17.45kb.
- Автореферат диссертации на соискание ученой степени, 682.05kb.
- Приказ Первого заместителя председателя Агентства Республики Казахстан по делам здравоохранения, 601.07kb.
- «Военно-медицинская академия имени С. М. Кирова», 394.13kb.
- Некоторые аспекты диагностики нарушений гемостаза в клинико-диагностических лабораториях, 248.96kb.
- Диагностика, клинико-морфологическая характеристика и лечение сухого кератоконъюнктивита, 456.73kb.
- Этиология, патогенез, классификация, клиника и диагностика острой одонтогенной инфекции, 519.74kb.
- Клинико-морфологическая характеристика изменений эутопического и эктопического эндометрия, 417.6kb.
Ранняя диагностика ВУИ у новорожденных
по исследованию плаценты методом ПЦР
Ко времени начала нашего исследования не было разработано тест-систем для экстракции НК из аутопсийного материала, удаления посторонних примесей и получения чистого препарата, пригодного для постановки ПЦР. Аутопсийный материал богат ингибиторами ПЦР – продуктами некроза и аутолиза тканей, распада ядер и клеток. Экспериментальным путем нами были подобраны условия получения чистого препарата нуклеиновых кислот: размельчение, щелочная экстракция, обработка анионным детергентом додецилсульфатом натрия, фенольно-хлороформная экстракция, осаждение этанолом. Такая обработка приводит к денатурации, солюбилизации белка, переходу нуклеиновых кислот в раствор, инактивации нуклеаз. При сравнении инфицированности различных участков плацент оказалось, что наиболее часто возбудители ВУИ обнаруживаются в 2-х участках плаценты: в месте разрыва плодных оболочек и в межворсинчатом пространстве. Это места наиболее вероятного пути проникновения вируса в плаценту и плод при восходящем и трансплацентарном путях передачи. В дальнейшем ограничивались исследованием образцов двух участков плаценты.
Указанным способом проведено исследование 50 плацент у новорожденных. В 4-х случаях определены ДНК инфекционных агентов (8,0±3,8 %): 2 – CMV, 1 – Evs и 2 – Ur. urealyticum. При выявлении ДНК CMV в плаценте ребенка, родившегося на 36 й неделе с массой тела 2 800 гр., обнаружены воспалительно-дистрофические изменения: отложение фибриноида на поверхности ворсин, псевдоинфаркты, кальцификаты, диссоциированное созревание ворсин плаценты, дистрофические изменения в строме ворсин, в стенках сосудов, а у новорожденного – кожные петехии, длительная желтуха, нарушение функции печени. На основании клинических данных, воспалительно-дистрофических изменений в плаценте и результатов генодиагностики сделан вывод о высоком риске реализации внутриутробной ЦМВИ. Даны рекомендации о переводе ребенка из роддома в отделение патологии новорожденных с наблюдением и решением вопроса о лечении, включающем применение иммуноглобулина для внутривенного введения или антицитомегаловирусного иммуноглобулина, виферона, метаболического комплекса и других адекватных мер, наблюдение педиатра, психолога, отоларинголога в постнатальном и младенческом периодах.
Таким образом, нами предложен способ, позволяющий выявлять конкретных возбудителей ВУИ методом ПЦР в пробах плаценты с целью ранней диагностики ВУИ у новорожденных. Метод запатентован – № 2005129856/15 (033481), решение о выдаче патента № 236 от 07.06.2006 г. Способ рекомендуется для исследования плаценты у новорожденных, родившихся с клиническими признаками ВУИ.
Оценка роли инфекций матери в генезе фетоинфантильных потерь
Сравнение структуры ПС проводили по материалам патологоанатомического отделения ДККБ и обсервационного роддома №11 г. Хабаровска. Проанализировано 246 протоколов вскрытия при ПС за 1988 г., 226 – за 2003 г. и 132 – за 2007 г. Частота выявления ВУИ как основной причины смерти в 2003 г. и 2007 г. увеличилась в 3,5–4,2 раза (p<0,01) по сравнению с 1988 г. и составила 35,8±3,2 % и 42,4±4,3 % соответственно (рис. 16).
Если учесть, что при морфологическом исследовании ВУИ диагностируется не только как основное, но и как сочетанное и фоновое заболевание, то в целом в структуре ПС в 2003 г. и 2007 г. признаки ВУИ определили в 92,3±1,8 % случаев и 97,8±1,3 % случаев, что в 2,2–2,4 раза чаще, чем в 1988 г. (41,5±3,1 %, p<0,05).

* p<0,01, ** p<0,001 – в сравнении с 1988 г. ° - p<0,001 – в сравнении с 2003 г.
Рис. 16. Динамика изменений структуры ПС (%)
В последние годы ВУИ при аутопсиях чаще регистрируют в генерализованной форме. Так в 1988 г. генерализованные формы составили 6,5±1,6 %, в 2003 г. – 23,0±2,8 %, а в 2007 г. – 78,7±3,5 %. В 2003 г. причиной ПС в 11,5±2,1 % случаев стал сифилис, который не диагностировали в прошлые годы. В 2007 г. частота выявления сифилиса достоверно не снижается – 9,8±2,6 %. Если в 1988 г. в аутопсийном материале преобладали гнойно-воспалительные реакции, то в 2003 г. и 2007 г. – гнойные и продуктивно-альтеративные процессы установлены в соотношении 1:1.
В 2007 г. в 2,3 раза снизилась частота врожденных дефектов (8,3±2,4 %) по сравнению с 2003 г. (19,0±2,6 %, p<0,01), что связано с улучшением выявления врожденных дефектов при УЗ-исследовании беременных на ранних сроках и своевременным медицинским прерыванием беременности.
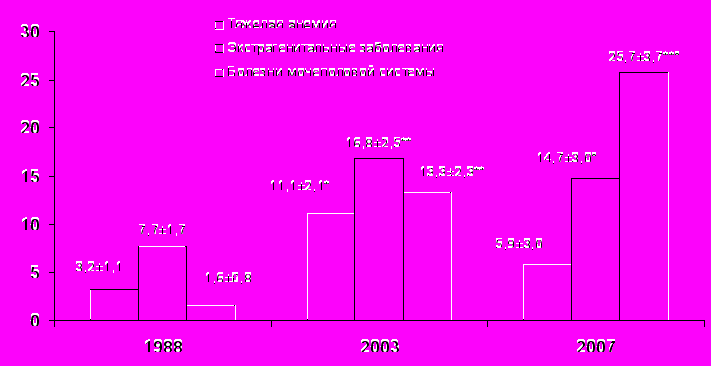
* p<0,01, ** p<0,001 – в сравнении с 1988 г; ° - p<0,05 – в сравнении с 2003 г.
Рис. 17. Состояние до беременности матерей погибших плодов и детей (%)
Рост ВУИ в структуре ПС можно объяснить ухудшением состояния здоровья женщин фертильного возраста до беременности. Экстрагенитальные заболевания, тяжелая анемия, болезни мочеполовой системы выявлены в 2,0–16,0 раза чаще, чем в 1988 г. (рис. 17). Снижение иммуноэндокринного статуса, низкий уровень прогестерона и высокая доля вторичных иммунодефицитных состояний определены у беременных женщин г. Хабаровска сотрудниками нашего института в прежние годы (Е.П. Когут и соавт., 1995, 2001; С.В. Кузнецова, 1998).
Нарко- и никотинозависимыми в 2003 г. и 2007 г. были 6,9 и 7,2 % рожениц. Не становятся на учет по беременности и не наблюдаются в женских консультациях до 20,0 % женщин. Длительный безводный период в родах (до 14 суток) был у 20,0 % матерей погибших плодов и новорожденных, что отражает не только влияние ВУИ, но кроме того – недостаточную осведомленность женщин о течении беременности и родов. Возраст вступления в половые отношения снизился до 12 лет. Эти факты связаны с деструктивными процессами в обществе, равнодушным отношением части молодых женщин к состоянию своего здоровья и здоровья ребенка, низким уровнем санитарного просвещения.
Частота и структура возбудителей ВУИ
при фетоинфантильных потерях
Тремя методами (МФА, БКМ и ПЦР) проведено исследование аутопсийного материала от 38 погибших плодов и новорожденных с морфологическими и клиническими признаками ВУИ.
Антигены или геном вирусов обнаружены у 28 обследованных (73,7±7,1 %). В большинстве случаев определено сочетание возбудителей (55,3±8,0 %), моноинфекции выявлены в 18,4±6,2 %. Совпадение результатов по методу ПЦР, который регистрирует нуклеотидные последовательности генома возбудителя, и методам БКМ и МФА, определяющим репродуцирующийся вирус, составило 57,9±8,0 %. При этом были зафиксированы патогномоничные для отдельных инфекций морфологические изменения (табл. 2).
Таблица 2
Характерные для отдельных возбудителей морфологические изменения,
обнаруженные при детекции вирусов разными методами в пробах
органов погибших плодов и новорожденных
| № | Данные протокола вскрытия | Органы | Вирус, метод | Морфологические признаки ВУИ |
| 1 | Поздний выкидыш на сроке 26 нед. гестации, масса тела 970 гр. Клинический диагноз: генерализованная ВУИ, ЗВУР | Головной мозг Сердце Печень | Evs (ПЦР) Evs (ПЦР) Evs (МФА) | Генерализованная форма инфекции: продуктивное воспаление в строме миокарда и почек, интерстиции легких, пролиферация бронхиального эпителия в форме «подушечек». В плаценте – очаговые кровоизлияния, некроз и склероз стромы ворсин |
| 2 | Преждевременные роды на 29 нед. гестации, прожил 2 дня, масса тела 1 600 гр. Клинический диагноз: асфиксия, СДР, гиалиновые мембраны | Почка, печень Лёгкое, печень | HIV A (МФА) HIV A (ПЦР) | Двухсторонняя серозно-геморрагическая пневмония с очаговыми некрозами, «подушкообразное» разрастание бронхиального эпителия, десквамация альвеоцитов с явлениями кариорексиса; бронхолегочная дисплазия. Неравномерное расправление распираторного отдела (очаги ателектаза и острой эмфиземы, гиалиновые мембраны), в децидуальной пластине плаценты – крупные клетки с гиперхромными ядрами. |
| 3 | Поздний самопроизвольный выкидыш, 26 нед. гестации, масса тела 970 гр. Клинический диагноз: генерализованная ВУИ | Лёгкое Почки Печень Головной мозг | HSV (МФА БКМ ПЦР) HSV (МФА) HSV (МФА) HSV (ПЦР) | Генерализованная форма ВУИ: продуктивный лимфоцитарный менингоэнцефалит, интерстициальная пневмония, эпиренит, мелкоузелковый некротический гепатит, кровоизлияния в надпочечниках, головном мозге и миокарде. Вилочковая железа гипоплазирована. Крупные ДНК-вирусные клетки с гиперхромными ядрами в эпителии бронхов. Гипоплазия плаценты, продуктивно-некротический лимфолейкоцитарный плацентит. |
Частота детекции отдельных возбудителей с использованием трех методов оказалась следующей: Evs – 34,2±7,7 %, HSV – 26,3±8,2 %, CMV – 26,3±8,2 %, респираторные вирусы – 23,7±6,7 %, Rub – 5,3±3,6 %, HHV-6 – 2,6±2,5 %. Среди энтеровирусов преобладали ECHO 22 типа, Коксаки А1-6, 11-15, 22 типов, Коксаки В1, 1-6.
Применение 3-х методов исследования аутопсийного материала объективизирует результаты, но длительно и трудоемко. Метод ПЦР лишен субъективности в оценке результатов реакции, присущей МФА и БКМ, а главное с его помощью в одной пробе можно в течение 1–2 дней проводить детекцию большого числа вирусных и бактериальных агентов, в частности трудно культивируемых (PV-B19, Rub, Chl. trachomatis, Ur. urealyticum, M. hominis). Последующее изучение аутопсийного материала при фетоинфантильных потерях осуществляли только методом ПЦР-диагностики с расширенным спектром выявляемых возбудителей.
Было проведено исследование образцов хориальной и плодовой тканей от ранних спонтанных выкидышей (135 проб) в сопоставлении с аналогичным материалом от добровольных медицинских абортов (70), а также проб, полученных при аспирационных биопсиях эндометрия вне беременности у женщин с невынашиванием (32) (рис. 18).
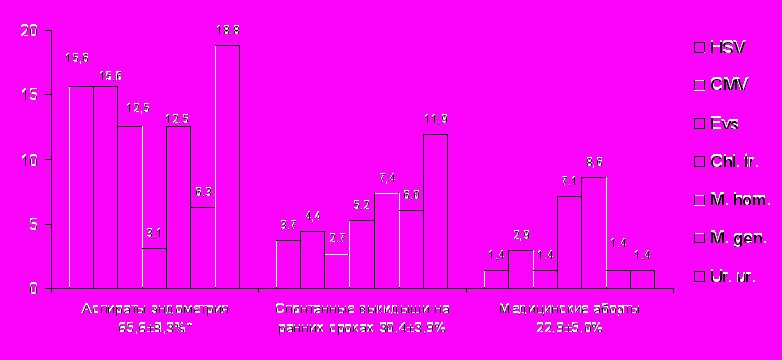 * p<0,001 – в сравнении с материалом от ранних спонтанных выкидышей и медицинских абортов
* p<0,001 – в сравнении с материалом от ранних спонтанных выкидышей и медицинских абортовРис. 18. Частота выявления возбудителей ВУИ в пробах аспирационных биопсий
эндометрия при привычном невынашивании беременности и в образцах хориальной
и плодовой тканей при ранних спонтанных выкидышах (%)
В аспиратах эндометрия женщин с привычным невынашиванием беременности процент инфицированных образцов (65,6±8,3 %) был в 2,2 и в 2,9 раза выше, чем в материале от ранних спонтанных выкидышей (30,4±3,9 %, p<0,01) и медицинских абортов (22,9±5,0 %, p<0,01). В пробах эндометрия и в тканях плодов при ранних выкидышах чаще определяли 2–3 возбудителя, а в материале от медицинских абортов – моноинфекции. В аспиратах полости матки и в тканях погибших плодов чаще всего обнаруживали возбудителей уреамикоплазмоза – 37,5±12,1 % и 23,7±3,7 %, что в 3,3–2,1 раза выше, чем при добровольных медицинских абортах – 11,4±3,8 % (p<0,05). Кроме того, в тканях погибших плодов и эндометрии выявляли HSV, CMV, Evs и Chl. trachomatis. L. monocytogenes обнаружена в одном случае в тканях плода при раннем спонтанном выкидыше.
Таким образом, детекция генома возбудителей ВУИ в образцах тканей погибших на ранних сроках гестации плодов и в пробах эндометрия показала значительную роль инфекционных процессов и трансмурального пути передачи в генезе раннего спонтанного прерывания беременности.
Методом ПЦР проведено изучение проб органов и плаценты от 80 случаев гибели плодов и новорожденных с признаками ВУИ, установленными клинически и при морфологическом исследовании (табл. 3).
Таблица 3
Частота обнаружения возбудителей ВУИ при потерях плода и новорожденного
методом ПЦР (n=80)
| Срок гестации 16–28 нед. поздние самопроизвольные выкидыши | Срок гестации 28–37 нед. мертворожденные – 9 недоношенные живорожденные – 14 | Срок гестации 38–40 нед. мертворожденные – 8 живорожденные – 3 |
| n = 46 | n = 23 | n = 11 |
| м о н о и н ф е к ц и я | ||
| CMV – 5 HSV – 6 Evs – 4 HHV-6 – 1 L. mon. – 8 | Evs – 2 CMV – 2 L. mon. – 1 | HSV – 3 Evs – 1 HHV-6 – 1 HIV A – 1 |
| с м е ш а н н ы е и н ф е к ц и и | ||
| HSV+HRSV – 1 HSV+CMV+ Chl. tr. – 2 HSV+CMV+Rub – 1 CMV+ Evs+Ur. ur. – 1 HSV+L. mon. – 1 HHV-6+L. mon. – 1 Evs+Ur. ur.+Chl. tr. – 1 | CMV+Evs – 1 Evs+Rub+HHV-6 – 1 Evs+Chl. tr.+L. mon. – 1 CMV+HHV-6 – 2 HSV+Evs+HRSV – 1 | CMV+Evs – 1 Rub+Evs – 1 |
| В с е г о п о л о ж и т е л ь н ы х р е з у л ь т а т о в (абс / %±m) | ||
| 32 / 69,56±6,8 | 11 / 47,83±10,4 | 8 / 72,73±13,4 |
Геном возбудителей ВУИ обнаружен в 51 случае (63,8±5,3 %). Среди положительных находок преобладали моноинфекции (43,8±5,5 %), сочетание возбудителей определено в 20,0±4,5 %. Чаще всего выявляли ДНК HSV, CMV, Evs. При этом морфологически была установлена ВУИ в генерализованной форме с поражением 3–5 органов и плаценты. Частота детекции отдельных возбудителей показана на рис. 19.
В мае – сентябре 2005 г. в аутопсийном материале от 10 поздних выкидышей из 23 исследованных (43,5±10,3 %) была определена ДНК L. monocytogenes. Культуральные, биохимические исследования, молекулярно-генетический анализ этого материала позволил установить патогенность выделенного сероварианта. В последующие годы выявление ДНК L. monocytogenes было спорадическим. В случаях детекции L. monocytogenes в аутопсийном материале в анамнезе у матерей были указания на лихорадку до 39°С во время беременности и родов, зеленый или желтый цвет околоплодных вод. Морфологически были обнаружены признаки ВУИ в форме генерализованной инфекции, гранулёзно-некротические изменения в печени, почках и селезёнке.
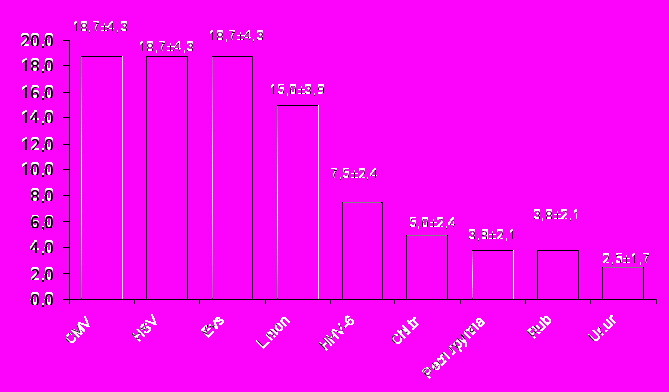
Рис. 19. Частота выявления возбудителей ВУИ в аутопсийном материале от погибших плодов
и новорожденных с морфологическими признаками инфекционно-воспалительных процессов (%±m)
Вирус HHV-6 обнаружен в 4-х случаях в сочетании с другими возбудителями, а в 2-х – в виде моноинфекции. Морфологически при этом находили ВУИ в генерализованной форме.
Если в целом при исследовании материала от 80 плодов и новорожденных ДНК Chl. trachomatis выявлена в 5,0 % случаев, то при целенаправленном изучении 20 плацент с наличием выраженных воспалительных процессов и/или дефектов развития установлен более высокий уровень инфицированности Chl. trachomatis – 45,0±11,1 %.
Не выявлены ДНК M. genitalium, T. gondii, HHV-4, HHV-8, HIV B, Adeno.
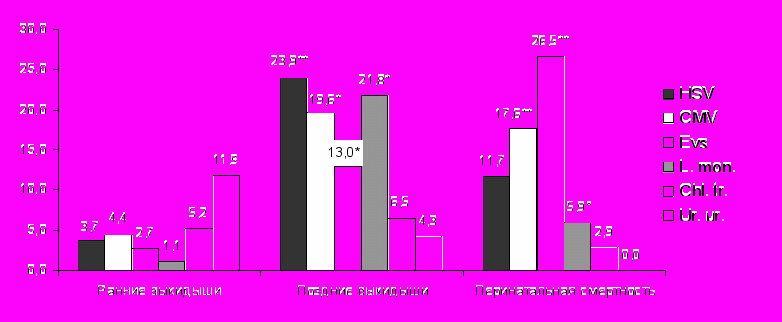 * p<0,05, ** p<0,01 – в сравнении с ранними выкидышами;
* p<0,05, ** p<0,01 – в сравнении с ранними выкидышами;° p<0,05 – в сравнении с поздними выкидышами.
Рис. 20. Частота выявления возбудителей ВУИ методом ПЦР в органах погибших плодов и новорожденных в зависимости от срока гестации (%)
Вирус краснухи определен в 3-х случаях, при этом не было анамнестических сведений о контакте матери с больным краснухой.
Учитывая тропизм PV-B19 к эритропоэтическим клеткам и эритробластам, способность вызывать анемию, отеки, многоводие, обследовано 16 погибших плодов с отечно-геморрагическим синдромом, PV-B19 не обнаружен.
Установлена зависимость частоты выявления отдельных возбудителей ВУИ от сроков гестации. При ранних выкидышах чаще определяли Ur. urealyticum, Chl. trachomatis, чаще проникающих в плод восходящим путем, при поздних – HSV, L. monocytogenes, CMV, при гибели плодов и новорожденных на сроке больше 28 недель гестации – Evs, CMV с наиболее вероятным путем проникновения в плодж гематогенно (рис. 20).
В изученном аутопсийном материале морфологические воспалительные изменения, свойственные вирусным инфекциям, установлены в 65,2±5,7 %, вирусно-бактериальным – в 34,8±5,7 %.
При детекции вирусов в изучаемых органах были обнаружены явления серозного, альтеративного, продуктивного воспалительного процесса – продуктивный лимфолейкоцитарный плацентит, продуктивный лимфоцитарный и серозно-лимфоцитарный энцефалит, пролиферативный эндоваскулит сосудов головного мозга, интерстициальная продуктивно-лимфоцитарная пневмония, очаги некроза в тканях легких, кариорексис в клетках бронхиального эпителия, продуктивный межуточный гепатит, миелоидная инфильтрация печеночных долек, интерстициальный фиброз поджелудочной железы, узелковое воспаление в надпочечниках. Регистрировали признаки длительного инфекционного процесса: клеточные инфильтраты в строме органов, очаги некроза с образованием кист, воспалительные гранулемы, кальцификаты. Фиксирован гигантоклеточный метаморфоз в различных тканях погибших: «ДНК-вирусные клетки» – увеличенные иногда до гигантских размеров клетки с крупными гиперхромными ядрами (иногда с ядрами неправильной формы) с явлениями глыбчатого или мелкоглыбчатого распада ядра, как правило, рядом с этими клетками находились очаги скопления лимфоцитов и очаги некроза; «РНК-вирусные клетки» – крупные, светлые клетки со светлыми крупными ядрами и мелкозернистой цитоплазмой. В этих же отделах отмечали отек, лимфоцитарную инфильтрацию и очаги некроза, иногда с кальцификатами. В 40,0 % случаев были выявлены признаки недостаточности иммунной системы: отсутствие явлений акцидентальной трансформации тимуса, лимфоидная гиперплазия и преждевременная жировая трансформация тимических долек, кистозное перерождение тимических телец, признаки гипоплазии тимического ретикулоэпителия.
Обнаружена патогномоничность морфологических изменений при детекции отдельных инфекционных агентов (табл. 4).
Отдельные возбудители ВУИ определялись в разных органах, что объясняется способностью инфекционных агентов хорошо размножаться в эмбриональных тканях. Самый высокий показатель детекции вирусов был в селезёнке и тимусе – по 9,6±1,6 %, почках – 7,3±1,4 %, лёгких – 4,9±1,1 %.
Таблица 4
Антенатальные воспалительные поражения органов и выявленные
инфекционные агенты
| Характерные морфологические изменения | Возбудитель |
| Серозно-геморрагическая пневмония, «подушкообразное» разрастание бронхиального эпителия, десквамированные альвеолоциты с крупными светлыми ядрами, явления кареорексиса, бронхолегочная дисплазия с преобладанием интерстиции | HIV A |
| ВУИ в генерализованной форме, лимфоцитарный менингоэнцефалит, продуктивно-некротический гепатит, интерстициальная пневмония, ДНК-вирусные клетки в плаценте | HSV |
| Продуктивная инфильтрация в строме миокарда, язвенно-некротический энтероколит, РНК-вирусные клетки в плаценте | Evs |
| ВУИ в генерализованной форме, гепатит, миокардит, плацентит, фиброкистоз околоушных желез, ДНК-вирусный метаморфоз | CMV |
| Продуктивный мелкоузелковый некротический гепатит, плацентит | L. mon. |
| Плацентит, патологическая незрелость плаценты, пороки развития плаценты, децидуальные клетки с базофильными включениями | Chl. tr. |
Показана возможность использования метода ПЦР для выявления причин младенческой смертности. При изучении аутопсийного материала в случае смерти ребенка до года с явлениями остро развившейся сердечной и дыхательной недостаточности обнаружили ДНК CMV, РНК Evs в пробах почек, печени, сердца в сочетании с фиброэластозом в мышцах и эндокарде сердца, персистенцией эмбриональных тканевых структур почек и легких, выраженными явлениями миелоидной инфильтрации печеночных долек, нарушением тканевого строения органов иммуноэндокринной системы, которые свидетельствовали о длительном антенатальном инфекционном процессе. Присоединение острой респираторной вирусной инфекции привело к развитию инфекционного процесса в лёгких, вызвало резкую и очень быструю декомпенсацию, в легких обнаружили HRSV.
Резюмируя вышесказанное, можно сказать, что использование метода ПЦР перспективно для выявления возбудителей ВУИ в аутопсийном материале при фетоинфантильных потерях, позволяет проводить экспресс-диагностику широкого круга вирусов и бактерий, в том числе трудно культивируемых, в аутопсийном материале. Этиологическая роль выявленных вирусов подтверждается наличием патогномоничных и неспецифических альтеративно-продуктивных и диспластических изменений в тканях, гигантоклеточным метаморфозом, морфологическими признаками иммунодефицитного состояния.
Бессимптомные и персистирующие инфекции матери
как тератогенный фактор
Анализ 2 832 протоколов вскрытия погибших плодов и новорожденных с 1993 по 2004 г. показал, что частота врожденных дефектов при фетоинфантильных потерях колебалась по годам от 12 до 24 на 100 летальных случаев с пиком в 1998, 2000, 2004 гг. Подъем частоты летальных врожденных дефектов произошел синхронно с экологическими катастрофами – обширными лесными пожарами в эти годы в Хабаровском крае. Дым содержит тератогенные факторы и способствует развитию гипоксии плода.
При анализе 480 случаев летальных ВД констатировано, что группа «гаметопатии» составила 19,8 % (рис. 21). Нарушения развития плода в результате хромосомных аберраций определены в 37 случаях (7,7 %): синдром Дауна (30 случаев), синдром Эдвардса (3), синдром Патау (3), синдром Тернера (1). Генные нарушения, передающиеся по законам Менделя (33), и с неуточненным типом наследования (25) выявлены в 12,1 %.
Среди ВД наиболее многочисленна группа «бласто- и эмбриопатий» – 59,8 %. Изолированные и системные ВПР диагностированы в 38,1 % случаев, в том числе ВПР центральной нервной системы – 13,9 %, сердечно-сосудистой системы – 12,5 %, органов пищеварения – 5,6 %, бронхолёгочной системы – 3,9 %, почек и мочевыводящих путей – 1,7 %. Множественные неклассифицированные комплексы обнаружены в 21,7 %.
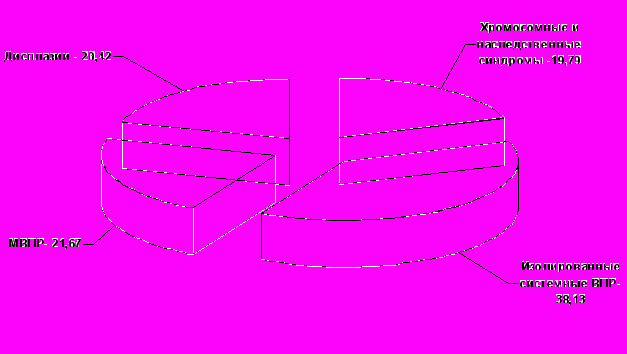
Рис. 21. Структура врожденных дефектов развития при фетоинфантильных потерях (%)
Врожденные дефекты по типу тканевых дисплазий или фетопатии явились причиной смерти плода или новорожденного в 20,4 %, при этом во всех случаях гистологическое исследование показало наличие диспластических процессов в органах иммунной системы. Кроме того, тканевые дисплазии выявляли в сочетании с гамето- и эмбриопатиями. Фетопатии могут развиться в результате генерализованной ВУИ с преобладанием альтеративного и экссудативного компонента с исходом в фиброзно-склеротические деформации органов. Чаще всего в головном мозге находили нарушение цитоархитектоники коры больших полушарий, микрополигирию, в сердце – очаговый фиброэластоз, липоматоз, в лёгких – бронхиоло-сосудистую дисплазию, дистелектаз, гипоплазию, бронхиальные кисты, в почках – микронефронию, олигонефронию, дисплазию с наличием эмбриональных клубочков, в печени – гипоплазию и пролиферацию внутрипечёночных желчных ходов, в поджелудочной железе – незидиодисплазию, в надпочечниках – гипоплазию коркового и мозгового слоев, дисплазию мозгового слоя, аденоматоз, в тимусе – тимомегалию, дисплазию тимических долек, преждевременную жировую трансформацию.
Методом ПЦР изучены образцы органов от 58 погибших плодов и новорожденных с врожденными дефектами развития, морфологическими проявлениями ВУИ и тканевыми дисплазиями (табл. 5). Геном возбудителей ВУИ определен в 60,34 % исследованных случаев, моноинфекции обнаружены – в 44,83 %, смешанные инфекции – в 15,52 %.
Таблица 5
Частота выявления возбудителей перинатальных инфекций при фетоинфантильных потерях с врожденными дефектами развития методом ПЦР
| № п/п | Врожденная аномалия | n | ___абс___ %±m | Моноинфекции | Сочетание возбудителей |
| 1 | Изолированные и системные врожденные пороки развития, тканевые дисплазии | 21 | ___14___ 66,67±10,3 | HSV – 4 CMV – 1 Evs – 2 Rub – 3 HRSV – 1 | CMV+Rub – 1 HSV+CMV – 1 L. mon.+HHV-6 – 1 |
| 2 | Неклассифицированные комплексы МВПР, тканевые дисплазии | 17 | ___7___ 41,17±11,9 | HSV – 1 CMV – 2 Evs – 3 | HSV+CMV – 1 |
| 3 | Генерализованная ВУИ, тканевые дисплазии | 20 | ___14___ 70,0±10,2 | HSV – 4 CMV – 3 Evs – 2 | HSV+Evs – 1 HSV+Rub – 1 CMV+Rub – 1 CMV+HHV-6 – 1 CMV+Evs+HHV-6 –1 |
| 4 | Всего | 58 | ___35___ 60,34±6,4 | ___26___ 44,83±6,5 | ___9___ 15,52±4,8 |
Частота детекции отдельных инфекционных агентов показана на рис. 22. Возбудители токсоплазмоза, хламидиоза, уреамикоплазмоза, вирус Эпштейна-Барр, PV-B19 не выявлены.
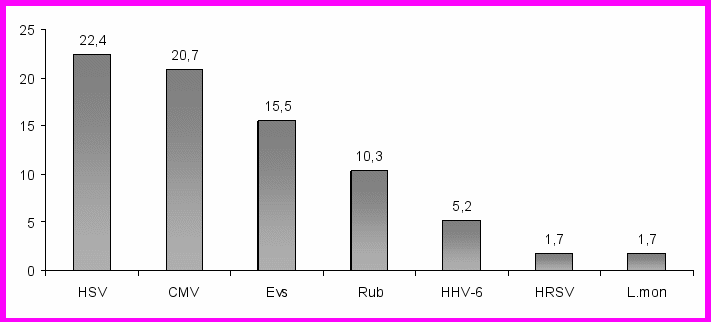
Рис. 22. Частота выявления возбудителей ВУИ при исследовании аутопсийного материала
от погибших плодов и детей с врожденными аномалиями развития методом ПЦР (%)
Частота определения возбудителей TORCH-инфекций варьировала в различных органах от 4,9±1,5 % (в сердце) до 8,8±1,9 % (в почках). В случаях выявления РНК Rubella в аутопсийном материале в анамнезе у матери не были зарегистрированы заболевания краснухой или контакт с больным краснухой перед зачатием или во время беременности, тем не менее РНК Rubella обнаружили в 10,3±5,8 %. Источником краснушной инфекции для беременной могут быть не только дети с манифестной формой инфекции, но и дети, и взрослые со стертой, бессимптомной или субклинической инфекцией. Эти факты требуют более тщательной диагностики бессимптомной краснухи у беременной, в частности при заболевании ОРВИ.
Органотропность возбудителей ВУИ проявлялась в формировании патогномоничных морфологических изменений (табл. 6).
Таблица 6
Врожденные дефекты и выявленные возбудители ВУИ
| Врожденный дефект | Возбудитель |
| Аплазия лёгкого, ложная или истинная диафрагмальная грыжа с вторичной гипоплазией лёгкого | HRSV, HSV, HIVA |
| МВПР, включающие пороки сердца (общий артериальный ствол, транспозиция магистральных сосудов, продуктивная инфильтрация в строме миокарда) и глаз (катаракта). | Rub |
| Гастрошизис, болезнь Гиршпрунга, врожденные пороки сердца, микроцефалия, аденоматоз надпочечников, синдром МВПР | Evs |
| Микроцефалия, гидроцефалия, поликистоз больших полушарий головного мозга, порэнцефалия, спинномозговая грыжа, глиоматоз головного мозга, стеноз аорты, фиброкистоз околоушных желёз, поликистоз и аденоматоз коры надпочечников, множественные диспластические пороки, поликистоз почек, гипоплазия лёгких, гипоплазия и дисхрония лёгких, гипоплазия и кальцификация тимуса, тимома лимфоидного типа | CMV |
| Врожденная тимома, дистелектаз лёгких, полимикрогирия, микроэнцефалия, гидроцефалия, порок лёгкого, нейробластома крестцово-копчиковой области, аденоматоз надпочечников, лимфангиома шеи | HSV |
| Пороки последа: пороки пуповины и ее прикрепления, добавочная долька плаценты | L. mon. Chl. tr. |
Известно, что для каждого органа существуют критические периоды, которые соответствуют стадии максимального напряжения обменных процессов в ходе его формирования. Если инфицирование плода происходит в одни и те же периоды развития, то разные вирусы обусловливают сходные нарушения. С другой стороны, один и тот же вирус, поражая зародыш в разные гестационные сроки, приводит к формированию разных ВПР. В наших наблюдениях в 34,5 % случаев врожденных летальных дефектов были определены морфологические признаки генерализованной ВУИ, диспластические процессы в тканях с формированием врожденных дефектов нескольких органов, при этом обнаруживали различные вирусы и их ассоциации. В остальных случаях установлены известные для конкретных возбудителей ВПР, а также выявлены ранее не описанные сочетания: HRSV, HIV A и врожденные пороки лёгких, Evs и гастрошизис, болезнь Гиршпрунга, HSV и нейробластома крестцово-копчиковой области, L. Monocytogenes, Chl. trachomatis и пороки последа.
Таким образом, детекция нуклеотидных последовательностей возбудителей ВУИ в аутопсийном материале при врожденных летальных дефектах развития с диспластическими изменениями в тканях установила значительную роль инфекционного процесса в мультифакториальной природе тератогенеза.
С целью определить возможность участия ВУИ в формировании хронических воспалительных заболеваний лёгких у детей изучено 22 случая гибели плодов с гистологически выявленными бронхолёгочными дисплазиями (дистелектаз, фиброзная дисплазия, очаговая гипоплазия бронхиол, незрелость лёгочной ткани с преобладанием стромальных компонентов, периваскулярный фиброз в виде муфт). Инфекционные агенты установлены в виде моно- и смешанных инфекций в 15 случаях (68,2±9,9 %), в том числе Evs – 5 случаев, CMV – 4, Rubella – 3, HHV-6 – 2, HSV – 2, HRSV – 1, HIV-A – 1. Не определены такие инфекционные агенты как T. gondii, HHV-4, Chl. trachomatis, M. hominis, Ur. urealyticum. Анализируя полученные результаты, можно заключить, что ВУИ могут быть одним из механизмов формирования бронхолёгочных дисплазий и хронических рецидивирующих заболеваний бронхолёгочной системы у детей младенческого и старшего возраста.
Проведенные исследования позволили усовершенствовать дородовую и раннюю диагностику ВУИ, уточнить существующие представления и получить новые данные о распространенности и путях передачи ВУИ, о влиянии отдельных возбудителей TORCH-комплекса на заболеваемость новорожденных и младенцев, формирование фетоинфантильных потерь и врожденных дефектов развития. В условиях плацентарной недостаточности и перинатальной гипоксии повышается активность репликации вирусов с появлением нового вирусного потомства. Вероятность инфекционного поражения плода зависит от вирусной нагрузки, от сочетания инфекции с другими патогенетическими факторами, при этом вирусная инфекция может играть коморбидную роль, провоцируя или усиливая патогенетические процессы. Исходы беременности для плода при этом варьируют от отсутствия клинических проявлений или неспецифических симптомов и нарушения процессов адаптации у новорожденного до клинически выраженных форм в раннем или отдаленном периодах. Дородовое выявление активизации вирусной инфекции способствует формированию групп риска, направлено на предупреждение врожденной патологии.
Потеря плода и ребенка – всегда трагедия для семьи. Использование современного молекулярно-биологического метода ПЦР для детекции возбудителей ВУИ в аутопсийном материале позволяет найти вероятное этиологическое объяснение причин фетоинфантильных потерь и врожденных дефектов, способствует адекватной реабилитационной терапии женщин и улучшению прогноза и исхода будущих беременностей. ВУИ – важное патогенетическое звено в совокупности факторов, обусловливающих формирование потерь плода и новорожденного. При выявлении в аутопсийном материале Chl. trachomatis, Ur. urealyticum, L. monocytogenes необходимо лечение матери антибиотиками. При детекции таких возбудителей как Rubella и Toxoplasma gondii образуется стойкий иммунитет, предотвращающий гибель плода при следующей беременности. Определение в аутопсийном материале Herpes simplex virus, Cytomegalovirus, Enteroviruses требует мероприятий по укреплению неспецифического иммунитета, противовирусной терапии, выявление вируса гриппа – вакцинации. Устранение потенциальных мутагенов и тератогенов может быть включено в систему преконцепционной профилактики супружеских пар, имеющих детей с врожденной паталогией. Разработка метода детекции инфекционных агентов с помощью ПЦР практически в любом клиническом материале, в том числе аутопсийном, биопсийном, постоянно пополняющийся список выпускаемых амплификационных тест-систем для ПЦР расширяют возможности диагностики ВУИ. Метод ПЦР перспективен для исследования клинического материала у новорожденных с врожденными пневмониями, неонатальным сепсисом, везикулопустулёзом, с перинатальным поражением ЦНС и т.д.
