Альний науковий селекційно-генетичний центр з вівчарства вівчарство міжвідомчий тематичний науковий збірник Випуск 35 Нова Каховка «пиел» 2009
| Вид материала | Документы |
- Науковий вісник, 5717.63kb.
- Збірник «студентський науковий вісник» Довідки, 26.92kb.
- Про затвердження Програми інвестиційного розвитку міста Нова Каховка до 2015 року, 735.83kb.
- Про затвердження Програми інвестиційного розвитку міста Нова Каховка до 2015 року, 740.27kb.
- Перелік публікацій кафедри журналістики за 2009 рік, 185.73kb.
- Bene diagnostitur bene curatur (якісна діагностика якісне лікування)/ М. Денисенко//Науковий, 194.1kb.
- Опис сортів та гібридів сільськогосподарських культур поширених по полтавській області, 2983.38kb.
- Заявка на участь у конференції, 82.92kb.
- Автореферат дисертації на здобуття наукового ступеня, 360.76kb.
- Регіональний науковий юридичний альманах молодих дослідників українська державність, 2685.65kb.
Таблиця 2. Перетравність поживних речовин та середньодобовий баланс азоту у піддослідних баранців, (
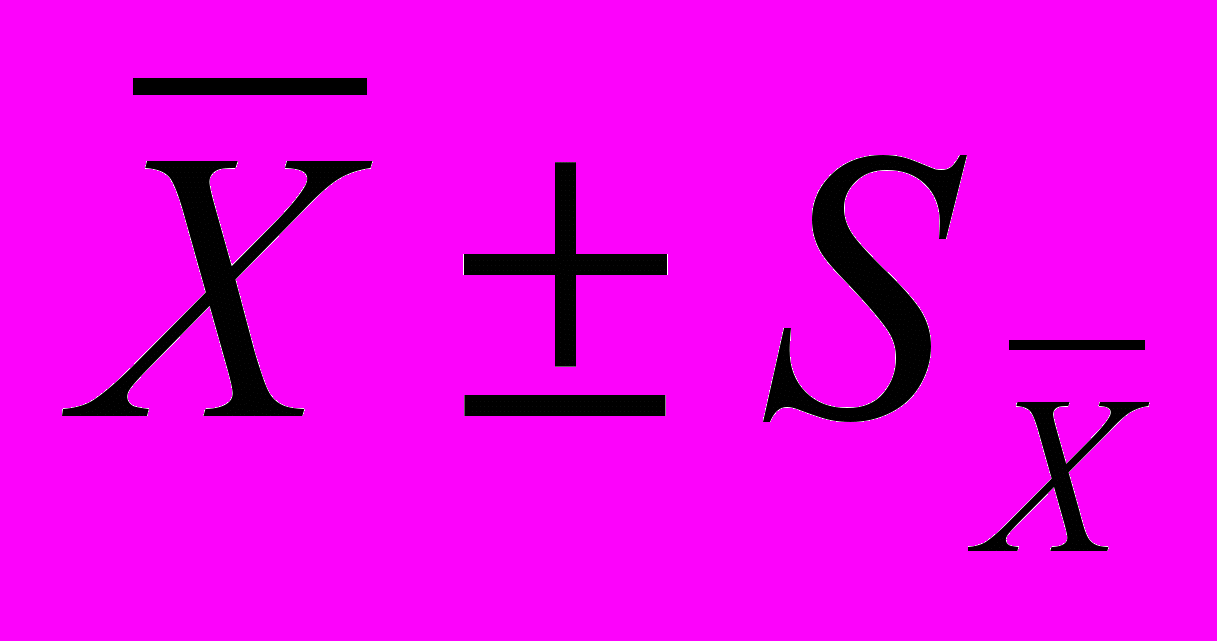 )
)| Показник | Група тварин | ||
| контроль | дослід | ||
| Поживні речовини | Суха речовина, % | 56,16±1,92 | 59,12±2,80 |
| Органічна речовина, % | 57,53±1,87 | 60,79±2,90 | |
| Протеїн, % | 54,95±1,20 | 58,94±4,21 | |
| Жир,% | 72,21±2,29 | 78,95±3,29 | |
| Клітковина, % | 58,57±2,24 | 58,73±5,67 | |
| БЕР,% | 71,94±2,79 | 70,92±1,83 | |
| Баланс азоту | Прийнято з кормом, г | 28,85±0,88 | 30,06±1,02 |
| Виділено з калом, г | 13,00±0,83 | 12,34±1,07 | |
| Перетравлено, г | 15,85±1,37 | 17,72±0,22 | |
| Виділено з сечею, г | 11,58±0,98 | 12,76±0,21 | |
| Відкладено в тілі, г | 4,27±0,58 | 4,96±0,42 | |
| % використання від прийнятого | 14,80±1,65 | 16,50±1,72 | |
| % використання від перевареного | 26,94±2,60 | 27,99±2,44 | |
Дослідження щодо перетравності та балансу поживних речовин у фізіологічному досліді показали, що використання біологічно активного препарату „Спікел” у дозі 1,0 мг на 1 кг живої маси разом із сольовою сумішшю сприяло більшому перетравленню протеїну та жиру у дослідній групі у порівнянні з контролем відповідно на 7,26% та 9,33% при (P<0,95).
Оскільки в обмінних реакціях організму провідне місце займає обмін білків [8], у балансовому досліді на трьох баранцях із кожної піддослідної групи визначали баланс азоту. Встановлено, що кращою перетравністю та більш високим коефіцієнтом засвоювання азоту відзначалися баранці дослідної групи. У середньому за добу вони перетравлювали 17,72 г азоту, що на 11,7% більше у порівнянні з контрольними тваринами. У досліді відмічена також підвищена екскреція азоту з сечею на 1,18 г у порівнянні з контрольними аналогами. Однак, не дивлячись на те, що загальні виділення азоту у тварин дослідної групи перевищували контроль на 0,52 г на добу, у них його також більше відкладалося у тілі. Так, якщо в контрольних баранців у середньому за добу засвоєння азоту становило 4,27 г, то у дослідній групі відповідно 4,96 г, що на 0,69 г (Р<0,95), або 16,1 % більше. Якщо проаналізувати відкладання азоту в тілі відносно прийнятої його кількості, то видно, що у баранців дослідної групи цей показник був вищим від контролю (на 1,7 і 1,05 абсолютних відсотка). Поряд з вивченням перетравності поживних речовин та азоту розраховано баланси кальцію, фосфору та магнію, що дало змогу судити про інтенсивність мінерального обміну в організмі тварин. Результати наведено у таблиці 3.
Таблиця 3. Середньодобовий баланс кальцію, фосфору та магнію піддослідних баранців, (
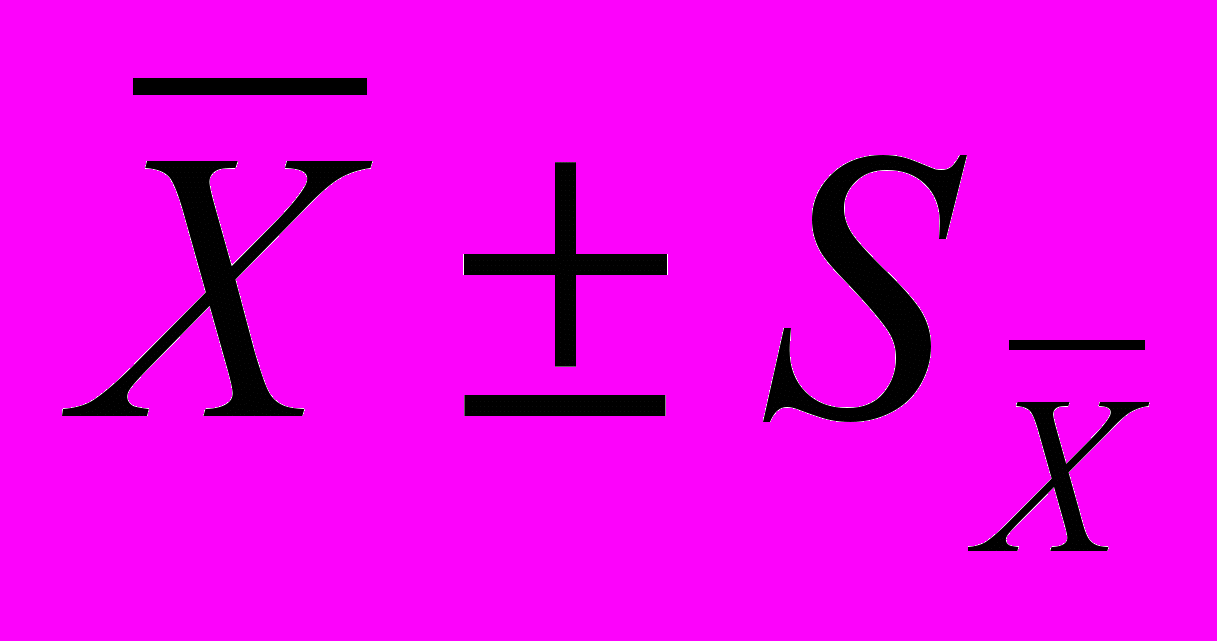 )
)| Показник | Група тварин | ||
| контроль | дослід | ||
| Кальцій | |||
| Прийнято з кормами | 8,49±0,40 | 9,37±0,68 | |
| Виділено | з калом | 6,29±0,40 | 6,82±0,41 |
| з сечею | 0,29±0,03 | 0,31±0,04 | |
| всього | 6,58±0,40 | 7,13±0,43 | |
| Відкладено в тілі | 1,91±0,16 | 2,24±0,33 | |
| % використання | 22,47±1,70 | 23,91±2,51 | |
| Фосфор | |||
| Прийнято з кормами | 3,77±0,28 | 4,07±0,20 | |
| Виділено | з калом | 2,72±0,25 | 2,89±0,19 |
| з сечею | 0,21±0,01 | 0,24±0,01 | |
| всього | 2,93±0,26 | 3,13±0,20 | |
| Відкладено в тілі | 0,84±0,02 | 0,94±0,11 | |
| % використання | 22,28±1,64 | 23,10±2,55 | |
| Магній | |||
| Прийнято з кормами | 5,88±0,55 | 6,28±0,59 | |
| Виділено | з калом | 5,41±0,48 | 5,72±0,55 |
| з сечею | 0,10±0,02 | 0,10±0,02 | |
| всього | 5,51±0,48 | 5,82±0,55 | |
| Відкладено в тілі | 0,37±0,12 | 0,46±0,05 | |
| % використання | 6,29±1,86 | 7,32±0,45 | |
Встановлено, що при використанні біологічно активного препарату „Спікел” тварини дослідної групи споживали кальцій, фосфор та магній у порівнянні з контрольною групою більше на 0,88 г; 0,33 г і 0,40 г, або 10,4 %; 7,9 % і 6,8 % відповідно. У досліді відмічена також підвищена екскреція цих елементів з калом на 0,53 г; 0,17 г і 0,31 г у порівнянні з контрольними аналогами. За сукупною кількістю видалених мікроелементів із сечею значної різниці не відмічено. Таким чином, у тілі тварин, котрі отримували „Спікел”, відкладання кальцію, фосфору та магнію було вищим, ніж у контролі на 0,33 г; 0,10 г і 0,09 г, або 17,3 %; 11,9 % і 24,3% (Р<0,95).
Цей експериментально доведений результат можна пояснити з одного боку підвищенням метаболічної активності організму ягнят дослідної групи за рахунок більшого (на 11 %) споживання ними води, що сприяє інтенсивності всмоктування поживних речовин і мінеральних солей, а з іншого – біологічно активний препарат “Спікел” містить у собі молекулу янтарної кислоти (С4Н6О4), яка приймає участь у всіх енергетичних процесах перетравлення поживних речовин корму, де у кінцевому результаті виділяється вуглекислий газ і, виконуючи одну із ключових ролей у клітинному диханні, ця кислота приймає участь у синтезі амінокислот, будівельних цеглинок білка організму, сприяючи підвищенню конверсійної здатності кормів.
Висновки. Новий технологічний спосіб використання біологічно активного препарату “Спікел” разом із сольовою сумішшю у дозі 1 мг на 1 кг живої маси підвищує: рівень загального білка у сироватці крові на 3,0%; перетравлення протеїну та жиру на 7,26% і 9,33 %; засвоєння азоту на 16,1%; кальцію на 17,3%; фосфору на 11,9%; магнію на 24,3%, що сприяє значному зростанню інтенсивності відгодівлі (на 16,8%).
Список використаної літератури
1. Биологически активные вещества – потенциальный резерв повышения продуктивности птицы / [Лукъянов А. Ф., Сенько А. Я., Топурия Г. М., Бакаева Л. Н. ]. – Оренбург : Издательский центр ОГАУ, 2006. – 194 с.
2. Петрушенко Ю. Н. Научно-практические особенности использования биологически активных веществ при производстве свинины : автореф. дис. на соискание научной степени д-ра с.-х. наук : спец. 06.02.02 “кормление сельскохозяйственных животных и технология кормов” / Ю. Н. Петрушенко. – Краснодар, 2009. – 43 с.
3. Гноєвий І. В. Продуктивність і захисні функції організму телят при згодовуванні їм біопрепарату “Байкал ЕМ-1-У” / І. В. Гноєвий, Е.С. Кутіков // Вісник Черкаського Інституту АПВ: міжвід. темат. наук. зб. – Черкаси, 2004. – Вип. 4. – С. 45-53.
4. Деклараційний патент № 35212 А Україна, МПК А 23 К 1/22 Моносіль 6,6,61,61 тетраметил 2,21, діоксо 4,41 спіробі/гексагідропірамідіну/ янтарної кислоти призначена для стимуляції росту і розвитку тварин та спосіб її використання / В. М. Туринський [ та ін.]; ІЕКВМ УААН. –№99094931; заявл. 03.09.1999; надрук. 15.03.01. Бюл 2. – 3с.
5. Викторов П. И. Методика и организация зоотехнических опытов : учеб. пособие / П. И. Викторов, В. К. Менькин. – М.: ВО Агропромиздат, 1991. – 112 с.
6. Плохинский Н. А. Руководство по биометрии для зоотехников / Н. А. Плохинский. – М.: Колос, 1969. – 255 с.
7. Гіржева О. Л. Продуктивність асканійського багатоплідного типу каракульських овець при згодовуванні ріпакової макухи, збагаченої підвищеними рівнями мікро- і мікроелементів : автореф. дис. на здобуття наук, ступеня канд. с.-х. наук : 06.02.02 “годівля сільськогосподарських тварин” / О. Л. Гіржева. – Львів, 2004. – 19 с.
8. Сивик Т.Л. Перетравність поживних речовин, баланс азоту та мінеральних елементів у асканійських тонкорунних ярок при споживанні гіпергалинної аквакультури в складі комбікорму / Т.Л. Сивик, А.Є. Сивик // Таврійський вісник: зб. наук. пр. – Херсон: Айлант, 1998. – № 12. – С. 71-74.
Г е н е т и к а т а в і д т в о р е н н я о в е ц ь
УДК: 636.32/38:612.6
БИОТЕХНОЛОГИЯ СОХРАНЕНИЯ И РАЦИОНАЛЬНОГО
ИСПОЛЬЗОВАНИЯ ГЕНОФОНДА МОЛОЧНЫХ КОЗ
М.М. Айбазов, д-р с.-х. наук,
П.В. Аксенова, канд.биол. наук,
Ставропольский НИИ животноводства и кормопроизводства, Росія
В статье изложены результаты по сравнительному испытанию синтетических сред для разбавления спермы козла и краткосрочного ее хранения при температуре тающего льда. Приводятся данные лабораторных исследований качества сохраняемой спермы (подвижности и выживаемости) и научно-производственного эксперимента по определению ее оплодотворяющей способности. Делается вывод о достоверных преимуществах новой экспериментальной среды перед известными, в т.ч. патентованной средой OVIX CELL, а также даются рекомендации по ее применению.
Ключевые слова: козлы, сперма, синтетическая среда, подвижность, выживаемость, оплодотворяющая способность.
В настоящее время в Российской Федерации достаточно успешно решены проблемы краткосрочного и длительного сохранения гамет многих сельскохозяйственных животных. В то же время, не была в должной степени разработана технология хранения спермы козла. В последние годы, в связи с быстрым развитием молочного козоводства, эта проблема стала очень актуальной. Более того, недостаточное количество высокоценных производителей, в т.ч. импортной селекции, требует их рационального использования, что предопределяет целесообразность транспортировки охлажденной/замороженной спермы к месту использования, зачастую за тысячи километров. В связи с этим, перед козоводами встала задача разработки технологии краткосрочного (в течение 12-72 часов) сохранения спермы козла. Более того, в связи с интенсивным развитием новых форм хозяйствования на селе (КФХ, ЛПХ) технология воспроизводства коз, основанная на организации осеменения с использованием краткосрочно сохраняемой спермы, будет в дальнейшем иметь еще большую востребованность.
В качестве первого шага необходимо разработать синтетические среды для разбавления спермы козла, которые бы сохраняли ее высокое качество. Известны среды для разбавления спермы баранов, включающие дисахара, желток куриного яйца, глицерин, буферные компоненты, ксилит, а также полисахариды: гуммиарабик, декстрин [1, 2]. Однако, как показали наши предварительные исследования, эти среды не приемлемы для спермы козла при ее краткосрочном хранении, т.к. не обеспечивают удовлетворительную для практики оплодотворяемость коз.
Целью собственных исследований являлась разработка технологии краткосрочного хранения спермы козла. При этом планировалось выполнение следующих научных задач:
1) усовершенствовать синтетические среды для краткосрочного хранения спермы козлов;
2) определить оплодотворяющую способность спермы козла после краткосрочного (12-36 часов) хранения.
Материал и методика исследований. Экспериментальные исследования проведены в лаборатории воспроизводства, на опытной станции ГНУ СНИИЖК, в отделе воспроизводства и биотехнологии Бел.НИИЖ, а также в Институте биологии гена РАН и ООО «Атлант» Шаховского района Московской области. Объектом исследований были молочные козы (самцы и самки) зааненской породы.
Сперму от козлов получали в искусственную вагину и исследовали по «Инструкции по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов сельскохозяйственных животных» (М., 2000) [3]. Каждый эякулят оценивали по подвижности, объему и концентрации. Концентрацию спермиев определяли в счетной камере Горяева. Путем проведения сравнительных лабораторных, а затем производственных тестов устанавливали оптимальные прописи рецептур синтетических разбавителей, максимально сохраняющие биологическую полноценность спермы.
Оплодотворяющую способность спермы козла после краткосрочного хранения устанавливали в производственных опытах при осеменении коз.
Результаты исследований. Лабораторный опыт 1. В задачи эксперимента входило конструирование оптимального состава синтетической среды, предназначенной для разбавления спермы перед ее охлаждением до температуры тающего льда и последующей транспортировки на определенные расстояния. Эксперимент проводили на козлах зааненской породы племрепродуктора СНИИЖК. Для разбавления спермы использовали 4 синтетические среды. В качестве контроля использовали глюкозо-цитратную среду, рекомендованную «Инструкцией по искусственному осеменению овец и коз» (М.,2000), в качестве прототипов - глюкозо-фосфатную (натрий фосфорнокислый двузамещенный, калий фосфорнокислый однозамещенный, глюкоза медицинская, желток куриного яйца); лактозную (лактоза; желток куриного яйца), экспериментальную среду, сконструированную нами по оригинальному рецепту.
Входящие в состав синтетической среды компоненты прошли специальную проверку на бактериальную загрязненность и безвредность для спермы. Синтетические среды готовили в стерильных условиях лаборатории. Навески сухих компонентов растворяли в колбе с прокипяченной дистиллированной водой, охлажденной до +70…+80°С. Желток добавляли в раствор после его охлаждения до +40° С. Среды использовали в течение 2 часов с момента приготовления.
Сперму с концентрацией спермиев не ниже 2,5 млрд. в 1 мл и подвижностью не менее 8 баллов разбавляли испытуемыми синтетическими средами в соотношении от 1:3 до 1:4 при температуре среды + 20…+25оС. Разбавленную сперму разливали в стеклянные флаконы объемом 10 мл и помещали в холодильник при температуре +2…+4оС на 72 часа. Для равномерного охлаждения спермы флаконы с разбавленной спермой помещали в поролоновые вкладыши.
Охлажденную сперму оценивали на подвижность по десятибалльной шкале после дополнительного разбавления в отношении 1:2 изотоническим раствором лимоннокислого натрия (3,1%), для чего каплю исследуемой спермы рассматривали под микроскопом в термостате при температуре +38оС …+40оС. Для определения выживаемости спермиев производили оценку по подвижности сразу после разбавления и через каждые 2 часа до гибели половых клеток.
Наилучшее качество спермы при краткосрочном сохранении ее при температуре тающего льда было в экспериментальной и глюкозо-фосфатной средах (табл.1).
Если после разбавления испытуемыми средами подвижность спермы во всех вариантах опыта была практически одинаковой, то после 8-12 часового хранения этот показатель в фосфатном и экспериментальном разбавителях достоверно (Р<0,05) превышал цитратный и лактозный разбавители. Через 24-30 часов после разбавления и до 42 часов преимущество первых было постоянным. После 42 ч. хранения в лактозной среде и после 44 ч. хранения в цитратной среде спермии погибали, тогда как в указанные сроки в фосфатном и экспериментальном разбавителях их подвижность составляла соответственно 3,0 и 2,5 баллов. Выживаемость спермы в указанных средах достигла 56-60 часов.
Таблица 1. Подвижность спермы после разбавления
| Подвижность спермы, проб(п=10) | Среда для разбавления спермы | |||
| фосфатная | цитратная | эксперимен-тальнаяй | лактозная | |
| После разбавления | 8,2±0,01 | 8,5±0,02 | 8,3±0,02 | 8,0±0,01 |
| Через 2 ч. | 8,0±0,02 | 8,0±0,02 | 8,0±0,04 | 8,0±0,04 |
| Через 4 ч. | 8,0±0,02 | 8,0±0,05 | 8,0±0,03 | 8,0±0,03 |
| Через 6 ч. | 8,0±0,01 | 7,7±0,02 | 8,0±0,03 | 7,0±0,03 |
| Через 8 ч. | 7,0±0,04 | 6,8±0,03 | 7,5±0,03 | 6,2±0,02 |
| Через12 ч. | 6,8±0,03 | 5,9±0,01 | 7,0±0,02 | 5,5±0,04 |
| Через16 ч. | 6,5±0,01 | 5,5±0,02 | 6,5±0,02 | 5,5±0,01 |
| Через18 ч. | 6,5±0,02 | 4,5±0,02 | 6,5±0,01 | 5,5±0,01 |
| Через20 ч. | 6,0±0,04 | 4,0±0,01 | 6,5±0,01 | 5,0±0,01 |
| Через24 ч. | 6,0±0,01 | 4,0±0,01 | 6,0±0,01 | 4,5±0,01 |
| Через28 ч. | 5,5±0,03 | 3,5±0,01 | 5,3±0,03 | 4,5±0,02 |
| Через30 ч. | 4,5±0,02 | 3,5±0,01 | 4,0±0,01 | 3,5±0,02 |
| Через 32ч. | 4,0±0,03 | 3,0±0,02 | 4,0±0,04 | 3,0±0,01 |
| Через 34ч. | 4,0±0,04 | 3,0±0,01 | 4,0±0,02 | 3,0±0,01 |
| Через 36ч. | 4,0±0,04 | 2,5±0,01 | 3,5±0,04 | 2,5±0,01 |
| Через 38ч. | 3,5±0,01 | 2,5±0,01 | 3,5±0,02 | 2,5±0,01 |
| Через 40ч. | 3,5±0,03 | 2,0±0,02 | 3,5±0,01 | 2,0±0,01 |
| Через 42 ч. | 3,0±0,02 | 2,0±0,04 | 3,0±0,03 | 1,0±0,03 |
| Через 44 ч. | 3,0±0,02 | 1,0±0,03 | 3,0±0,03 | ед |
| Через 46 ч. | 2,5±0,03 | 1,0±0,03 | 2,5±0,01 | н |
| Через 48ч. | 2,5±0,02 | ед | 2,5±0,01 | |
| Через 50 ч. | 2,0±0,02 | н | 2,0±0,02 | |
| Через 52ч. | 1,0±0,02 | | 2,0±0,04 | |
| Через 56 ч. | 1,0±0,03 | | 2,0±0,02 | |
| Через 60 ч. | ед | | 1,0±0,02 | |
| Через 66 ч. | н | | 1,0±0,02 | |
| Через 72 ч. | | | ед | |
| Через 78 ч. | | | ед | |
| Через 84 ч. | | | н | |
Лабораторный опыт 2. Несмотря на то, что в предыдущем опыте были получены результаты, которые достоверно указывали на преимущества фосфатной и экспериментальной сред при хранении спермы козла в охлажденном виде, мы решили провести повторное тестирование экспериментальной синтетической среды. Эксперимент был продолжен на базе Биотехцентра БелНИИЖ, г. Жодино, Беларусь. Цель исследования состояла в изучении сохранности качества и оплодотворяющей способности спермы козлов зааненской породы после ее хранения в течение 15-30 часов при температуре тающего льда и транспортировки на большое (800-900 км) расстояние. Сперму получали от козлов, принадлежащих Биотехцентру БелНИИЖ. Оценку качества спермы проводили по общепринятой методике.
Таблица 2. Подвижность спермы после разбавления
| Подвижность спермы, проб (n=10) | Среда для разбавления спермы | |||
| козел №1 | козел №2 | |||
| экспери-менталь-ная | OVIX CELL (Франция) | экспери-менталь-ная | OVIX CELL (Франция) | |
| После разбавления | 8,2±0,01 | 8,0±0,01 | 8,2±0,01 | 8,1±0,01 |
| Через 2 ч. | 8,0±0,02 | 7,8±0,02 | 8,0±0,02 | 8,0±0,02 |
| Через 4 ч. | 8,0±0,02 | 7,7±0,02 | 8,0±0,02 | 8,0±0,02 |
| Через 6 ч. | 8,0±0,01 | 6,8±0,03 | 8,0±0,01 | 7,7±0,02 |
| Через 8 ч. | 7,0±0,01 | 5,9±0,01 | 7,0±0,01 | 6,5±0,03 |
| Через12 ч. | 6,8±0,03 | 5,5±0,02 | 6,8±0,03 | 5,9±0,01 |
| Через16 ч. | 6,5±0,01 | 4,5±0,02 | 6,5±0,01 | 5,5±0,02 |
| Через18 ч. | 6,5±0,02 | 4,0±0,01 | 6,5±0,02 | 4,5±0,02 |
| Через20 ч. | 6,0±0,01 | 4,0±0,01 | 6,0±0,01 | 4,0±0,01 |
| Через24 ч. | 6,0±0,01 | 3,5±0,01 | 6,0±0,01 | 4,0±0,01 |
| Через28 ч. | 5,5±0,03 | 3,5±0,01 | 5,5±0,03 | 3,5±0,01 |
| Через30 ч. | 4,5±0,02 | 3,0±0,02 | 4,5±0,02 | 3,5±0,01 |
| Через 32ч. | 4,0±0,01 | 3,0±0,01 | 4,0±0,01 | 3,0±0,02 |
| Через 34ч. | 4,0±0,02 | 2,5±0,01 | 4,0±0,02 | 3,0±0,01 |
| Через 36ч. | 4,0±0,01 | 2,5±0,01 | 4,0±0,01 | 2,5±0,01 |
| Через 38ч. | 3,5±0,01 | 2,0±0,02 | 3,5±0,01 | 2,5±0,01 |
| Через 40ч. | 3,5±0,03 | 2,0±0,04 | 3,5±0,03 | 2,0±0,02 |
| Через 42 ч. | 3,0±0,02 | 1,0±0,03 | 3,0±0,02 | 1,5±0,04 |
| Через 44 ч. | 3,0±0,02 | 1,0±0,03 | 3,0±0,02 | 1,0±0,03 |
| Через 46 ч. | 2,5±0,01 | ед | 2,5±0,01 | 1,0±0,03 |
| Через 48ч. | 2,5±0,02 | н | 2,5±0,02 | ед |
| Через 50 ч. | 2,0±0,01 | | 2,0±0,01 | н |
| Через 52ч. | 2,0±0,01 | | 2,0±0,01 | |
| Через 56 ч. | 1,0±0,02 | | 1,0±0,02 | |
| Через 60 ч. | 1,0±0,01 | | 1,0±0,01 | |
| Через 66 ч. | ед | | ед | |
| Через 72 ч. | н | | н | |
Одной из задач эксперимента было сравнительное исследование собственной среды, показавшей наилучшие результаты в предыдущем исследовании и патентованной среды OVIX CELL (Франция). Для более точного соблюдения методических требований, с целью исключения влияния индивидуальных особенностей сперму от козлов №1 и №2 разбавляли и исследовали отдельно, используя принцип разделенных эякулятов. Сперму козлов разбавляли экспериментальной средой в соотношении 1:3. Разбавление спермы средой OVIX CELL осуществляли в соответствии с наставлением по ее применению. Для охлаждения спермы использовали бытовой термос объемом 1,5 литра, заполненный на 1/3 кубиками льда. Для предохранения спермы от прямого контакта со льдом флаконы с разбавленной спермой помещали в поролоновые вкладыши. На первом этапе провели лабораторную оценку качества охлажденной спермы по показателям подвижности через каждые 2-4 часа. Результаты сравнительного исследования спермы, сохраняемой в собственной экспериментальной среде и патентованной среде OVIX CELL (Франция) приведены в таблице 2.
Как видно с данных таблицы, новая экспериментальная среда оказалась более физиологичной для спермы козла. Если сразу после разбавления и в течение 4 часов после подвижность спермы в обоих разбавителях была практически одинаковой, то после шестичасового хранения преимущество экспериментальной среды проявилось в полной мере. С удлинением срока хранения эта разница только усиливалась. Через 46 часов после помещения спермы в тающий лед спермии в среде OVIX CELL погибали, тогда как в экспериментальной среде количество спермиев с прямолинейным поступательным движением составляло 25%. В среде OVIX CELL число спермиев, совершающих колебательные и манежные движения, было достоверно больше. При микроанализе состояния спермиев отмечалось уплощение головки, появление вакуоли на хвостиках, лизис протоплазмы, множественные фрагменты спермиев, агглютинаты.
Таким образом, результат повторного эксперимента подтвердил вывод о том, что новая экспериментальная среда является более благоприятной для сохранения подвижности спермиев при хранении при температуре тающего льда.
Производственный опыт. В лабораторных исследованиях были установлены преимущества экспериментальной среды для разбавления и краткосрочного хранения спермы козлов при температуре 0…3оС. Однако наиболее объективную картину сохранения качества спермы дает ее оплодотворяющая способность. Для ее изучения был проведен производственный эксперимент. Разбавленную и охлажденную сперму транспортировали сначала железнодорожным, а затем автомобильным транспортом в ООО «Атлант» Шаховского района Московской области для осеменения поголовья коз. Половую охоту у коз синхронизировали подкожным введением 0,5 мл (125 мкг по АДВ клопростенолу) «Эстрофана», дважды, с интервалом 8 дней. Через 48 ч. после второй инъекции коз осеменяли двукратно, утром сразу после выборки и вечером с интервалом между осеменениями 10 ч. Доза спермы при каждом осеменении составляла 0,1 мл. Расчет времени показал, что с момента взятия спермы до первого осеменения проходило 12-14 ч., до второго – соответственно, 22-24 часа. Подвижность спермы перед первым осеменением составила: козел №1 – 6,8 баллов, козел №2 – 6,6 балла, перед вторым осеменением – соответственно, 6,0 и 5,8 баллов. Техника осеменения состояла в следующем. Козу в охоте помещали в специальном станке таким образом, чтобы тазовая часть была приподнята под углом 35-40°. Сперму вводили цервикально, как правило, на глубину 0,5-2,0 см при помощи стеклянного шприца-катетера с дозирующим приспособлением. Результаты осеменения представлены в таблице 3.
Таблица 3. Результаты осеменения коз охлажденной транспортированной спермой краткосрочного (12-24 часа) хранения
| Козел – производитель | Осе-менено коз, гол. | Из них окозлилось от первого осеменения | Получено козлят | Живая масса козлят при рождении, кг | |||
| гол. | % | гол. | % | одинцов | двоен | ||
| №1 | 49 | 34 | 69,3±4,0 | 46 | 135,3 | 3,9 | 3,6 |
| №2 | 53 | 38 | 71,7±4,6 | 51 | 134,2 | 3,8 | 3,5 |
Оплодотворяющая способность спермы, сохраняемой в новой экспериментальной среде при температуре 2…4о C в течение 12-24 часов, составила в среднем 70,0% с колебаниями по козлам 69,3-71,7%. Плодовитость коз составила в среднем 134,7% при лимите 134,2…135,3%. Различий в количестве козочек и козликов не выявлено. Родившиеся козлята характеризовались средней живой массой: одинцы – 3,85, двойни – 3,55 кг.
Выводы. Установлено, что сперма козла сохраняет высокую биологическую полноценность в разработанной нами синтетической среде. Это позволяет рекомендовать данную технологию при искусственном осеменении животных на фермах, расположенных на расстоянии 800-1000 км от пункта получения спермы с приемлемым для практики результатом.
Список использованной литературы
Желтобрюх Н.А. Оплодотворяющая способность спермы баранов, замороженной в рафинозной и лактозно-гуммиарабиковой средах /Н.А.Желтобрюх, В.К. Ивахненко, А.-М.М. Айбазов // Методы и приемы эффективной селекции овец и коз: Сб. науч. тр. / ВНИИОК.-Ставрополь, 1987. – С. 79–84.
- Пат. 1755431 СССР А 61 Д 19/02. Среда для разбавления спермы баранов / М.М.Айбазов, Н.П.Галаган, В.И. Богомаз и др. (СССР). – № заявки 4702977; Заявлено 18 апреля 1989 г; опубликовано 15 апреля 1992 г. – 4 с.
- Инструкция по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов с.-х. животных. - М.,2000.-175 С.
УДК: 636.32/38:612.6
БИОГЕННАЯ СТИМУЛЯЦИЯ КАЧЕСТВА СПЕРМОПРОДУКЦИИ КОЗЛОВ В АНЭСТРАЛЬНЫЙ ПЕРИОД
П.В. Аксенова, канд. биол. наук,
М.М. Айбазов, докт. с.-х. наук,
Ставропольский НИИ животноводства и кормопроизводства, Росія
Изложен новый способ стимуляции половой активности козлов-производителей в анэстральный сезон, повышения качества спермопродукции и устойчивости спермы к криоконсервации. Для достижения указанного эффекта применяли БСМ (биостимулятор из мозговой ткани) по разработанной схеме. Действующим веществом препарата мы считаем нейрогормоны, а также продукты их расщепления – пептиды и их фрагменты, образующиеся под действием замораживания-оттаивания и облучения УФЛ.
Ключевые слова: биостимулятор, нейропептиды, половая активность, спермопродукция, криоконсервация, козлы-производители.
В связи с быстрым развитием молочного козоводства возникла необходимость рационализации использования генофонда высокоценных козлов-производителей. Однако, в отличие от баранов-производителей, у козлов вне сезона разведения очень трудно получить сперму, если же это удается, то по качеству она не соответствует нормам «Инструкции по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов сельскохозяйственных животных» [1] и не пригодна для криоконсервации.
Для стимуляции половых рефлексов козлов-производителей в анэстральный период и повышение уровня спермопродукции применяли БСМ (биостимулятор из мозговой ткани), разработанный под руководством профессора Ф.А. Мещерякова [2].
Действующим началом препарата мы считаем стимулирующее влияние нейропептидов и их фрагментов, которые в качестве физиологических адаптогенов участвуют в обеспечении гомеостатических процессов организма. Модулирующее влияние пептидных гормонов осуществляется путем изменения биохимических процессов в клетке; проходимости ионов Са2+, Na+, К+, активности аденилатциклазы, гуанилатциклазы и ферментов, регулирующих биосинтез медиатора в нервных окончаниях и др. Активными являются не только целые пептиды, но, и даже в большей степени, их метаболиты (С- и N-концевые фрагменты, отдельные аминокислоты). Воздействия на мозговую ткань, применяемые при изготовлении БСМ, способствуют расщеплению отдельных пептидов на фрагменты, которые обладают самостоятельным, отличным от гормона-предшественника, спектром действия.
Методика эксперимента. Для получения биостимулятора использовали гомогенизированную мозговую ткань крупного и мелкого рогатого скота, отобранную у клинически здоровых животных после убоя.
Образование биогенных веществ индуцировали помещением мозговой ткани в холодильную камеру с последующим облучением УФЛ по оригинальному методу. Массу обеззараживали, фасовали во флаконы и лиофилизировали.
Качество препарата проверяли по следующим показателям: растворимость, цвет и наличие посторонних примесей, стерильность, постоянство химического состава, безвредность, биологическая активность.
При проверке на растворимость к сухому препарату приливали дистиллированную воду так, чтобы довести его до первоначального объема. При температуре 20оС в течение 10 минут происходило полное растворение биостимулятора. Раствор представлял собой жидкость белого цвета, без хлопьев и сгустков.
Для проверки препарата на стерильность делали высевы БСМ на мясопептонный агар и мясопептонный бульон. После выдержки засеянных сред в термостате в течение 7 суток при 37оС они оставались стерильными.
Проверку исследуемого вещества на безвредность проводили по И.А. Калашнику [3]. Для этого 3 лабораторным мышам ввели подкожно по 0,3 мл биостимулятора, разведенного до исходного объема дистиллированной водой. В течение семи дней наблюдали за подопытными животными. Мыши остались живы, клинических нарушений не наблюдалось.
Биологическую активность стимулятора определяли собственным методом, основанным на изменении оптической плотности раствора с культурой Saccharomyces ellipsoides до и после инкубации. Активность стимулятора вычисляли по формуле:
АС=(О2-О1)/ (Ок2-Ок1)×10 [Ед],
где АС-активность стимулятора;
О1-оптическая плотность раствора до опыта;
О2-оптическая плотность раствора после опыта;
Ок1-оптическая плотность контроля до опыта;
Ок2-оптическая плотность контроля после опыта
Результаты исследований. Исследуя БСМ установили, что его активность равна 20,4 Ед. Лабораторные исследования воздействия БСМ на организм проводили на белых мышах. Были сформированы 3 группы по 4 животных в каждой. Мышам І и ІІ групп вводили БСМ подкожно в области спины в дозах 1 и 100 мг/кг массы тела соответственно. Животные ІІІ группы служили контролем. На 3-и сутки после введения препарата мышей умерщвляли с помощью эфира и брали у них органы для исследования.
Наиболее выраженные изменения у животных І и ІІ групп были обнаружены в селезенке. Так, было отмечено увеличение органа в 2,0 и 2,6 раз по группам соответственно. У мышей, получивших дозу препарата 1мг/кг, отмечали бугристость органа, плотную консистенцию и выраженность структуры на разрезе. У животных ІІ группы рисунок строения был сглажен. Гистологическое исследование показало значительное увеличение общей площади белой пульпы по сравнению с контролем (с 24,6 % - в контроле до 59,9 % - в І группе и до 63,5 % - во 2-й). В красной пульпе обнаружено большое количество макрофагов, плазматических и лимфоидных клеток. Выявлена активная артериальная гиперемия. У животных ІІ группы, кроме того, в цитоплазме отдельных лейкоцитов наблюдались признаки зернистой и вакуольной дистрофий – плотные гранулы и вакуоли различной величины, ядра в отдельных клетках не просматривались.
При исследовании печени у мышей І группы были обнаружены явления, характерные для гиперплазии органа. Наблюдалось незначительное увеличение печени в объеме, паренхима выступала за края разреза. При гистологическом исследовании отмечалось неравномерное увеличение гепатоцитов в объеме, в цитоплазме клеток просматривалась мелкая зернистость. Ядра были интенсивно окрашены, набухшие, с четко видными глыбками хроматина. Встречались гепатоциты в стадии деления, наблюдались периваскулярные и межклеточные инфильтраты из лимфоцитов и плазматических клеток, умеренная артериальная гиперемия. Печень, взятая от мышей 2 группы, была дрябловатой консистенции, неравномерно полнокровна, паренхима выступала за края разреза. Микроскопически отмечались выраженная артериальная гиперемия, множественные обширные лейкоцитарно-макрофагальные инфильтраты, разрушение печеночных балок. Гепатоциты были значительно увеличены, в цитоплазме отдельных клеток присутствовали плотные гранулы и вакуоли, свидетельствующие о зернистой и вакуольной дистрофиях органа. Эндотелиальные клетки сосудов были набухшие, местами разрушены.
При микроскопии почек у животных І группы отметили увеличение клеток канальцев, ядра клеток были набухшие, глыбки хроматина крупные, ярко окрашенные. Капилляры клубочков кровенаполнены. Встречались эндотелиальные клетки в стадии деления. У мышей ІІ группы почки были кровенаполнены, паренхима выступала за края разреза. На гистопрепаратах были выявлены обширные пролифераты, обнаружено значительное увеличение клубочков, утолщение эндотелия капилляров, в клетках канальцев - изменения характерные для зернистой и вакуольной дистрофии.
Таким образом, установлено, что при введении препарата в дозе 1 мг/кг в селезенке происходят характерные пролиферативные изменения, свидетельствующие об активизации иммунных реакций. В печени и почках повышаются регенеративные процессы. Использование значительно завышенных доз препарата (в 100 раз) вызывает дегенеративные явления во внутренних органах.
Для того, чтобы определить безвредность исследуемого биостимулятора для коз, было сформировано ІІ группы (n=10), которым вводили БСМ в дозах 1 мг/кг и 100 мг/кг разведенным в 0,9%-ном растворе NaCl.
Установлено, что введение препарата БСМ козам не вызывает активной местной и общей воспалительной реакции (табл. 1).
