План урока по теме «Кислород»
| Вид материала | План урока |
- План-конспект открытого урока в 5 «В» классе по теме «Семья», 43.36kb.
- Конспект урока по теме «…простое величие простых людей…», 225.54kb.
- План проведения урока: Проверка домашнего задания. Письменный опрос по теме "Опасные, 124.16kb.
- Анализ и самооценка урока технологии, 19.45kb.
- Урока: повторение по теме «Колебания и волны», 154.3kb.
- План-конспект урока по теме "Классификация и термическая обработка сталей", 100.32kb.
- План урока английского языка в10-б классе по теме „Man the Child of Nature. Natural, 50.69kb.
- План урока Вступление Закрепление и обобщение изученного материала. Составление плана, 86.07kb.
- Ступление, 140.81kb.
- План-конспект урока №1 Тема: «Читаем журналы на английском языке», 467.05kb.
План урока по теме «Кислород»
Достоин тот газ удивленья
Его применяют сейчас
Для резки металлов в сталеваренье,
И в мощных доменных печах
Берет его летчик в высокие дали,
Подводник собою берет
Вы верно уже угадали,
Что этот газ кислород.
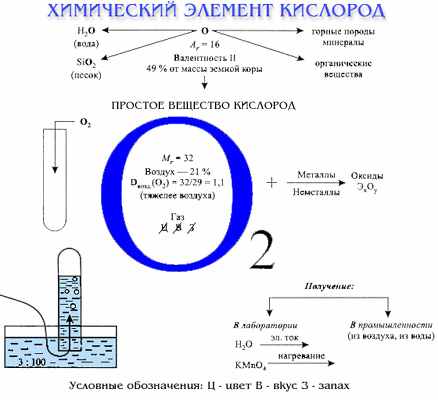
Тема: Кислород как элемент и простое вещество.
Цель: сформировать представление учащихся о кислороде как химическом элементе и простом веществе.
Задачи урока: продолжить формирование представления о химических элементах; обобщить знания учащихся о распространении кислорода в природе, его физических свойствах; познакомить учащихся с историей открытия кислорода; изучить химические свойства кислорода; сформировать понятие относительная плотность газа.
Оборудование к уроку: две колбы по 250 мл с кислородом (для сжигания серы и красного фосфора), стеклянная банка 400-500 мл с песком на дне (для сжигания железа), две ложечки для сжигания веществ, стальная струна, прикрученная к толстой металлической проволоке (на конец спирали следует прикрепить кусочек спички для разогрева стальной струны), спиртовка, спички, лучинка, кристаллическая сера, красный фосфор, стеклянные (картонные или полиэтиленовые) пластинки для прикрывания колб с продуктами горения веществ, фарфоровая чашка с водой (для тушения горящих остатков фосфора и серы); плакаты с планами изучения элемента и вещества.
На доске плакат с надписью:
«Кислород- это вещество вокруг которого вращается земная химия»
Я.Берцелиус
| № п/п | Этапы урока | Методы и приемы | Время (мин) |
| I | Вводная часть: 1) Организация класса; 2) Связь с предыдущим материалом; 3) Задачи урока. | Рассказ с элементами беседы | 2-3 |
| II | Изучение нового материала: 1. Знакомство с планом характеристики элемента. 2. Кислород как элемент. 3. Знакомство с планом характеристики вещества. 4. Кислород как простое вещество: 1) физические свойства; 2) химические свойства. 5. Горение и окисление. 6. Относительная плотность газа. 7. Обобщение по уроку. | Объяснение (плакат). Беседа, составление опорного конспекта. Объяснение (плакат). Рассказ с элементами беседы, демонстрация горения серы, фосфора, железа. Составление опорного конспекта. Рассказ. Объяснение, работа со справочником. Рассказ | 25 |
| Ш | Закрепление: Составление уравнение реакций горения простых и сложных веществ. | Фронтальная работа учащихся | 10 |
| IV | Домашнее задание: конспект в тетради, схема превращений с участием кислорода. | | 2 |
Приложение к плану урока
План характеристики элемента:
- Химический знак
- Относительная атомная масса
- Распространение в природе
- Валентность
План характеристики вещества:
- Химическая формула (дополнительно – структурная формула)
- Относительная молекулярная масса
- Распространение в природе
- Физические свойства
- Химические свойства
- Применение и получение
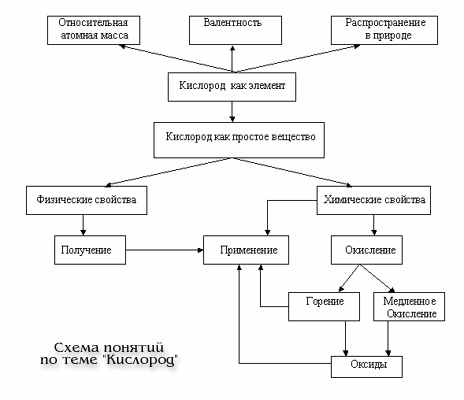
Опорный конспект по теме "Кислород"
Опыт 1. Получение кислорода в лаборатории и заполнение им газометра
Кислород получают разложением перманганата калия:
2KMnO4 ® K2MnO4 + MnO2 +O2
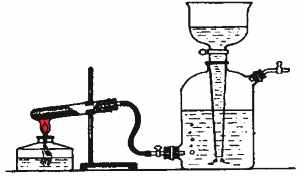 | Прибор для получения кислорода состоит из пробирки и газоотводной трубки, соединенной с нижним тубуcом газометра. Чтобы в газометр не попадали частицы перманганата калия (вода окрасится), в пробирку у пробки помещают ватный тампон. Вата не должна соприкасаться с солью. |
 | Порядок заполнения газометра кислородом: Газометр заполните водой, полностью вытеснив воздух.
|
 | |
Опыт 2. Заполнение газометра кислородом вытеснением из кислородной подушки.
Экономически выгоднее для демонстрационных опытов использовать готовый кислород, который можно приобрести в аптеке, получить у газосварщиков, заполнив газом кислородную подушку. Для заполнения газометра кислородом подушку присоедините к нижнему тубусу и, открыв кран, сильно надавите на нее. Кислород заполнит газометр, вытеснив воду в воронку (кран воронки должен быть открыт, а газовый кран – закрыт).
Вычислите по уравнению реакции, какой объем кислорода (при нормальных условиях) можно получить разложением 100 г перманганата калия.
Какой вывод можно сделать об экономической эффективности получения кислорода из этой соли?
Опыт 3. Сжигание в кислороде серы
- Заполните кислородом колбу емкостью 250–300 мл. Заполнение проверьте тлеющей лучиной, поднеся ее к краю сосуда. Прикройте колбу стеклянной пластинкой.
- В железную ложку поместите кусочек серы и зажгите его от пламени спиртовки. Как горит сера на воздухе?
- Внесите горящую серу в колбу с кислородом. Как она теперь горит?
Сжигание серы в кислороде
Внимание! Опыт проводится в вытяжном шкафу. При отсутствии тяги ложку можно вставить в полиэтиленовую крышку, которой закрыть колбу с горящей серой.
Опыт 4. Горение железа в кислороде
- На дно стеклянной банки емкостью не менее 500 мл насыпьте сухого песка, наполните ее кислородом и накройте стеклянной пластинкой.
- Для сжигания приготовьте спираль из тонкой стальной проволоки (например, балалаечной струны), один конец которой прикрепите к металлическому стержню, а на другой – насадите небольшую лучинку (например, половину спички).
- Зажгите лучинку на спиртовке и, когда она хорошо разгорится, внесите спираль в сосуд с кислородом. Железо начнет энергично гореть, разбрасывая раскаленные частицы. Банка заполняется бурым дымом оксидов железа, хорошо заметным на фоне белого экрана
Горение железа в кислороде
В кислороде можно сжечь и другие простые и сложные вещества – магний, фосфор, натрий, парафиновую свечу и т.д.
Горение фосфора в кислороде
После сжигания в сосуды надо приливать понемногу дистиллированную воду, встряхнуть их и исследовать растворы индикаторами.
Опыт 5. Установление состава воздуха
- Стеклянный колокол, размеченный на пять равных частей вливанием одного и того же объема воды, поместите в чашу с водой. Долейте воду до первого деления.
- В железную ложку, стержень которой пропущен через резиновую пробку, поместите немного красного фосфора.
- Зажгите фосфор на спиртовке и быстро внесите ложку в колокол, плотно закрыв его горло.
- Наблюдайте за происходящими явлениями. Через 10–15 мин вода в колоколе поднимется примерно на 1/5 его объема.
Долейте в чашу воды до того уровня, который образовался внутри колокола, и откройте пробку. Исследуйте горящей лучиной оставшийся в колоколе газ.
Почему в нем гаснет лучина?
Установление состава воздуха
Опыт 6. Получение озона
Прибор для получения озона называется озонатор. Школьные озонаторы, применявшиеся до недавнего времени, сняты с производства. Приборы, сохранившиеся в химических кабинетах, используются в качестве модели. Применяя высоковольтный индуктор “Разряд-1”, можно провести опыт получения озона в самодельном озонаторе, устройство которого схематически приведено на рисунке:
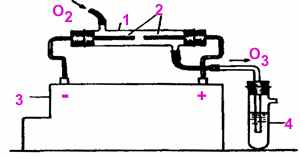 | 1 - трубка-реактор 2 - электроды 3 - высоковольтный индуктор 4 - пробирка с йодкрахмальным раствором |
- Соберите установку согласно рисунку
- Не приводя в действие индуктор, пропустите через озонатор кислород из газометра. В сосуде с йодкрахмальным раствором никаких изменений не наблюдается.
- Включите индуктор и продолжайте пропускать кислород. Под действием электрических разрядов кислород частично превращается в озон:
3O2 ® 2O3
Йодкрахмальный раствор окрашивается в синий цвет, так как озон окисляет ионы йода I до свободного йода I2:
2KI + O3 + H2O ® 2KOH + O2 + I2
Опыт 7. Получение озона с помощью электрофорной машины (по В.Г. Прокопенко)
К одному из кондукторов электрофорной машины прикрепите отрезок железной проволоки с заостренным концом. На другой кондуктор пластилином прилепите пластиковый экран размером 2 х 2 см, а на него – листок фильтровальной бумаги, смоченный насыщенным раствором йодида калия. Между иглой и экраном установите расстояние в 1–2 см и приведите машину в движение. Образующийся вследствие электрических разрядов озон окисляет йодид калия, на листке бумаги появляется бурое пятно йода. Ощущается запах озона.
Примерный тест контроля знаний с выборочным типом ответа по теме “Кислород”
- Какие вещества образует химический элемент кислород в природе:
а) только простые вещества;
б) простые и сложные вещества;
в) только сложные вещества.
- Сырьем для промышленного получения кислорода преимущественно является:
а) вода;
б) воздух;
в) кислородсодержащие минералы.
- Кислород в воде:
а) очень хорошо растворим;
б) растворим;
в) нерастворим.
- Кислород растворяется лучше:
а) в теплой воде;
б) в холодной воде;
в) одинаково в теплой и холодной воде.
- При горении фосфора в кислороде:
а) образуется бесцветный газ;
в) газ коричневого цвета;
в) твердое вещество белого цвета.
- При горении топлива обязательно образуется:
а) оксид серы (IV);
б) оксид азота (IV);
в) оксид углерода (IV).
- Какой из процессов, происходящих в природе, приводит к связыванию кислорода:
а) фотохимическое разложение воды в высших слоях атмосферы;
б) гниение растительных и животных остатков;
в) фотосинтез зеленых растений.
- Постоянными составными частями воздуха являются:
а) кислород, азот и углекислый газ;
б) водород, кислород, азот;
в) кислород, азот, благородные газы.
- Загрязнение воздуха вызывают:
а) водород и углекислый газ;
б) водяной пар и метан;
в) оксид серы (IV) и оксид азота (IV).
- В какой реакции из простых веществ образуются оксиды:
а) реакция соединения;
б) реакция разложения;
в) реакция замещения.
Кислоты

Химические диктанты
Вариант 1
- Назовите кислоты, формулы которых - НNО3, Н2СО3, Н3РO4, НСI, H2SO4, Н2SO4, H2SO3, H2S, HI.
- Укажите валентность кислотного остатка каждой кислоты из пункта 1.
- Подчеркните одной чертой химические формулы одноосновных кислот, двумя чертами - двухосновных кислот, тремя чертами - трехосновных.
Вариант 2
- Напишите химические формулы следующих кислот - серной, соляной, угольной, сероводородной, ортофосфорной, кремниевой, сернистой, бромоводородной.
- Укажите валентность кислотных остатков данных кислот.
- Подчеркните одной чертой химические формулы бескислородных кислот, двумя чертами - кислородсодержащих кислот.
Вариант 3
- Назовите вещества, формулы которых - СаО, Н3РO4, SO2, KNO3, MgO, Н20, НСI, Na2O.
- Составьте формулы следующих веществ - оксид фосфора (V), азотная кислота, оксид кремния, соляная кислота, серная кислота, оксид серебра, угольная кислота, оксид железа (III).
- Выберите кислоты из перечня веществ в пункте 2, указав их формулы.

Задания для индивидуальной работы
Общее задание для всех вариантов: допишите уравнения реакций до конца.
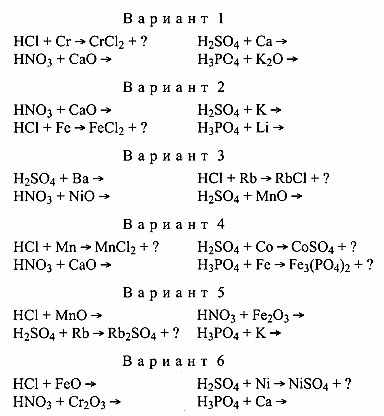

Выборочный тест
На доске записываются основы для ответов на вопросы по вариантам:
| Вариант 1 | Вариант 2 |
 |  |
1. Какое свойство характерно для кислоты, формула которой написана в пункте 1 :
- вязкая;
- "дымит" на воздухе;
- взрывоопасная;
- поддерживает горение?
2. Какую валентность проявляет кислотный остаток, формула которого указана в пункте 2:
- I;
- II;
- III;
- IV?
3. К какому типу относится реакция, схема которой приведена в пункте 3:
- соединения;
- разложения;
- замещения;
- обмена?
4. Выберите название для вещества из пункта 4:
- сульфат железа (II);
- фосфат железа (III);
- нитрат железа (III);
- хлорид железа (III).
5. Выберите из перечня формулу вещества, названного в пункте 5:
- CaSO4;
- MgO;
- СО2;
- HNO3.
6. С какими из соединений реагирует вещество, названное в пункте 6:
- СиО;
- MgO;
- НС1;
- Н2О?

Тест на соответствие (можно использовать электротренажер)

Химический пасьянс "Классы неорганических соединений"
Каждому ученику выдается комплект из 25 карточек размером 2 х 2,5 см, на которых написаны формулы простых и сложных веществ: Р, Н2, Zn, О2, Сu, Fe, S, Н2О, Fe2O3? Na2O, CaO, CuO, P2O5, H2SO4, HNO3, H3PO4, HCI, K2SO4, Na3PO4, CuCO3, ВаСI2, Fe(ОН)3, Al(OH)3 NaOH, Ca(OH)2.
Отвечая на вопросы учителя, выполняя различные задания, учащиеся выбирают необходимые карточки и называют вещества.
Вопросы и задания
- Выберите карточки с формулами простых веществ. Назовите вещества.
- На какие две группы можно разделить простые вещества?
- Выберите карточки с формулами оксидов. Назовите оксиды.
- Распределите оксиды на две группы (какие?).
- Укажите растворимые в воде оксиды; составьте уравнения реакций взаимодействия этих оксидов с водой.
- Какие реакции возможны между выбранными:
а) простыми веществами; б) оксидами; в) оксидами и простыми вещее'
- Выберите карточки с формулами кислот и назовите эти кислоты. Определите, к какой группе кислот - одноосновных, двухосновных или трехосновных, кислолородсодержащих или бескислородных - относятся данные кислоты.
- С какими из простых веществ и оксидов будут взаимодействовать данные кислоты? Составьте уравнения необходимых реакций.
- Какими способами можно получить выбранные кислоты? Напишите соответствующие уравнения.
- Найдите среди веществ соли; дайте им названия.
- Какими способами можно получить эти соли? Составьте химические уравнения.
- Найдите среди веществ основания; дайте им названия; укажите, растворимы ли они в воде. Составьте уравнения реакций получения этих оснований.
- С какими из имеющихся веществ будут взаимодействовать основания? Составьте уравнения реакций.
