Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета нижний новгород 2005 г
| Вид материала | Учебное пособие |
- Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета, 376.65kb.
- Учебное наглядное пособие для студентов экономического факультета Нижний Новгород, 356.34kb.
- Учебное пособие Нижний Новгород 2007 Балонова М. Г. Искусство и его роль в жизни общества:, 627.43kb.
- Учебное пособие Нижний Новгород 2002 удк ббк к найденко В. В., Губанов Л. Н, Петрова, 1219.74kb.
- Учебно методическое пособие Рекомендовано методической комиссией факультета вычислительной, 269.62kb.
- Учебное пособие по патофизиологии для студентов фармацевтического факультета, 677.92kb.
- Учебное пособие Нижний Новгород 2003 удк 69. 003. 121: 519. 6 Ббк 65. 9 (2), 5181.42kb.
- Учебное пособие Нижний Новгород 2010 Печатается по решению редакционно-издательского, 2109.64kb.
- Учебное пособие для студентов факультета очно-заочного обучения Нижний Новгород 2010, 795.89kb.
- Учебно-методическое пособие для студентов, обучающихся по специальности 030501 Нижний, 1855.66kb.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
НИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ
Учебное пособие по курсу "Биотехнология"
для студентов фармацевтического факультета
НИЖНИЙ НОВГОРОД 2005 г
УДК 615.014У79
Инженерная энзимология: Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета. - Нижний Новгород: Изд-во Нижегородской государственной медицинской академии, 2005.
Учебное пособие предназначено для ознакомления студентов с отдельными главами курса “Биотехнология”, посвященными применению в производстве, экологии и медицине чистых и иммобилизованных ферментных препаратов и клеток, полимерных биоматериалов а так же методов их получения и технологическом оформлении процессов на их основе.
Составлено на соответствии с программой по биотехнологии (Москва, 2001г.) и приказом МЗ РФ № 93 от 31.03.97 “О поэтапном введении с 1997 года итоговой государственной аттестации выпускников высших медицинских и фармацевтических вузов”
Рекомендовано к изданию ученым советом Нижегородской государственной медицинской академии, протокол № от
Составители: Османов В.К., Бирюкова О.В., Борисов А.В., Борисова Г.Н., Мацулевич Ж.В.,
Рецензенты:
Османов В.К., Бирюкова О.В.
Борисов А.В., Борисова Г.Н.,
Мацулевич Ж.В., 2005
1.ВВЕДЕНИЕ
Ферментами обычно называют вещества биологического происхождения, представляющие собой соединения белковой природы и являющиеся специфическими катализаторами. По своей природе ферменты являются сложными соединениями. Для большинства из них структура не является до конца установленной. Однако существование так называемой белковой "составляющей" - неотъемлемой части биологического катализатора можно считать доказанным для большинства промышленно получаемых ферментных препаратов. Практически все попытки "очистить" эти препараты от соединений белковой природы приводили к потере их каталитической активности.
Все основные источники ферментов можно разделить на три основные группы:
1. Ткани животных как отход мясоперерабатывающей промышленности. Прежде всего, это богатые ферментами поджелудочная железа и слизистая оболочка желудка.
2. Некоторые растения. Например, такие гидролитические ферменты, как папаин и рицин извлекают соответственно из сока дынного дерева и инжирного дерева, из ячменя - амилазу.
3. Микроорганизмы.
Выбор источника получения того или иного фермента предполагает учет ряда требований, предъявляемых к чистоте получаемого препарата, потребности в нем, стоимости сырья, проведения процессов выделения и очистки готового продукта.
Из всех вышеперечисленных источников ферментов наибольшее практическое значение имеют микроорганизмы - продуценты ферментов. Их широкое использование обусловлено, прежде всего, их доступностью, возможностью организовать более эффективное промышленное производство на относительно дешевом сырье и управление, процессом биосинтеза, используя, различные продуценты ферментных препаратов. Использование микроорганизмов значительно расширило круг получаемых ферментных препаратов с различным спектром действия. Только с их помощью удалось получить такие ферменты, как целлюлазы и глюкозоизомеразы.
В качестве продуцентов ферментов, как правило, выбирают те штаммы-мутанты, полученные путем направленной селекции, которые обеспечивают максимальный выход целевого продукта при использовании стандартного оборудования. При этом штаммы-мутанты получают как традиционным путем с использованием таких широкоизвестных методов воздействия, как облучение УФ светом, γ- и рентгеновскими лучами, обработкой клеток различными химическими агентами: этилимином, диметилсуфатом, гидроксиламином, диазометаном, оксидом азота и пр., изменением температуры и величины рН, так и методами генной инженерии.
В качестве продуцентов ферментов могут использоваться различные микроорганизмы. Для получения амилолитических и протеолитических ферментных препаратов в промышленности наиболее часто используют различные штаммы гриба рода Aspergillus и бактерий Bacillus. У бактерий короче цикл развития, на их основе легче получать мутанты.
Технология получения ферментных препаратов микробным синтезом обязательно включает в себя стадию промышленного культивирования соответствующего микроорганизма. В условиях промышленного производства значительное количество продуцента получают одним из следующих двух способов:
- культивирование на твердых питательных средах (поверхностный способ выращивания продуцента),
- культивирование соответствующего продуцента в большом объеме жидкой фазы, содержащей все необходимые для нормального роста и развития микроорганизма питательные вещества (глубинный способ выращивания продуцента).
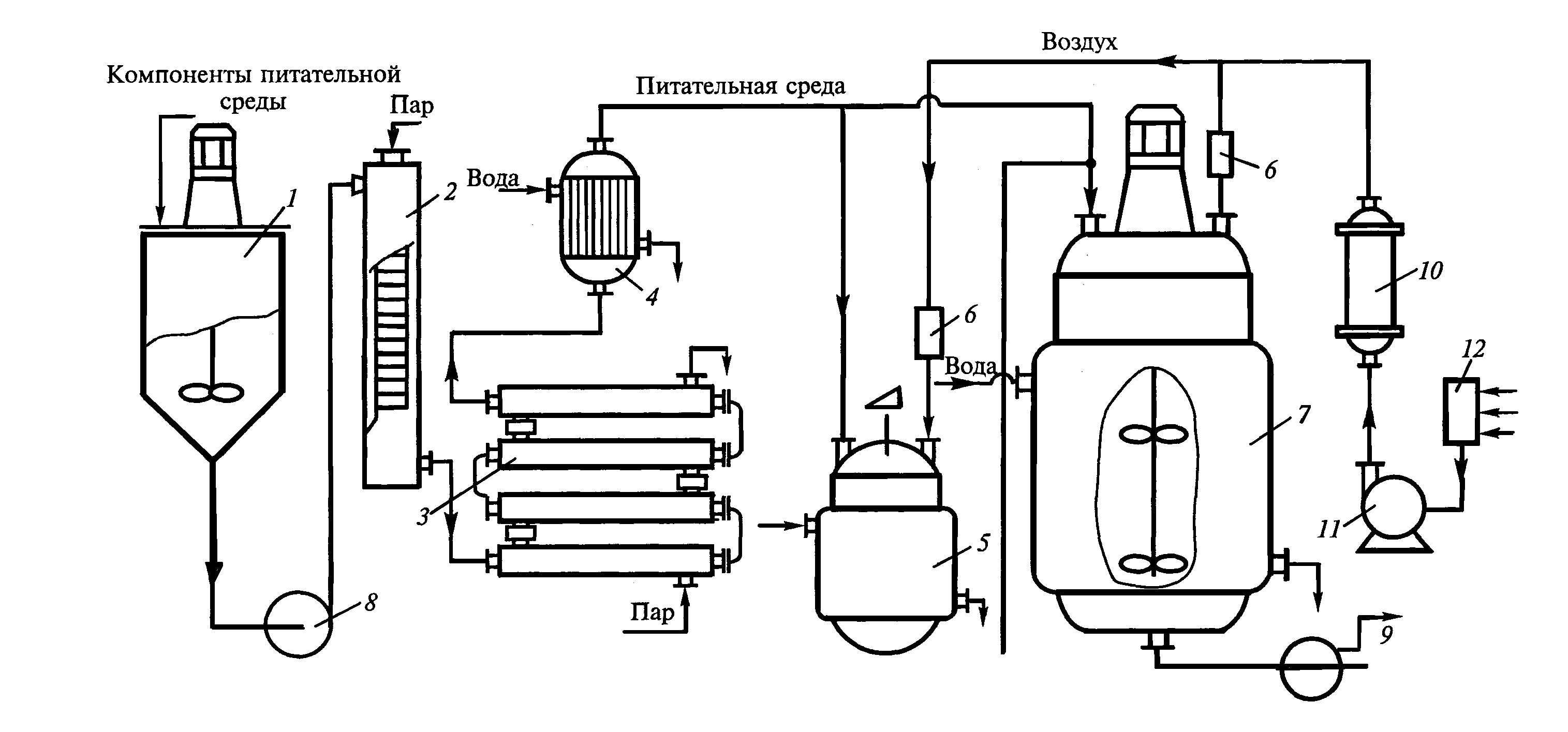
Рис .1 Принципиальная технологическая схема процесса глубинного культивирования микроорганизмов
1 – смеситель питательной среды; 2 – колонна для непрерывной стерилизации потока питательной среды острым паром; 3 - теплообменник – выдерживатель; 4 – теплообменник для охлаждения потока питательной среды; 5 – инокуляторы (посевные аппараты); 6 – индивидуальный фильтр для очистки воздуха, подаваемого в инокулятор; 7 – реактор – ферментер; 8,9 – насосы; 10 – масляный фильтр для предварительной очистки воздуха; 11 – компрессор; 12- головной фильтр для очистки воздуха
2.ПРИМЕНЕНИЕ ФЕРМЕНТОВ
Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток, поэтому их традиционно широко применяют в практике. Биологические катализаторы нетоксичны, работают в мягких условиях, используют доступное сырье (в том числе и отходы), в связи, с чем их применение в промышленности выгодно с экономической и экологической точек зрения.
По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из нескольких тысяч известных в настоящее время ферментов наиболее широко в промышленности используются различные гидролазы, которые можно разделить на четыре основные группы ферментных препаратов.
I. Амилолитические ферментные препараты
К этой группе препаратов относятся α- и β-амилазы и глюкоамилаза. Их используют для гидролиза крахмала и гликогена. В процессе гидролиза сначала образуются более простые полисахариды - декстрины, а в последующем - глюкоза. При этом α-амилаза гидролизует без определенного порядка α-1,4-глюкозидные связи с образованием декстринов, мальтозы и глюкозы, β-амилаза отщепляет остатки мальтозы, а глюкоамилаза - остатки глюкозы от концевых частей молекул полисахарида.
Наиболее широкое применение эти препараты нашли в пищевой промышленности (производство патоки и глюкозы).
2. Протеолитические ферментные препараты
Эта группа ферментов относится к гидролазам. Они обладают такой важной особенностью, как высокоселективное воздействие на некоторые пептидные связи белковых молекул и пептидов. Например, пепсин способствует гидролизу пептидных связей с остатками ароматических аминокислот, трипсин катализирует гидролиз пептидной связи между остатками аминокислот аргинина и лизина. Ферментов, входящих в этот класс, очень много. Их классифицируют, в основном, по способности проявлять максимум ферментативной активности в определенной области рН раствора. Кислые протеазы проявляют максимум активности в интервале рН раствора от 1,5 до 3,0, нейтральные - 6,5-7,5, щелочные - от 8,0 и выше.
Протеазы нашли свое применение в различных отраслях народного хозяйства: в пищевой и легкой промышленности (предварительная обработка свежего сырого мяса и шкур, животных в кожевенной промышленности), в химической промышленности при получении синтетических моющих средств с добавками протеолитических ферментных препаратов, в здравоохранении при лечении некоторых воспалительных процессов, ожогов, тромбозов,
3. Пектолитические ферментные препараты
Пектолитические ферментные препараты используются для расщепления пектиновых веществ, содержащихся в стеблях растений (льна), в различных корнеплодах, фруктах. К ним относятся пектин, пектиновые кислоты и протопектин. Пектиновая кислота - это полимер галактурононой кислоты. Пектин - это полностью или частично этерифицированная метиловым спиртом пектиновая кислота. Протопектин представляет собой комплекс с целлюлозой и белковыми веществами. Строение комплекса пока полностью не установлено.
Пектиновые вещества имеют молекулярную массу от 20000 до 200000.
Все пектиназы делятся на две группы - гидролазы и трансэлиминазы. Первые катализируют процесс отщепления метоксильных групп (пектинэстераза) или обеспечивают разрыв α-1,4-гликозидных связей (полигалактуроназы). Вторые осуществляют негидролитическое расщепление пектиновых веществ с образованием двойных связей (пектинтрансэлиминазы).
Препараты нашли свое применение в легкой промышленности при вымачивании льна, в пищевой промышленности (осветление вин, консервирование фруктовых соков).
4. Целлюлолитические ферментные препараты
Целлюлолитические ферментные препараты используются при обработке целлюлозы. Сама целлюлоза или клетчатка представляет собой полисахарид общей формулы (С6Н10О5)n и содержится в клеточных стенках растений. При степени полимеризации n=10 образует кристаллическую решетку. Нитевидные молекулы, взаимодействуя между собой, образуют прочные структуры - фибриллы. В объеме таких фибрилл существуют упорядоченные кристаллические участки, где молекулы расположены параллельно друг другу и связаны водородными связями, сущеcтвуют также участки с неупорядоченной структурой - аморфные.
Микроорганизмы способны синтезировать целый комплекс целлюло-литических ферментов, которые последовательно катализируют процесс гидролиза целлюлозы до глюкозы. В ферментном комплексе различают три группы ферментных препаратов: Ci-фактор, Сx-фермент и целлюбиазу.
Целлюлолитические ферментные препараты нашли применение в целлюлозно-бумажной промышленности, медицинской промышленности (получении лекарственных веществ - стероидов из растений), в пищевой промышленности (при производстве растительных масел) и в сельском хозяйстве (в качестве добавок к кормам жвачных животных).
По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают глюкоизомераза и глюкоамилаза, применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50 % рынка пищевых энзиматических препаратов.
На коммерческий уровень поставлено ферментативное разделение рацемических смесей аминокислот и эфиров терпенов. Такие смеси образуются при химическом синтезе, и разделение их по оптическим свойствам составляющих имеет важное практическое значение. Известно, что для этого можно использовать традиционные физико-химические и химические методы (хроматография; механическое разделение, избирательное взаимодействие энантиомеров с другими оптически активными веществами), но гораздо более эффективными и удобными оказываются процессы, основанные на стереоспецифичности ферментов. Рассмотрим некоторые из используемых приемов.
1.Избирательное ацилирование аминов L-аминокислотами под действием ферментов папаина, бромелина или фицина.
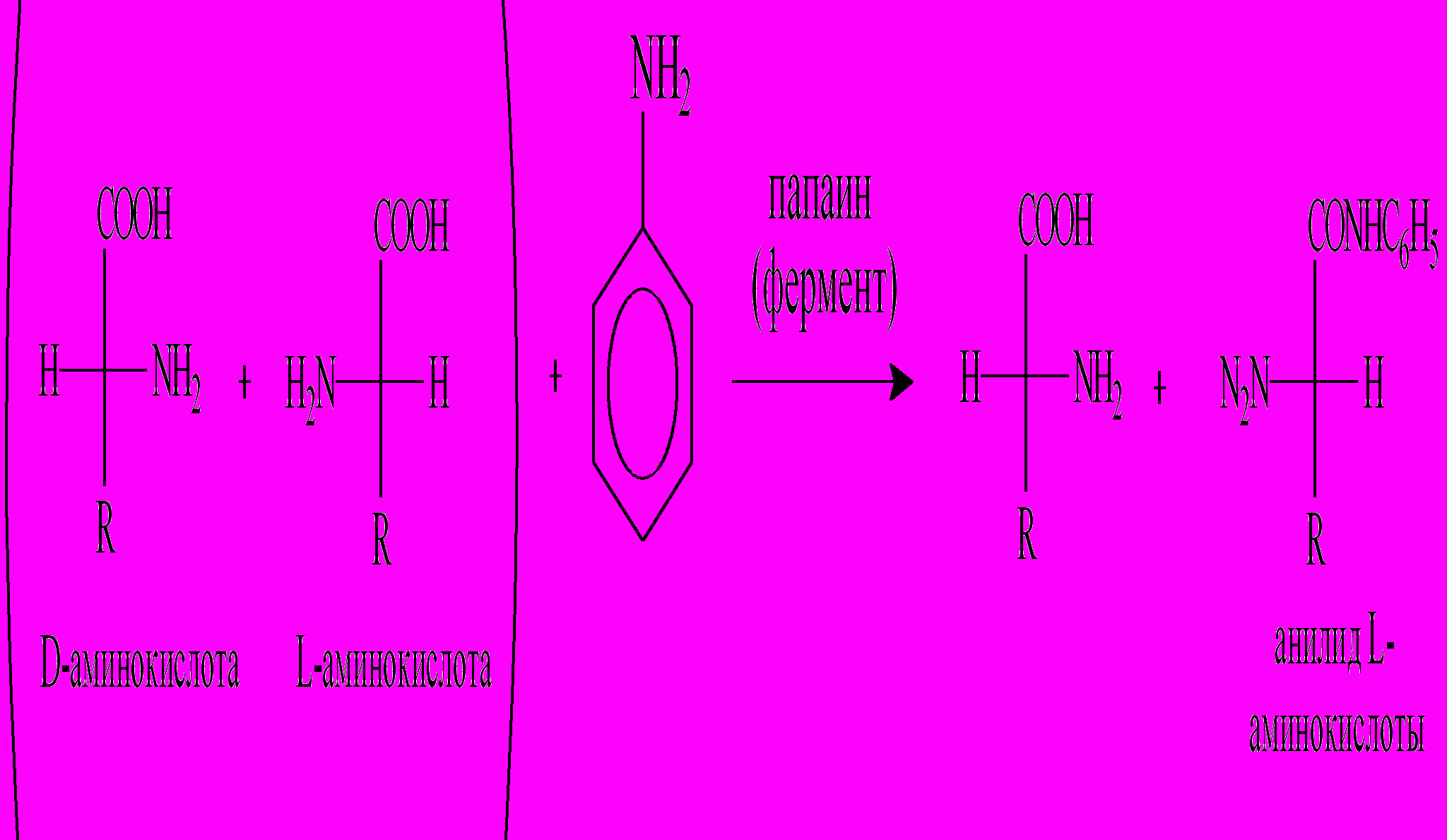
Образующийся анилид L-аминокислоты нерастворим в воде и может быть легко отделен от D-изомера, а затем подвергнут гидролизу.
2. Асимметричный гидролиз. В этом случае осуществляется стереоспецифический гидролиз производных аминокислот, в результате которого образуется только один энантиомер. Эфиры L-аминокислот гидролизуют протеолитическими ферментами (химотрипсином); нужный продукт и не вступающие в реакцию D-эфиры разделяют по растворимости.
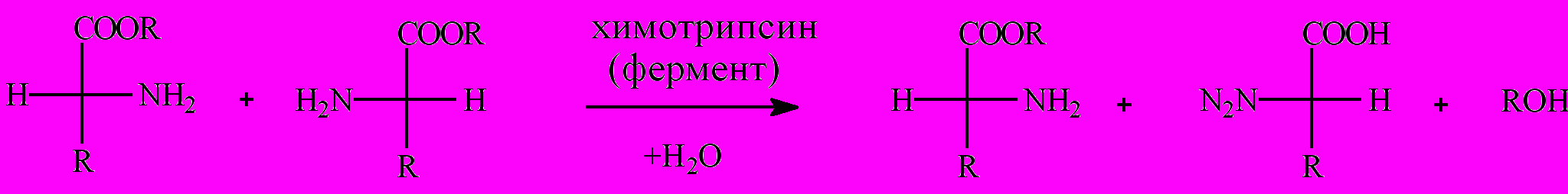
3. Использование амидаз. Эти ферменты из почек и поджелудочной железы млекопитающих или из микроорганизмов стереоспецифически гидролизуют амиды L-аминокислот. Образующуюся L-кислоту и непрореагировавший D- изомер затем разделяются методом дифференциальной растворимости. Амиды менее склонны к самопроизвольному гидролизу, чем эфиры, поэтому получаются более чистые препараты аминокислот.
4. Стереоспецифический гидролиз N-ацил -L-аминокислот под действием аминоацилазы или карбоксипепсидазы, приводящий к образованию L-аминокислот.
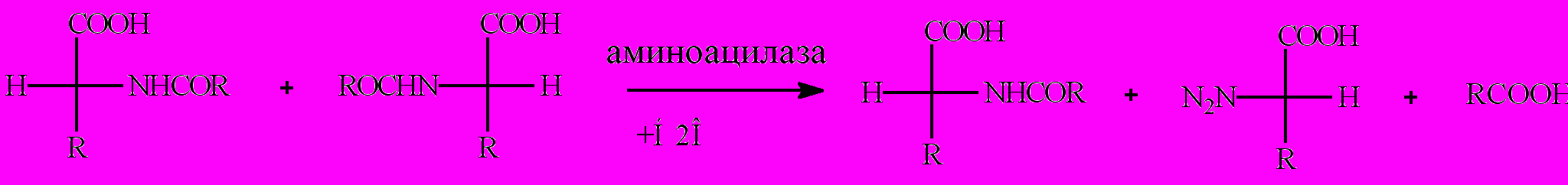
Принципы избирательного гидролиза аксиально или экваториально расположенной простой эфирной группы под действием ферментов лежит и в основе разделения рацемических смесей эфиров и терпенов.
Весьма перспективным представляется использование ферментов в качестве датчиков вредных и ядовитых веществ. Так, в качестве индикатора на фосфорорганические отравляющие вещества нервно-паралитического действия применяется холинэстераза. Ее так же возможно использовать и для определения многих пестицидов. Степень ингибирования этого фермента в присутствии ОВ или пестицидов оценивают электрохимическими или колориметрическими методами.
Аналогично карбонгидраза весьма чувствительна к хлорпроизводным алифатических, а гексокиназа – ароматических углеводородов.
Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих коферменты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление α - кетокислот в α - гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфатазу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу. Применение сопряженных ферментативных реакций с участием алкогольоксидазы и каталазы дрожжей Hansenulla polimorpha и формальдегиддисмутазы бактерии Pseudomonas putida позволило осуществить окисление метанола в муравьиную кислоту с выходом 88- 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе (“каталитические антитела”), в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре 100 °С. Препараты липазы используют для синтеза оптически чистых сложных эфиров и феромонов, применяющихся в парфюмерии и медицине.
Для деградации и модификации антропогенных органических соединений, поступающих в окружающую среду, используют ферменты разных классов и в том числе лакказу, лигниназу, тирозиназу, монооксигеназу, диоксигеназу и др. Перспективна для очистки сточных вод новая технология, основанная на использовании реакции пластеинообразования, открытой А. Я. Данилевским в 1886 г. Сущность работ Данилевского состоит в экспериментальном доказательстве обращения протеолиза и возможности синтеза белковоподобных веществ (пластеинов) под действием ряда протеолитических ферментов. Сточные воды содержат аминокислоты и пептиды, концентрация которых возрастает в результате гидролиза белковых компонентов отходов под воздействием пептидогидролаз микроорганизмов. Данная технология, активно внедряющаяся во
Франции, нацелена на производство в промышленных масштабах кормовых белков из аминокислот и пептидов сточных вод.
Развитие клеточной и генной инженерии было бы невозможно, если бы в распоряжении исследователей не было целого набора специфических ферментов (рестриктаз, лигаз, синтетаз, ферментов избирательно разрушающих клеточную оболочку и др.). Так, в настоящее время в продаже имеется более 300 различных рестриктаз.
Ферменты широко используют в медицине, например в заместительной терапии в составе лечебных препаратов. Пероральное введение фенилаланин-аммиак-лиазы снижает уровень фенилаланина в крови при фенилкетонурии. Протеолитические ферменты, амилазу и липазу применяют при заболеваниях желудочно-кишечного тракта и печени. В последние годы накопились данные об эффективности применения протеиназ в энзимотерапии злокачественных новообразований. Это объясняется большей проницаемостью мембран раковых клеток для гидролитических ферментов в сравнении с нормальными клетками, благодаря чему опухолевые клетки быстро лизируются при введении смеси протеиназ (препарат «папайотин»). Протеолитические ферменты - плазмин и активирующие его стрептокиназу и урокиназу используют для растворения тромбов в кровеносных сосудах и разжижении гноя; коллагеназу - для рассасывания рубцовых образований; эластазу - для задержки развития атеросклероза; лизоцим - для лечения конъюнктивитов; дезоксирибонуклеазу из стрептококка (стрептодорназа) - для лечения заболеваний верхних дыхательных путей и роговицы глаза.
L-аспарагиназу продуцируют Е. coli и Erwinia carotovora. Фермент используют при химиотерапии некоторых форм лейкемии. L-аспарагиназа отщепляет одну аминогруппу от аспарагина, превращая его в аспарагиновую кислоту. Избирательность действия фермента определяется потребностью некоторых форм опухолевых клеток в аспарагине, тогда как нормальные клетки в аспарагине не нуждаются.
Нейраминидазу получают при культивировании Vibrio cholera. Фермент отщепляет остатки N-ацетилнейраминовой кислоты, входящей в мембрану некоторых опухолевых клеток, повышая таким образом их антигенную активность. Может быть использован при лечении некоторых форм лейкемии.
β-лактамазы, инактивирующие пенициллины и цефалоспорины, используются при определении стерильности этих антибиотиков (см. ниже) или при микробиологическом анализе клинического материала от больных, получающих эти антибиотики. В терапевтических целях их используют в случае тяжелой аллергической реакции на β-лактамные антибиотики. Фермент вводят внутримышечно или внутривенно совместно с другими препаратами (адреналин, антигистаминные средства).
В 2004 г. появилось сообщение о том, что израильские ученые Вейцманнского института в Реховоте, добились значительных успехов в разработке микроскопических роботов, предназначенных для борьбы с тяжелыми заболеваниями и, в первую очередь, с раковыми опухолями. Созданные исследователями "наномашины" состоят из синтетических молекул ДНК и натуральных ферментов, а их размеры настолько малы, что в одном микролитре может уместиться до триллиона подобных устройств. Попав в кровоток, микророботы начинают путешествовать по организму, отыскивая злокачественные образования. Роль сенсоров при этом играет одна из частей ДНК, фиксирующая повышение уровня определенных рибонуклеиновых кислот (РНК). Аномальная концентрация РНК конкретного типа может свидетельствовать о начале развития раковой опухоли. Как только такая РНК обнаруживается, в дело вступает другой компонент "наномашины", подавляющий активность генов, приводящих к развитию болезни. Правда, в настоящее время о практическом применении предложенной методики речи не идет. Ученым удалось завершить только лабораторные тесты в пробирке, успешно идентифицировав клетки, ответственные за развитие рака простаты. И прежде чем "умное лекарство" сможет помочь людям, необходимо доказать его эффективность и безопасность, проведя эксперименты на отдельных тканевых культурах, простейших организмах и, наконец, млекопитающих. На это, могут уйти годы, и даже десятилетия.
Важнейшую область применения ферментов в медицине составляет энзимодиагностика - тестирование патологии того или того органа человека по уровню активности фермента или соотношению его множественных форм и изоферментов. Так, аспартатаминотрансфераза, изоцитратдегидрогеназа, лактатдегидрогеназа: альдолаза служат для выявления инфаркта миокарда; аланинаминотрансфераза, аспартатаминотрансфераза и лактатдегидрогеаза - для диагностики заболеваний печени; глутамилтрансфера-1 - для блокировки отторжения органов при их пересадке и т.д. Таким образом, производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к тем ее отраслям, объем продукции, которых постоянно растет, а сфера применения неуклонно расширяется. По объему производства ферментов доминируют страны Западной Европы (фирма “Ново Индастри”, Дания), резкий рост этой индустрии наблюдается в США и Японии.
3.“ КАТАЛИТИЧЕСКИЕ АНТИТЕЛА”: ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ В ОРГАНИЧЕСКОМ СИНТЕЗЕ.
Благодаря разработке огромного количества методов создания углеродного скелета и его направленной функционализации в настоящее время при необходимости можно получать органические соединения практически любой степени сложности. Обычно синтез соединений сложной структуры осуществляют в несколько стадий. При этом решающим фактором, определяющим успех, является эффективность и однозначность каждой стадии. Эффективность реакции определяется ее скоростью и выходом продукта, а однозначность - ее регио- и стереоспецифичностью. Это позволяет получить максимально чистое вещество и избежать сложной процедуры выделения и очистки. По мере развития тонкого органического синтеза и получения все более сложных структур требования к эффективности и специфичности реакции непрерывно возрастают. При этом использование в многостадийных синтезах чисто химических методов нередко оказывается недостаточным. В последнее время для создания углеродного скелета соединений и его функционализации на отдельных стадиях синтеза все чаще стали применять ферментативные реакции.
Использование ферментов часто позволяет проводить реакцию быстрее и, благодаря их высокой регио- и, особенно, стереоселективности, чище. Поэтому методы ферментативного и химико-ферментативного синтеза быстро внедряются в практику тонкого органического синтеза. Препятствием для широкого использования биосинтетических методов часто является малая доступность природных ферментов нужной активности и специфичности. Это требует дополнительной трудоемкой работы по поиску подходящего и доступного источника фермента, разработке методов его выделения и очистки и детальному исследованию его специфичности. Поэтому в настоящее время в лабораторной и промышленной практике используется довольно ограниченный круг природных ферментов, катализирующих ограниченный круг химических превращений.
Давней мечтой химиков-органиков является получение искусственных ферментов с высокой эффективностью и, главное, с заданной избирательностью действия. Такие ферменты должны изготовляться в лаборатории и направленно использоваться для осуществления нужной реакции. Подобные искусственные ферменты заданной специфичности («tailor-made enzymes») позволили бы сильно повысить эффективность органического синтеза и открыли бы пути к получению новых классов органических соединений.
Природные ферменты являются высокомолекулярными белками с однозначной структурой. Их каталитическая активность и избирательность действия заданы строго определенной последовательностью аминокислот белковой цепи. Это, в свою очередь, предопределяет конформацию белковой молекулы и, в конечном счете, формирование пространственной структуры активного центра фермента.
Казалось бы, что наиболее простым путем получения искусственного фермента является его прямой синтез. Hо несмотря на общеизвестные успехи в синтетической химии белков, этот путь представляется малоэффективным не только из-за своей трудоемкости, но и потому, что требует информации о первичной структуре целевого белка-фермента. Однако определение аминокислотной последовательности само по себе является сложным и трудоемким исследованием.
Решением проблемы явился иной подход к получении искусственных ферментов с заданной специфичностью. Он основан на биосинтезе с использованием мощного иммунологического аппарата клетки, который отличается способностью синтезировать огромное разнообразие белковых молекул.
Как известно, иммунная система животных служит для биосинтеза антител - защитных белков, предназначенных для «нейтрализации» попавших в организм чужеродных молекул и более сложных комплексов, так называемых антигенов. Иммунная система создает белковую молекулу антитела, структура которого соотносится со структурой антигена таким образом, что активный центр антитела оказывается комплементарным специфической части антигена, так называемого гаптена. Антитело образует с антигеном достаточно прочный комплекс и тем самым «нейтрализует» его действие. Иными словами, биосинтетический аппарат иммунной системы делает возможным получение белковой молекулы, в которой формируется активный центр, структура и пространственное строение которого задаются структурой вводимого в организм антигена. Этот принцип и был использован для получения искусственных ферментов.
Согласно современным представлениям, каталитическое действие природного фермента заключается, в первую очередь, в облегчении перехода субстрата реакции из основного состояния в возбужденное переходное состояние. Последнее стабилизируясь в активном центре фермента, превращается далее в продукт или продукты реакции. Таким образом, для проявления каталитической активности в белковой молекуле должен, прежде всего, сформироваться активный центр, способный облегчить формирование и стабилизацию переходного состояния субстрата. Следовательно, при биосинтезе в иммунном аппарате антитела, обладающего каталитическими свойствами, нужно использовать антиген, строение которого моделирует переходное состояние, возникающее в каталитической реакции. Получить стабильную молекулу соответствующую переходному состоянию, невозможно, так как оно представляет собой неустойчивый комплекс. Поэтому в качестве антигенов, генерирующих каталитически активные антитела, были использованы соединения, молекулы которых по своей пространственной и электронной структуре имитировали переходное состояние. Будучи введенными в клетки иммунной системы, такие антигены: должны генерировать антитела, стабилизирующие переходное состояние соответствующей реакции и, следовательно, обладающие каталитическими свойствами подобно природным ферментам.
Хотя эта идея была высказана довольно давно, ее реализация вначале столкнулась с трудностями, так как в ответ на введение антигена клетки иммунной системы синтезируют большое количество антител («поликлональные антитела»). Трудности, возникающие при выделении из полученной сложной смеси близких по структуре белков антитела, обладающего наибольшей каталитической активностью и избирательностью, делали этот метод непригодным для практического использования.
Положение коренным образом изменилось, когда был открыт и детально разработан метод получения так называемых «моноклональных антител», количество которых и разнообразие более ограничено. В этом случае действительно удалось выделить антитела, обладающие каталитическими свойствами.
Таким путем около 10 лет назад были синтезированы первые антитела, получившие название «каталитических антител» (КА) или «абзимов» (сокращение английского «antibody enzymes»). С тех пор эта область стремительно развивается. В настоящее время получено уже около сотни КА, способных ускорять и специфически направлять реакции самого различного типа, и сформулированы основные принципы, используемые при генерации КА заданной специфичности. Все КА были подвергнуты тщательному исследованию методами ферментативной кинетики. Их физико-химические характеристики оказались сходными с характеристиками природных ферментов.
В некоторых случаях активность КА приближалась к активности природных ферментов. Полученные КА обладали, как правило, высокой специфичностью, в том числе стереоселективностью, которая могла быть заранее задана. Кроме того, были получены КА, катализирующие реакции, для которых вообще неизвестны природные ферменты (например, для реакции Дильса -Альдера). Но наиболее важно и перспективно для синтетической химии то, что удалось получить КА, позволяющие изменить направление известной реакции и направить ее по пути, запрещенному энергетически или стерически в обычных некатализируемых условиях, иными словами, изменить хемо-, регио- и стереоспецифичность реакции и реализовать превращения, недоступные для обычных химических методов.
Известны попытки использования “каталитических антител” в практической медицине, например в качестве препаратов, купирующих действие некоторых токсинов, наркотиков и т.д. Перспективным представляется также применение их при создании лекарственных препаратов – предшественников (“prodrugs”).
Таким образом, «каталитические антитела» представляют собой новое поколение биокатализаторов белковой природы, а их получение знаменует значительный шаг вперед в теоретическом и практическом аспектах науки о биокатализе.
В этой связи возникает вопрос о получении КА в укрупненных масштабах. Первые разработки, касающиеся получения крупных партий КА и их использования для синтеза веществ в граммовых количествах, включая и создание лабораторной установки для этой цели, работающей в полуавтоматическом режиме, уже известны. В настоящее время каких-то принципиальных затруднений для использования КА в препаративном синтезе не просматривается. При современном уровне развития биотехнологии и белковой инженерии получение значительных количеств высокоочищенных “каталитических антител” не вызывает серьезных проблем. Разумеется, их практическое использование в укрупненных лабораторных и технологических масштабах потребует еще решения ряда вопросов и инженерных разработок. Один из вопросов касается наиболее рациональной формы их использования - в растворах, в двухфазной системе, иммобилизованными на носителе, в условиях мицеллярного катализа и т.д. Многие из этих проблем возникали при использовании природных ферментов, но были успешно решены. Это облегчает их решение в случае “каталитических антител”.
Что касается экономического аспекта, то несмотря на трудоемкость и дороговизну процесса получения таких биокатализаторов, эффект от их использования, например в асимметрическом синтезе, может полностью окупить эти затраты. Тем не менее, вопрос об их использовании в крупнотоннажных процессах представляется пока преждевременным.
