Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета нижний новгород 2005 г
| Вид материала | Учебное пособие |
- Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета, 376.65kb.
- Учебное наглядное пособие для студентов экономического факультета Нижний Новгород, 356.34kb.
- Учебное пособие Нижний Новгород 2007 Балонова М. Г. Искусство и его роль в жизни общества:, 627.43kb.
- Учебное пособие Нижний Новгород 2002 удк ббк к найденко В. В., Губанов Л. Н, Петрова, 1219.74kb.
- Учебно методическое пособие Рекомендовано методической комиссией факультета вычислительной, 269.62kb.
- Учебное пособие по патофизиологии для студентов фармацевтического факультета, 677.92kb.
- Учебное пособие Нижний Новгород 2003 удк 69. 003. 121: 519. 6 Ббк 65. 9 (2), 5181.42kb.
- Учебное пособие Нижний Новгород 2010 Печатается по решению редакционно-издательского, 2109.64kb.
- Учебное пособие для студентов факультета очно-заочного обучения Нижний Новгород 2010, 795.89kb.
- Учебно-методическое пособие для студентов, обучающихся по специальности 030501 Нижний, 1855.66kb.
Цель занятия: Повторение и закрепление раздела посвященного применению в производстве, экологии и медицине чистых и иммобилизованных ферментных препаратов и клеток, а так же методам их получения и технологическом оформлении процессов на их основе.
План занятия
- Установка преподавателя о порядке проведения занятия.
- Сдача студентами теоретической части лабораторной работы.
- Самостоятельная работа студентов (лабораторная работа №1 и №2).
- Оформление отчета по выполненной лабораторной работе.
ЛАБОРАТОРНАЯ РАБОТА №1
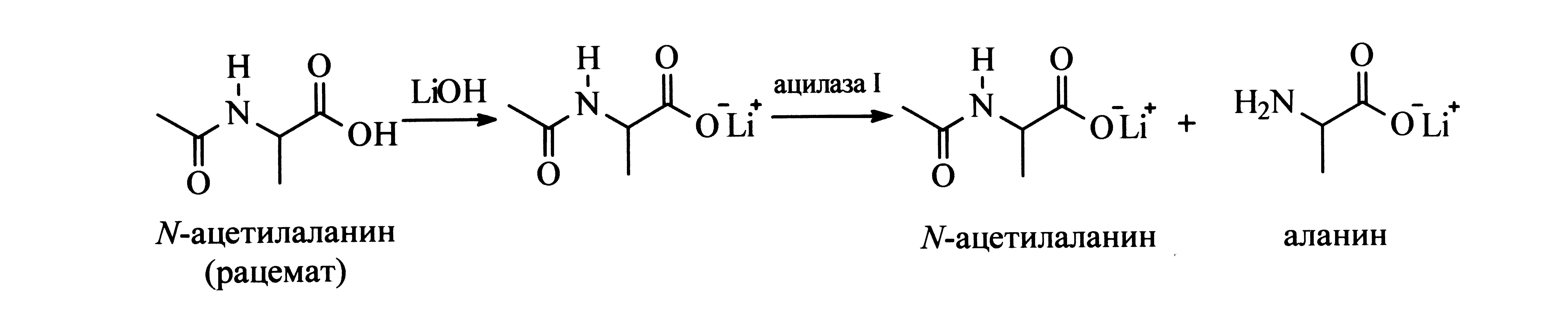
ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ N-АЦЕТИЛАЛАНИНА: ПРИМЕР ЭКОЛОГИЧЕСКИ БЕЗОПАСНОГО ПРОЦЕССА
Цель работы: ознакомление с методами ферментативного разделения оптических изомеров аминокислот, овладение лабораторными навыками проведения таких процессов, определение выхода целевого продукта.
Теоретическая часть: Биологические процессы катализируются ферментами. Многие ферменты обладают высокой каталитической селективностью и могут селективно катализировать реакции только с одним из энантиомеров в рацемате. В современной химии ферменты используются во многих процессах in vitro, особенно в синтезе оптически чистых продуктов. В данном эксперименте изучается гидролиз N-ацетилаланина в присутствии фермента ацилазы I.
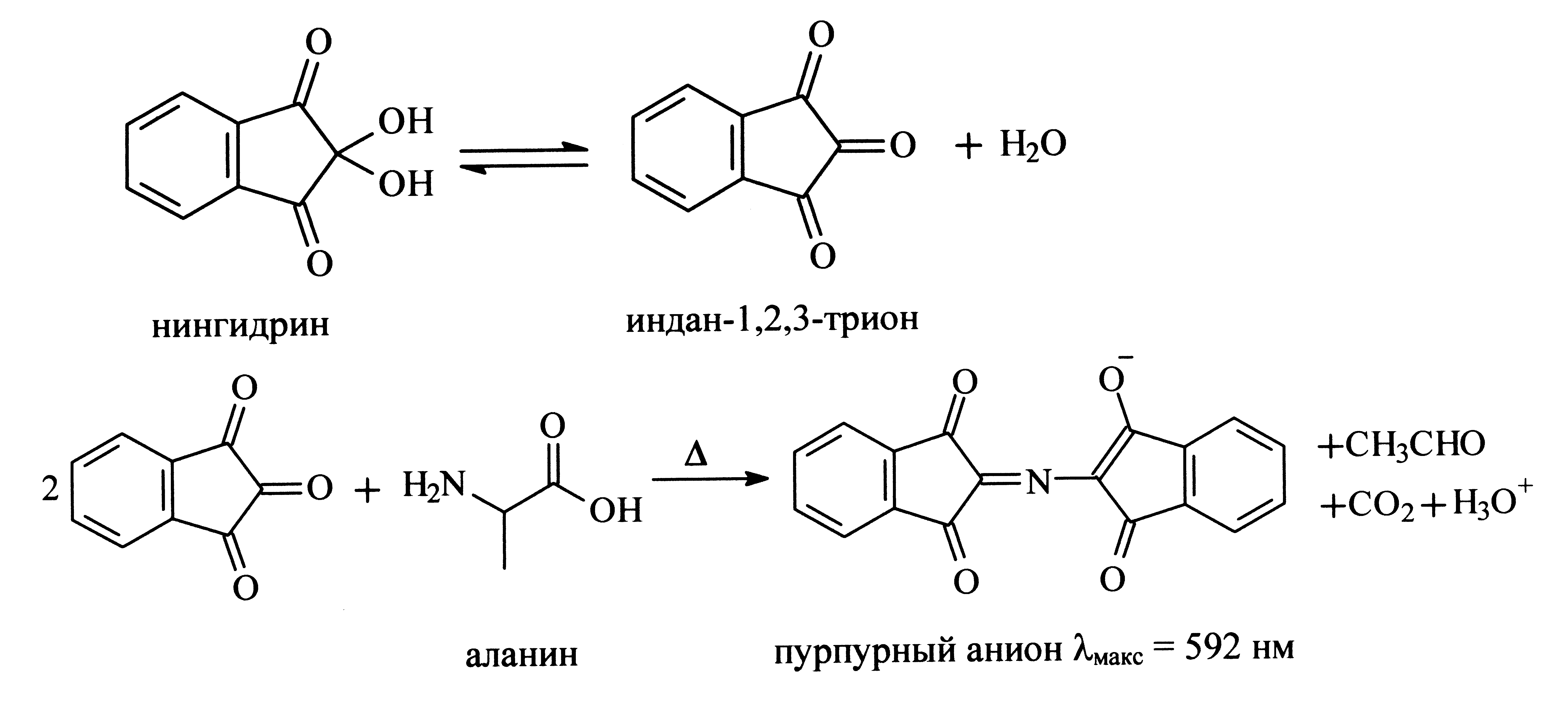
За ходом реакции можно следить, если в реакционную смесь добавить нингидрин, который взаимодействует с образующимся аланином, давая яркое пурпурное окрашивание раствора:
Ход работы:
Растворите рацемат N-ацетилаланина (262 мг; 2,0 ммоль) в 10 мл воды. Медленно, при осторожном перемешивании прибавляйте раствор моногидрата гидроксида лития (84 мг; 2,0 ммоль) в воде (4 мл) до тех пор, пока рН раствора не станет равным 7. Контролируйте рН лакмусовой бумагой. В течение 2 минут, при интенсивном перемешивании прибавьте раствор ацилазы I (10 мг) в воде (водный раствор ацилазы I готовится следующим образом: навеска фермента добавляется к 5 мл воды, затем раствор отфильтровывается на стеклянном фильтре, покрытом диатомитом). После этого доведите объем раствора водой до 20,0 мл (точно). Поместите реакционную смесь в водяную баню (37°С) на 60 минут. Затем перенесите ровно 0,25 мл (для этого используйте шприц или мерную пипетку) реакционной смеси в пробирку и добавьте туда нингидрин (Sigma N 1632) (1,25 мл). Эту смесь нагревайте в кипящей воде в течение 20 минут, при этом появится интенсивная пурпурная окраска. После охлаждения аккуратно добавьте содержимое пробирки к буферному раствору, состоящему из 4 М литий-ацетатного водного буфера (рН = 5,2) и диметилсульфоксида в соотношении 1:3, находящемуся в мерной колбе на 250 мл. Доведите объем раствора до 250 мл. Измерьте оптическую плотность на спектрофотометре при λ = 592 нм. В качестве стандарта используйте раствор нингидрина в том же литий-ацетатном бу-
фере в диметилсульфоксиде. (ε пурпурного комплекса = 13350 л . Моль-1 . см-1)
Запишите следующие данные:
1. Начальную концентрацию рацемического N-ацетилаланина.
2. Значение оптической плотности при λ = 592 нм.
3. Используя закон Бугера-Ламберта-Бера, рассчитайте количество аланина (в
ммоль), образовавшегося в результате ферментативной реакции.
4. Рассчитайте степень превращения.
5. Если позволяет время, остановите реакцию и определите концентрацию
аланина через 10, 25, 40 и 60 минут после начала реакции. Постройте график
зависимости концентрации аланина от времени и оцените оптимальное время
проведения реакции.
Контрольные вопросы
1. Будет ли образующийся аланин оптически активен: да или нет?
2. Будет ли непрореагировавший N-ацетилаланин: (1) оптически неактивен, (2) обогащен одним из энантиомеров, (3) оптически чист, если степень превращения меньше 50%?
3. Будет ли непрореагировавший N-ацетил аланин: (1) оптически неактивен, (2) обогащен одним из энантиомеров, (3) оптически чист, если степень превращения составит ровно 50%?
4. Достижима ли степень превращения больше 50%, да_или нет?
ЛАБОРАТОРНАЯ РАБОТА №2
В ПОЛУЧЕНИЕ 6-АМИНОПЕНИЦИЛЛАНОВОЙ КИСЛОТЫ ГИДРОЛИЗОМ БЕНЗИЛПЕНИЦИЛЛИНА С ПОМОЩЬЮ ПЕНИЦИЛЛИНАЦИЛАЗЫ, ИММОБИЛИЗОВАННОЙ ПОЛИАКРИЛАМИДНЫЙ ГЕЛЬ
Цель работы: ознакомление с технологией получения 6-амино-пенициллановой кислоты гидролизом бензилпенициллина с помощью иммобилизованного фермента, овладение лабораторными навыками проведения процессов с иммобилизованными ферментами, определение выхода продукта.
Теоретическая часть:
6-Аминопенициллановая кислота (6-АПК) является полупродуктом в химическом синтезе ряда полусинтетических антибиотиков. Современная технология получения 6-АПК складывается из следующих основных стадий:
1. Получение биомассы клеток микроорганизма E.coli, содержащих фермент пенициллинацилазу.:
2. Выделение и очистка фермента пенициллинацилазы.
3. Иммобилизация фермента в полиакриламидный гель.
4. Получение 6-АПК.
Последняя стадия включает в себя проведение следующих операций:
а) гидролиз бензилпенициллина с помощью иммобилизованного фермента; б) осветление гидролизной жидкости углем и отделение угля;
в) осаждение 6-АПК в изоэлектрической точке;
г) фильтрация и промывка полученного осадка 6-АПК водой и органическим растворителем;
д) вакуум-сушка готового продукта.
Клетки микроорганизма E.coliI выращивают методом глубинной ферментации в течение 24 ч. в слабощелочном растворе при температуре 25°С, при постоянном перемешивании и аэрации, на среде, содержащей очищенный кукурузный экстракт и фенилуксусную кислоту. По окончании ферментации клетки E.coli отделяют от культуральной жидкости сепарацией. Полученную пасту направляют на переработку с целью извлечения из неё фермента. Для этого проводят следующие технологические операции:
а) извлечение пенициллинацилазы из клеток Е.coli экстракцией нагретым до 400С O,9%-м раствором бутилацетата в воде при рН=8 и отделение отработанных клеток фильтрацией;
б) осаждение неактивных примесей (балластных белков) из бесклеточного экстракта;
Процесс проводят при температуре 5-8°С путем добавления к экстракту до концентрации 20% сухого сульфата аммония, полученный раствор перемешивают в течение 0,5 ч и отделяют выпавшие балластные белки сепарацией;
в) осаждение активного белка (фермента) и его отделение;
Для этого к осветленному на предыдущей операции экстракту при температуре 5-8°С вновь добавляют до уровня 12% сульфат аммония и полученную смесь выдерживают до 20 ч, из экстракта выпадает осадок, содержащий преимущественно целевой фермент пенициллинацилазу, который впоследствии отделяют от маточника сепарацией и направляют на вакуум-сушку;
г) вакуум-сушка полученного фермента.
Приготовленный таким образом ферментный препарат подвергают иммобилизации в полиакриламидный гель.
Получение иммобилизованной пенициллинацилазы состоит в радикальной сополимеризации акриламида и N, N’-метилен-бис-акриламида в водной среде в присутствии инициаторов - персульфата аммония (NH4)2S2O8 и N, N,N’,N’ -тетраметилендиамина. В реакционную смесь вводится бифункциональный реагент- глутаровый альдегид (ГА) под действием которого молекулы фермента-коваленню связываются с мономерами и сшиваются друг с другом.
Приготовление иммобилизованного фермента завершают промывкой полученного геля водой.
Процесс получение 6-АПК включает в себя последовательное проведение ряда вышеуказанных операций, выполнение которых и составляет экспериментальную часть данной лабораторной работы.
Ход работы:
Гидролиз бензилпенициллина под действием иммобилизованного фермента можно представить следующим стехиометрическим уравнением;

Гидролиз проводят в стеклянном пятигорловом реакторе, снабженном водяной "рубашкой”. В реактор введена мешалка, электроды и термокомпенсатор рН-метра.
В реактор заливают 100 см3 дистиллированной воды. В рубашку реактора из термостата подают нагретую до температуры 41°С воду. В реактор вносят точную навеску (5 г) соли бензилпенициллина и включают мешалку. После полного растворения соли в раствор вносят I мл концентрированной ортофосфорной кислоты, 15 г гель-фермента и производят начальный отсчёт времени. Момент внесения фермента считает началом времени гидролиза.
В течение гидролиза реакционную смесь подвергают достаточно интенсивному перемешиванию.
Гидролиз проводят при значениях рН в пределах 7,5-7,6, величина которого поддерживается добавлением из бюретки 12,5%-го раствора гидроксида аммония. По ходу процесса каждые 15 мин записывают объем, пошедшей на подтитровку щелочи.
С течением времени скорость гидролиза уменьшается и в зависимости от активности фермента процесс заканчивается через 1,5-2 ч. Окончание гидролиза определяется по установившемуся постоянному значении рН раствора.
По завершению гидролиза реакционную смесь выгружают из реактора на воронку Бюхнера, где осадок отфильтровывают через плотный бумажный фильтр.
Освобожденный от гель-фермента гидролизат переливают в мерный цилиндр, измеряют его объем и переносят в коническую колбу вместимостью 500 мл. Содержимое колбы охлаждают до температуры 40С в токе холодной воды или на водяной бане со льдом.
Далее проводят осветление гидролизата активированным углем. Для этого в колбу с охлажденным гидролизатом вносят активированный уголь марки "Е", взятого из расчета на каждые 100 мл гидролизата по 1г угля. После внесения угля содержимое колбы в течение 15 мин перемешивают. Затем уголь отделяют от гидролизата фильтрованием на, воронке Бюхнера. Осветленную жидкость переливают в химический стакан вместимостью 250 мл в токе холодной воды или в бане с тающим льдом и охлаждают до температуры 6-8°С. После этого стакан устанавливают на столик магнитной мешалки, вводят электроды и_термокомпенсатор рН-метра. При включенной мешалке из бюретки по каплям добавляют 18-20%- ую соляную кислоту до тех пор, пока значение рН не достигнет 3,9-4,1.В. Этом интервале значений начинают выпадать кристаллы 6-АПК.
Стакан с реакционной массой снимают с мешалки, переносят в баню со льдом или холодильник, где выдерживают не менее 2 часов.
Полученный осадок отфильтровывают на воронке Бюхнера и дважды промывают охлажденной до 4-ЗсС дистиллированной водой порциями по объёму примерно вдвое больше объема полученного осадка.
Промытый водой осадок подсушивают на той же воронке Бюхнера и дважды промывают ацетоном порциями по объёму вдвое большими, чем объем осадка.
Ацетон тщательно отсасывают и 6-АПК переносят в предварительно взвешенную чашку Петри, изготовленную из тонкого, стекла или пластмассы.
Окончательное высушивание продукта производят в вакуум-сушильном шкафу при температуре 45-50°С и остаточном давлении 2,5-4,0; кПа
до постоянной массы.
По окончании работы оценивают выход 6-АПК в расчете на прогидролизованнный бензилпенициллин. Для этого по химическому уравнению гидролиза бензилпенициллина и количеству израсходованной щелочи сначала находят число разложившихся молей бензилпенициллина. Далее определяют процентное соотношение массы полученного выше осадка 6-АПК, пересчитанное на число молей, к количеству молей прогидролизованного бензилпенициллина.
Контрольные вопросы
1. Каковы основные технологические стадии получений 6-АПК с помощью иммобилизованных ферментов? Дайте их краткую характеристику. Каково назначение 6-АПК?
2. Какие продукты (основные и побочные) могут получаться в результате гидролиза бензилпенициллина?
3. Каковы Ваши предложения по утилизации фенилуксусной кислоты, остающейся в гидролизате после осаждения из него кристаллов 6-АПК?
4. Каковы основные стадии процесса получения иммобилизованного фермента пенициллинапилазы? Какова роль персульфата аммония и глутарового альдегида при получении иммобилизованного фермента?
5. Какие, на Ваш взгляд, возможны пути повышение интенсификации процесса получения 6-АПК из солей бензилпенициллина и снижения себестоимости готового продукта?
6. Каково назначение ортофосфорной кислоты, добавляемой к водному раствору бензилпенициллина перед началом гидролиза?
7. Какое влияние могут оказать изменения температуры и рН раствора на процесс получения 6-АПК путем гидролиза бензилпенициллина?
8. Какие технологические преимущества имеет вышеописанный способ получения 6-АПК по сравнению с технологией получения 6-АПК в результате направленного химического синтеза?
11. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА .
11.1. Основная литература
1. Учебно-методические разработки для практических занятий по
биотехнологии лекарственных средств./ Под ред. В.А. Быкова. - М.: ММА им. И.М.Сеченова, 1993. - 176 с.
2. Биотехнология: Учебное пособие для ВУЗов. В 8 кн./Под ред.
Н.С.Егорова, В.Д. Самуилова. - М.: Высшая школа, 1987.
3. Б.Глик, Дж.Пастернак. Молекулярная биотехнология. Принципы и
применение. М. “Мир”. 2002.- 590 с.
4. Т.А Егорова, С.М.Клунова, Е,А,Живухина. Основы биотехнологии.
Издательский центр “Академия”, М. 2003.-208 с.
5. Елинов Н.П. Основы биотехнологии. Издательская фирма "Наука",
СПБ, 1995.-600 с.
6. Егоров Н.С. Основы учения об антибиотиках: Учебник.- М.: Изд-во
МГУ, 1994.-512 с.
7. Сниииин А.П., Райнииа Е.И., Лозинский В.И., Спасов С.Д. Иммобили-
зованные клетки микроорганизмов. - М.: Изд-во МГУ, 1994. - 288 с.
8. Биотехнология. Принципы и применение. - Пер. с англ./ Под ред.
И. Хиггинса, Д.Беста, Дж. Джойса. - М.: Мир, 1988.
9. Иммобилизованные клетки и ферменты. - Пер. с англ./ Под ред.
Дж. Вудворта.-М.: Мир, 1988.
10. Биотехнология лекарственных средств. Учебное пособие./Под ред. В.А.
Быкова и М.В. Далина. - М.: Медбиоэкономика, 1991. - 303 с.
11.2 Дополнительная литература
1. Краткий терминологический словарь микробиолога-биотехнолога. - М.:
Наука, 1989. - 136 с.
2. Государственная фармакопея СССР. Вып.2. Общие методы анализа. –
М.: Медицина, 11 изд., 1990. - 398 с.
3. Промышленная микробиология / Под ред. Н.С. Егорова. - М.: Высшая
школа, 1989.-687 с.
4. Современная генетика/ Под ред. Ф. Айала, Д. Кайчур. - М.: Мир, 1987.
5. Молекулярные и клеточные аспекты биотехнологии / Под ред.
С.Г. Инге-Вечтомова. - Л.: Наука, 1986. - 256 с.
6. Сазыкин Ю.О. Антибиотики как биохимические реагенты. - М.:
ВИНИТИ, 1984.-203 с.
7. Самуилов В.Д., Олескин А.В. Технологическая биоэнергетика. М.:
Изд-во МГУ,1994.- 192 с.
8. Шилова С.В.,Пузакова С.М. и др. Организация производства лекарст-
венных средств с учетом правил GMP. Химико-фармацевтическое
производство, обзорная информация. - М.: ВНИИСЭНТИ, 1990.- 36 с.
10. Саруханов А.В., Быков В.А. Оборудование микробиологических
производств: Справочник. - М.: Колос, 1993. - 384 с.
11. Сниииин А.П., Райнииа Е.И., Лозинский В.И., Спасов С.Д. Иммобили-
зованные клетки микроорганизмов. - М.: Изд-во МГУ, 1994. - 288 с.
12. Фармацевтическая микробиология/ под ред. проф. В.А.Галынкина, проф.
В.И.Кочеровца.- ЗАО “Арнебия”, 2003г. - с.
СОДЕРЖАНИЕ
- Введение. 3
- Применение ферментов 4
- “Каталитические антитела”: Перспективы использования 10
в органическом синтезе.
4. Рибозимы 16
5. Инженерная энзимология, ее задачи. 19
5.1. Иммобилизованные ферменты 20
5.1.1. Носители для иммобилизации ферментов 21
5.1.2. Методы иммобилизации ферментов 22
5.2. Иммобилизация клеток 27
6. Промышленные процессы с использованием 28
иммобилизованных ферментов и клеток
6.1. Получение глюкозофруктозных сиропов 28
6.2. Биотрансформация других углеводов. 29
6.3. Получение L-аминокислот из их рацемических смесей. 32
6.4. Получение L-аспарагиновой кислоты. 32
6.5. Получение L-аланина. 33
6.6. Получение органических кислот. 33
6.7. Получение антибиотиков 37
6.8. Трансформация стероидов. 39
6.9. Получение ферментов 41
6.10. Применение иммобилизованных клеток для 41
утилизации отходов
6.11. Биогеотехнология 45
6.12. Биосенсоры на основе иммобилизованных ферментов 47
6.13. Иммобилизованные ферменты в медицине 51
7. Реакторы с иммобилизованными клетками 52
8. Мембранные реакторы 57
9. Полимерные биоматериалы 59
9.1. Получение гемосовместимых полимерных материалов 59
9.2. Использование радиационного сшивания для получения 62
полимерных биоматериалов
- Получение полимерных имплантантов 63
- Иммобилизация лекарственных препаратов 64
- Иммобилизация компонентов крови 65
- Получение “умных” полимеров и их использование для 66 иммобилизации биологически активных веществ
10. Лабораторный практикум 67
Лабораторная работа №1 67
Лабораторная работа №2 69
11. Рекомендуемая литература 73
