Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета нижний новгород 2005 г
| Вид материала | Учебное пособие |
- Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета, 376.65kb.
- Учебное наглядное пособие для студентов экономического факультета Нижний Новгород, 356.34kb.
- Учебное пособие Нижний Новгород 2007 Балонова М. Г. Искусство и его роль в жизни общества:, 627.43kb.
- Учебное пособие Нижний Новгород 2002 удк ббк к найденко В. В., Губанов Л. Н, Петрова, 1219.74kb.
- Учебно методическое пособие Рекомендовано методической комиссией факультета вычислительной, 269.62kb.
- Учебное пособие по патофизиологии для студентов фармацевтического факультета, 677.92kb.
- Учебное пособие Нижний Новгород 2003 удк 69. 003. 121: 519. 6 Ббк 65. 9 (2), 5181.42kb.
- Учебное пособие Нижний Новгород 2010 Печатается по решению редакционно-издательского, 2109.64kb.
- Учебное пособие для студентов факультета очно-заочного обучения Нижний Новгород 2010, 795.89kb.
- Учебно-методическое пособие для студентов, обучающихся по специальности 030501 Нижний, 1855.66kb.
ОСНОВНЫЕ ПРИНЦИПЫ И ТЕХНИКА ПОЛУЧЕНИЯ “КАТАЛИТИЧЕСКИХ АНТИТЕЛ”
Принцип действия каталитических антител, как и обычных ферментов, состоит в облегчении формирования переходного состояния молекулы субстрата и создании благоприятных условий для его превращения в конечные продукты реакции. При этом барьер на энергетической координате реакции, возникающий при формировании переходного состояния, снижается, и скорость реакции возрастает. Это- результат нескольких различных по природе взаимодействий, протекающих на активном центре фермента. Полость активного центра комплементарна пространственной структуре субстрата. На поверхности центра расположены активные группировки, стимулирующие соответствующие превращения молекулы субстрата. Пространственная и электронная комплементарность активного центра и субстрата способствуют “узнаванию” субстрата ферментом и образованию фермент – субстратного комплекса, а активные группировки обеспечивают переход молекул субстрата в продукты реакции посредством кислотно-основного катализа, нуклеофильных или электрофильных взаимодействий и т.п.
При образовании фермент-субстратного комплекса подвижность молекулы субстрата ограничивается и она «замораживается» в наиболее благоприятной для дальнейшего превращения конформации. Таким образом, достигается существенный выигрыш энергии и создается так называемая «энтропийная ловушка». Такой каталитический эффект особенно существен для бимолекулярных реакций, когда обе реагирующие молекулы фиксируются в выгодном для реакции взаимном положении. Существенную роль в проявлении каталитического эффекта играют и другие факторы, например, наличие в активном центре гидрофобных зон, облегчающих превращения субстрата в неполярной апротонной («неводной») среде.
Чтобы получить эффективное каталитическое антитело, необходимо наделить его активный центр свойствами, характерными для активного центра фермента (см. выше), и тем самым сделать возможным проявление каталитического действия. Этой цели служит антиген, в ответ на введение которого в процессе биосинтеза белковой молекулы в иммунном аппарате происходит формирование активного центра нужной структуры.
Антиген, используемый для получения КА, состоит из двух основных частей: низкомолекулярного гаптена и высокомолекулярного носителя (доступного природного белка). Гаптен является именно тем фрагментом молекулы антигена, который непосредственно формирует активный центр КА. По своему пространственному и электронному строению он должен соответствовать переходному состоянию, возникающему в процессе реакции, и обеспечивать появление у активного центра активных групп, гидрофобных зон и т.п.
Белковая же часть антигена (так называемый «иммуноген») представляет собой высокомолекулярный носитель, обеспечивающий генерацию в иммунном аппарате антител. В качестве белковой части антигена чаще всего используют доступные природные белки- гемоцианин моллюска Mega-tura crenulata (Keyhole Limpet Hemocyanin, KLH) или бычий сывороточный альбумин (BSA).
Правильный выбор гаптена является ключевым моментом, который и обеспечивает успех при получении КА. Естественно, что для правильного дизайна гаптена следует знать структуру переходного состояния, пути его возникновения и последующего распада. По сути дела - знать механизм реакции. В настоящее время удалось получить КА, катализирующие протекание многих реакций, различающихся своими механизмами. Однако дать общие рекомендации по дизайну гаптена, естественно, невозможно. Ниже для каждой конкретной реакции будут приведены соображения, послужившие основанием для выбора структуры гаптена.
Порою, при недостатке точных знаний о механизме реакции, подбор гаптена носит полуэмпирический характер. В этом случае большое значение имеет опыт, и даже интуиция исследователя. Так, на начальных этапах значительную роль сыграло несколько упрощенное представление о соответствии пространственного и электронного строения гаптена структуре переходного состояния. Этого оказалось достаточно для получения первых эффективных КА. Примером может служить моделирование переходного состояния, возникающего при гидролизе сложноэфирной группировки, группировкой фосфорной или фосфоновой кислоты.
Гаптен, наряду с главной «реакционной частью», формирующей активный центр КА, должен содержать также фрагменты, обеспечивающие «узнавание» субстрата антителом. Это достигается включением в гаптен группировок, аналогичных группировкам субстрата. Кроме того, гаптен обязательно должен иметь группировку, позволяющую иммобилизовать его на белке, причем так, чтобы остаток гаптена находился в антигене на некотором расстоянии от белковой цепи. Такой группировкой, называемой «спейсером» или «линкером», может быть короткая алифатическая цепочка, содержащая на конце активную функции- ональную группу (например, карбоксильную). При иммобилизации карбоксильная группа спейсера реагирует, например, с аминогруппой остатка лизина белковой молекулы и привязывает к ней гаптен прочной амидной связью.
Иммобилизация гаптена на белке обычно протекает в мягких условиях, не затрагивающих ни гаптен, ни иммуногенный белок. Количество молекул гаптена, которые при этом связываются с молекулой белка, зависит от условий иммобилизации. Обычно при синтезе антигена стараются достигнуть привязки не менее 10-20 остатков гаптена на одну молекулу белка.
Полученный таким образом антиген используется для иммунизации животных - мышей чистых линий. Иммунизацию обычно проводят по стандарт-ной методике; при получении конкретных КА различаются лишь отдельные детали. Как правило, осуществляют двух-трехкратную иммунизацию посредством внутримышечной инъекции в присутствии адъюванта (чаще всего адъюванта Фрейнда), а затем - одну внутривенную инъекцию без адъюванта для усиления иммунного ответа. По истечении определенного срока клетки селезенки иммунизованного животного используют для получения моноклональных антител в соответствии с классической гибридомной технологией. Для этого клетки селезенки «сплавляют» с клетками миеломы в растворе полиэтиленгликоля. Сформированные таким образом гибридомы продуцируют моноклональные антитела, отвечающие различным фрагментам молекулы антигена. Из всей массы полученных моноклональных антител отбирают те, которые генерированы к структурным фрагментам гаптена и способны образовывать с ним комплекс (благодаря комплементарности их структур). Это достигается исследованием образовавшихся антител методом иммуноферментного анализа (enzyme linked immunosorbent assay - ELISA). В качестве реагента используют гаптен, иммобилизованный на BSA. Образование комплекса гаптена с антителом свидетельствует о комплементарности структуры активного центра антитела со структурой гаптена (и, следовательно, со структурой переходного состояния субстрата, которое моделировал данный гаптен). Можно ожидать, что такие антитела будут обладать каталитическими свойствами. Это проверяется далее прямыми экспериментами по способности отобранного антитела катализировать исследуемую реакцию.
Для получения каталитического антитела в количестве, необходимом для дальнейшего исследования, соответствующую гибридому, отобранную при ELISA-анализе, снова вводят мыши и выделяют целевое КА из асцитной жидкости, в которой оно содержится в высокой концентрации. Полученное КА очищают далее обычными приемами белковой химии (осаждение, хроматография и электрофорез).
Будучи белком, КА полностью теряет свою активность при термической обработке (денатурации), а также меняет ее при обработке типичными модификаторами белка (иодацетамидом, диэтилкарбонатом, тетранитрометаном и др.).
Иногда для получения активных КА применяют более сложные специфические процедуры. Так, например, производится последовательная иммунизация мышей двумя антигенами, различающимися структурой гаптена (так называемая «гетерологическая иммунизация»). При этом у КА формируется активный центр, отвечающий особенностям обоих гаптенов, что придает КА нужную специфичность. В других случаях используют антиген, содержащий гаптен, который не только является стабильной моделью переходного состояния, возникающего при превращении субстрата, но и сам вступает во взаимодействие с формирующимся активным центром КА, воссоздавая тем самым динамику превращения молекулы субстрата в процессе каталитической реакции (так называемая «реактивная иммунизация»).
По своим свойствам и поведению КА являются типичными белками, относящимися к классу иммуноглобулинов. Их физико-химические характеристики близки к характеристикам природных ферментов. Так, их поведение в каталитическом процессе подчиняется насыщающей кинетике и следует уравнению Михаэлиса-Ментена. Это свидетельствует о том, что в основе их каталитического действия лежит образование фермент-субстратного комплекса, что было непосредственно подтверждено масс-спектрометрическим исследованием.
Ингибирование действия КА гаптеном или его аналогом свидетельствует о том, что полость активного центра КА действительно комплементарна используемому для его генерации гаптену. Ингибиторный анализ КА широко применяется при исследовании строения активного центра КА и механизма его каталитического действия. Каталитический эффект количественно оценивается соотношением констант скорости катализируемой и некатализируемой (основной) реакций.
Важнейшей характеристикой КА является специфичность, в том числе стереоселективность. Для определения специфичности действия КА используют традиционный подход - изучают реакции структурных аналогов субстрата и определяют скорости их превращения и/или их ингибиторный эффект при катализе.
В нескольких случаях структура КА или его активного центра детально изучалась методом рентгеноструктурного анализа самого КА или его комплекса с субстратом. Такие исследования предпринимались главным образом для выяснения механизма действия КА на молекулярном уровне, для сравнения структуры и механизма действия КА и близкого природного фермента и для решения других вопросов этимологии, где КА использовались в качестве моделей.
4.РИБОЗИМЫ.
До начала 80-х годов ХХ века основополагающей аксиомой биохимии было утверждение, что все метаболитические реакции происходят с надлежащими для обеспечения жизни скоростями только благодаря высокоэффективным специфическим катализаторам белковой природы - ферментам или энзимам.
Однако в 1981-1982 г. группой американских биохимиков во главе с Т.Чехом было обнаружено, что в природе имеются виды РНК, которые, подобно белкам, обладают высокоспецифической каталитической активностью. Их субстратсвязывающий домен присоединяется к комплементарному участку РНК-мишени с помощью водородных и, возможно, других связей, а каталитический расщепляет ее в специфическом сайте. Такие РНК-катализаторы были названы рибозимами. Открытие рибозимов имело огромное теоретическое и практическое значение для биохимии, молекулярной биологии и биотехнологии.
Во-первых, был положен конец представлению об исключительной роли белков в катализе биохимических реакций. В настоящее время установлено, что рибозимы играют важнейшую роль в процессах синтеза и превращения РНК, например в процессах сплайсинга у эукариот и способны осуществлять практически весь спектр ферментативных реакций (рестрикция, сшивка, трансформации и др.). В настоящее время рибосому тоже принято рассматривать как рибозим. Действительно, все имеющиеся экспериментальные данные свидетельствуют о том, что синтез полипептидной цепи белка в рибосоме катализируется рибосомной РНК, а не рибосомными белками. Идентифицирован каталитический участок большой рибосомной РНК, ответственный за катализ реакции транспептидации, посредством которой осуществляется наращивание полипептидной цепи белка в процессе трансляции.
Во-вторых, это позволило существенно пересмотреть взгляды на механизмы возникновения жизни и на ранние этапы эволюции. В частности в последнее время активно обсуждается гипотеза “Мира РНК”, как противовес классической теории академика А.И.Опарина. В частности гипотеза “Мира РНК” позволяет решить проблему, на которую долго закрывали глаза практически все ученые- сторонники теории академика А.И.Опарина, а именно, каким образом случайно получившиеся, единичные, удачные белковые молекулы могли копироваться и воспроизводиться в коацерватной капле, а тем более передаваться коацерватам – потомкам.
Накопление знаний о генетическом коде, нуклеиновых кислотах и биосинтезе белков привело к утверждению принципиально новой идеи о том, что все начиналось вовсе не с белков, а с РНК. Нуклеиновые кислоты являются единственным типом биологических полимеров, макромолекулярная структура которых, благодаря принципу комплементарности при синтезе новых цепей, обеспечивает возможность копирования собственной линейной последова-тельности мономерных звеньев, другими словами, возможность воспроизведения (репликации) полимера, его микроструктуры. Поэтому только нуклеиновые кислоты, но не белки, могут быть генетическим материалом, то есть воспроизводимыми молекулами, повторяющими свою специфическую микро-структуру в поколениях.
По ряду соображений именно РНК, а не ДНК, могла представлять собой первичный генетический материал.
Во-первых, и в химическом синтезе, и в биохимических реакциях рибонуклеотиды предшествуют дезоксирибонуклеотидам; дезоксирибонуклеотиды - продукты модифи-кации рибонуклеотидов.
Во-вторых, в самых древних, универсальных процессах жизненного метаболизма широко представлены именно рибонуклеотиды, а не дезоксирибонуклеотиды, включая основные энергетические носители типа рибонуклеозид-полифосфатов (АТФ и т.п.).
В-третьих, репликация РНК может происходить без какого бы то ни было участия ДНК, а механизм редупликации ДНК даже в современном живом мире требует обязательного участия РНК-затравки в инициации синтеза цепи ДНК.
В-четвертых, обладая всеми теми же матричными и генетическими функциями, что и ДНК, РНК способна также к выполнению ряда функций, присущих белкам, включая катализ химических реакций. Таким образом, имеются все основания рассматривать ДНК как более позднее эволюционное приобретение - как модификацию РНК, специализированную для выполнения функции воспроизведения и хранения уникальных копий генов в составе клеточного генома без непосредственного участия в биосинтезе белков.
После того как были открыты каталитически активные РНК, идея первичности РНК в происхождении жизни получила сильнейший толчок к развитию, и была сформулирована концепция самодостаточного мира РНК, предшествовавшего современной жизни. Возможная схема возникновения “Мира РНК” представлена на рис.2.
Абиогенный синтез рибонуклеотидов и их ковалентное объединение в олигомеры и полимеры типа РНК могли происходить приблизительно в тех же условиях и в той же химической обстановке, что постулировались для образования аминокислот и полипеп-тидов. Недавно российскими учеными (Институт белка РАН) было экспериментально показано, что, по крайней мере, некоторые полирибонуклеотиды (РНК) в обычной водной среде способны к спонтанной рекомбинации, то есть обмену отрезками цепи, путем транс-эстерификации. Обмен коротких отрезков цепи на длинные, должен приводить к удлинению полирибонуклеотидов (РНК), а сама подобная рекомбинация способствовать структурному многообразию этих молекул. Среди них могли возникать и каталитически активные молекулы РНК. Даже крайне редкое появление единичных молекул РНК, которые были способны катализировать полимеризацию рибонуклеотидов или соединение (сплайсинг) олигонуклеотидов на комплементарной цепи как на матрице, означало становление механизма репликации РНК. Репликация самих РНК-катализаторов (рибозимов) должна была повлечь за собой возникновение самореплицирующихся популяций РНК. Продуцируя свои копии, РНК размножались. Неизбежные ошибки в копировании (мутации) и рекомбинации в самореплицирующихся популяциях РНК создавали все большее разнообразие этого мира. Таким образом, предполагаемый древний мир РНК - это самодостаточный биологический мир, в котором молекулы РНК функционировали и как генетический материал, и как энзимоподобные катализаторы.
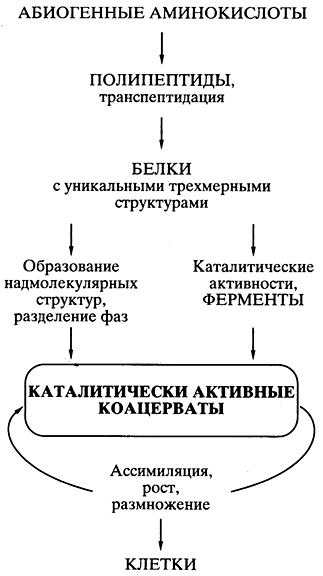
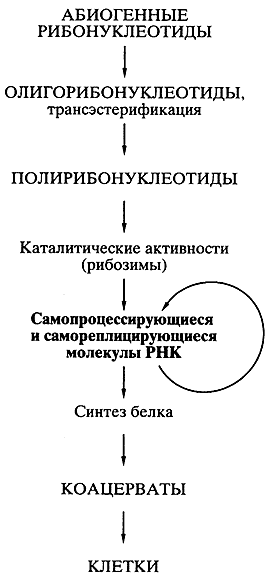
Рис. 2 гипотеза А.И.Опарина гипотеза ”Мир РНК”
В настоящее время в природе известно только восемь рибозимов, обладающих достаточно низкой каталитической активностью по сравнению с белковыми катализаторами. Возможно раньше, рибозимов было гораздо больше, и они обеспечивали все многообразие необходимых для биосинтеза реакций, а затем они исчезли в процессе эволюционного отбора наиболее эффективных способов хранения и обработки наследственной информации. Что касается низкой эффективности катализа рибозимами, то у эволюции, было, достаточно времени и ее начальные стадии могли проходить очень медленно.
В настоящее время в лабораториях разных стран проводятся работы по искусственному синтезу различных рибозимов. Наибольших успехов достигла группа во главе с Д.Бартелом. Используя разработанную ими селекс-технологию (метод эволюции искусственного мира РНК в пробирке) они синтезировали 65 новых рибозимов и сумели повысить их активность в десятки и сотни раз.
В третьих, рибозимы могут использоваться как высокоэффективные лекарственные препараты направленного действия для генной терапии. В большинстве методов генной терапии ех vivo и in vivo используются клонированные генетические конструкции, возмещающие функциональную форму белка, который не синтезируется в организме больного или синтезируется в дефектной форме. Однако многие заболевания человека (рак, воспаления, вирусные и паразитарные инфекции) связаны, напротив, с гиперпродукцией нормального белка. Для лечения таких состояний разработаны терапевтические
системы с использованием олигонуклеотидов. Небольшой олигонуклеотид может либо гибридизоваться со специфическим геном или мРНК и снижать уровень транскрипции или трансляции, уменьшая тем самым количество синтезируемого белка, ответственного за патологию (“антигенные” или “антисмысловые” нуклеотиды) либо разрушать их (дезоксирибозим или рибозим).
Создание «терапевтического» рибозима - сложный процесс. Связано это с трудностью получения больших количеств синтетических РНК и сохранения их в нативном состоянии в клетке-мишени. Модифицируя субстрат - связывающую последовательность нуклеотидов с помощью методов генной инженерии, получают рибозимы, расщепляющие специфические мРНК и подавляющие трансляцию белка, ответственного за развитие того или иного заболевания. Рибозимы, созданные методами генной инженерии, можно использовать для лечения рака и вирусных инфекций.
Природных ДНК-ферментов (дезоксирибозимов) пока не обнаружено, но уже синтезированы олигодезоксинуклеотиды, обладающие каталитической активностью. Преимущество дезоксирибозимов состоит в том, что для их получения не нужно использовать экспрессирующий вектор: ДНК-ферменты можно просто упаковать в липосомы и доставить в клетку-мишень. Однако создание эффективных ДНК-ферментов находится пока на начальном этапе развития.
5.ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ, ЕЕ ЗАДАЧИ
Инженерная энзимология — это отрасль биотехнологии, базирующаяся на использовании каталитических функций ферментов (или ферментных систем) в изолированном состоянии или в составе живых клеток для получения соответствующих целевых продуктов. Биообъект здесь - фермент (или комплекс ферментов).
Развитие прикладной энзимологии долгое время сдерживалось дороговизной чистых ферментных препаратов, неустойчивостью их при хранении и невозможностью многократного использования. Принципиально новые перспективы открылись перед прикладной энзимологией в 60-е годы XX в. в результате появления на стыке химии и биологии новой отрасли - инженерной энзимологии. Ее задачи заключаются в развитии прогрессивных методов выделения ферментов, их стабилизации и иммобилизации; конструировании катализаторов с нужными свойствами и разработке научных основ их применения.
На практике обычно используют иммобилизованные ферменты (реже - иммобилизованные клетки), благодаря чему стабилизируется и пролонгируется их ферментативная активность. Иногда инженерную энзимологию отождествляют с биотехнологией. В этом содержится большая доля истины, так как все реакции в клетках катализируются ферментами. Однако слово "инженерная" привносит свою специфику, заключающуюся в акценте на создание конструкции (от франц. engin - машина), в данном случае - на конструирование биокатализаторов с заданными свойствами с последующим использованием в биотехнологическом процессе.
В частности, методами белковой инженерии, сущность которых состоит в изменении первичной структуры природной молекулы фермента посредством химической модификации самого энзима или его гена, удается принципиально трансформировать структуру активного центра и его функцию, модулировать субстратную специфичность и физико-химические свойства фермента. Так, замена остатка глутамина-102 в молекуле лактатдегидрогеназы на аргинин превратила фермент в высокоактивную малатдегидрогеназу. Описанным способом получены термостабильные формы лизоцима Т-4 и субтилизина (каталитическая константа субтилизина изменена в 100 раз), созданы гибридные формы ферментной системы, ценной в иммуноферментном анализе, сочетающие в себе свойства β-галактозидазы и β -галактокиназы.
Многие проблемы технологии синтеза органических соединений, пищевой и медицинской промышленности, мониторинга человека и окружающей среды, защиты окружающей среды, энергетики не могут быть решены без использования методов современной инженерной энзимологии.
Важным этапом развития инженерной энзимологии стала разработка способов получения и использования иммобилизованных ферментов.
