Практическое пособие Москва 1998 Оглавление Оглавление 3 устройство современных аппаратов искусственного кровообращения 4 регуляция свертывающей системы крови во время искусственного кровообращения 22
| Вид материала | Документы |
- Автоматическая детекция эмболии при операциях на сердце в условиях искусственного кровообращения, 168.16kb.
- Прогностическое значение маркеров воспаления у больных ибс, оперированных в условиях, 339.25kb.
- Медицинские показания и противопоказания для направления на санаторно-курортное лечение., 70.77kb.
- Патофизиология регионарного кровообращения и микроциркуляции, 124.19kb.
- Тематический план практических занятий на 3-й кафедре внутренних болезней для субординаторов, 35.73kb.
- Башкирский государственный медицинский университет гизатуллин а. Г. Краткая патофизиология, 1816.16kb.
- Задачи искусственного интеллекта 6 Тест по теме «История развития искусственного интеллекта», 1504.97kb.
- В. К. Финн к структурной когнитологии: феноменология сознания с точки зрения искусственного, 366.95kb.
- Реферат по физкультуре Тема: Влияние физических упражнений на кровь и органы кровообращения, 159.42kb.
- Системы искусственного интеллекта и нейронные сети, 208.41kb.
14.ВСПОМОГАТЕЛЬНОЕ КРОВООБРАЩЕНИЕ
История перфузионных методов вспомогательного кровообращения (ВК) тесно связана с развитием искусственного кровообращения, которое на сегодняшний день можно интерпретировать как механическое пособие, временно заменяющее функцию сердца и легких при выполнении кардиохирургического вмешательства в условиях «открытого» сердца. Если искусственное кровообращение условно можно отнести к методам анестезиологического плана (таким, как наркоз или релаксация, позволяющие хирургу выполнить операцию), то вспомогательное кровообращение вообще, - а в частности его перфузионные методы, -является реаниматологическим пособием, обеспечивающим совместно с сердцем минутный объем кровообращения, достаточный для питания тканей в условиях сердечной недостаточности (ОСН).
В зависимости от способа разгрузки сердца все виды ВК делятся на три группы:
- методы, основанные на снижении противодавления сердечному выбросу (методы контрапульсации);
- методы, основанные на уменьшении перекачиваемого сердцем объема крови (методы шунтирования);
- методы прямой помощи желудочкам (массаж сердца).
Помимо уменьшения потребности миокарда в кислороде, почти все они одновременно увеличивают его доставку в результате увеличения коронарного кровотока.
Методы шунтирования обладают большими возможностями разгрузки сердца, вплоть до полной замены функции одного или двух желудочков. Все они относятся к перфузионным методам и поэтому доступны учреждениям, использующим метод общего искусственного кровообращения.
Главной отличительной чертой методов шунтирования является возможность поддержки адекватного, необходимого по величине, минутного объема кровообращения (МОК) Все, что не в состоянии обеспечить ослабленное сердце, берет на себя аппарат вспомогательного кровообращения. Критериями эффективности шунтирующих методов ВК могут служить показатели общей гемодинамики и газообмена (суммарный МОК, системное артериальное давление, центральное венозное давление, напряжение кислорода в венозной крови, общее потребление кислорода, диурез и др.).
Подключение аппарата вспомогательного кровообращения (АВК) производят как к периферическим, так и к центральным сосудам (при вскрытии грудной клетки). А зависит это от конкретно сложившейся ситуации при возникновении ОСН. Ниже даны схемы подключения исполнительного устройства к пациенту, нуждающемуся в перфузионных методах ВК.
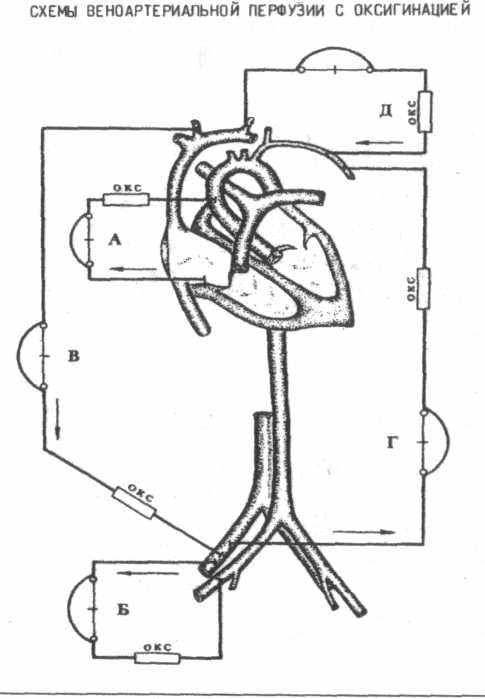
1. Веноартериальная перфузия с оксигенацией
а) правое предсердие - аорта,
б) бедренная вена - бедренная артерия,
в) яремная вена - бедренная артерия,
г) бедренная вена - подмышечная артерия,
д) яремная вена - подмышечная артерия.
2. Веноартериальная перфузия без оксигенации
а) бедренная вена - бедренная артерия,
б
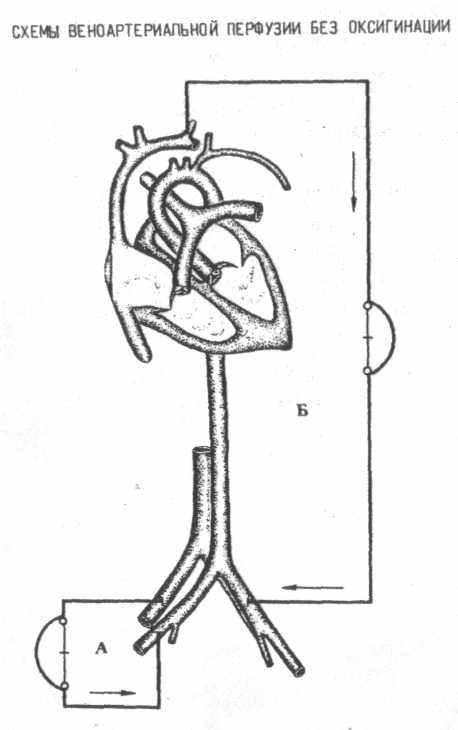 ) яремная вена - бедренная артерия.
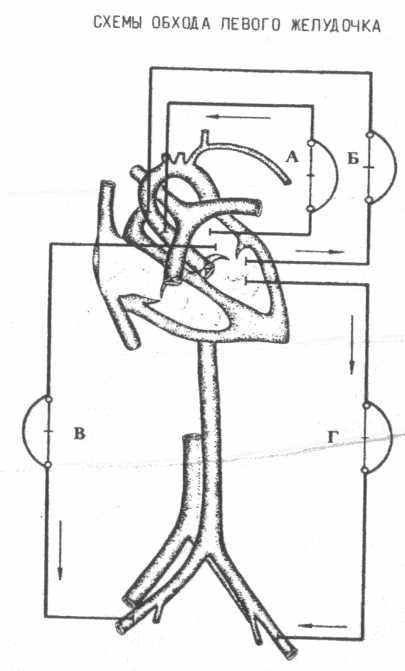
) яремная вена - бедренная артерия.3. Обход левого желудочка
а) левое предсердие - аорта,
б) левый желудочек - аорта,
в) левое предсердие - бедренная артерия,
г) левый желудочек - бедренная артерия.
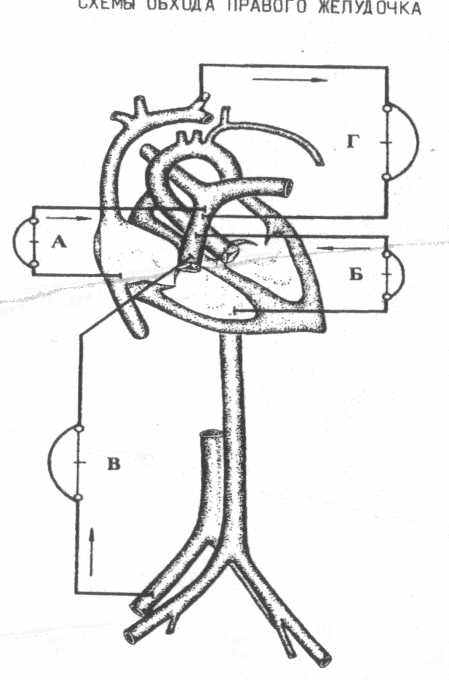
4. Обход правого желудочка
а) правое предсердие - легочная артерия,
б) правый желудочек - легочная артерия,
в) бедренная вена - легочная артерия,
г) яремная вена - легочная артерия.
5.Обход обоих желудочков
а) правое предсердие - легочная артерия, левое
предсердие - аорта,
б) правое предсердие - легочная артерия, левый
желудочек - аорта.
СХЕМЫ ОБХОДА ОБОИХ ЖЈЛУ1ОЧКОВ
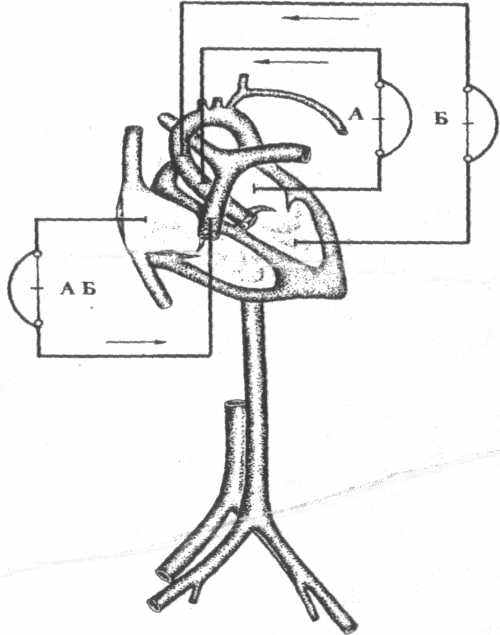
При присоединении к периферическим сосудам обычно канюлируют дистальный и проксимальный концы вены и артерии - с целью полного дренажа и кровообеспечения конечности.
В качестве исполнительных устройств могут быть использованы. 1. роликовый насос как наиболее доступный в кардиохирургических клиниках, 2. центрифужный насос, 3. различные модификации искусственных желудочков. Последние могут располагаться экстра - и интракорпорально (в .грудной или брюшной полости).
Главной особенностью роликовых и центробежных насосов является отсутствие пульсации кровотока, которую обеспечивают различные модификации искусственных желудочков. Справедливорти ради необходимо заметить, что современные роликовые насосы могут работать в пульсирующем режиме, о преимуществах и недостатках которого ведутся дискуссии и по сей день.
Вспомогательное кровообращение может вестись в синхронном и асинхронном с работой сердца пациента режимах. Предпочтительно синхронизировать работу пульсирующего исшэлйи?№чопэ устройства, эффективнее помогая ослабленному сердцу. Но, к сожалению, чаще не удается это сделать из-за развивающихся у пациентов с ОСН тахикардией или аритмией. Правда, когда речь идет о ситуации, при которой шунтируется весь или почти весь МОК, синхронизированная поддержка теряет свой смысл.
Основная задача-минимум перфузионных методов ВК - обеспечить суммарный с сердцем перфузионцый индекс для адекватного метаболизма в организме пациента.
Основная задача-максимум перфузионных методов ВК - способствовать восстановлению утраченной функции жизненно важных органов (сердца, легких, мозга, почек, печени и т.д.), т.е. выздоровлению пациентов, перенесших тяжелую ОСН, рефрактерную к медикаментозной терапии.
Опыт показывает, что выздоровление происходит в тех случаях, когда к моменту начала ВК еще не наступили необратимые изменения в жизненно важных органах человека.
Таким образом, особо важное значение приобретает правильный подход к показаниям для тех или иных видов ВК.
Специалист, имеющий в своем арсенале все вышеперечисленные перфузионные методы ВК и вспомогательного дыхания (ВД), должен правильно ориентироваться в возникшей ситуации, а после оперативной коррекции того или иного порока ввести соответствующую поправку и предложить данному больному оптимальную методику. Надо сказать, что иногда трудно принять верное решение даже при учете отработанных показаний вследствие изменений, привнесенных коррекцией порока. Чаще всего это бывает при врожденных пороках сердца, когда сердечно-сосудистая система адаптировалась к порочному кровообращению, а после радикальной коррекции порока норма приводит к фатальному исходу. Это касается, прежде всего, таких пороков, как тетрада или триада Фалло, когда малый круг недогружен кровотоком, а после коррекции через него должно проходить столько же крови, как и через большой.
Тут действует так называемый второй барьер, когда кровь устремляется по шунтам, не омывая альвеолы и не рксигенируясь. При этом растет общее легочное сопротивление, а правый желудочек испытывает большую постнагрузку, чем до коррекции. В связи с тем, что кровь в левые отделы сердца по коронарным артериям идет недооксигенированной, желудочки работают на «голодном пайке». Результат -относительная правожелудочковая недостаточность, которую, прежде всего, регистрируют в операционной - по сниженному артериальному и повышенному венозному давлению. Легочная й левожелудочковая недостаточность проходит «вторым планом» и часто не диагностируется.
Специалист, занимающийся вспомогательным кровообращением и дыханием, знает, что если имеется изолированная слабость левого желудочка, - показан обход левого желудочка, если имеется изолированная слабость правого желудочка, что встречается значительно реже, нужен обход правого желудочка, если возникает тотальная слабость сердца - необходим обход обоих желудочков (бивентрикулярный обход).
В ситуациях, когда помимо ОСН имеются явления острой дыхательной недостаточности (ОДН) или, как говорят, легочной недостаточности, необходим один из вариантов веноартериальной перфузии с оксигена-цией.
На сегодняшний день в большинстве учреждений вопрос о применении перфузионных методов ВК ставится только тогда, когда использованы все средства медикаментозной терапии, искусственной вентиляции легких и интрааортальная контрапульсация. При этом упущено время и не получен положительный эффект. Правомочность такой установки сомнительна, в связи со скромностью получаемых результатов.
Первопричиной такой ситуации называют позднее начало ВК по поддержанию адекватного МОК уже после наступления необратимых изменений органов и
тканей.
Веноартериальная перфузия с оксигенацией
Веноартериальная перфузия с оксигенацией - это процедура, сущность которой заключается в частичной замене функции сердца и легких. Когда же речь идет о замене функции сердца и легких в связи с их недостаточностью, то данный метод выступает в новой роли вспомогательного кровообращения и дыхания.
Логика веноартериальной перфузии с оксигенацией (ВАПО) при острой сердечной недостаточности, особенно при кардиогенном шоке, заключается в механической возможности удвоить или учетверить доставку оксигенированной крови к тканям и к органам, и разгрузить ослабленное сердце. Уменьшая объем каждой камеры сердца, ВАПО предотвращает чрезмерное напряжение стенки сердца (закон Лапласа), а, следовательно, уменьшает потребление кислорода миокардом.
Вторым положительным фактором ВАПО является возможность уменьшить (а в некоторых случаях и прекратить) введение катехоламинов, а, следовательно, снизить вероятность развития метаболических некрозов в миокарде и снизить летальность от ОСН в ближайшем постперфузионном периоде.
Общим показанием к осуществлению ВАПО является ОСН, не позволяющая прекратить искусственное кровообращение после коррекции порока, согревания больного и обычной медикаментозной терапии с применением небольших доз катехоламинов (допа-мин до 4 мкг/кг мин). Если пользоваться ординарными критериями гемодинамики, то ВАПО следует считать показанной, когда при венозном давлении 10-14 мм рт.ст. среднее артериальное давление не поднимается выше 60 мм рт.ст., а на ЭКГ наблюдаются признаки ишемии миокарда.
При измерении сердечного выброса и давления в левом предсердии крайними проявлениями острой левожелудочковой недостаточности являются: сердечный индекс (СИ) менее 2 л/мин м2 и среднее давление в левом предсердии выше 25 мм рт.ст
При правожелудочковой недостаточности: СИ < 2 л/мин м2, ЦВД выше 15 мм рт.ст.
После установления факта острой сердечной недостаточности не следует использовать весь арсенал медикаментов с целью увеличить инотропизм миокарда, а продолжать искусственное кровообращение во вспомогательном режиме. То есть с помощью аппарата искусственного кровообращения осуществлять разгрузку сердца настолько, чтобы не перегружать его объемом перекачиваемой крови.
Мы исходим из концепции, что сердце должно осуществлять работу в пределах своих возможностей, которые мы определяем по косвенным признакам: отсутствию ишемии миокарда на ЭКГ, среднему артериальному давлению выше 60 мм рт.ст., давлению в левом предсердии ниже 15 мм рт.ст., суммарному перфузионному индексу выше 2 л/мин м2 при гема-токрите около 30%. Так как последний при управляемой гемодиллюции к моменту окончания перфузии редко достигает 30%, то необходимо внести поправку в объемную скорость, получив анализ содержания кислорода в венозной крови. Напряжение кислорода в венозной смешанной крови при нормотермии не должно быть ниже 36 мм рт.ст.
Когда будут достигнуты нормальных показателей перечисленные критерии, станет ясно, сколько крови может перекачивать сердце больного без применения инотропных средств, то есть без стимуляции а- и р-рецепторов. Это позволит оценить возможность сердца выполнять работу самостоятельно. Как правило, на выяснение причин и степени острой сердечной недостаточности уходит до 20-30 минут. За это время, если коррекция порока адекватна, и не нарушены проводящие пути сердца, если не наступили необратимые изменения в миокарде и не развился инфаркт миокарда вследствие неадекватной кардиоплегии или травмы коронарных артерий, если не произошло тромбоэмболии' в сосудистое русло сердца, если ликвидирована гиповолемия, то, как правило, удается справиться с острой сердечной недостаточностью и прекратить вспомогательное кровообращение. В таких случаях за эти 20-30 минут удается «отмыл»» сердце от кардиоплегического раствора и метаболитов или «прогнать» воздух из коронарных сосудов, устранить мозаичность в кровоснабжении всех слоев, миокарда, то есть подготовить сердце к нормальным нагрузкам. Наш опыт показал, что чаще всего этим больным в ближайшем постперфузионном периоде не требуется введение инотропных препаратов.
Если же при попытке прекратить искусственное кровообращение острая сердечная недостаточность выражена настолько, что требуется почти полная замена сердца как насоса и объемная скорость ВК равна или почти равна объемной скорости ИК, то совершенно очевидна более серьезная причина, в которой необходимо тут же разобраться, не затушевывая картину введением больших доз катехоламинов, в частности допамина свыше 10 мкг/кг мин.
В такой ситуации появляется необходимость обсудить прогноз для жизни больного, и определить показания для применения длительных видов вспомогательного кровообращения или же в организме больного произошли необратимые изменения.
Было отмечено, что если после искусственного кровообращения концентрация лактатов превышает 6 ммоль/л, то в 90-100% случаев наступает смерть.
Обход левого желудочка.
Обход левого желудочка (ОЛЖ) - перфузионный метод вспомогательного кровообращения (ВК), заключающийся в шунтировании (перекачивании) части или всего минутного объема сердца из левого предсердия или желудочка в аорту или бедренную артерию с помощью того или иного насоса.
На сегодняшний день наиболее эффективным и чаще других используемым способом механической поддержки ослабленного левого желудочка у кардио-хирургических больных является обход, или шунтирование левого желудочка. Методы шунтирования желудочков обладают большими возможностями разгрузки сердца вплоть до полной замены одного или обоих желудочков.
Основная цель ОЛЖ - работая вместо или одновременно @ левым желудочком сердца; поддерживать в организме объемный суммарный кровоток, достаточный для нормального питания тканей. При этом на долю самого ослабленного левого желудочка должна приходится работа, которую он способен выполнять в оптимальном для данного состояния режиме (без перегрузки)
Показания к ОЛЖ. Обход левого желудочка применяют в случае изолированной его слабости. При сочетанной слабости обоих желудочков необходимо применять обход обоих желудочков.
Общим показанием для ОЛЖ, как для любого пер-фузионного метода ВК, является невозможность отключить больного от АИК во время операции на открытом сердце, т.е. перевести больного на самостоятельное кровообращение: ОЛЖ показан при невозможности уменьшить объемную скорость перфузии АИК ниже 30% от расчетной.
Критериями опасной для жизни депрессии левого желудочка при попытке отключить аппарат искусственного кровообращения являются:
- повышение среднего давления в левом предсердии выше 25 мм рт.ст.,
- сердечный индекс меньше 2 л/мин м2,
- снижение среднего артериального давления меньше 60 мм рт ст.,
- быстрое нарастание медленной активности на ЭЭГ
- появление признаков ишемии миокарда и нарушение ритма на ЭКГ,
- видная на глаз слабость сокращений левого желудочка и его перерастяжение.
- появление признаков ишемии миокарда и нарушение ритма на ЭКГ,
- видная на глаз слабость сокращений левого желудочка и его перерастяжение.
В такой ситуации необходимо тут же начинать ОЛЖ через дренаж левого желудочка, как показано на рисунке, а, следовательно, не удалять дренаж да попытки прекратить искусственное кровообращение и убедиться, что'нет острой сердечной недостаточности.

Во время обхода левого желудочка необходимо попытаться найти причину слабости левого желудочка и устранить ее. Если для этого понадобится искусст-. венное кровообращение, то начать его.
В ситуации, когда ясно, что причина сердечной слабости неустранима или не найдена, и комплексное лечение с применением медикаментозных средств (допамин до 10мкг/кг мин) не дает эффекта, надо переходить на длительный обход левого желудочка как эффективный метод частично или полностью заменить слабый левый желудочек.
Техника ОЛЖ. Подключение насоса к больному можно проводить через тройники. артериальной магистрали АИК и дренаж левого желудочка, с помощью которого осуществляется временный его обход или через специальную одноразовую систему, отдельно приготовленную для этой процедуры. В последние годы для ОЛЖ мы используем систему с центрифужным насосом, которую собирает операционная сестра из одноразовых компонентов (трубки, головка центрифужного насоса, флоу-коннектор, коннектор для измерения перфузионного давления). Затем операционная сестра отдает всю систему пер-фузиологу за исключением приводящей и отводящей петли, и начинает заполнять физиологическим раствором с гепарином (в соотношении 1000:1).
Перфузиолог устанавливает головку в центрифужный насос, накладывает зажим на отводящую магистраль системы и выставляет ноль на флоуметре. После подсоединения камеры давления к датчику давления устанавливается электрический ноль по каналу давления
После удаления пузырьков воздуха из экстракорпоральной системы для ОЛЖ включают центрифужный насос и, не снимая зажима с отводящей петли, доводят количество оборотов в минуту до 1500-1600 в минуту и только затем снимают зажим. В это время на флоуметре появляются цифры производительности насоса. Затем перфузиолог ручкой производительности насоса выставляет, заданную скорость перфузию, равную объемной скорости аппарата для общей перфузии на этапе, предшествовавшем включению насоса. Увеличивая или уменьшая частоту вращения ротора. Одновременно с этим производительность аппарата для общей перфузии также плавно
снижают до 0; Далее производительность насоса регулируют таким образом, чтобы давление в левом предсердии было не выше 15 мм рт.ст., а среднее артериальное давление выше 60 мм рт.ст. Аппарат для общей перфузии не отключают от больного до тех пор, пока не ликвидируют гиповолемию и не произведут тщательный гемостаз
Затем предпринимают частичную нейтрализацию гепарина протаминсульфатом (примерно 1 мг/кг), снижая время активированного свертывания до 110-140 с. На этом уровне ВАС поддерживают, проверяя его каждый час и добавляя гепарин в малых дозах (3-10 ед. кг/час внутривенно). Закрывают грудную клетку так, чтобы магистрали ОЛЖ нигде не перегибались и не пережимались.
При стабильных гемодинамических показателях больного перекладывают на носилки аппарата вспомогательного кровообращения и транспортируют в специальное отделение кардиологической реанимации с непрекращающимся шунтированием крови, во избежание свертывания ее в экстракорпоральной системе.
В отделении реанимации, если это не было сделано в операционной, необходимо ввести в правые отделы сердца до бифуркации легочной артерии катетер Swan-Ganz с целью определения минутного объема кровообращения (МОК) методом термодилюции и давления в легочной артерии.
Проводить ОЛЖ следует таким образом, чтобы суммарный МОК был не менее 2,5 л мин/м2, а среднее давление в левом предсердии не превышало 15 мм рт.ст. При этом необходимо помнить, что- при функциональной полноценности правого желудочка это может быть достигнуто только при достаточном объеме циркулирующей крови в организме, критерием чего может служить ЦВД на уровне 10-12 мм рт.ст.
Поддержание оптимального объема циркулирующей крови (ОЦК) достигают внутривенным введением крови, ее компонентов (эритроциты, плазма) или плазмозамещающих жидкостей, руководствуясь данными измерения гематокрита, состава плазмы, а • также величиной диуреза.
Определение суммарного МОК дает возможность вычислить процент участия в нем левого желудочка (ЛЖ) по формуле:
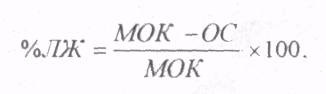
где ОС - объемная скорость насоса.
По мере увеличения % ЛЖ следует медленно уменьшать ОС до 500 мил/мин. ВАС необходимо увеличить до 200-250с. По достижении доли участия ЛЖ, равной 90% и более, при сохранении сердечного индекса на уровне не менее 2,5 л/мин м2 и при удовлетворительных цифрах давления в левом предсердии и в артерии ОЛЖ может быть прекращен.
Главными критериями адекватности ОЛЖ считаются показатели метаболизма (напряжение кислорода в венозной крови, концентрация лактата и ионов плазмы, артериовенозная разница по кислороду).
Деканюляцию левого предсердия, аорты или бедренной артерии производят хирурги оперативным путем (рестернотомия).
Наш экспериментальный и клинический опыт лечения острой сердечной недостаточности подтверждает данные литературы о гемодинамической эффективности шунтирования левого желудочка. Показатели метаболизма свидетельствуют об адекватном ответе организма пациента, находящегося на ОЛЖ. .
Экстракорпоральная мембранная оксигенация (ЭКМО)
Проблема лечения острой дыхательной недостаточности до сих пор остается одной из самых сложных, что заставляет искать новые методы борьбы с этим осложнением. До недавнего времени искусственная вентиляция легких оставалась последним достижением медицины в лечении дыхательной недостаточности, когда весь комплекс терапевтических мероприятий оказывался неэффективным.
Сегодня можно использовать новые достижения исследователей, занимающихся искусственным кровообращением и разработкой новой аппаратуры для вспомогательного кровообращения. Создание мембранного легкого позволило осуществлять газообмен в течение нескольких дней и даже недель, т.е. появилась возможность помочь больным, которым грозит Смерть от острой дыхательной недостаточности. Каждый метод лечения имеет пределы своего воздействия, и судить о его эффективности можно только по приобретении достаточного опыта его применения.
Впервые метод экстракорпоральной мембранной оксигенации был применен у больного с дыхательной недостаточностью J.A. Helmsworth в 1952 году. Однако до создания современных мембранных оксигенаторов он не мог получить широкого распространения. Так же, как и новые методы вспомогательного кровообращения, мембранную оксигенацию применяли у умирающих больных, поэтому успех терапии был незначительным.
Непрерывное совершенствование оксигенаторов заставляет по-новому оценить роль ЭКМО в лечении больных с острой дыхательной недостаточностью. Накапливающийся опыт убеждает в необходимости начинать ЭКМО до развития необратимых процессов в органах и тканях, обязательно учитывая при этом степень эффективности обычных терапевтических мероприятий.
Так как с помощью искусственной вентиляции легких обычно удается корригировать дыхательный ацидоз, применение экстракорпоральной мембранной оксигенации показано, главным образом, при резко выраженной гипоксемии.
Больным с такими видами острой дыхательной недостаточности показана ЭКМО, когда, несмотря на вдыхание смеси, содержащей более 50% кислорода, напряжение кислорода в артериальной крови не поднимается выше 50 мм рт.ст. При гипоксемии такой степени (в условиях нормальной работы сердца) ве-ноартериальное шунтирование составляет более 2 /3 общего объема легочного кровотока. Дальнейшее повышение инспираторной фракции кислорода существенно не влияет на величину напряжения кислорода в артериальной крови, но возрастает риск токсического действия кислорода и дальнейшего поражения легких.
Одним из действенных способов снизить внут-рилегочное шунтирование является применение постоянной искусственной вентиляции легких с положительным давлением в конце выдоха, которая позволяет повысить напряжение кислорода в артериальной крови. В тех случаях, когда, несмотря на большую концентрацию кислорода в дыхательной смеси, гипоксемия сохраняется, нужно, прежде всего, применить положительное давление в конце выдоха. До тех пор, пока напряжение кислорода в артериальной крови (РаОг) не превышает 50 мм рт.ст., величину положительного давления в конце выдоха (ПДКВ) можно поддерживать в пределах 5-20 см вод. ст.
Нарастание гипоксемии, несмотря на применение ИВЛ с ПДКВ 100% кислородом в течение длительного времени, а также клинические признаки ухудшения состояния больного, служат показаниями для экстракорпоральной мембранной оксигенации.
Показания к применению ЭКМО разработали W.M. Zapol и соавторы, которые считают, что если у больного определена прогрессирующая гипоксемия (РаО2 ниже 50 мм рт.ст. при 100% вдыхании кислорода и ПДКВ - 10 см вод. ст.) в течение 6-12 часов, а также уменьшена растяжимость легких до значений менее 15 мл/см вод. ст, увеличена доза кардиотони-ческих препаратов, необходимых для поддержания адекватного сердечного выброса, появились опасные для жизни нарушения ритма сердца и отсутствуют противопоказания к ЭКМО, необходимо осуществлять экстракорпоральный газообмен с применением мембранного оксигенатора.
К противопоказаниям ЭКМО авторы относят: 1) геморрагию, 2) распространенный опухолевый про
цесс, 3) пожилой возраст больного, 4) хроническую или заведомо необратимую легочную недостаточность, 5) резкие неврологические нарушения, б) сепсис, 7) ожоги более 50% поверхности тела. Почечная недостаточность, по их мнению, не является противопоказанием к экстракорпоральной мембранной ок-сигенации.
После массивных травм ЭКМО может быть применена, если прошло 12-24 часа с момента прекращения кровотечения. Увеличенное сопротивление легочных сосудов свидетельствует об интенсивной их облитерации и служит плохим прогностическим признаком
Экстракорпоральная мембранная оксигенация, однако, не является лечением самого патологического процесса, приведшего к острой дыхательной недостаточности. Это лишь симптоматическая терапия, дающая возможность выиграть время, в течение которого газообменная функция легких может быть восстановлена, Главным условием успеха данного лечения является обратимость патологических процессов в легких. К сожалению, мы еще не знаем, какие из них обратимы. Несомненно, однако, что уменьшение действия таких повреждающих факторов, как высокая концентрация кислорода и повышенное давление в дыхательных путях, при экстракорпоральной мембранной оксигенации должно способствовать обратному развитию патологических процессов.
Перфузионные схемы Э)КМО На сегодняшний день существует много схем подключения экстракорпорального контура к периферическим сосудам пациента для лечения острой
дыхательной недостаточности. Мы будем говорить о наиболее употребляемых, а, следовательно о наиболее эффективных схемах экстракорпоральной мембранной оксигенации.
Артериовенозная (АВ) схема, при которой кровь продвигается по экстракорпоральной и венозной системе за счет сердечных сокращений (варианты Б,В) Недостатки ее те же, что и при любом артерио-венозном шунте: снижение периферического кровообращения и перегрузка левого сердца. Дяя компенсации этих нарушений необходима повышенная работа сердца, которую не всегда переносят больные, особенно находящиеся в тяжелом состоянии.
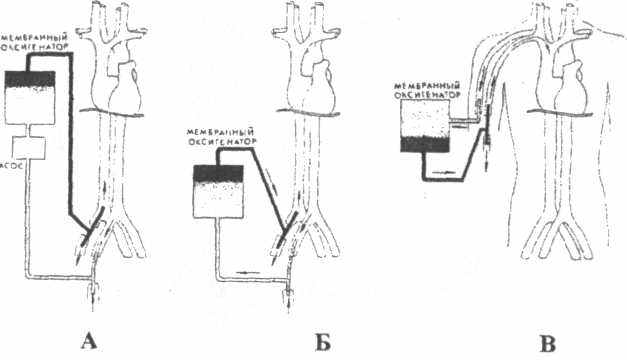
Варианты подключения ЭКМО по артериовенозной схеме
А - артериовенозная схема с насосом (бедренная артерия-бедренная вена)
Б - артериовенозная схема без насоса
(бедренная артерия-бедренная вена)
В - артериовенозная схема без насоса (лучевая артерия - лучевая вена)
У большинства современных оксигенаторов большое перфузионное сопротивление, что требует включения в контур одного или двух насосов (вариант А).
Недостатки артериовенозной схемы ЭКМО:
- требуется увеличенный сердечный выброс,
- чаще всего при наличии легочной гипертензии и правожелудочковой недостаточности;
- во время байпасса в оксигенатор поступает артерилизованная кровь, что снижает его коэффициент полезного действия;
- при увеличении сердечного выброса во время артериовенозного байпасса может снизиться коэффициент вентиляция /кровоток или увеличится сброс справа налево, что, в свою очередь, приведет к снижению насыщения кислородом артериальной крови.
Достоинства артериовенозной схемы ЭКМО:
- простота и безопасность безнасосной перфузии; с хорошими канюлями и простой антикоагуляцией, методика может быть использована в домашних условиях при задержке элиминации углекислоты с помощью простого диализатора;
- минимальная травма крови;
- необходим только один разрез; это важно в плане снижения инфицирования тканей и кровотечения;
- оксигенированная кровь может оказывать терапевтический эффект на пораженные, патологическим процессом легкие;
- хорошая оксигенация в проксимальной аорте, правда, аналогичного эффекта можно достигнуть вено-венозной, веноартериальной дуговой перфузиями или сочетанной вено-венозной и веноартериальной.
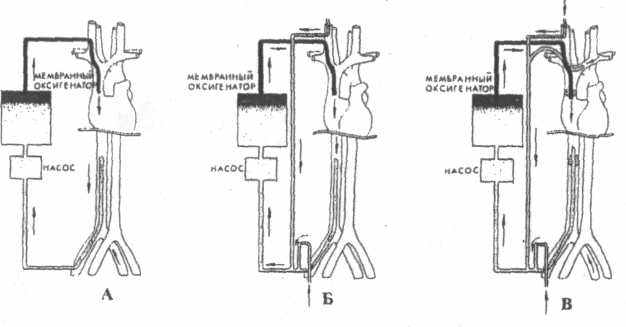
Варианты подключения ЭКМО по веновенозной
схеме
А - дренаж из НПВ, возврат в ВПВ Б - дренаж из НПВ и из внутренней яремной вены (ВЯВ), возврат в ВПВ
В - дренаж из НПВ с обтурирующим баллончиком и ВЯВ, возврат в ВПВ
Следующей по частоте применения является вено-венозная (ВВ) схема ЭКМО. Преимуществами вено-венозной схемы, при которой кровь из нижней точности и большого сердечного выброса. При этом внутрилегочный шунт справа налево, более чем 50% минутного объема сердца приводит к низкой арте-риовенозной разнице по кислороду. В таких случаях неадекватно снабжаются кислородом сердце и мозг.
Наилучшим образом оксигенированная кровь распределяется, если возвратная канюля или катетер находятся в дуге аорты (вариант Б), рядом с аортальным клапаном. При периферическом подключении веноартериальной дуговой схемы экстракорпоральной мембранной оксигенации необходим тонкостенный широкопросветный армированный катетер. При внешнем диаметре порядка 8 мм внутренний диаметр должен быть не менее 7 мм. Через такой катетер длиной до 800 мм можно обеспечить кровоток до 5 л/мин с градиентом перфузионного давления менее 75 мм рт. ст.
Модификацией веноартериальной техники экст-. ракорпоральной оксигенации является «смешанная» веновенозная и веноартериальная (ВВА) перфузия (вариант В). При такой методике улучшается снабжение окснгенированной кровью сердца и головного мозга, а также пораженных легких, путем возвращения части крови в верхнюю полую вену. Но для осуществления данной методики требуется два разреза -на бедре и на шее. Для определения кровотока в каж.-дой системе необходимо включать флуометры в экстракорпоральный контур, что связано с усложнением подготовки и проведения ЭКМО.
Управление свертывающей системой крови во время ЭКМО - это общая проблема для осуществления всех методов экстракорпоральной оксигенации.
Низкие дозы гепарина (0,15-0,45 мг/кг/час) предотвращают образование тромбов в мембранных оксигенаторах, трубках, катетерах, канюлях.
Контроль за кровотечением - один из самых важных аспектов длительной перфузии. Разрезы следует делать чрезвычайно осторожно - с тщательным гемостазом.
Наибольшую популярность приобрел тест время активированного свертывания (Activated Clotting Time - ACT) или в русской аббревиатуре - ВАС. Мы предлагаем во время ЭКМО поддерживать ВАС в пределах 110-140 сек. при норме 85-90 секунд.
Биологические вариации различных пациентов могут быть значительными. Температурный фактор по-разному влияет на метаболическую деструкцию гепарина. При увеличенном диурезе требуется и повышенная доза гепарина. С учетом этих и других моментов рекомендуется определять ВАС не реже одного раза в час.
В течение перфузии показатели ретракции фиб-ринового сгустка, фактора УШ, концентрации фибриногена и протромбинового времени не имеет смысла контролировать чаще, чем один раз в сутки.
Наиболее трудно разрешимой на практике в проблеме тромбоцитопении является денатурация крови вследствие постоянного соприкосновения ее с полимерной поверхностью оксигенатора и механической травмой ее форменных элементов. Очевидно, что инородные активные поверхности адсорбируют и денатурируют белки крови больше, чем естественный эндотелий. Следовательно, один из путей сохранения крови в экстракорпоральной системе заключается в создании псевдоинтимы на поверхностях окси

 генатора и трубок. Второй путь сохранения элементов крови - синтез препаратов, отличных от гепарина, способных «защитить» тромбоциты.
генатора и трубок. Второй путь сохранения элементов крови - синтез препаратов, отличных от гепарина, способных «защитить» тромбоциты.J.J. White и соавт. (1976) сообщили об отличном от гепарина средстве антикоагуляции - об арвине, яде малазийской гадюки, который полностью дефиб-ригенизирует кровь. Под влиянием арвина фибриноген переходит в фибринопептид-А, фибриноген-В остается без изменений, фактор УШ не активизируется. Таким образом, образуется арвин-фибриновый полимер, быстро элиминируемый ретикулоэндотели-альной системой.
Было отмечено, что газообменная функция мембранного легкого при использовании арвина была лучше, чем при применении гепарина, и мало изменялась к концу перфузии.
Арвин циркулирует в крови в течение 12 часов после последней инъекции. По истечении этого времени для нормализации коагуляции следует перелить кровь или плазму.
Арвин в отличие от гепарина, не вызывает кровотечения при длительных перфузиях.
Функция и состояние легких при острой дыхательной недостаточности во время длительной ЭКМО. Этиология острой дыхательной недостаточности - различна, чаще всего это осложнения вирусной или бактериальной пневмонии, жировая эмболия мелких ветвей легочной артерии после травмы крупных трубчатых костей или кардиогенный отек легких, ингаляция химических веществ или травма грудной клетки с повреждением паренхимы легких и т.д. и т.п. В связи с этим и патогенез ОДН - различен.
Но, несмотря на различие этиологических и патогенетических моментов острой дыхательной недостаточности, лечение должно быть направлено на предотвращение изменений в легких, затрудняющих адекватный газообмен. К таким патологическим изменениям относятся: интерстициальный фиброз, ин-тра-альвеолярный фиброз, бронхолитическая облитерация, гиалиноз альвеолярной мембраны. При их развитии нарушается газообмен, и больные умирают. Решающим моментом в определении необходимости мембранной оксигенации является уточнение взаимосвязанных понятий:
1) переносимая гипоксемия и .
2) потенциально обратимые заболевания легких.
Необходимо установить, при какой степени «де-сатурации» кислорода артериальной и венозной крови происходят необратимые изменения в органах и тканях, в частности в легких.
Результаты применения мембранного легкого при лечении острой дыхательной недостаточности свидетельствуют о том, что необратимые изменения в легких существуют независимо от продолжительности экстракорпоральной оксигенации. В случаях необратимых изменений метод экстракорпоральной мембранной оксигенации может быть эффективным средством в поддержании жизненных функций в период подготовки операции по пересадке легкого.
Внутриаортальная баллонная контрапульсация (ВАБК)
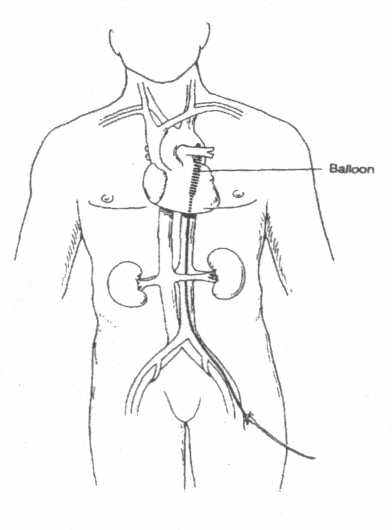
В
 нутриаортальная баллонная контрапульсация -нешунтирующий вид вспомогательного кровообращения, суть которого заключается в повышении диа-столического и снижении пресистолического давления в аорте. При повышении диастолического давления увеличивается коронарный кровоток, а, следовательно улучшается питание ослабленного миокарда, при снижении пресистолического давления в аорте уменьшается преднагрузка на левый желудочек, следовательно увеличивается его выброс. Считается, что эффективность внутриаортальной контрапульса-ции определяется 10% от сердечного выброса, то есть, составляет 500-800 мл/мин, что необходимо учитывать при выработке показаний к этому методу.
нутриаортальная баллонная контрапульсация -нешунтирующий вид вспомогательного кровообращения, суть которого заключается в повышении диа-столического и снижении пресистолического давления в аорте. При повышении диастолического давления увеличивается коронарный кровоток, а, следовательно улучшается питание ослабленного миокарда, при снижении пресистолического давления в аорте уменьшается преднагрузка на левый желудочек, следовательно увеличивается его выброс. Считается, что эффективность внутриаортальной контрапульса-ции определяется 10% от сердечного выброса, то есть, составляет 500-800 мл/мин, что необходимо учитывать при выработке показаний к этому методу. Надо отметить, что данный метод в силу своей простоты и относительной дешевизны нашел самое широкое применение в кардиохирургии и кардиореа-нимации. Он доступен не только хирургам, но и терапевтам, которые используя технику Seldinger'a, вводят баллончик перкутанно, через бедренную артерию Баллончик располагают в нисходящей аорте, тотчас от отхождения левой подключичной артерии. Доказано, что в этой позиции его гемодинамическая эффективность наибольшая. Баллончики бывают однокамерные и двухкамерные. У двухкамерных баллончиков меньшая по объему камера, находясь дисталь-нее от аортального клапана, но проксимальное к началу баллончика, при ее раздувании как бы перекрывает аорту. Причем по времени это происходит раньше, чем раздувается большая камера, которая и увеличивает диастолическое перфузионное давление крови в коронарных сосудах. Понятно, что эффективность работы двухкамерных баллончиков выше за счет уменьшения объема нисходящей аорты, находящегося выше раздутой малой камеры.
После введения баллончика в аорту его подсоединяют к исполнительному устройству пневматического типа (Datascope, Kontron), задача которого состоит в синхронизированном с сердцем нагнетании и вакуумировании инертного газа или углекислоты, которыми заполняется баллончик.
Данные газы используются с целый предотвращения газовой эмболии на случай разрыва баллончика в аорте. При использовании этого метода вспомогательного кровообращения необходим мониторный контроль ЭКГ и артериального давления. С помощью этих показателей вычисляют момент раздувания и спадения баллончика. Зная что интервал S-T на ЭКГ соответствует систоле левого желудочка, очень важно, чтобы спадение баллончика предшествовало выбросу из него крови. По кривой давления легко проверяем момент раздувания баллончика. Волна после дикротики должна быть выше, чем до дикротики, то есть диастолическое давление выше систолического, как показано на рисунке Современные аппараты для ВАБК автоматически
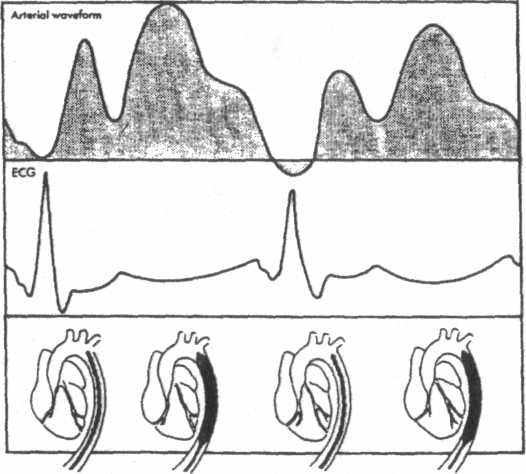
подстраиваются по кривой давления и, или ЭКГ и раздувают баллончик, не создавая конкуренции сердцу.
Показаниями для интрааортальной контрапульса-ции в кардиохирургии являю-гся: а) предоперационная сердечная недостаточность, не позволяющая взять больного на операционный стол, б) послеоперационная сердечная недостаточность во время отключения больного от аппарата искусственного кровообращения и в) сердечная недостаточность в послеоперационном периоде, развившаяся в реанимационном отделении.
Клиническими показателями острой сердечной недостаточности, требующей ннтрааортальной кон-трапульсации являются:
A) сердечный индекс меньше 2,5 л/мин м2,
Б) среднее давление в аорте меньше 80 мм рт.ст.,
B) среднее давление в левом предсердии более 15 мм
рт.ст.,
Г) диурез менее 20 мл/час,
Д) доза допамина выше 5 мкг/кг мин.
Противопоказаниями к интрааортальной контра-пульсации являются более выраженная сердечная недостаточность, требующая более эффективных ( шунтирующих) методов вспомогательного кровообращения, выраженная тахикардия и аритмия, резко-выраженный атеросклеротический процесс в бедренной и подвздошной артерии, препятствующий проведению баллончика в аорту. Правда, с широким внедрением перкутаннои техники введения баллончика на гибком проводнике число неудачных попыток катетеризироватиь аорту резко сократилось.
| Сравнительная характеристика пузы | рьковых оксигенаторов. | ||||||
| Спецификация | Baxter Bentley-10 Plus | Dideco D-700E | Jostra НСА-500 | Bard Н-1700 | Macci OBDII -40 | Biotro nik Braile-Biome dica | Polystan Venothe rm-Plus |
| 11ределы кропотока,( л/мин) | 2-6 | 1-6 | 1-6 | 1.5-6.5 | 1-6 | 1-6 | 1-5 |
| Минимальный уровень крови в оксигенаторе, (мл) | 300 | 300 | 300 | 300 | 400 | 500 | 600 |
| Максимальный объем артер.резервуара, (л) | 3,5 | 4,5 | 3,5 | 3,0 | 3,8 | за | 3,0 |
| Клапан безопасности | - | + | - | - | - | - | + |
| Транспорт кислорода на кровотоке в 4л/мин,(мл/мин) | 220 | 300 | 200 | 200 | 140 | ? | ? |
| Транспорт углекислоты на кровотоке в 4л/мип, (мл/мин) | 180 | 210 | 168 | 200 | 120 | ? | ? |
| Предел давления по водному контуру теплообменника,(ря1) | 75 | 45 | 69 | ? | 40 | 40 | 45 |
| Гнездо дня температурного датчика | +арт*вен | +арг+вен | +api+Be н | +арт+в ен | +арт | -арт-вен | -арт-вен |
| Дополнительный артериальный выход | - | + c клапаном | + | + | + | + | • |
| Коэффициент теплообмена на кровотоке 4 л/мин | 0.50 | 0.53 | 0.63 | 0.55 | 0.58 | | 0.60 |
Из осложнений этого метода вспомогательного кровообращения необходимо отметить следующие, а) перфорация проводником абдоминальной аорты, б) расслоение аорты, в) повреждение сосудов, через которые вводится баллончик, в виде нарушения целостности стенки и кровотечения, г) эмболизация атеро-склеротической бляшкой или тромбом периферической части сосуда с последующей ишемией конечности, д) кровотечение после удаления баллончика, е) развитие аневризмы, ж) сепсис.
Тем не менее, на сегодняшний день метод внутри-аортальной контрапульсации остается наиболее часто применяемым методом вспомогательного кровообращения у больных с левожелудочковой недостаточностью, рефрактерной к медикаментозной терапии.
