Регуляция активности свободных мультиферментных комплексов цикла кальвина у высших растений
| Вид материала | Автореферат |
- Лекция 11 Тема: Высшие растения. Происхождение высших наземных растений. Отдел Моховидные, 276.22kb.
- Культура столонов и регуляция роста растений и клубнеобразования у картофеля in vitro, 342.87kb.
- Эпигенетическая регуляция фотосинтетической ассимиляции со 2 у хлопчатника (03. 00., 544.35kb.
- План по теме «Анатомия и морфология высших растений» Цель курса, 22.96kb.
- №3. "Фотосинтез", 852.51kb.
- Учебно-методический комплекс дисциплины "Физиология растений" вузовского компонента, 1046.86kb.
- Конференция по систематике и морфологии растений, посвященная 300-летию со дня рождения, 28.08kb.
- Синтез, исследование строения и no-донорной активности нитрозильных комплексов железа, 509.45kb.
- Рабочая программа дисциплины «ботаника» Код дисциплины по учебному плану опд., 301.75kb.
- Общая характеристика высших растений, 83.92kb.
На правах рукописи
Мирзорахимов Акобир Каримович
РЕГУЛЯЦИЯ АКТИВНОСТИ СВОБОДНЫХ МУЛЬТИФЕРМЕНТНЫХ КОМПЛЕКСОВ ЦИКЛА КАЛЬВИНА У ВЫСШИХ РАСТЕНИЙ
Специальность: 03.01.04 – биохимия
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
доктора биологических наук
Душанбе – 2012
Работа выполнена на кафедре биохимии и лаборатории ферментологии при кафедре физиологии растений Таджикского национального университета, Лаборатории молекулярной биологии и генной инженерии Института ботаники,. физиологии растений и генетики АН Республики Таджикистан.
Научный консультант: заслуженный работник
Республики Таджикистан
доктор биологических наук, профессор
Бабаджанова Мухаббат Абдурахмановна
Официальные оппоненты: заслуженный работник Высшей школы Российской Федерации, доктор
биологических наук, профессор
Карначук Раиса Александровна
доктор химических наук, профессор
Халиков Ширинбек Халикович
доктор биологических наук, главный
научный сотрудник
Нугмонов Мукбил
Ведущая организация: Таджикский аграрный университет
им. Ш. Шотемура
Защита состоится «______» ____________2012 года в __ __ часов на заседании диссертационного совета Д 737.004.05 по защите докторских диссертаций при Таджикском национальном университете по адресу: 734025, Республика Таджикистан, г. Душанбе, пр. Рудаки, 17.
С диссертацией можно ознакомиться в библиотеке Таджикского национального университета
Автореферат разослан «______» _______________ 2012 года.
Размещён на сайте ВАК www.ed.gov.ru
Учёный секретарь
диссертационного совета,
кандидат биологических наук,
доцент З.М.Хамрабаева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Эффективность функционирования фотосинтетического аппарата оказывает существенное влияние на рост, развитие и продуктивность растений. Ведущая роль фотосинтеза в продукционном процессе доказана работами многих исследователей (Ничипорович, 1956; 1967; 1982; 1988; Насыров, 1975; 1982; 1982а; 1986; Мокроносов, 1981; 1983; 1988; 1992; Тарчевский, 1977).
В процессе фотосинтеза синтезируются первичная энергия (АТФ, НАДФ . Н) и первичные органические вещества, используемые для роста, развития и плодоношения растений. Какие по химической природе вещества, в каком количестве, на каком этапе онтогенеза и в какие органы они будут поступать, зависит продуктивность растений и качество урожая. Каждый из этих этапов подвержен действию имеющихся в живом организме различных типов регуляторных механизмов. Координация всех метаболических процессов и способность организма выполнять свои разнообразные функции осуществляется через регуляцию активности ферментов в клетке. Поэтому выявление регуляторных механизмов, действующих на уровне сложной кооперативной взаимосвязи между ферментной системой фотосинтеза и эпигенетическими процессами является актуальным.
П.Д. Усмановым (1984) была установлена широкая генотипическая изменчивость признаков фотосинтетического аппарата высших растений.
В 1972-1990 – тые годы М.М. Якубовой с сотрудниками и М.А.Бабаджановой с сотрудниками были проведены комплексные исследования структурно-функциональных особенностей фотосинтетического аппарата у мутантных форм растений с низкой и высокой интенсивностью фотосинтеза и продуктивностью. Проведённые исследования показали, что фотосинтетический аппарат мутантов отличающихся по продуктивности характеризуется рядом физиолого–биохимических особенностей влияющих на его функциональную активность (Якубова и др. 1980; Якубова, Юлдашев, 1983; 1984; 1986; 1989; Бабаджанова, 1990; Бакаева, 1996) .
Любое изменение в организме, в конечном счёте, связано с изменениями, происходящими на молекулярном уровне. По современным представлениям, одним из ведущих регуляторных механизмов метаболизма на молекулярном уровне является образование разнообразных надмолекулярных комплексов ферментов. Такие комплексы обнаружены при протекании гликолиза, цикл Кребса, окисления жирных кислот, биосинтеза белков и нуклеиновых кислот. (Наградова и др., 1984; Фридрих, 1986; Курганов, 1978; 1984; 1986; 1986а;1992; Курганов и др., 1986; 1989;1991; Капрельянц, 1988; Каган, 1989; Наградова, 1990; Наградова, Муромец, 1985;1991; Ермаков, 1993).
Ответ на вопрос, способны ли ключевые ферменты фотосинтеза образовывать мультиферментные комплексы, имеет принципиальное значение, так как механизмы регуляции активности ферментов в свободном состоянии и ферментов, встроенных в мультиферментный комплекс различаются.
С 1980-ых годов Бабаджановой М.А. с сотрудниками ведутся комплексные исследования молекулярно-кинетических свойств ключевых ферментов темновой фазы фотосинтеза–рибозофосфатизомеразы (РФИ, КФ 5.3.1.6), фосфорибулокиназы (ФРК, КФ 2.7.1.19) и рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы (РБФК/О, КФ 4.1.1.39) из листьев арабидопсиса и хлопчатника. Была установлена кинетическая комплементарность этих ферментов и координированная регуляция активности одними и теми же эффекторами, что указывало на объединение их в функциональный кластер (Бабаджанова, 1981; 1981а; 1990; 1990а; Бабаджанова и др., 1985; Бабаджанова, Бакаева, Бабаджанова, 1998; Бабаджанова, Бакаева, Алиев, 1989; 1990). Объединение этих ферментов в структурно-функциональный кластер было доказано выделением из листьев хлопчатника электрофоретически гомогенного ферментного препарата с молекулярной массой 520 кД, у которого были определены рибозофосфатизомеразная, фосфорибулокиназная и РБФ-карбоксилазная активности (Бабаджанова, 1990а; Мирзорахимов и др., 1993; 1994).
Затем из листьев хлопчатника, гороха, пшеницы и арабидопсиса при использовании разных методов очистки были выделены мультиферментные комплексы цикла Кальвина с различными величинами молекулярных масс: 180, 240, 400, 480 и 520 кД. У этих отдельно выделенных специфическим для каждого мультиферментного комплекса методом были изучены кинетические параметры ферментов РФИ, ФРК и РБФК/О (Бакаева и др., 1993; 1993а; 1993б; 1994; Мирзорахимов и др., 1993;1994).
Из листьев хлопчатника были одновременно выделены свободный и менбраносвязанный мультиферментные комплексы и проведено сравнительное изучение их каталитических свойств и кинетических параметров (Бабаджанова М.П., Алиев К.А. и др., 1999; 2001; 2001а;2002;2003;2003а).
К настоящему времени установлено, что ферменты цикла Кальвина могут образовывать мультиферментные комплексы с различным числом ферментов - от двух до восьми, различающиеся по молекулярной массе – от 200 до 1000 кД и функциональным свойствам (обзоры: Романова, Павловец, 1997; Бабаджанова М.П. 2003; Gontero, 2002).
Однако, оставались невыясненными причины образования мультиферментных комплексов с такими различными величинами молекулярных масс и функциональной активности и какую роль они играют при фотосинтетической ассимиляции СО2 в различных условиях роста и развития растений.
На основании анализа, литературных данных и результатов собственных многолетних исследований нами сделано предположение, что образование разных по молекулярной массе и функциональным свойствам мультиферментных комплексов может быть связано с различным морфофизиологическим состоянием растений, их возрастом, с условиями их выращивания, влиянием факторов внешней среды.
Всё выше изложенное даёт основание считать, что исследование молекулярно–функциональных свойств мультиферментных комплексов цикла Кальвина, выделенных в различные фазы развития растений и влияния на их ферментативную активность разнообразных факторов окружающей среды является весьма актуальным.
Отсутствие комплексных сравнительных исследований структурно-функциональных особенностей мультиферментных комплексов цикла Кальвина у мутантов, отличающихся по интенсивности фотосинтеза и продуктивности от исходных форм растений, делают эту работу ещё более актуальной.
Целью настоящей работы являлось: сравнительное исследование возрастных изменений спектра (набора) и функциональной активности мультиферментных комплексов цикла Кальвина в листьях хлопчатника, выявление регуляторных механизмов фотосинтетической ассимиляции СО2 на основе анализа структурно-функциональных свойств мультиферментных комплексов у различающихся по интенсивности фотосинтеза и продуктивности исходных и мутантных форм растений, а так же изучение механизмов адаптации активности мультиферментных комплексов к изменяющимся факторам внешней среды.
Для достижения поставленной цели необходимо было решить следующие экспериментальные задачи:
- подобрать для листьев хлопчатника и арабидопсиса такие условия выделения электрофоретически – гомогенных препаратов свободных мультиферментных комплексов, которые не вызывали бы денатурацию белков;
- выделить из листьев растений хлопчатника различного возраста свободные мультиферментные комплексы цикла Кальвина и определить у них величины молекулярных масс и активности трёх ферментов рибозофосфатизомеразы (КФ 5.3.1.6), фосфорибулокиназы (КФ 2.7.1.19) и рибулозобисфосфаткарбоксилаза/оксигеназы (КФ 4.1.1.39);
- выделить из листьев трёх генотипов хлопчатника (сорт 108-Ф, мутант Дуплекс, линия Л-461,) и трёх генотипов арабидопсиса (раса Энкхайм, мутанты – триплекс, 58/15), различающихся по интенсивности фотосинтеза и продуктивности, мультиферментные комплексы, сравнить их содержание и величины ферментативных активностей;
- изучить влияние условий выращивания растений хлопчатника и гороха на спектр (набор) и ферментативные активности свободных мультиферментных комплексов.
Научная новизна. Из листьев растений хлопчатника различного возраста с помощью методики щадящего выделения получены электрофоретически гомогенные препараты свободных мультиферментных комплексов цикла Кальвина. Впервые установлены возрастные изменения спектра (набора) и ферментативных активностей мультиферментных комплексов цикла Кальвина: в фазе 5-6 настоящих листьев обнаружен один мультиферментный комплекс с молекулярной массой 520 20 кД, а начиная с фазы бутонизации два - с молекулярными массами 520 20 кД и 480 15 кД.
Установлено, что независимо от величины молекулярной массы мультиферментных комплексов наибольшая рибозофосфатизомеразная, фосфорибулокиназная и рибулозо-1.5-бисфосфаткарбоксилазная активность этих комплексов, как и интенсивность фотосинтеза, проявлялась в фазах бутонизации и цветения растений, то есть в репродуктивную фазу. Такая закономерность свидетельствует о том, что необходимое при формировании репродуктивных органов увеличение количества ассимилятов связано с возрастанием функциональной активности мультиферментных комплексов цикла Кальвина.
Обнаружено, что на всех фазах развития растений величины фосфорибулокиназной и рибулозо-1.5-бисфосфаткарбоксилазной активности мультиферментных комплексов в присутствии собственных специфических субстратов были ниже, чем при использовании рибозо-5-фосфата – субстрата первого фермента метаболической последовательности, состоящий из пяти ферментов – рибозофосфатизомеразы (КФ 5.3.1.6), фосфорибулокиназы (КФ 2.7.1.19), рибулозобисфосфаткарбоксилаза/ оксигеназы (КФ 4.1.1.39), фосфоглицераткиназы (КФ 2.7.2.3.) и глицеральдегидфосфатдегидрогеназы (КФ 1.2.1.13).
Полученные данные являются весьма существенным доказательством преимуществ работы комплекса ферментов в сравнении со свободными формами ферментов. Более высокая каталитическая эффективность работы ферментов в комплексе свидетельствует о проявлении таких механизмов регуляции активности ферментов в мультиферментном комплексе как – «направленный или туннельный перенос метаболитов», координированная и диссоциативная регуляция. Снижение РБФ-карбоксилазной активности по мере уменьшения величины молекулярной массы мультиферментных комплексов указывает на функциональную значимость диссоциативного механизма регуляции карбоксилазной активности РБФК/О, встроенной в мультиферментные комплексы с различной молекулярной массой.
Результаты проведенных исследований контрастных по интенсивности фотосинтеза и продуктивности трёх генотипов хлопчатника и трёх генотипов арабидопсиса дают основание считать, что повышение эффективности фотосинтеза у продуктивных мутантов хлопчатника, и арабидопсиса наряду с другими факторами обусловлено действием двух основных биохимических механизмов регуляции метаболизма: увеличением количественного содержания мультиферментных комплексов и возрастанием каталитической активности входящих в их состав ферментов, причём эти различия сохранялись при значительном изменении факторов внешней среды (понижение температуры и освещённости). Следовательно, содержание и функциональная активность мультиферментных комплексов являются важнейшими механизмами регуляции фотосинтеза и эпигенеза.
Впервые изучено влияние изменений факторов внешней среды – температуры и освещённости на количественное содержание и ферментативную активность мультиферментных комплексов с различными величинами молекулярных масс, выделенных из листьев хлопчатника и гороха взятого в качестве классического объекта биохимических исследований.
Установлено, что при пониженных температурах и освещённости независимо от генотипа растения образуется новый тип мультиферментного комплекса с молекулярной массой 400кД. Полученные результаты дают основание считать, что образование новой разновидности мультиферментного комплекса, является проявлением третьего биохимического механизма регуляции активности ферментов при адаптации растений к изменяющимся условиям окружающей среды.
Практическая ценность. Результаты полученных экспериментальных исследований имеют значение для понимания и дальнейшего изучения механизмов регуляции физиолого-биохимических процессов в течение жизни растения и его адаптации к постоянно меняющимся внешним факторам, при решении ряда теоретических и прикладных задач физиологии и биохимии продукционного процесса растений, при разработке тестов в биотехнологической и селекционной работе для оценки продуктивности и устойчивости сельскохозяйственных растений, теоретических и прикладных аспектов энзимологии фотосинтеза, а так же для развития теории ферментативного катализа.
Полученные данные можно рекомендовать для чтения лекций по общим курсам биохимии, физиологи растений, спецкурсов по фотосинтезу, энзимологии и экологии на биологических факультетах ВУЗ-ов, а разработанные методы – использовать при проведении различных лабораторных практикумов, выполнении дипломных и диссертационных работ.
Положения, выносимые на защиту:
- ведущими биохимическими механизмами регуляции фотосинтетической ассимиляции углекислоты в онтогенезе растений являются изменения спектра (набора) мультиферментных комплексов цикла Кальвина, их количественного содержания и функциональной активности ферментов, встроенных в эти комплексы;
- более высокая каталитическая эффективность ферментов цикла Кальвина встроенных в мультиферментные комплексы в сравнении со свободными формами этих ферментов обусловлена проявлением действия важнейших механизмов регуляции активности ферментов в мультиферментных комплексах – «направленный» перенос метаболитов («интермедиатов») координированная и диссоциативная регуляция;
- характерными физиолого-биохимическими особенностями продуктивных мутантов хлопчатника и арабидопсиса в сравнении с исходными формами растений являются увеличение количественного содержания водорастворимых белков, содержания мультиферментных комплексов и их функциональной активности. Следовательно, возрастание фотосинтетической активности у исследуемых мутантов обусловлено на ряду с другими факторами состоянием ферментной системы цикла Кальвина.
- Адаптация фотосинтетического аппарата к пониженным температурам и освещённости осуществляется благодаря действию находящихся под генетическим контролем трёх биохимических механизмов регуляции метаболизма:
- увеличение количественного содержания уже имеющихся типов мультиферментных комплексов с молекулярной массой 520 и 480 кД.
- возрастание каталитической активности этих мультиферментных комплексов
- появление нового типа мультиферментного комплекса с молекулярной массой 400 кД.
Устойчивость мультиферментных комплексов цикла Кальвина в неблагоприятных условиях роста может быть использована в числе других признаков используемых в селекции при выделении высокопродуктиных сортов.
Апробация работы. Материалы диссертации были доложены на ежегодных апрельских конференциях профессорско-преподавательского состава Таджикского национального университета (Душанбе, 1986; 1987; 1989; 1990; 1991; 1993; 1994; 2007; 2009, 2010; 2011), II-ом Всесоюзном съезде физиологов растений (Минск, 1990), международной конференции «Итоги и перспективы энзимологических исследований метаболизма углерода при фотосинтезе» (16-20 сентября, 1991г., г. Душанбе), V-ой Конференции биохимиков республик Средней Азии и Казахстана (Ташкент, 1991), I-ой Конференции биохимиков Таджикистана (Душанбе, 1993), II-ой Конференции биохимического общества республики Таджикистан «Проблемы биохимии» (Душанбе, 1996), международной научной конференции «Достижения современной физиологии растений: теоретические и прикладные аспекты», посвященной памяти академика АН Республики Таджикистан Ю.С.Насырова (Душанбе, 2008), международной конференции «Состояние и перспективы развития биохимии в Таджикистане» (Душанбе, 2009).
Структура и объем работы. Диссертация изложена на … страницах и состоит из введения, 6 глав (обзор литературы; экспериментальная часть – объекты и методы исследований; четырёх глав – результаты исследований), заключения, выводов и списка цитированной литературы, включающего в себя 281 источника, из них 79 иностранных авторов. Работа содержит 28 таблиц, 32 рисунка.
Публикации. По материалам диссертации опубликовано 31 работ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ГЛАВА 2.МАТЕРИАЛЫ И МЕТОДЫ
2.1. Объекты исследований
Источником получения ферментных препаратов служили листья сельскохозяйственной культуры - средневолокнистого хлопчатника (Gossypiym hirsutum L., семейство Malvaceae) сорта 108-Ф, его мутанта Дуплекс и инбредной линии Л-461, модельного объекта - арабидопсиса (Arabidopsis thaliana (L.) Heynh), семейство Cruciferae расы Энкхайм, его мутантов – триплекс, 58/15, а также гороха (Pisum sativum L., семейство Leguminosae), сорта Крепыш как классического объекта биохимических исследований.
Исследованиями Якубовой М.М. и сотр. (Якубова и др., 1980; 1984; Кононенко, 1983; Юлдашев, 1985; Хамрабаева, 1992) установлено, что листья исходных и мутантных форм хлопчатника и арабидопсиса различались по структурно-функциональным особенностям фотосинтетического аппарата, эффективности протекания первичных световых реакций, скорости синтеза транспортного продукта – сахорозы и т.д., а также интенсивности фотосинтеза и продуктивности.
Хлопчатник сорта 108-Ф,. мутант Дуплекс и инбредная линия Л-461 выращивались в полевых условиях на экспериментальном участке Института ботаники, физиологии растений и генетики АН Республики Таджикистан (Гиссарская долина, г. Душанбе, 830 м над ур. моря).
Исходная раса арабидопсиса Энкхайм и мутанты триплекс, 58/15 выращивались в ящиках в оранжерее при оптимальных условиях - температура 20-25ºС, почва (перегной, песок, 1:2), относительная влажность 70-80%, освещённость 20-25 тыс. люкс. (Иванов, 1974).
Определение содержания белка. Количественное содержание белка определяли по методу Лоури и др. (Lowry et al, 1951) или с реактивом Бенедикта (Кочетов, 1980). Измерения велись при длине волны 330 нм на высокочувствительном спектрофотометре ULTROSPEC II (LKB, Швеция) с полной шкалой от 0 до 0,001 экстинции.
Определение ферментативных активностей мультиферментных комплексов. Рибозофосфатизомеразную активность определяли по модифицированному методу Аксельрода и Янг (Axelrod, Jang, 1954). Определение продукта реакции - кетосахара рибулозо-5-фосфата проводили карбазольным методом по реакции Дише (Dische, Borenfreund, 1951).
Фосфорибулокиназную активность определяли по методу Гурвитца и др. (Hurwitz et al., 1956). Количество щелочегидролизуемого фосфора определяли по методу Фиске-Суббароу (Лоури-Лопас) в модификации Скулачева (Кочетов, 1980).
Активность РБФК/О определяли радиометрически или спектрофотометрическим по методике Рэккера, модифицированной А.К.Романовой (1980).
Получение электроферетически гомогенных ферментных препаратов. При получении ферментных препаратов из листьев хлопчатника в соответствии со специфическими особенностями объектов использовали общепринятые приёмы очистки, модифицировав методику получения и очистки экстракта.
Определение гомогенности и молекулярной массы ферментных препаратов. Аналитический диск-элекрофорез в 7.5% полиакриламидном геле использовали для определения гомогенности ферментных препаратов и их молекулярной массы. Молекулярную массу определяли по калибровочному графику, построенному по относительной электрофоретической подвижности белков-метчиков.
Полученные результаты обработаны статистически (Урбах, 1964; Методы биохимического анализа,1978; Лакин,1973).
Представленные данные достоверны при доверительной вероятности 97-99%.
ГЛАВА 3. ВЛИЯНИЕ УСЛОВИЙ ВЫДЕЛЕНИЯ НА РАЗДЕЛЕНИЕ СВОБОДНЫХ МУЛЬТИФЕРМЕНТНЫХ КОМПЛЕКСОВ ЦИКЛА КАЛЬВИНА И ИХ ФЕРМЕНТАТИВНЫЕ АКТИВНОСТИ ИЗ ЛИСТЬЕВ ХЛОПЧАТНИКА СОРТА 108-Ф.
Хлопчатник является для энзимологических исследований очень трудным, специфическим объектом из-за содержания в его листьях большого количества фенольных соединений. В связи с этим нами была модифицирована методика получения и очистки экстракта, а так же изучено влияние на выделение мультиферментных комплексов различных величин рН в течение всех процедур очистки и ионообменной хроматографии на ДЭАЭ-целюлозе при ступенчатом и линейном градиентах концентраций NaCl.
3.1. Выделение мультиферментных комплексов при pH 8.0 и ионообменной хроматографии при различных градиентах концентрации NaCl.
Для наших методических исследований были выбраны растения хлопчатника в фазе начала бутонизации.
На рисунках 1,3 представлены профили элюции при ионообменной хроматографии на ДЭАЭ-целюлозе свободных белков, выделенных при значении рН 8.0 в течение всех процедур очистки и ионообменной хроматографии ступенчатым (1) и линейным (2) градиентом концентраций NaCl.
Ступенчатый градиент
концентраций NaCl





100
300
500
NaСlмМ



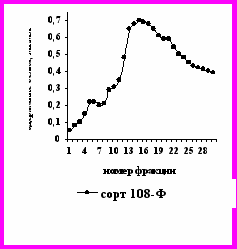
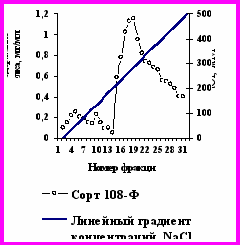
Рис.1. Профиль элюции белков выделенных из листьев хлопчатника сорта 108-Ф в фазе начала бутонизации, при ионообменной хроматографии на ДЭАЭ – целлюлозе ступенчатым градиентом концентраций NaCl, рН 8.0.
Рис. 3. Профиль элюции белков выделенных из листьев хлопчатника сорта 108-Ф в фазе начала бутонизации, при ионообменной хроматографии на ДЭАЭ – целлюлозе линейным градиентом концентраций NaCl, рН 8.0.
На рис. 1 видно, что белки элюировались в виде двух нечётких пиков, причём второй был очень широким. Для определения гомогенности, молекулярной массы и активности ферментов нами были выбраны белки фракций 5 и фракции 15.
Для определения величин молекулярных масс белковые фракции 5 и 15 по отдельности и их смесь подвергали диск-электрофорезу в 7.5% ПААГ. На рис. 2а видно, что смесь белков фракций 5 и 15 (рис. 1) разделилась на две полосы. Белки фракции 5, а также фракции 15, нанесенные по отдельности, проявились в виде одной полосы (рис. 2б и 2в). Молекулярная масса белков фракции 15 (рис. 2б) составляла 520 ± 20 кД. Белок фракции 5 (рис. 2в) имел бóльшую электрофоретическую подвижность по сравнению с белком фракции 15 (рис. 2б), и его молекулярная масса равнялась 480 ± 15 кД.
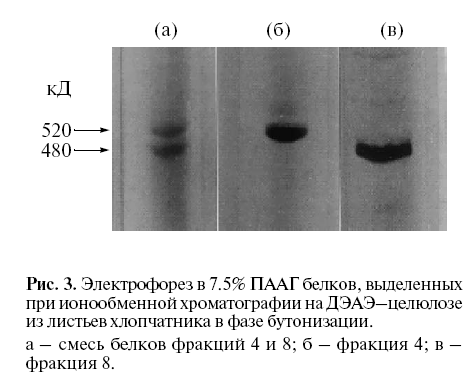
Рис.2. Электрофорез в 7.5% ПААГ белков, выделенных при ионообменной хроматографии на ДЭАЭ-целлюлозе из листьев хлопчатника в фазе бутонизации.
а – смесь белков фракций 5 и 15; б – фракция 15; в – фракция 5.
На рис. 3 видно, что белок элюировался в виде двух более чётких пиков, чем при ступенчатом градиенте концентраций NaCl. Для определения гомогенности, молекулярной массы и активности ферментов были выбраны белки фракций 4 и 18. Белок фракции 4 имел молекулярную массу 480±15кД, а белок фракции 18 - 520 ±20.
В табл. 1 приведены данные о величинах активностей обоих мультиферментных комплексов выделенных при ионообменной хроматографии на ДЭАЭ-целлюлозе при рН 8.0 ступенчатым и линейным градиентом концентрации NaCl.
Из приведенных в табл. 1 данных видно, что мультиферментные комплексы не различались по величинам рибозофосфатизомеразной и фосфорибулокиназной активности. По величинам же РБФ-карбоксилазной активности мультиферментный комплекс с молекулярной массой 520кД выделенный при ионообменной хроматографии на ДЭАЭ-целлюлозе при рН 8.0 ступенчатым градиентом концентрации NaCl превосходил мультиферментный комплекс с молекулярной массой 480кД в 4 раза, а выделенный линейным градиентом NaСl превосходил мультиферментный комплекс с молекулярной массой 480кД по РБФ-карбоксилазной активности в 3.6 раз.
Таблица 1.
Активности мультиферментных комплексов (МФК) выделенных из листьев хлопчатника сорта 108-Ф при рН 8.0 и ионообменной хроматографии при ступенчатом и линейном градиенте концентраций NaCl рН 8.0. Фаза развития растений начало бутонизации.
| Мол. масса МФК, кД | Тип активности | Субстрат | Удельная активность, мкмоль продукта/ мин. на 1 мг белка. | |
| Ступенчатый | Линейный | |||
| 480 520 | Рибозофосфатизомеразная | Рибозо-5-фосфат | 1298 ± 17 1357 ± 21 | 1372±22 1366±19 |
| 480 520 | Фосфорибулокиназная | Рибулозо-5-фосфат | 1348±20 1341±20 | 1341±20 1322±19 |
| 480 520 | РБФ-карбоксилазная | РБФ | 0.13±0.01 0.53±0.01 | 0.22±0.01 0.82±0.01 |
В результате проведённых экспериментов можно сделать вывод, что независимо от ступенчатого или линейного градиента концентраций NaCl при ионообменной хроматографии мультиферментные комплексы не различались по величинам рибозофосфатизомеразной и фосфорибулокиназной активности. Что же касается величины РБФ-карбоксилазной активности мультиферментных комплексов с различной молекулярной массой выделенных при ионообменной хроматографии на ДЭАЭ-целлюлозе линейным градиентом концентраций NaCl, то они были значительно выше, чем при использовании ступенчатого градиента концентраций NaCl. Мультиферментный комплекс с молекулярной массой 520 кД, выделенный линейным градиентом концентраций NaCl, превосходил в 2 раза по РБФ-карбоксилазной активности аналогичный комплекс, выделенный ступенчатым градиентом концентраций NaCl. РБФ-карбоксилазная активность мультиферментного комплекса с молекулярной массой 480 кД, выделенного линейным градиентом концентраций NaCl, была выше на 56% в сравнении с активностью мультиферментного комплекса, выделенного ступенчатым градиентом концентраций NaCl.
3.2. Выделение мультиферментных комплексов при pH 8.5 и ионообменной хроматографии при различных градиентах концентрации NaCl.
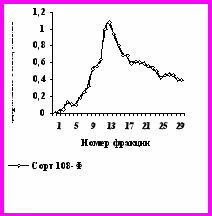
На рисунках 4-5 представлены профили элюции при ионообменной хроматографии на ДЭАЭ-целлюлозе свободных белков, выделенных при значении рН 8.5 во время получения экстракта и буфера с рН 8.3 в течение всех остальных процедур очистки и ионообменной хроматографии ступенчатым и линейным градиентом концентраций NaСl.
500
100
300
NaCl мМ
Ступенчатый градиент
Концентраций, NaCl








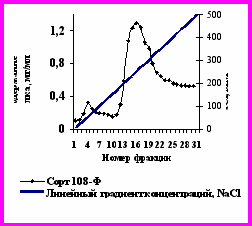
Ступенчатый градиент
концентраций NaCl
Рис. 4. Профиль элюции белков выделенных из листьев хлопчатника сорта 108-Ф в фазе начала бутонизации, при ионообменной хроматогрбафии на ДЭАЭ – целлюлозе ступенчатым градиентом концентраций NaCl, рН 8.3.
Рис. 5. Профиль элюции белков выделенных из листьев хлопчатника сорта 108-Ф в фазе начала бутонизации, при ионообменной хроматографии на ДЭАЭ – целлюлозе линейным градиентом концентраций NaCl, рН 8.3.
На рис. 4 видно, что белки элюировались в виде одного большого пика с пологами плечами и одного маленького. Для анализов были выбраны белки фракции 4 и 13. Молекулярная масса белка фракции 4 составляла 480±15кД, а фракции 13 - 520±20кД.
На рис. 5 видно, что белки элюировались в виде двух чётких пиков. Для анализов были выбраны белки фракции 4 и 16. Молекулярная масса белка фракции 4 составляла 480±15кД, а фракции 16 - 520±20кД.
Результаты определения активности этих мультиферментных комплексов представлены в таблице 2.
Таблица 2
Активности мультиферментных комплексов (МФК), выделенных из листьев хлопчатника сорта 108-Ф при рН 8.5 и ионообменной хроматографии при рН 8.3 ступенчатым и линейным градиентом концентраций NaСl. Фаза развития растений – начало бутонизации.
| Мол. масса МФК, кД | Тип активности | Субстрат | Удельная активность, мкмоль продукта/ мин. на 1 мг белка. | |
| Ступенчатый | Линейный | |||
| 480 520 | Рибозофосфатизомеразная | Рибозо-5-фосфат | 2116 ±23 2281±24 | 3210±27 3418±30 |
| 480 520 | Фосфорибулокиназная | Рибулозо-5-фосфат | 2267±19 2307±20 | 3199±17 3375±21 |
| 480 520 | РБФ-карбоксилазная | РБФ | 0.19±0.01 1.44±0.01 | 0.95±0.01 1.51±0.01 |
Из представленных в таблице 2 данных видно, что мультиферментные комплексы почти не различались по рибозофосфатизомеразной и фосфорибулокиназной активности. По величинам же РБФ-карбоксилазной активности независимо от градиента концентраций NaCl мультиферментные комплексы с молекулярной массой 520 кД значительно превосходили мультиферментные комплексы с молекулярной массой 480 кД. Выделенные линейным градиентом NaСl мультиферментные комплексы по РБФ-карбоксилазной превосходили аналогичные мультиферментные комплексы, выделенные ступенчатым градиентом концентраций NaCl.
Таким образом, чёткое разделение мультиферментных комплексов и наибольшие величины всех ферментативных активностей были получены при использовании для получения экстракта из листьев буфера со значением рН 8.5 и при ионообменной хроматографии с буфером рН 8.3 линейным градиентом концентраций NaСl. В связи с этим, данный метод выделения свободных мультиферментных комплексов был использован нами в последующих исследованиях.
