Монстакова Ирина Минеевна, 1 квалификационная категория, моу сош №11, город Североуральск, Свердловская область. Предмет : химия, 10 класс. Тип урок
| Вид материала | Урок |
- Куликова Надежда Владимировна, вторая квалификационная категория Цель урок, 113.09kb.
- Яковлева Лариса Александровна учитель химии и биологии моу «Новогеоргиевская сош» Петуховского, 47.46kb.
- Пивоварова Елена Владимировна, учитель истории и обществознания моу «Туринская средняя, 362.33kb.
- Маклакова Елена Владимировна, первая квалификационная категория, моу «Первомайская, 260.98kb.
- Ятманкина Галина Михайловна моу саврушская сош с. Савруха Похвистневский район Самарская, 34.69kb.
- Рабочая программа педагога Васиной Т. И. (I квалификационная категория) по математике, 665.92kb.
- Гусева Ольга Владимировна, учитель химии и биологии, высшая квалификационная категория, 158.84kb.
- Урока английского языка и изобразительного искусства по теме: «наши выходные», 218.23kb.
- Конкурс "Современный урок" Урок биологии в 7 классе. Тип членистоногие, 119.78kb.
- Лучкина Наталья Петровна, учитель русского языка и литературы моу «сош №6», высшая, 164.19kb.
Белки: строение и свойства
Обобщающий интегрированный урок-семинар в 11-м классе
В современной науке наблюдается тенденция к объединению различных отраслей знания. С этим связано появление биофизики, биохимии, медицинской физики, космической медицины и т.п. Однако школьники обычно не знакомы с этими отраслями науки.
К сожалению, учащиеся часто не могут применить знания, полученные, например, на уроках химии и физики к анализу закономерностей, изучаемых на уроках биологии, считая эти предметы несовместимыми. Предлагаемый урок позволяет показать учащимся не только взаимосвязь биологии, химии, физики, но и принципиальную необходимость такого объединения.
Урок охватывает круг вопросов, связанных со строением, свойствами и значением белков. Подобный урок способствует формированию научного мировоззрения учащихся, т.к. позволяет более полно раскрыть современную научную картину мира.
Задачи урока
Познавательные:
– сформировать знания о белках как макромолекулах, биополимерах, играющих ведущую роль в строении и жизнедеятельности клетки; мономерах белка; образовании химических связей и образовании структур;
– сформировать знания о свойствах и функциях белков, показать их ведущую роль в процессах жизнедеятельности;
– показать значимость физических методов познания природы и возможность их приложения к объяснению закономерностей в биологических микросистемах;
– обобщить знания, получаемые учащимися на уроках химии, биологии по теме «Белки», уточнить и проанализировать эти факты с точки зрения физических теорий.
Развивающие:
– развивать умение анализировать результаты лабораторных опытов, устанавливать причинно- следственные связи между явлениями живой и неживой природой, явлениями окружающей среды и процессами в биологических объектах на базе комплекса научных данных физики, химии, биологии;
– развивать познавательный интерес учащихся на основе использования межпредметных связей;
– научить применять знания, получаемые на уроках по одному предмету, к анализу явлений или процессов, изучаемых другими предметами.
Воспитательные:
– формирование научного мировоззрения, четких представлений о роли естественных наук в современном обществе;
– создание в представлении учащихся общей, целостной картины мира с его единством и многообразием свойств живой и неживой природы.
Оборудование: эпипроектор, графопроектор, экран, реактивы для проведения практической части, опорный конспект (рис. 1), таблички с вопросами.
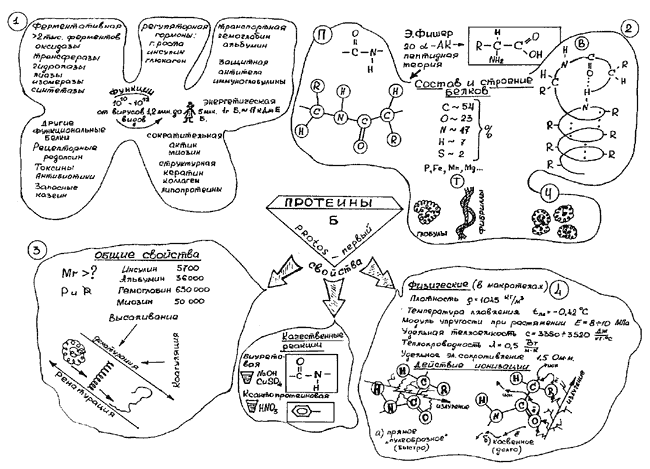
Рис. 1. Опорный конспект урока
Оформление: на доске цветными мелками изображен опорный конспект; написан эпиграф: «Мыслящий ум не чувствует себя счастливым, пока ему не удастся связать воедино разрозненные факты, им наблюдаемые» (Д.Хевеши).
Ход урока
Учитель химии. Ребята, сегодня у нас не совсем обычный урок, так как вести его будут сразу три учителя: химии, биологии и физики. Тема нашего урока: «Белки: строение и свойства». Пройдет урок под девизом: «Мыслящий ум не чувствует себя счастливым, пока ему не удастся связать воедино разрозненные факты, им наблюдаемые» (Д.Хевеши).Сегодня мы попробуем рассмотреть белки со всех сторон и связать воедино факты и сведения об этих удивительных веществах. Чем же они удивительны? Об этом расскажет учитель биологии.
Учитель биологии. С какими материальными объектами связана тайна жизни? Это один из главных вопросов, на который пыталась ответить наука на протяжении своей истории. И уже довольно давно ученые поняли, что важную, а может быть, и главную роль во всех жизненных процессах играют белки.
Белки составляют 10–18% от общей массы клетки. В каждой клетке находится более 3 тыс. молекул белков. В организме человека насчитывается свыше 100 тыс. белков.
В клетках белки играют важнейшую роль. Есть белки – переносчики веществ, ионов, протонов, электронов; есть биокатализаторы; есть регуляторы разнообразных процессов в клетках и организмах. Важную роль играют опорные и сократительные белки. Белки защищают организм от инфекций. Контакты клетки с внешней средой осуществляют разнообразные белки, различающие форму молекул, чувствительные к температурным изменениям, ничтожным примесям веществ, отличающие один цвет от другого. Уже из этого можно сделать вывод: наиболее важными органическими соединениями клетки являются белки.
Для понимания сущности многочисленных функций белков в клетке, обеспечивающих ее жизнедеятельность, необходимо знать строение белковых молекул.
Учитель химии. Вещества белковой природы известны с давних времен. Начало их изучению положено в середине XVIII в. итальянцем Беккари, который предложил углеродную теорию. Через 100 лет ученые пришли к выводу, что белки – главный компонент живых организмов. Затем из белковых гидролизатов были получены продукты расщепления, и возникла гипотеза о строении белка из аминокислот (Данилевский). Над проблемой строения белков долгое время работал Фишер, и после его работ была создана полипептидная теория строения белков. Было доказано, что в состав белков входят атомы углерода, водорода, кислорода, азота, серы, фосфора и др. (демонстрируется табл. 1).
Таблица 1. Элементарный состав белков
| Элемент | Содержание (%) |
| С Н О N S | 50–55 6,5–7,3 19–24 15–19 0,2–2,4 |
Особенно характерно для белков содержание азота в концентрации 15–19%. На заре белковой химии этот показатель играл большую роль при решении вопроса о принадлежности высокомолекулярного вещества к классу белков.
Сейчас мы с вами докажем наличие азота и серы в курином белке. Для этого вам надо выполнить опыт №1 из предложенного методического пособия (Приложение 1). Сделайте вывод и запишите его в тетрадь.
Согласно полипептидной теории белки имеют первичную, вторичную, третичную, а некоторые и четвертичную структуру. Прослушаем сообщение о первичной структуре белка.
1-й ученик. Под первичной структурой белка понимают последовательность расположения аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка (рис. 2 а). Если принять аминокислоту за бусинку, то даже из небольшого числа бусинок можно составить несколько самых разнообразных сочетаний (демонстрирует несколько ниток бус, собранных из одинаковых бусинок). Так и в молекуле белки могут давать огромное число изомеров.
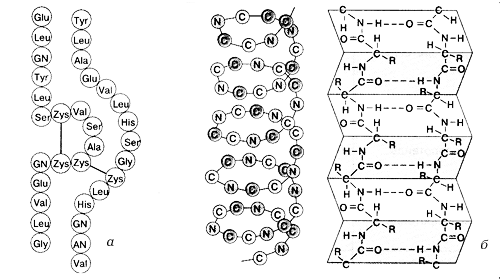
Рис. 2. Структура белков: а – первичная, б – вторичная
Ни одно из природных соединений не обладает такими потенциальными возможностями к изомерии, как белки. Именно так и реализуется в природе бесконечное разнообразие структур белковых тел, дающее начало миллионам растительных и животных видов, каждый из которых обладает сотнями и тысячами собственных белков, не похожих на белки других видов. Если бы в первичной структуре белков не было заложено этого качества, то не было бы и того разнообразия жизненных форм, свидетелями и частью которого являемся мы сами.
Учитель химии. Прослушаем сообщение о вторичной структуре белка.
2-й ученик. Строго линейная полипептидная цепь присуща ограниченному числу белков. Такую структуру имеет фиброин шелка – белок, синтезируемый гусеницами шелкопряда. В силу особых условий формирования шелкового волокна в мускульном прессе гусеницы нитевидные молекулы фиброина, почти лишенные обрамляющих главную полипептидную цепь радикалов, ориентируются вдоль шелкоотделительного протока и плотно упаковываются по ходу шелкового волокна.
В последнее время ученые показали, что даже в волокнистых, фибриллярных, белках очень редко удается обнаружить полностью растянутые полипептидные цепи. Рентгеновские снимки постоянно указывали на наличие в белках каким-то образом сложенных или скрученных полипептидных цепей. В результате расшифровки рентгенограмм удалось доказать, что некоторые участки в полипептидной цепи в молекулах подавляющего числа белков свернуты в виде a-спирали (на доске демонстрируется рис. 2б– модель
 -спирали).
-спирали). -спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, так что все пространство внутри «цилиндра» (если так можно сказать), в пределах которого идет закручивание, заполнено. Наиболее просто закручивание можно представить следующим образом (учащийся накручивает кусочек проволоки на карандаш, получая тем самым спираль).
-спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, так что все пространство внутри «цилиндра» (если так можно сказать), в пределах которого идет закручивание, заполнено. Наиболее просто закручивание можно представить следующим образом (учащийся накручивает кусочек проволоки на карандаш, получая тем самым спираль).Как мы видим, упаковка действительно очень плотная, но насколько близко друг к другу располагаются витки спирали? Очевидно, что витки можно сблизить или растянуть (сжимает и растягивает спираль). Исследования ученых показали, что на каждый виток правозакрученной a--спирали приходится 3,6 аминокислотных остатков, радикалы которых направлены всегда наружу. Шаг спирали (расстояние между витками) составляет 0,54 нм (демонстрируется рис. 3 – схема
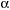 --спирали).
--спирали).
Рис. 3. Схема  -спирали
-спирали
Огромную роль в формировании и поддержании
 -спиральной конфигурации полипептидной цепи играют водородные связи, возникающие между –СО– и –NН– группами хребта полипептидной цепи, расположенной на соседних витках спирали (учащийся демонстрирует через эпипроектор типы связей между радикалами аминокислотных остатков в белковой молекуле). И хотя энергия водородных связей невелика, большое их количество приводит к значительному эффекту, в результате чего
-спиральной конфигурации полипептидной цепи играют водородные связи, возникающие между –СО– и –NН– группами хребта полипептидной цепи, расположенной на соседних витках спирали (учащийся демонстрирует через эпипроектор типы связей между радикалами аминокислотных остатков в белковой молекуле). И хотя энергия водородных связей невелика, большое их количество приводит к значительному эффекту, в результате чего 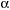 -спиральная конфигурация устойчива и жестка.
-спиральная конфигурация устойчива и жестка.Степень спирализации полипептидных цепей различна у разных белков: в гемоглобине, например, 3/4 полипептидных цепей находится в спирализированном состоянии, а 1/4 – в растянутом. У рибонуклеазы же только 1/5 часть полипептидной цепи спиральна, а остальные 4/5 линейны. Молекулы белков, построенные из полностью спирализованных и полностью линейных полипептидных цепей, встречаются редко.
Учитель химии. Прослушаем сообщение о третичной структуре белка.
3-й ученик. Выявление чередования аминокислотных остатков в полипептидной цепи и наличие в белковой молекуле спиральных и не спиральных участков полипептидной цепи еще не дает представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу. Эти детали строения белков выясняются при изучении третичной структуры .
Под третичной структурой белковой молекулы понимают общее расположение в пространстве одной или нескольких полипептидных цепей, соединенных ковалентными связями. Естественно, что полипептидная цепь имеет определенную конфигурацию, представленную, как правило, сочетанием спиральных и линейных участков.
Считают, что третичная структура белковой молекулы определяется первичной структурой, т.к. решающая роль в поддержании характерного расположения полипептидной цепи в пространстве (конформации) принадлежит взаимодействию радикалов аминокислот. Особую роль в поддержании третичной структуры белка играют дисульфидные мостики: именно они прочно фиксируют расположение участков полипептидной цепи по отношению друг к другу. Таким образом, положение в молекуле белка остатков цистеина предопределяет расположение дисульфидных связей и, следовательно, третичную структуру.
Третичная структура белка обусловливает его функции, в частности ферментативную активность. В молекулах белков-ферментов за счет специфической конформации участков полипептидной цепи образуются каталитические и регуляторные центры. Так как третичная структура белков довольно легко изменяется под действием физических и химических факторов, способность белков ускорять химические процессы бывает выражена то ярче, то слабее. Белковая молекула непрерывно изменяет свою третичную структуру, чутко реагирует на изменение внешних условий смещением по отношению друг к другу спирализованных и линейных участков, радикалов аминокислот и т.д. В этой способности белковых молекул изменять свою конформацию в ответ на сигналы внешней среды, по существу, уже заложены многие свойства (раздражимость, приспособляемость и т.п.) живых организмов.
Учитель химии. Прослушаем сообщение о четвертичной структуре белка.
4-й ученик. Белки, относительные молекулярные массы которых превышают 50 кДа, как правило состоят из субъединиц. Относительные молекулярные массы субъединиц колеблются от нескольких тысяч до нескольких десятков тысяч, а их число в таких сверхмолекулах может быть от 2 до 162.
Структура, характеризующаяся наличием в белковой молекуле определенного числа полипептидных цепей, или субъединиц, занимающих строго фиксированное положение, вследствие чего белок обладает той или иной биологической активностью, называется четвертичной. С этой точки зрения детально изучено строение некоторых белков.
Молекула гемоглобина построена из четырех субъединиц с молярной массой 17 кДа каждая. Первичная, вторичная и третичная структуры субъединиц молекулы гемоглобина полностью установлены. При соединении с кислородом молекула гемоглобина изменяет свою четвертичную структуру, «запирая» кислород внутри молекулы. Причиной этого является изменение третичной структуры субъединиц. Таким образом, структура и функции молекулы гемоглобина тонко «пригнаны» друг к другу.
Самое поразительное состоит в том, что объединение субъединиц в молекулу белка осуществляется самопроизвольно. Предполагают, что в каждой субъединице есть специфические контактные участки, взаимодействующие с таковыми в других субъединицах. Проделано уже много опытов с вирусами и фагами, где показано, что их можно разрушить, удалить нуклеиновую кислоту, а потом из белковых субъединиц снова собрать оболочку вируса или фага. В природе широко распространена самосборка надмолекулярных структур, в основном с участием белковых молекул.
Учитель химии. Чем глубже химики познают природу и строение белковых тел, тем более они убеждаются в исключительном значении установления связи между структурой и функцией белковых молекул для раскрытия одной из важнейших тайн природы – тайны жизни.
Как мы видим, белки имеют сложное строение, молекулы их очень велики, молекулярные массы достигают сотен килодальтон (рис. 4), а молекулярная масса белка вируса желтухи шелковичного червя составляет 916 тыс. кДа.
Рис. 4
Важной особенностью молекулярных масс белков является подмеченная еще Сведбергом кратность их стандартному значению в 17–18 кДа, хотя эта зависимость выполняется и не всегда.
А теперь прошу вас ответить на вопросы под заголовком «Строение белков» (Приложение 2). Ответы запишите в тетрадь (учащиеся отвечают на вопросы).
Учитель биологии. Сложность строения белковых молекул и чрезвычайное разнообразие их функций крайне затрудняют создание четкой единой классификации белков, на какой-либо одной основе. Приняты три разные классификации белков.
КЛАССИФИКАЦИЯ БЕЛКОВ
| ПО СОСТАВУ 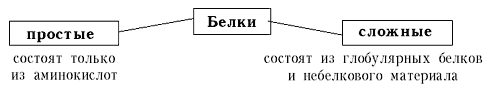 | ||||||
| ПО ФУНКЦИЯМ Структурная .............................. коллаген, склеротин, эластин Каталитическая .........................триплен, полимеразы, рибонуклеаза Регуляторная..............................инсулин, глюкагон Транспортная............................. гемоглобин, гемоциатин Защитная .....................................антитела, фибриноген Двигательная..............................миозин, актин Запасательная........................... казеин, альбумин Токсичная ................................. змеиный яд, токсин Сигнальная ................................рецепторы | ||||||
| ПО СТРУКТУРЕ
|
К простым белкам относятся: альбумины, глобулины, гистоны, склеротины.
К сложным белкам относятся: фосфопротеиды, гликопротеиды, нуклеопротеиды, хромопротеины, липопротеиды, флавопротеиды, металлопротеины.
