«Российский кардиологический научно-производственный комплекс»
| Вид материала | Автореферат диссертации |
- Связанную с нарушениями ритма сердца и проводимости, 31.42kb.
- На правах рукописи габрусенко сергей Анатольевич, 1031.18kb.
- Буклет "Национального Центра санитарного просвещения населения (санпросвет)" на тему, 974.5kb.
- Вопросы для обсуждения: Организационные вопросы оказания неотложной кардиологической, 16.96kb.
- Открытое акционерное общество "Научно-производственный комплекс "элара" имени, 1486.93kb.
- Содержание 1 Общие сведения об акционерном обществе, 307.14kb.
- Положение о проведении Всероссийского фестиваля-конкурса бального танца «Бал XXI век»., 23.22kb.
- V международная научно-техническая конференция «Информационные технологии в науке,, 63.57kb.
- Д-р техн наук, проф. Новиков, 655.84kb.
- Методические рекомендации по техническому диагностированию трубопроводов тепловых сетей, 1333.3kb.
Таблица 2. Сравнительная характеристика обследованных женщин.
| | Группы | пациентов | р |
| Показатель | ИБС | Без ИБС | |
| Количество пациентов | 220 | 78 | |
| Средний возраст, лет | 57,7 9,6 | 56,4 8,8 | >0,1 |
| Постменопауза (>55 лет) | 161 (73%) | 46 (59%) | <0,05 |
| Артериальная гипертония | 178 (79%) | 55 (71%) | >0,1 |
| Курение в прошлом | 28 (13%) | 10 (13%) | >0,1 |
| Курение в настоящем | 35 (16%) | 14 (18%) | >0,1 |
| Ожирение | 88 (39%) | 24 (31%) | >0,1 |
| Семейный анамнез ИБС | 96 (43%) | 27 (35%) | >0,1 |
| Сахарный диабет 2 типа | 49 (22%) | 11 (14%) | >0,1 |
| Гиперлипидемия | 172 (77%) | 56 (72%) | >0,1 |
| Факторы риска | 3,0 + 0,7 | 2,6 + 1,3 | <0,001 |
| Лп (а), мг/дл | 44 + 3 | 17 + 2 | <0,0001 |
| Лп (а) > 30мг/дл | 105 (48%) | 12 (15%) | <0,0001 |
| ОХС, ммоль/л | 6,7 + 1,6 | 6,0 + 1,2 | <0,001 |
| ТГ, ммоль/л | 2,3 + 1,4 | 1,8 + 1,1 | <0,01 |
| ХС-ЛВП, ммоль/л | 1,3 + 0,4 | 1,4 + 0,4 | >0,1 |
| ХС-ЛНП, ммоль/л | 4,7 + 1,5 | 3,7 + 1,0 | <0,01 |
| Фибриноген, г/л | 3,3 1,1 | 3,4 1,1 | >0,1 |
| вчСРБ, мг/л | 3,1 2,6 | 2,4 2,4 | >0,1 |
В общей группе обследованных (n=2120) связь с наличием ИБС продемонстрирована для большинства классических факторов риска и Лп(а). При проведении многофакторного анализа с учетом пола и возраста больных уровень Лп(а) сохранял свою независимую связь с наличием значимого поражения коронарных артерий (r=0,181, p<0,0001) сопоставимую с таковой для курения (r=0,177, p<0,0001), концентрации ХС-ЛНП (r=0,209, p<0,0001) и ХС-ЛВП (r=-0,214, p<0,0001). Отношение шансов (95% доверительный интервал) наличия ИБС при ГиперЛп(а) в общей группе (n=2120) составило 2,83 (2,32-3,60), среди 1384 мужчин, прошедших КАГ, – 4,24 (2,48-7,27), у 298 женщин, прошедших КАГ, – 5,02 (2,57-9,81), во всех случаях р<0,01. У мужчин с ИБС моложе 55 лет частота ГиперЛп(а) достоверно выше, чем у мужчин старшего возраста: 42% и 36% соответственно, 2=3,87, р=0,0498. Отношение шансов наличия ИБС при ГиперЛп(а) у мужчин до 55 лет равно 5,01 (2,45-10,27) (р<0,01), у мужчин старше 55 лет – 3,54 (1,56-8,27) (р<0,01). Методом кривых операционных характеристик установлено, что пороговый уровень Лп(а) в исследованной когорте больных для мужчин составил 23 мг/дл (чувствительность 44%, специфичность 83%, положительная предсказующая ценность 96%, отрицательная предсказующая ценность 14%), а для женщин – 40 мг/дл (чувствительность 42%, специфичность 90%, положительная предсказующая ценность 92%, отрицательная предсказующая ценность 36%),
ГиперЛп(а) у больных ИБС обычно встречается в 25-30% случаев. В нашем исследовании 600 пациентов (40%) имели уровень Лп(а) более 30 мг/дл, что, возможно, обусловлено преобладанием больных с тяжелым течением ИБС: 70% больных имели стенокардию III - IV функционального класса, 80% перенесли по крайней мере 1 инфаркта миокарда. Больные, включенные в исследование, направлялись или обращались в Отдел атеросклероза НИИ кардиологии им. А.Л. Мясникова. Столь тяжелый контингент больных свидетельствует о том, что вопросы первичной и вторичной профилактики сердечно-сосудистых осложнений, включая коррекцию классических факторов риска атеросклероза, решаются недостаточно адекватно. Мы отметили, что клинически проявляющиеся нарушения углеводного обмена в виде ожирения и сахарного диабета не отличались у больных ИБС и с неизмененными коронарными артериями. Что касается, других классических факторов риска атеросклероза, то у мужчин с ИБС они встречались закономерно чаще по сравнению с контрольной группой, а у женщин, несмотря на более высокую частоту основных факторов, отличия не достигли статистической значимости, что, вероятно, связано с меньшим количеством наблюдений.
С учетом полученных нами результатов и анализом данных литературы, можно сделать вывод, что встречаемость повышенного уровня Лп(а) в популяции достигает 15%, а среди больных ИБС - 40%. В одномоментных и проспективных исследованиях показана важная роль ГиперЛп(а) в развитии атеросклероза различных сосудистых бассейнов. В этой связи мы считаме целесообразным и предлагаем включить ГиперЛп(а) в классификацию гиперлипопротеидемий по ВОЗ/Fredrickson.
В нашем исследовании 41% мужчин до 45 лет имели уровень Лп(а) более 30 мг/дл, что может свидетельствовать об участии этого показателя в развитии ИБС именно в молодом возрасте. При этом сочетание повышенного Лп(а) с другими факторами риска ассоциируется с выраженным коронарным атеросклерозом и более тяжелым течением ИБС. В нескольких клинико-анатомических исследованиях продемонстрировано, что примерно в половине случаев ИМ развивается в артериях, имевших стенозы менее 50% по диаметру (Fishbein M.C., Siegel R.J., 1996). Учитывая эти данные и полученные нами результаты, можно предполагать, что развитию инфаркта миокарда со стойким окклюзированием способствуют протромботические свойства молекулы апо(а), а в случае диффузного поражения коронарного русла - атерогенность ХС-ЛНП, входящего в состав Лп(а).
Уровень липопротеида (а) и поражение коронарных артерий у больных различного пола и возраста.
Все больные были разделены на 4 подгруппы в зависимости от количества пораженных коронарных артерий. В соответствии с клиническими проявлениями основного заболевания преобладали пациенты с тяжелым поражением коронарного русла: у 957 мужчин и 162 женщин с ИБС были гемодинамически значимые изменения в двух или трех магистральных артериях.
Для выявления связи Лп(а), других липидов крови и факторов риска ИБС со степенью коронарного атеросклероза был проведен сравнительный анализ между подгруппами у мужчин и женщин. У мужчин отмечена корреляция между количеством пораженных коронарных артерий и возрастом, артериальной гипертонией, курением, семейного анамнезом, сахарным диабетом, концентрацией общего ХС, ТГ, ХС-ЛНП. Медиана уровня Лп(а) в зависимости от количества пораженных коронарных артерий была равна: 8; 17; 18 и 21 мг/дл (Рис. 2). При множественном регрессионном анализе у мужчин с наличием ИБС и тяжестью коронарного атеросклероза достоверную независимую связь продемонстрировали: концентрации Лп(а), общего ХС, ТГ, артериальная гипертония, семейный анамнез ИБС.
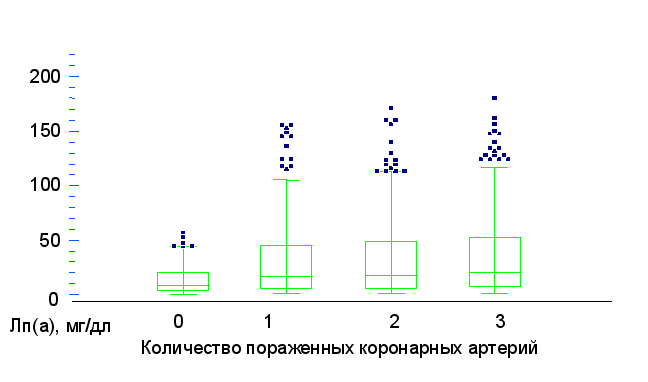
Рис. 2. Зависимость концентрации липопротеида (а) от количества пораженных коронарных артерий у мужчин (r=0,123, p<0,0001).
У женщин отмечена корреляция между количеством пораженных коронарных артерий и возрастом, артериальной гипертонией, сахарным диабетом, концентрацией общего ХС, ТГ, ХС-ЛНП и Лп(а). Медиана уровня Лп(а) в зависимости от количества пораженных коронарных артерий была равна: 11; 24; 36 и 22 мг/дл 8 (Рис. 3). При множественном регрессионном анализе, проведенном с учетом возраста, независимая связь концентрации Лп(а) с количеством пораженных коронарных артерий сохранялась.
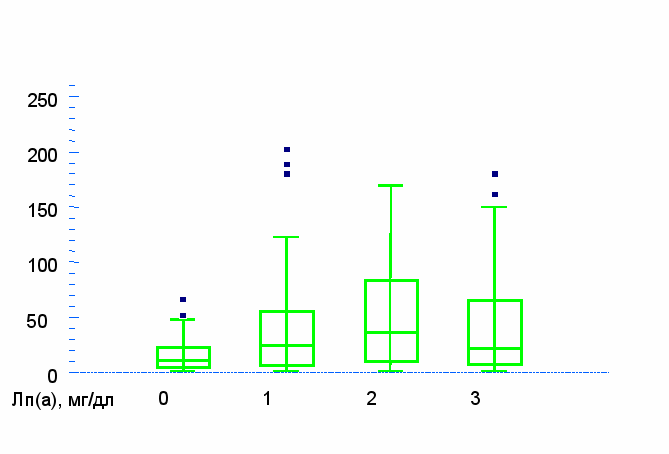
Количество пораженных коронарных артерий
Рис. 3. Зависимость концентрации липопротеида (а) от количества пораженных коронарных артерий у женщин (r=0,205, p<0,0001).
Изучение связи уровня липопротеида (а) с факторами риска ИБС.
У мужчин не выявлено связи уровня Лп(а) с такими факторами как семейный анамнез ИБС, курение, ожирение, сахарный диабет, артериальная гипертония, концентрация ХС-ЛВП, вчСРБ, фибриногена. Время начала ИБС при ГиперЛп(а) было раньше, чем у пациентов с Лп(а) менее 30 мг/дл: 49,8 + 8,8 и 51,0 + 9,0, <0,05. Среди мужчин с ГиперЛп(а) количество лиц, заболевших ИБС до 45 лет, было существенно больше, чем среди больных с Лп(а)<30 мг/дл: 36% и 26% соответственно, 2=8,44, р=0,004. Далее мы разделили мужчин с ИБС на 5 подгрупп в зависимости от уровня Лп(а). Частота возникновения ИБС в молодом возрасте увеличивалась по мере нарастания концентрации Лп(а), достигая максимума в подгруппе с Лп(а)>80 мг/дл: 41% (64 из 158 человек) (рис. 4).
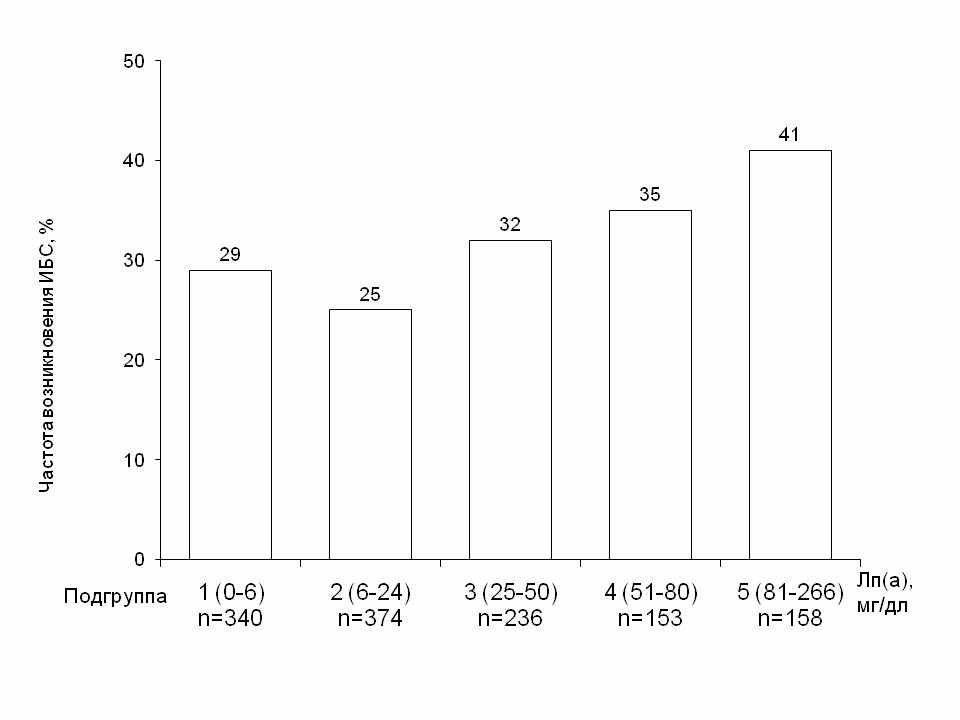 Рис. 4. Частота возникновения ИБС у мужчин до 45 лет в зависимости от концентрации Лп(а). (2=13,69, р=0,008).
Рис. 4. Частота возникновения ИБС у мужчин до 45 лет в зависимости от концентрации Лп(а). (2=13,69, р=0,008).При расширении возрастного диапазона до 55 лет не выявлено каких-либо отличий по встречаемости мужчин с ИБС между подгруппами: 74%, 70%, 72%, 78% и 74% соответственно, 2=4,45, р=0,3. По-видимому, после 45 лет в манифестации ИБС играют роль другие факторы риска, тогда как Лп(а), на наш взгляд, имеет большее значение в развитии коронарного атеросклероза в молодом и среднем возрасте. По частоте классических факторов риска подгруппы существенно не отличались друг от друга.
Нами выявлена связь уровня Лп(а) с общим ХС (r=0,21, p=0,001) и ХС-ЛНП (r=0,23, р<0,001). С увеличением концентрации Лп(а) содержание ХС, входящего в его состав, также возрастает, поэтому для более точной оценки ХС-ЛНП сыворотки, мы рекомендуем использовать модифицированную формулу Фридвальда. Уровень корригированного ХС-ЛНП был существенно ниже некорригированного при концентрации Лп(а) более 60 мг/дл (4,2±1,0 ммоль/л и 5,0±1,1 ммоль/л соответственно, р<0,01). После вычитания значений ХС Лп(а) из общего ХС и ХС-ЛНП положительная корреляция между этими показателями не наблюдалась. У мужчин установлена обратная связь между уровнем Лп(а) и ТГ: r=0,13, p<0,05. В исследованной нами группе больных отмечена позитивная связь Лп(а) с уровнем общего ХС и ХС-ЛНП, что, вероятно, связано с преобладанием в исследовании лиц с ГиперЛп(а). Во избежание артефактов при расчете ХС-ЛНП мы использовали модифицированную формулу Фридвальда. После ее применения корреляция между концентрацией Лп(а) и общего ХС, ХС-ЛНПк не наблюдалась.
Мы вычленили из общей когорты больных ИБС без гиперлипидемии и разделили на 2 группы: с ГиперЛп(а) (n=123, 89% мужчин, средний возраст 55,2± 9,9 лет) и концентрацией Лп(а)<30 мг/дл (90% мужчин, средний возраст 54,2 ± 10,8 лет). Обе группы были сопоставимы по профилю факторов риска и тяжести заболевания в начале исследования. Однако при наблюдении в течение 10 лет частота серьезных клинических исходов (смертельные исходы, ИМ, операции реваскуляризация миокарда, прогрессирующая стенокардия) была выше среди больных с ГиперЛп(а): 40% в сравнении с 25% в группе с Лп(а)<30 мг/дл, р<0,0001. При этом между группами не было отличий по применению основных кардиологических препаратов, включая статины: 76% и 68% соответственно.
Так же, как у мужчин, у женщин с ГиперЛп(а) выявлено более раннее (на 2,7 года) начало ИБС, чем у женщин с Лп(а) менее 30 мг/дл: 53,1 + 8,3 и 55,8 + 10,0 лет, р<0,05. Частота возникновения ИБС до 55 лет была выше при ГиперЛп(а): 66% с сравнении с 47% при Лп(а)<30 мг/дл, 2=7,41, р=0,007. У женщин с ИБС не отмечено связи Лп(а) с другими факторами риска.
Уровень липопротеида (а) и чрескожные коронарные вмешательства.
В рамках данного исследования были подвергнуты ЧКВ 502 человека (85% мужчин, средний возраст 54,7±8,9 лет): 92 – обычной баллонной ангиопластике (ТБКА), 270 – ТБКА с имплантацией простых стентов, 140 – ТБКА с имплантацией стентов с лекарственным покрытием. Повторная коронарография была выполнена в течение 24 месяцев (в среднем через 93 месяца) после ЧКВ у 243 (48%) больных. Признаки рестеноза выявлены у 103 человек. Лп(а) был достоверно выше в группе рестеноза только после имплантации стентов без покрытия (Рис. 5), По другим показателям (частота различных факторов риска, концентрация липидов крови, вчСРБ, фибриногена) не выявлено отличий между группами с рестенозом и без вне зависимости от типа эндоваскулярного лечения. В группе рестеноза пациенты принимали статины существенно реже, чем в группе без рестеноза: 55% и 75%, р<0,05.
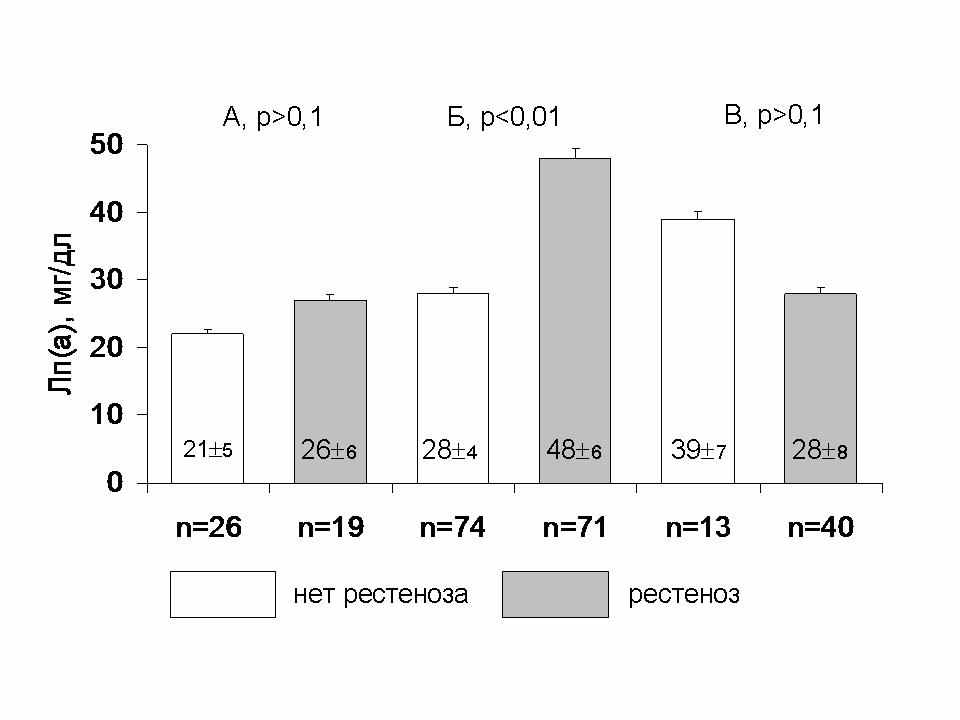 Рис. 5. Уровень Лп(а) в зависимости от рестеноза после А – обычной баллонной коронарной ангиопластики, Б – имплантации стентов без покрытия, В – с лекарственным покрытием.
Рис. 5. Уровень Лп(а) в зависимости от рестеноза после А – обычной баллонной коронарной ангиопластики, Б – имплантации стентов без покрытия, В – с лекарственным покрытием. Также по результатам повторной ангиографии были сформированы группы: с прогрессированием и без прогрессирования коронарного атеросклероза в нативных артериях (сегментах, не подвергшихся ангиопластике), их отличал между собой лишь уровень Лп(а): 49±4 (36; 13-62) мг/дл и 21±3 (12; 4-26) мг/дл, соответственно, р<0,0001 (Рис. 6),. Различий по другим факторам риска и медикаментозной терапии между группами не наблюдалось.
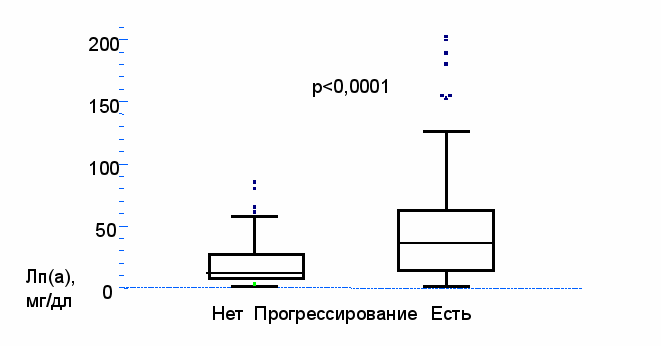
Рис. 6. Зависимость прогрессирования коронарного атеросклероза у больных, перенесших ЧКВ, от уровня липопротеида (а).
Из 240 больных, которым была выполнена ТБКА с имплантацией стентов без покрытия, контрольная ангиография проведена у 145 человек: у 71 человека были выявлены признаки рестеноза внутри стента. Достоверным отличием между группами служил лишь уровень Лп(а). В аналогичном исследовании спустя год после имплантации стента рестеноз выявили у 38 из 109 человек (35%). Концентрация Лп(a) в группе рестеноза (30,5±23,9 мг/дл) была достоверно выше, чем в группе без рестеноза (16,9±11,1 мг/дл) (p<0,01), тогда как значения других липидов были сопоставимы (Kamitani et al, 2005). В других работах связи уровня Лп(а) с рестенозом после имплантации МС не установлено (Ribichini F et al, 1998; Wehinger A et al, 1999; Zairis M et al, 2002; Gazzaruso C et al, 2003). Нами не выявлено аасоциации уровня Лп(а) с рестенозом у больных, перенесших обычную ТБКА или имплантацию стентов с лекарственным покрытием. Ряд других исследований также не обнаружил связи Лп(а) с рестенозом после ТБКА (Cooke T et al, 1994; Alaigh et al, 1998). Работ, посвященных изучению роли Лп(а) в развитии рестеноза стентов с лекарственным покрытием, нами не найдено.
Работы, посвященные быстрому прогрессированию коронарного атеросклероза, единичные (W.Terres et al, 1995; Hartmann et al, 2006). Наши результаты согласуются с работой японских авторов: у больных после инфаркта миокарда выполняли ТБКА (n=51) или стентирование (n=79) Спустя 9 месяцев прогрессирование атеросклероза было отмечалось у 65,8% лиц с ГиперЛп(а) в сравнении 29,3% больных с Лп(а)<30 мг/дл, р<0,01 (Morita Y et al, 2006).. В нашем исследовании также, как в упомянутых, не выявлено корреляции между ускоренной прогрессией коронарного атеросклероза и другими факторами риска.
При проспективном (57±33 мес) наблюдении за 399 больными, перенесшими ЧКВ, зарегистрировано 352 осложнений у 201 (50%) человека. От общего числа осложнений количество смертельных исходов составило 16, из них 13 кардиальных [5% (4%)], нефатальных инфарктов миокарда – 31 (9%), инсультов – 3 (1%), случаев прогрессирования или возобновления стенокардии – 124 (35%), АКШ – 37 (11%), повторной ангиопластики – 80 (23%), ЧКВ другой артерии – 61 (17%). Всего осложнений, не связанных с рестенозом, отмечено 98 (28%) больных, уровень Лп(а) в этой группе был выше, чем у больных без осложнений: 38±4 (23; 6-56) мг/дл и 26±2 12 (5-34), соответственно, р<0,01. У больных с ГиперЛп(а) выявлено большее количество осложнений, чем у больных с Лп(а)<30 мг/дл (63% и 43%, соответственно, р<0,01) и первое осложнение наступало раньше: 25±3 и 34±3 мес соответственно, р=0,02. За 5-летний период наблюдения у 50% больных, перенесших ЧКВ, отмечено одно и более серьезное осложнение, при этом половина событий была обусловлена рестенозирующим процессом Уровень Лп(а) был существенно выше в группе больных с клиническими событиями. Так как механизмы рестеноза различны при разных типах эндоваскулярного вмешательства, мы отдельно анализировали частоту осложнений, не связанных с рестенозом. При построении кривых Каплана-Майера установлено, что у лиц с ГиперЛп(а) после ЧКВ прогноз существенно хуже. р=0,04 (Рис. 7). Относительный риск сердечно-сосудистых осложнений составил 3,61 (95% ДИ 2,56-3,07), р<0,0001. Основную лепту в этот риск вносят события, обусловленные течением процесса в артериях, не подвергнутых ЧКВ [ОР=3,50 (2,35-5,25), р<0,0001], а не те, что связаны с рестенозом [ОР=1,89 (0,76-4,67), р=0,2]. По данным корреляционного анализа следующие показатели также продемонстрировали значимую связь с сердечно-сосудистыми осложнениями после ЧКВ: концентрация ТГ - r=0,151, p=0,003, общего ХС - r=0,119, p=0,018; наличие трехсосудистого поражения - r=0,119, p=0,018; прием статинов r= - 0,110, p=0,031. Другие факторы риска, а также прием различных групп кардиологических препаратов, не ассоциировались с частотой серьезных осложнений.
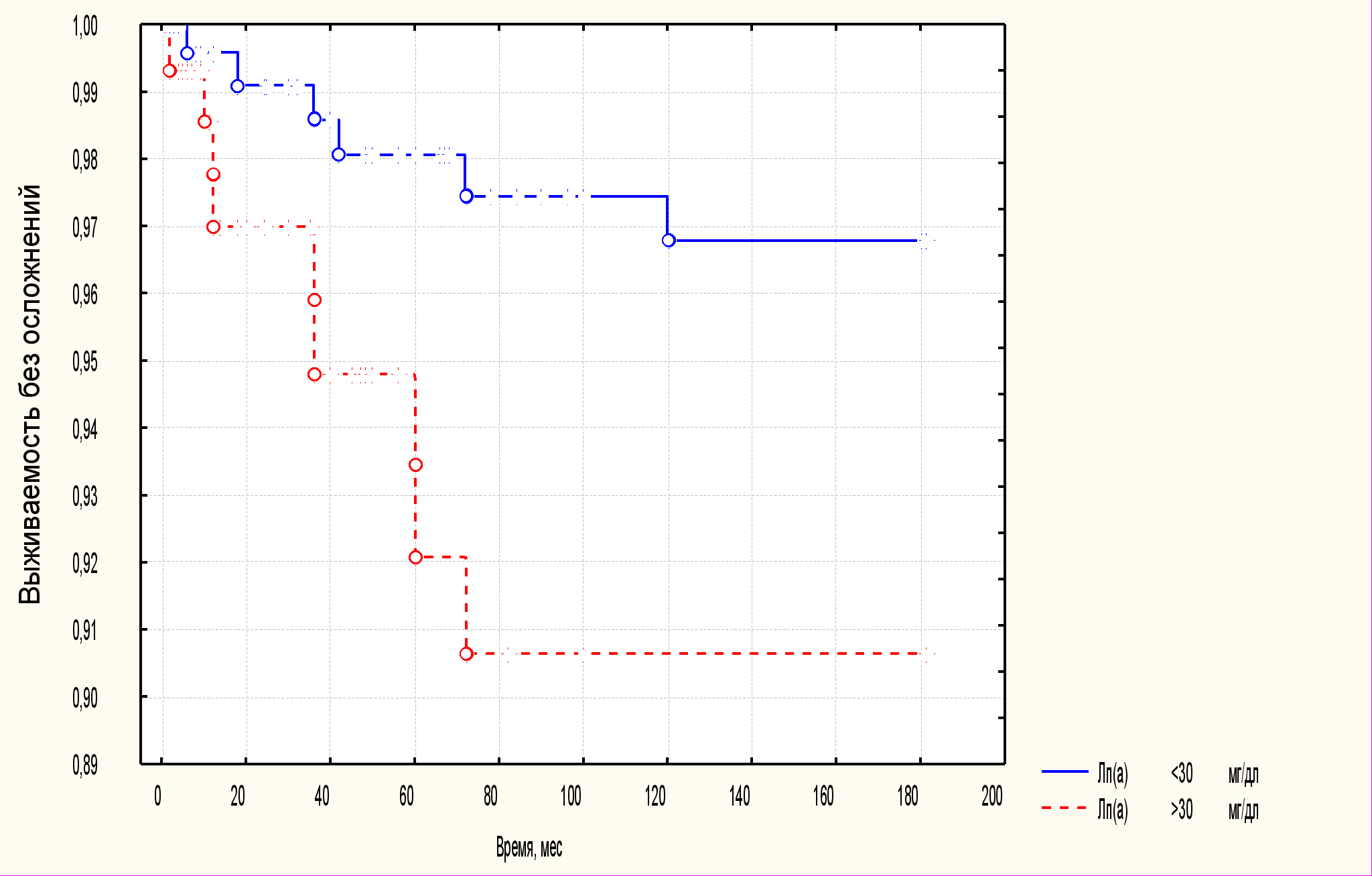
Рис. 7. Кривые выживаемости после ЧКВ в зависимости от уровня Лп(а).
Уровень липопротеида (а) и АКШ.
Из 1621 больных ИБС, включенных в исследование, 361 человек перенесли операцию АКШ (88% мужчин, средний возраст 55±9 лет). После операции обследовали 102 больных, у которых в течение первого года возобновился болевой синдром в грудной клетке. При велоэргометрии у 33 человек были выявлены признаки преходящей ишемии миокарда. Всем пациентам выполнили шунтографию с помощью электронно-лучевой томографии, по результатам которой сформированы две подгруппы: I (n=36, 35%) - с проходимыми венозными анастомозами, II (n=66, 65%) - с окклюзией одного или более шунтов (Табл. 3).
Таблица 3. Характеристика больных с проходимыми и пораженными венозными шунтами.
| | Проходимые шунты n=36 | Окклюзия шунта n=66 | р |
| Возраст, лет | 519 | 539 | >0,1 |
| Срок после КШ, мес. | 5,02,9 | 5,83,0 | >0,1 |
| Курение в настоящем | 10 (26%) | 20 (30%) | >0,1 |
| Семейный анамнез ИБС | 21 (54%) | 41 (61%) | >0,1 |
| Артериальная гипертония | 16 (41%) | 31 (46%) | >0,1 |
| Лечение статинами | 15 (42%) | 12 (18%) | 0,017 |
| Лп(а), мг/дл | 24 5 | 42 5 | < 0,01 |
| ОХС, ммоль/л | 6,2 1,3 | 6,5 1,6 | >0,1 |
| ТГ, ммоль/л | 1,9 1,8 | 1,9 1,2 | >0,1 |
| ХС ЛНП, ммоль/л | 4,41,2 | 4,61,5 | >0,1 |
| ХС ЛНПк, ммоль/л | 4,3 1,2 | 4,3 1,5 | >0,1 |
| ХС ЛВП, ммоль/л | 1,1 0,5 | 1,0 0,4 | >0,1 |
В подгруппе больных с окклюзированными шунтами уровень Лп(а) был достоверно выше: 24 (12-64) мг/дл и 12 (5-28) мг/дл, р=0,007. Кроме того, больных с поражением шунтов было существенно больше в подгруппе с ГиперЛп(а): 32 из 39 (82%) в сравнении с 34 из 63 (54%), если Лп(а)<30 мг/дл, р=0,005. Нами установлено, что пороговый уровень Лп(а), характеризующий окклюзии венозных шунтов, составил 28 мг/дл (чувствительность 49%, специфичность 81%, положительная предсказующая ценность 82%, отрицательная предсказующая ценность - 46%).
Исследование связи между проходимостью шунтов после операции АКШ и различными показателями липидного спектра крови было ретроспективным. В небольших исследованиях с участием 176 больных (Korpilahti K et al, 1998) и 77 больных (Harris M et al, 2004) уровень Лп(а) был связан с окклюзией венозных шунтов по данным шунтографии. Более крупная работа (610 больных) не выявила подобной ассоциации (Eritsland J et al, 1994. Отличие нашего исследования от перечисленных в том, что мы использовали только тех больных, у которых были клинические показания для шунтографии. С этим связана и высокая частота окклюзии венозных шунтов в течение первого года после АКШ (65%). По данным многофакторного анализа, с учетом всех исследованных нами показателей липидного спектра крови и факторов риска ИБС, повышенный уровень Лп(а) является независимым маркером окклюзий аутовенозных шунтов в течение первых 12 месяцев после операции АКШ.
Максимальный период наблюдения за больными, перенесшими АКШ, составил 180 мес, в среднем 68,7±44,3 мес. Всего у 109 из 263 больных зарегистрировано 142 серьезных события, в том числе: 1) смертельные исходы – 34 (24%), из них связанные с операцией – 11 (8%), сердечно-сосудистые – 20 (14%), несердечные – 3 (2%);. 2) нефатальный ИМ – 14 (10%); 3) ЧКВ – 29 (20 %); 4) ре-КШ – 6 (4 %); 5) стенокардия, требующая госпитализации – 53 (37 %); 6) нефатальный инсульт – 4 (3%); 7) нефатальный рак – 2 (1%). Госпитализация в стационар в плановом порядке без каких-либо осложнений не считалась неблагоприятным событием. У больных с наличием осложнений (n=109) выявлены достоверно более высокие уровень Лп(а)
