Приоритетные направления программы Укрепление и сохранение здоровья детей. Развитие воспитательного потенциала с использованием традиций, современного опыта и инноваций. Создание условий для получения качественного образования
| Вид материала | Документы |
- Направления воспитательной работы, 339.27kb.
- Приоритетные направления Программы развития учреждения на 2010 2014 г г. Создание условий, 106.64kb.
- План методической работы Методическая тема школы в 2011-2012 учебном году, 105.33kb.
- Учебный план. Охрана и укрепление здоровья детей (развитие здоровьесберегающих технологий, 1151.72kb.
- Отче т о деятельности российской академии наук в 2002 году, 3624.75kb.
- Доклад начальника му «Управление образования г. Горно-Алтайска», 2021.47kb.
- Опыта, 193.86kb.
- Межведомственной программы «здоровье детей города красноярска на 1999 2000 гг.», 3476.8kb.
- Утвержден приказом Управления образования Вашкинского муниципального района, 291.19kb.
- Задачи мдоу детский сад №7 «Василек» общеразвивающего вида Муниципального района Кинель, 351.25kb.
Азот – "безжизненный" элемент, но важная составная часть жизни на Земле. Урок в 9-м классе с применением ИКТ
Корабельникова Татьяна Анатольевна, учитель химии
Статья отнесена к разделу: Преподавание химии

Объявление
С 26 марта по 23 апреля 2008 года состоялся Первый интернет-марафон учебных предметов для учителей всей страны. Материалы читайте и смотрите на нашем сайте.


 Цели:
Цели: - изучить свойства азота и область его применения на основе строения атома и молекулы;
- формировать умения формулировать проблему, находить пути её решения через самостоятельный поиск информации в учебнике, в Интернете, делать выводы.
Оборудование: презентация Power Point к уроку, ресурсы Интернет (on-lain), учебник “Химия-9” (Кузнецова Н.Е., “Вентана-Граф”, 2001), компьютерный класс.
ХОД УРОКА (таблица)
| | Деятельность учителя | Деятельность учащихся |
| Организационный момент | ||
| | Сегодня мы будем говорить об одном самых из интересных элементов периодической системы, противоречивом азоте. | |
| Вызов а) собственно вызов | ||
| | Чтобы сформулировать тему урока, обратите внимание на информацию на слайдах презентации. Сл.-1 Сл.-2 Сл.-3 Сл.-4 Сл.-5 Предлагаю перейти к слайду “Постановка проблемы” В ходе беседы формулируется тема урока в виде вопроса: Сообщаю, что тема урока и есть та проблема, которую предстоит уч-ся решить. | Почему назвали “азот”? Соединения азота - селитра, азотная кислота, аммиак - были известны задолго до получения азота в свободном состоянии. В 1772 г. Д.Резерфорд, сжигая фосфор и другие в-ва в стеклянном колоколе, показал, что остающийся газ не поддерживает дыхания и горения. Д.Резерфорд назвал его “удушливым воздухом”. К.Шееле назвал этот элемент, извлеченный из воздуха,- “дурным воздухом”. В 1787 г. А.Лавуазье установил, что “жизненный” и “удушливый” газы, входящие в состав воздуха, это простые в-ва, и предложил название “азот”. “А” - отсутствие, “зоо” - жизнь. “Безжизненный”- азот. И не случайно: испытания проводили на лабораторных мышах, помещая их под колпак с азотом, где они погибали. Нахождение в природе. Азот – один из распространенных элементов на Земле. - в атмосфере - 4•1051 по массе и 78% газообразного азота по объёму - литосфере – 1,9•10-3 по массе - в живых организмах - 0,3% по массе В белке животных и человека - 16–17% азота. В организмах человека и плотоядных животных белок образуется за счёт потребляемых белковых в-в травоядных животных и в растениях. “Жизнь - есть способ существования белковых тел на Земле” - по определению Ф.Энгельса Д.Резерфорд –“удушливый воздух” К. Шееле – “дурной воздух” А.Лавуазье – “безжизненный воздух” Д.И.Прянишников – “Нет жизни без азота, ибо он является важнейшей составляющей частью белковой молекулы” Запись темы урока в тетрадь “ Азот – “безжизненный” элемент или важная составная часть жизни на Земле?” |
| б) актуализация знаний | ||
| | Что уже известно из курса изучения химии об азоте? Ответьте на вопросы на следующем слайде. Сл.-6. “Азот – химический элемент” | Учащиеся работают с текстом и заданием на слайде. Азот – химический элемент Положение азота в периодической системе * Ar(N) = ? * 7N +7 ) ) Каково строение атома азота? ? ?
Вывод : какова окислительно-восстановительная способность атома азота? |
| Осмысление 1) постановка учебной задачи | ||
| | Предлагаю учащимся, исходя из проблемы, наметить пути её решения. Сл.-7. Обращаю внимание на необходимость установления связи между строением, св-ми и применением. Предлагаю составить план изучения нового материала. Сл.-8. | Цель урока:
Учащиеся предлагают план изучения строения молекулы, св-в и применения этого в-ва. Содержание: * Азот – простое в-во 1. Строение молекулы 2. Физические св-ва 3. Химические св-ва 4. Способы получения * Применение азота и его значение |
| 2) открытие нового знания | ||
| | Сл.-9. Предлагаю рассмотреть задания на слайде “Строение молекулы азота” Обращаю внимание на оформление сведений об азоте в виде опорного конспекта Сл.-10. Сл.-11. Сл.-12. При переходе к слайду о способах получения обращаю внимание на гиперссылки на сайты в Интернете. Сл.-13. При переходе к слайду “Применение азота” обращаю внимание на гиперссылки на сайт Интернета. | Уч-ся изучают сведения об азоте и строении его молекулы.(Учебник §30) Молекула азота – N2 N = N Напишите электронную формулу молекулы. В обычных условиях в свободном состоянии азот образует молекулу N2, где атомы связаны тремя ковалентными связями. Молекула азота очень устойчива: энергия диссоциации ее на атомы составляет 942,9 кДж/моль, поэтому даже при температуре 3300° степень диссоциации азота составляет 0,1%. Каков вид хим. связи в молекуле азота?  Физические свойства азота Азот немного легче воздуха; плотность 1,2506 кг/м3 (при н.у.), tпл.= - 209,8оС, tкип.= -195,8оС. Азот сжижается с трудом: плотность жидкого азота 800 кг/м3. В воде азот менее растворим чем кислород: при 0оС в 1м3 Н2О растворяется 23,3 г азота. Азот не поддерживает дыхание и горение. Составьте описание физ. св-в N2 в виде уголковой схемы Химические свойства азота К металлам: N2+Li (об.усл.) —> Li3N N2+Mg (об.усл.) —> Mg3N2 N2+Al (to) —> AlN К неметаллам: N2+H2 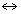 NH3 NH3N2+O2 (2000o) —>NO N2+F2 (эл. разряд) —> NF3 Вывод:
Дома: Составьте уравнения этих реакций с использованием электронного баланса. Способы получения азота: *Лабораторный способ: NH4NO2 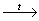 N2+ 2H2O N2+ 2H2O* Промышленный способ Технический способ получения азота основан на разделении предварительно сжиженного воздуха. Интернет —> Азотные установки, азотные станции, генераторы азота Применение азота:
|
| 3) составление алгоритма | ||
| | Под составлением алгоритма в данном уроке предлагаю считать составление опорного конспекта | Учащиеся обмениваются информацией по заполнению конспекта, проверяют друг у друга наличие всех блоков. |
| 4) первичное закрепление | ||
| | Первичное закрепление провожу в виде беседы. Вопросы для беседы задаю те, которые изложены на слайдах презентации | Учащиеся отвечают на вопросы |
| Рефлексия | ||
| | Сл.-14. Данный этап урока провожу в виде самостоятельной работы на 2–3 минуты. Предлагаю записать в тетрадь аргументы в пользу каждой версии. Рабочие тетради собираю на проверку, оцениваю выполненную работу. | Азот – друг или враг?
Учащиеся записывают аргументы в тетрадь. |
| Домашнее задание | ||
| |
| |
