Овчарова Анастасия Никитовна Морфологическая характеристика тонкой и толстой кишки при экспериментальном первичном дисбиозе и его коррекции пробиотиками 03. 03. 04 клеточная биология, цитология, гистология автореферат
| Вид материала | Автореферат |
- Морфофункциональная характеристика пульпы зуба и оценка иммунного статуса при кариесе,, 552.48kb.
- Лимфоидные органы и миокард в системе мать-плод при вибрации, воздействии кадмием, 640.36kb.
- Эколого-морфологическая характеристика репродуктивной активности рыжей полёвки (clethrionomys, 243.57kb.
- Ультраструктурная и цитохимическая характеристика макрофагов, инфицированных рнк-содержащими, 636.4kb.
- Эколого-морфологическая характеристика размножения мелких млекопитающих из популяций,, 635.9kb.
- Закономерности дегенерации и адаптации сетчатки глаз при экспериментальных ретинопатиях,, 745.16kb.
- Экспериментальное обоснование применения нейропептидов в комплексной терапии острого, 259.86kb.
- Цитологические особенности вторичных миелодисплазий при лимфомах 03. 00. 25 гистология,, 526.98kb.
- Морфофункциональная характеристика слизистой оболочки кишечника потомства самок крыс, 303.36kb.
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
1 2
а правах рукописи
Овчарова Анастасия Никитовна
Морфологическая характеристика тонкой и толстой кишки при экспериментальном первичном дисбиозе и его коррекции пробиотиками
03.03.04 – клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва - 2012
Работа выполнена в Федеральном государственном бюджетном учреждении «Научно-исследовательский институт морфологии человека» Российской академии медицинских наук
Научные руководители:
член-корр. РАМН доктор медицинских наук Кактурский Лев Владимирович
доцент, кандидат биологических наук Серебряков Сергей Николаевич
Официальные оппоненты:
доктор биологических наук, доцент ,
ведущий научный сотрудник лаборатории
иммуноморфологии воспаления ФГБУ
«НИИ морфологии человека РАМН» Кондашевская Марина Владиславовна
доктор медицинских наук, профессор, ведущий
научный сотрудник ФБУН «Московский НИИ
эпидемиологии и микробиологии
им. Г.Н. Габричевского» Щербаков Иван Тимофеевич
Ведущая организация: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И.Скрябина»
Защита диссертации состоится «22» марта 2012 года в 14.00 ч. на заседании диссертационного совета Д 001.004.01 при Федеральном государственном бюджетном учреждении «Научно-исследовательский институт морфологии человека» Российской академии медицинских наук (117418, Москва, ул. Цюрупы д.3).
С диссертацией можно ознакомиться в библиотеке Федерального государственного бюджетного учреждения «Научно-исследовательский институт морфологии человека» Российской академии медицинских наук
Автореферат разослан “____” ___________ 2012 года
Ученый секретарь
диссертационного совета
доктор медицинских наук Михайлова Лилия Петровна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность. В желудочно-кишечном тракте человека обитает более 450 видов микроорганизмов, общая биомасса которых у взрослого человека составляет 3-4 кг (Овсянников Д. Ю., 2006). Микробиом рассматривают как дополнительный многоклеточный «орган» человека, состоящий из различных линий клеток, которые взаимодействуют как между собой, так и с организмом хозяина (Martin F.P. et al., 2008). На состав нормальной микрофлоры оказывает влияние ряд факторов: неблагоприятная экологическая обстановка, неправильный рацион питания, психоэмоциональные нагрузки, лекарственные воздействия и др. Дисбиотические состояния выявляют у 80-100% пациентов, страдающих воспалительными заболеваниями кишечника (Friswell M., 2010). Особенно выраженное влияние на микрофлору оказывают химиотерапевтические препараты. Распространение дисбиотических расстройств среди всех возрастных групп населения неуклонно растет. Это приводит к более тяжелому течению соматических заболеваний, изменяет их клинические проявления, затрудняя диагностику и лечение, что диктует необходимость коррекции нарушений состава кишечной микрофлоры. В связи с этим, поиск новых средств и методов коррекции и лечения дисбиотических состояний различного происхождения актуален.
Основными средствами коррекции нарушений количественного и качественного состава кишечной микрофлоры являются пробиотические препараты. Механизм положительного действия пробиотиков основан на подавлении патогенных и условнопатогенных микроорганизмов, нормализации микробного пейзажа за счет продукции биологически активных веществ, влияющих на ферментативную активность желудочно-кишечного тракта и иммунную систему организма хозяина. Наиболее важным свойством пробиотических препаратов является обеспечение колонизационной резистентности, которая определяет характер взаимоотношений пробиотических и индигенных представителей кишечной флоры (Шендеров Б.А., 2001; Бондаренко В.М., Воробьев А.А., 2004;). Механизм этого явления заключается в конкуренции микрофлоры за питательные вещества и участки связывания, а также в выработке нормальной микрофлорой субстанций, ингибирующих рост патогенов (Stecher B. et al., 2010).
Применяемые в настоящее время в клинической практике пробиотические препараты, как отечественные, так и зарубежные, в ряде случаев оказываются недостаточно эффективными, так как их действие зачастую носит транзиторный характер (Семёнов В.А., Терехов В.И., 2007). Действие пробиотиков на организм человека изучено недостаточно. В литературе есть данные о случаях осложнений, вызванных применением некоторых пробиотиков (Андреева И.В., 2007). Некоторые исследователи наблюдали воспалительно-реактивные изменения в желудочно-кишечном тракте после длительного приема пробиотика (Хомякова Т.И. и соавт., 2010). В последние годы наблюдается необоснованно широкое использование пробиотических препаратов, их часто добавляют в продукты питания. В связи с этим необходимо более углубленное изучение действия пробиотиков на организм человека. Наиболее распространенным способом оценки действия пробиотиков является микробиологический метод. Однако, он не позволяет в полной мере оценить эффективность действия пробиотиков на макроорганизм. Одним из наиболее объективных методов оценки эффективности действия пробиотиков является морфологическое исследование с количественной оценкой структурных изменений кишечника. В современной литературе сведения о морфологических изменениях желудочно-кишечного тракта при приеме пробиотиков представлены фрагментарно. На качественном светооптическом уровне описано влияние пробиотиков на слизистую оболочку тонкой и толстой кишки, печень, лимфоидные образования кишечника (Щербакова Э.Г., 1998; Калмыкова А.И. и соавт., 2005; Афонюшкин В.Н. и соавт., 2007; Манухина А.И. и соавт., 2001). В литературе отсутствуют работы по комплексной оценке действия пробиотиков на морфологическую структуру тонкой и толстой кишки и органов иммунной системы при первичных дисбиозах.
Цель. Изучение морфологических изменений тонкой и толстой кишки, печени, органов иммунной системы и микробиома при экспериментальном первичном дисбиозе и его коррекции пробиотиками.
Задачи:
- Воспроизвести у мышей линии Balb/с первичное дисбиотическое состояние с помощью внутрижелудочного введения смеси антибиотиков канамицина и тетрациклина.
- Провести оценку изменений микробиома при первичном экспериментальном дисбиозе, вызванном введением антибиотиков, и при его коррекции пробиотиками энтероцина и колибактерина.
- Исследовать количественные и качественные морфологические изменения тонкой и толстой кишки при первичном экспериментальном дисбиозе, вызванном антибиотиками, и при его коррекции пробиотиками энтероцином и колибактерином.
- Изучить морфологические изменения печени и органов иммунной системы при первичном экспериментальном дисбиозе, вызванном антибиотиками, и при его коррекции пробиотиками энтероцином и колибактерином.
- На основании исследований морфологических изменений тонкой и толстой кишки, печени, органов иммунной системы и микробиома дать сравнительную оценку действия пробиотиков энтероцина и колибактерина при коррекции первичного дисбиотического состояния.
Положения, выносимые на защиту:
- После внутрижелудочного введения антибиотиков широкого спектра действия у половозрелых самцов мышей Balb/с развивается первичное дисбиотическое состояние, которое, по данным морфологического исследования, сопровождается реактивными изменениями тонкой, толстой кишки, печени и органов иммунной системы.
- Курсовое введение пробиотиков энтероцина или колибактерина частично восстанавливает микрофлору, при этом снижается выраженность реактивных морфологических изменений в тонкой, толстой кишке, печени и органах иммунной системы.
- В отдаленные сроки исследования при применении пробиотиков нормализуется морфофункциональное состояние тонкой, толстой кишки, печени и органов иммунной системы; при этом, после применения энтероцина происходит восстановление микрофлоры, а после колибактерина дисбаланс просветной микрофлоры сохраняется.
Научная новизна. На основании экспериментального морфологического, морфометрического и микробиологического исследования установлено, что развитие первичного дисбиотического состояния, индуцированного введением терапевтических доз антибиотиков широкого спектра действия, сопровождается реактивными изменениями тонкой, толстой кишки, печени, тимуса и селезенки.
Впервые проведено сравнительное исследование влияния курсового введения индигенного штамма пробиотика энтероцина и чужеродного данному виду пробиотика колибактерина на тонкую, толстую кишку, печень и органы иммунной системы. Установлено, что индигенный штамм – энтероцин приводит к нормализации микрофлоры, а чужеродный данному виду – колибактерин не нормализует дисбиотическое состояние. При применении обоих пробиотиков сохраняются реактивные изменения тонкой, толстой кишки, печени, тимуса и селезенки, которые через 30 сут после курсового введения препаратов нивелируются, однако реактивные изменения в толстой кишке сохраняются.
Практическая значимость. Полученные экспериментальные данные о развитии при первичном дисбиотическом состоянии, индуцированном введением терапевтических доз антибиотиков, реактивных изменений не только толстой, но и тонкой кишки, печени и органов иммунной системы, следует учитывать при разработке лечебных мероприятий по коррекции нарушений микробиоценоза.
Данные о морфологических изменениях в органах пищеварительной и иммунной систем организма, а также динамических изменениях микробиома под влиянием пробиотиков следует учитывать при доклинической оценке эффективности новых пробиотических препаратов.
Внедрение в практику. Результаты исследования внедрены в работу лаборатории генно-инженерных препаратов Государственного научного учреждения «НИИ пушного звероводства и кролиководства им. В.А. Афанасьева» Российской академии сельскохозяйственных наук.
Апробация результатов исследования.
Основные положения диссертации представлены в докладах на научной конференции «Актуальные вопросы морфогенеза в норме и патологии» (Москва, 2008), международной научной конференции «Пробиотики и пребиотики» (Словакия, 2011), межлабораторной конференции в НИИ морфологии человека РАМН (Москва, 2011).
Публикации материалов исследования.
По материалам исследования опубликовано 5 научных работ, из них 2 в изданиях, рекомендованных ВАК РФ.
Объем и структура диссертации
Диссертация состоит из введения и четырех глав: обзор литературы, материалы и методы исследования, результаты собственных исследований, обсуждение полученных результатов и практические рекомендации; выводы и список литературы. Работа изложена на 143 страницах машинописного текста и проиллюстрирована 17 рисунками и 32 таблицами. Библиографический указатель включает 124 источника (63 отечественных и 61 иностранных).
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В работе использованы 90 мышей - самцов линии BALB/c массой тела 18–20 г. При работе с экспериментальными животными руководствовались приказом Минздрава СССР №755 от 12.08.1977. На проведение экспериментов было получено разрешение биоэтической комиссии НИИ морфологии человека РАМН (протокол №5 от 15.09.2006).
Животные были разделены на 5 экспериментальных групп и 4 контрольных по 10 мышей в каждой группе. Контрольной группе мышей вводили 50 мкл физиологического раствора. С целью моделирования первичного дисбиотического состояния мышам всех экспериментальных групп, кроме контрольной, вводили внутрижелудочно смесь антибиотиков тетрациклина и канамицина в течение 14 дней ежедневно в дозе 250 мг/кг. После курса антибиотиков одну группу мышей выводили из опыта, две другие группы мышей получали пробиотик энтероцин, и две группы - колибактерин внутрижелудочно в течение 14 дней ежедневно в дозах 3х109 КОЕ. После курса пробиотиков 10 мышей, получавших колибактерин и 10 мышей, получавших энтероцин, выводили из опыта. Оставшихся мышей после курса антибиотиков и коррекции дисбиоза энтероцином и колибактерином содержали 30 сут в стандартных условиях вивария для изучения пролонгированного действия пробиотиков. Мышей выводили из эксперимента передозировкой диэтилового эфира. Забирали кусочки подвздошного отдела тонкой кишки, слепого отдела толстой кишки, печени, органов иммунной системы (тимуса, селезенки). Кусочки тонкой, толстой кишки и печени фиксировали в 10% растворе забуференного формалина, тимус, селезенку – в растворе Буэна, заливали в парафин, изготавливали срезы толщиной 4–5 мк и окрашивали их гематоксилином и эозином, кроме этого, кусочки тонкой и толстой кишки окрашивали ШИФФ-реактивом. Проводили морфометрическое исследование гистологических препаратов тонкой, толстой кишки, печени, тимуса, селезенки. Для количественного и качественного анализа просветной микрофлоры применяли бактериологический метод с использованием селективных питательных сред: среда Эндо, агар Мак-Конки, энтерококк-агар, среда MRS, бифидум-агар. Для обработки полученных данных использовалась программа Statistika 6.0. Статистическая достоверность определялась по t-критерию Стьюдента .
Результаты исследования и их обсуждение
Состав просветной микрофлоры и морфологические изменения тонкой, толстой кишки, печени и органов иммунной системы после курсового введения антибиотиков
Состав микрофлоры толстой кишки у мышей линии Balb/с по качественному и количественному составу нормофлоры отличался от имеющихся в литературе данных для Mus musculus (Гайдеров А.А., 2007; Нечай В.В. и соавт., 2011; Абдулаева С.О. и соавт., 2011).
Количество ферментирующих эшерихий колебалось в пределах от 6*104 до 2,5*105 КОЕ/г при высоком содержании неферментирующих форм и других представителей семейства Enterobacteriaceae, тогда как нормальным считается их содержание в пределах 106 – 107 КОЕ/г. Количество энтерококков было увеличено - 1,6*106 -1,2*107 при норме 105 - 106. Число же лактобацилл и бифидобактерий было снижено более чем на два порядка (рис. 1).
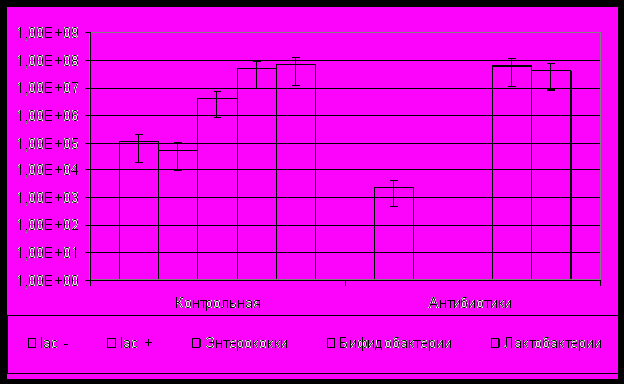
*- различия статистически значимы по сравнению с контрольной группой
*
1
2
3
4
5
1
2
3
4
5
1-
2-
3-
4-
5-
Рис. 1. Качественный и количественный состав просветной микрофлоры мышей BALB/c после курсового введения антибиотиков
Полученные результаты можно объяснить высокой степенью индивидуальной специфичности микробиома в зависимости от условий содержания, сезона и возраста животных, а также особенностями иммунной системы мышей линии Balb/с, у которых преобладает T-хелпер 2 (гуморальный) тип иммунного ответа (Трунова Г.В., 2011). Индивидуальные значения количества микроорганизмов, составляющих ядро микробиома, могут значительно отличаться между особями, при этом оставаясь достаточно постоянными в течение всей жизни (Dore J., 2010). Кроме того, микрофлора, оказывая влияние на иммунную систему, находится под ее жестким контролем, в связи с чем следовало ожидать, что нормальные показатели микрофлоры у мышей линии Balb/с будут отличны от таковых у беспородных мышей или мышей других линий.
Введение антибиотиков широкого спектра действия канамицина и тетрациклина вызвало значительные изменения состава микрофлоры толстой кишки. Наиболее выраженные изменения выявлялись среди «нормальных» - ферментирующих форм кишечной палочки, которые практически не обнаруживались у экспериментальных животных. Менее выраженные изменения наблюдались среди неферментирующих E. coli и других условно-патогенных энтеробактерий (рис. 1). Причиной большей устойчивости условно-патогенных энтеробактерий к действию антибиотиков является, на наш взгляд, наличие в их геномах генов лекарственной устойчивости, входящих в состав так называемых «островов и островков патогенности» (Бондаренко В.М., 2001). Локализованные на бактериальных плазмидах, «островки патогенности» получили широкое распространение в популяциях патогенных и условно-патогенных микроорганизмов за счет их горизонтального переноса в пределах не только вида, но и между представителями различных родов и даже семейств (Козловский Ю.Е. и соавт., 2007). Выраженные изменения выявлены в группе кокков. Так, энтерококки Enterococcus faecium и Enterococcus faecalis высевались только у мышей контрольной группы (рис. 1). Выявленные у мышей после применения антибиотиков изменения микробиома коррелируют с изменениями при дисбиозе у человека (Кононенко В.В. и соавт., 1998). Представители других систематических групп – бифидобактерии и лактобациллы, оказались менее чувствительны к действию антибиотических препаратов (рис. 1). Подобная стабильность количественного состава лактобацилл и бифидобактерий и их устойчивость к действию антибиотиков in vivo, наблюдавшаяся нами в эксперименте, соответствует результатам, полученным другими авторами (Колганова Т.В., 2003; Гатаулшин А.Г.,2005).
Таким образом, по данным анализа основных представителей просветной микрофлоры толстой кишки экспериментальных животных после курсового введения канамицина и тетрациклина, становится очевидным, что антибиотики оказали выраженное угнетающее воздействие на микробиоценоз, присущий в норме желудочно-кишечному тракту мышей Balb/с. Наблюдаемые у мышей изменения качественного и количественного состава просветной микрофлоры – элиминация отдельных и снижение численности ряда других представителей нормофлоры, а также частичное замещение их на апатогенную микрофлору можно расценивать, как первичное дисбиотическое состояние.
Морфологические изменения тонкой кишки у мышей с первичным дисбиотическим состоянием характеризовались гипертрофией и гиперплазией (увеличением объемной доли) слизеобразующих бокаловидных клеток, повышением показателя содержания нейтрофилов среди клеточных элементов собственной пластинки слизистой оболочки, увеличением количества межэпителиальных лимфоцитов (табл. 1).

В толстой кишке мышей после курсового введения антибиотиков при морфометрическом исследовании выявлено достоверное увеличение толщины слизистой оболочки, увеличение числа нейтрофилов в собственной пластинке слизистой оболочки и увеличение объемной доли бокаловидных клеток (табл. 2).
Таблица 1. Морфометрическая характеристика слизистой оболочки тонкой кишки мышей Balb/с при первичном дисбиозе и его коррекции пробиотиками
| № | Группа Наблюдений | Объемная плотность собственной пластинки слизистой оболочки, (%) | Кол-во Нейтро-филов в п/з) | Кол-во МЭЛ (на 100 эп-в) | ||||
| Бокаловид-ные клетки | Эпителиаль-ные клетки | Клетки стромы | Строма | |||||
| 1 | Контроль | 0,6±0,2 | 91,8±0,9 | 2,0±0,4 | 5,0±0,5 | 1,8±0,4 | 2,7±0,33 | |
| 2 | Антибиотики | 1,3±0,2 | 90,2±1,9 | 3,4 ±0,5 | 5,1±0,9 | 4,3±0,5 | 3,9±0,48 | |
| 3 | Пробиотик Энтероцин | 0,6±0,2 | 93,7±0,7 | 1,5 ±0,4 | 4,2±0,6 | 3,9±0,6 | 8,1±0,45 | |
| 4 | Пробиотик Колибактерин | 0,8 ±0,2 | 92,5±0,7 | 1,4±0,3 | 5,3±0,5 | 3,5±0,7 | 4,2 ± 0,5 | |
| 5 | Через 30 сут после окончания введения Энтероцина | 0,3±0,1 | 92,4±0,6 | 2,7±0,4 | 4,6±0,2 | 2,8±0,6 | 2,6± 0,3 | |
| 6 | Через 30 сут после окончания введения Колибактерина | 0,8 ±0,2 | 92,8±0,4 | 2,8±0,2 | 3,6±0,2 | 1,8±0,4 | 1,2± 0,1 | |
| Достоверность различий | 1-2 1-3 1-4 1-5 1-6 3-4 5-6 | < 0,01 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 < 0,05 | > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 | <0,05 > 0,05 > 0,05 < 0,05 < 0,05 > 0,05 > 0,05 | > 0,05 > 0,05 > 0,05 > 0,05 <0,05 > 0,05 > 0,05 | < 0,01 < 0,05 <0,05 > 0,05 > 0,05 > 0,05 > 0,05 | < 0,05 < 0,01 < 0,01 > 0,05 < 0,01 < 0,01 < 0,01 | |
В печени мышей после курсового введения антибиотиков балочное и дольковое строение сохранено, гепатоциты с зернистой эозинофильной цитоплазмой. При морфометрическом исследовании выявлено достоверное снижение числа внутридольковых лимфоцитов и неэпителиальных клеточных элементов (табл. 3).
В тимусе мышей после курсового введения антибиотиков определялось очаговое опустошение коркового слоя, граница между корковым и мозговым слоем была очагово-нечеткая. При морфометрическом исследовании показатель отношения коркового слоя к мозговому был достоверно ниже контрольного (табл.4).
В селезенке мышей после курса антибиотиков преобладала белая пульпа, часть лимфоидных узелков была со светлыми центрами, зона ПАЛМ выражена слабо. При морфометрическом исследовании селезенки выявлено достоверное увеличение показателя объемной доли светлых центров лимфоидных узелков и снижение зоны ПАЛМ (табл. 5). Эти данные частично совпадают с результатами других исследователей. В исследовании
Таблица 2. Морфометрическая характеристика слизистой оболочки толстой кишки мышей Balb/с при первичном дисбиозе и его коррекции пробиотиками
| № | Группа наблюдений | Объемная плотность (%) | Кол-во нейтрофилов в поле зрения | Толщина слизистой оболочки в мкм | ||||
| Бокаловидные клетки | Эпителиальные клетки | Клетки стромы | Строма | |||||
| 1 | Контроль | 2,6±0,4 | 87,1 ±3,4 | 1,3±0,4 | 9,0±0,1 | 0,7±0,3 | 181,2±6,4 | |
| 2 | Антибиотики | 8,6±1,5 | 70,0±4,1 | 7,4 ±1,4 | 14,0±2,1 | 3,0 ±0,6 | 222,6±6,0 | |
| 3 | Пробиотик энтероцин | 8,2±0,7 | 80,6±3,4 | 3,2 ±0,4 | 8,0±0,8 | 3,0 ±0,9 | 168,1±4.2 | |
| 4 | Пробиотик колибактерин | 5,8 ±0,7 | 81,1±3,0 | 4,0±0,5 | 9,1±0,8 | 2,3 ±0,8 | 170,0±6,0 | |
| 5 | Через30сут после окончания введ. энтероцина | 4,9±1,0 | 86,7 ±3,2 | 3,4±0,2 | 5,0±0,4 | 2,7 ±1,1 | 146,0±3,5 | |
| 6 | Через 30 сут после оконч.введ. колибактерина | 5,2±1,2 | 84,5±2,0 | 3,3±0,3 | 7,0±0,5 | 2,6 ±0,6 | 140,0±2,0 | |
| Достоверность различий | 1-2 1-3 1-4 1-5 1-6 3-4 5-6 | < 0,01 < 0,01 < 0,01 < 0,05 < 0,05 < 0,05 > 0,05 | < 0,01 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 | < 0,01 < 0,01 < 0,01 < 0,01 < 0,01 > 0,05 > 0,05 | < 0,05 > 0,05 > 0,05 < 0,01 < 0,01 > 0,05 > 0,05 | < 0,05 < 0,05 < 0,05 < 0,05 < 0,05 > 0,05 > 0,05 | < 0,01 > 0,05 > 0,05 < 0,01 < 0,01 > 0,05 > 0,05 | |
Э.Г. Щербаковой (1998) при введении больших доз антибиотиков в слизистой оболочке тонкой кишки у крыс наблюдали морфологические признаки токсического энтерита с увеличением числа межэпителиальных лимфоцитов, уменьшением объемной доли бокаловидных клеток. По данным И.А. Дьяченко (2007) при гистологическом исследовании толстой кишки крыс после перорального введения ампициллина в дозе 500 мг/кг в течение 14 сут выявлена картина токсического колита, характеризовавшаяся дистрофией поверхностных эпителиоцитов и полнокровием сосудов. По данным Т.И. Хомяковой с соавт. (2010) при внутрижелудочном введении имипенема мышам отмечались реактивные изменения структуры селезенки: опустошение белой пульпы, уменьшение толщины коркового слоя. В тонкой кишке наблюдались выраженные реактивные изменения: гипертрофия и гиперплазия бокаловидных клеток, отек и инфильтрация собственной пластинки слизистой оболочки лейкоцитами и нейтрофилами. По данным Н.М. Грачевой с соавт. (2007) при дисбактериозах у человека наблюдается морфологическая картина катарального колита, характеризующегося увеличением числа
Таблица 3. Количество лимфоцитов и неэпителиальных клеточных элементов в печени мышей Ваlb/c при первичном дисбиозе и его коррекции пробиотиками
| № | Группа Наблюдений | Количество клеточных элементов в поле зрения х 900 | |||
| Лимфоциты | Нейтрофилы | Неэпителиальные элементы (НПЭ) | |||
| 1 | Контроль | 1,2 ± 0,1 | 0,6 ±0,2 | 11,0 ±1,0 | |
| 2 | Антибиотики | 0,3 ± 0,1 | 1,0 ±0,3 | 5,0 ±0,6 | |
| 3 | Пробиотик колибактерин | 2,0 ± 0,1 | 0,9 ±0,3 | 12,1 ±0,9 | |
| 4 | Пробиотик энтероцин | 0,5 ± 0,1 | 0,8 ± 0,1 | 12,0 ±1,0 | |
| 5 | Через 30 сут после оконч. введения колибактерина | 0,6 ±0,2 | 0,2 ±0,1 | 9,2 ±0,8 | |
| 6 | Через 30 сут после оконч. введения энтероцина | 0,4 ± 0,1 | 0,3 ± 0,1 | 9,7 ±1,0 | |
| Достоверность различий | 1-2 1-3 1-4 1-5 1-6 2-3 2-4 3-4 5-6 | < 0,01 > 0,05 < 0,01 < 0,01 < 0,01 < 0,01 > 0,05 < 0,01 > 0,05 | > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 | < 0,01 > 0,05 > 0,05 > 0,05 > 0,05 < 0,01 < 0,01 >0,05 > 0,05 | |
бокаловидных клеток, объемной плотности клеточного инфильтрата в собственной пластинке слизистой оболочки.Таким образом, после курсового внутрижелудочного введения смеси тетрациклина и канамицина мышам Balb/с у них развивалось первичное дисбиотическое состояние, которое характеризовалось изменениями в группах энтеробактерий и энтерококков, при сохранении бифидо- и лактофлоры. Первичное дисбиотическое состояние сочеталось с реактивными морфологическими изменениями тонкой, толстой кишки, печени и иммунной системы.
Таблица 4. Морфометрическая характеристика тимуса мышей Balb/с при первичном дисбиозе и его коррекции его пробиотиками
| № | Группа наблюдений | Объемная доля функциональных зон тимуса (%) | Соотношение К/М | ||
| Корковый слой | Мозговой слой | ||||
| 1 | Контроль | 72,5 ± 2,3 | 27,5 ± 2,3 | 2,9 ±0,4 | |
| 2 | Антибиотики | 63,6 ±1,3 | 36,3± 1,3 | 1,8± 0,1 | |
| 3 | Пробиотик энтероцин | 63,5 ± 1,4 | 36,5 ±1,4 | 1,8 ± 0,1 | |
| 4 | Пробиотик колибактерин | 73,3 ± 2,1 | 26,7±2,1 | 3,0 ±0,3 | |
| 5 | Через30 сут после оконч. введения энтероцина | 68,4 ±1,4 | 31,6 ± 1,5 | 2,3 ±0,1 | |
| 6 | Через 30 сут после оконч. введения колибактерина | 67,0 ±1,5 | 33,0 ± 1,4 | 2,1±0,1 | |
| Достоверность различий | 1-2 1-3 1-4 1-5 1-6 3-4 5-6 | < 0,05 < 0,05 > 0,05 > 0,05 > 0,05 < 0,05 > 0,05 | < 0,05 < 0,05 > 0,05 > 0,05 > 0,05 < 0,05 > 0,05 | < 0,05 < 0,05 > 0,05 > 0,05 > 0,05 < 0,05 > 0,05 | |
