Овчарова Анастасия Никитовна Морфологическая характеристика тонкой и толстой кишки при экспериментальном первичном дисбиозе и его коррекции пробиотиками 03. 03. 04 клеточная биология, цитология, гистология автореферат
| Вид материала | Автореферат |
| Состав просветной микрофлоры и морфологические изменения тонкой, толстой кишки, печени и органов иммунной системы через 30 сут п Список работ, опубликованных по теме диссертации |
- Морфофункциональная характеристика пульпы зуба и оценка иммунного статуса при кариесе,, 552.48kb.
- Лимфоидные органы и миокард в системе мать-плод при вибрации, воздействии кадмием, 640.36kb.
- Эколого-морфологическая характеристика репродуктивной активности рыжей полёвки (clethrionomys, 243.57kb.
- Ультраструктурная и цитохимическая характеристика макрофагов, инфицированных рнк-содержащими, 636.4kb.
- Эколого-морфологическая характеристика размножения мелких млекопитающих из популяций,, 635.9kb.
- Закономерности дегенерации и адаптации сетчатки глаз при экспериментальных ретинопатиях,, 745.16kb.
- Экспериментальное обоснование применения нейропептидов в комплексной терапии острого, 259.86kb.
- Цитологические особенности вторичных миелодисплазий при лимфомах 03. 00. 25 гистология,, 526.98kb.
- Морфофункциональная характеристика слизистой оболочки кишечника потомства самок крыс, 303.36kb.
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
1 2
Таблица 5. Морфометрическая характеристика функциональных зон селезенки мышей Balb/с при первичном дисбиозе и его коррекции пробиотиками
| № | Группа наблюдений | Объемная доля функциональных зон селезенки | Соотно-шение БП/КП | ||||
| Лимфоидные фолликулы | Светлый центр | ПАЛМ | Красная пульпа | ||||
1 | Контроль | 35,9±2,0 | 9,6±0,9 | 19,3±1,3 | 44,8± 2,1 | 1,2 ± 0,2 | |
| 2 | Антибиотики | 40,0 ±1,9 | 17,2± 1,2 | 14,7± 1,7 | 45,3± 2.0 | 1,2±0,1 | |
| 3 | Пробиотик Энтероцин | 42,8± 3,3 | 18,3 ±1,5 | 13,4± 0,9 | 43,8± 2,9 | 1,3±0,3 | |
| 4 | Пробиотик колибактерин | 35,6 ±1,5 | 21,9± 1,2 | 15,3± 0,6 | 49,1± 2,3 | 1,0±0,2 | |
| 5 | Через30сут после оконч.введ. энтероцина | 37,6± 4,6 | 18,8 ±3,3 | 16,3 ±1,4 | 46,1± 2,2 | 1,1±0,1 | |
| 6 | Через30сут после оконч.введ. колибактерина | 37,8 ±5,9 | 22,2± 2,1 | 15,7± 1,1 | 46,5± 2,5 | 1,1±0,03 | |
| Достовер-ность различий | 1-2 1-3 1-4 1-5 1-6 3-4 5-6 | >0,05 >0,05 >0,05 >0,05 >0,05 >0,05 >0,05 | <0,01 <0,01 <0,01 <0,01 <0,01 >0,05 >0,05 | <0,05 <0,01 <0,05 >0,05 >0,05 >0,05 >0,05 | >0,05 >0,05 >0,05 >0,05 >0,05 >0,05 >0,05 | > 0,05 > 0,05 > 0,05 >0,05 >0,05 > 0,05 > 0,05 | |
Состав просветной микрофлоры и морфологические изменения тонкой, толстой кишки, печени и органов иммунной системы после курсового введения пробиотиков
После коррекции первичного дисбиотического состояния пробиотиками энтероцин и колибактерин состав просветной микрофлоры мышей изменился: нормализовалось количество энтеробактерий, появились ферментирующие эшерихии, что отражает частичное восстановление микробиома (рис. 2).

*- различия статистически значимы по сравнению с контрольной группой
*
*
*
*
*
*
*
*
*
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
1-
2-
3-
4-
5-
Рис. 2. Количественный и качественный состав просветной микрофлоры мышей BALB/c после курсового введения антибиотиков и после коррекции первичного дисбиоза пробиотиками энтероцин и колибактерин
На основании полученных данных нельзя сказать, что введенные мышам Balb/с пробиотические штаммы колонизировали кишечник, поскольку их способность к колонизации в суспензионной форме подвергается сомнению (Del Piano M., 2010). В связи с этим, определяемые в фекалиях ферментирующие энтеробактерии могут в действительности иметь источником пробиотический штамм, который, проходя через желудочно-кишечный тракт, активно выделяет метаболиты, позитивно действующие на барьерную функцию кишечника. Тем не менее, после курса пробиотиков, количество ферментирующих эшерихий в составе просветной микрофлоры практически сравнялось с таковым в контрольной группе животных. Возросло количество бифидобактерий и лактобацилл после введения колибактерина, после энтероцина количество как бифидо-, так и лактобактерий снижалось. Неоднозначные результаты были получены среди представителей рода Enterococcus. У животных контрольной группы статистически достоверные изменения качественного и количественного состава энтерококков на всех стадиях эксперимента не фиксировались. В группе животных, получавших пробиотик энтероцин, наблюдалось восстановление количества энтерококков. В группе мышей, получавшей колибактерин, представители рода Enterococcus в составе просветной микрофлоры обнаружены не были (Рис. 2), что может быть связано наличием антагонистических взаимодействий между ними и пробиотическим штаммом. Данные в пользу этого предположения были получены в опытах in vitro при длительном совместном культивировании в бинарных культурах на плотной питательной среде штамма E.coli M17 (штамм, на основе которого был создан колибактерин) и индигенных энтерококков (Чертович Н.Ф. с соавт., 2008).
В слизистой оболочке тонкой кишки мышей после коррекции дисбиоза при гистологическом исследовании патологических изменений не выявлялось. При морфометрическом исследовании показатель объемной доли бокаловидных клеток достигал контрольных значений. Число межэпителиальных лимфоцитов в группе мышей, получавших энтероцин, статистически значимо увеличивалось, а в группе, получавшей колибактерин, достоверно не изменялось, число нейтрофилов в собственной пластинке слизистой оболочки достоверно не менялось относительно мышей после курса антибиотиков (табл. 1). Это отражает реактивные изменения тонкой кишки в ответ на введение пробиотика и коррелирует с данными других исследователей (Калмыкова А.И. с соавт., 2005).
В слизистой оболочке толстой кишки мышей после курсового введения пробиотиков при гистологическом исследовании выявлялось большое количество бокаловидных клеток, в собственной пластинке слизистой оболочки определялась слабо выраженная очаговая инфильтрация клеточными элементами. По данным морфометрического исследования толщина слизистой оболочки толстой кишки после курса обоих пробиотиков была достоверно ниже, чем в группе мышей после курса антибиотиков, показатели достоверно не отличались от контроля. Показатель объемной доли бокаловидных клеток у мышей, получавших энтероцин, достоверно не изменялся; у мышей, получавших колибактерин, достоверно снижался, но не достигал контрольных значений. Число нейтрофилов статистически значимо не отличалось от такового у мышей после курса антибиотиков (табл. 2). По данным В.Н. Афонюшкина с соавт. (2007) у крыс после введения пробиотика SL-бактерина на фоне антибиотик-индуцированного дисбиоза наблюдалась гипертрофия и гиперплазия бокаловидных клеток в тонкой кишке, увеличивалась толщина слизистой оболочки толстой кишки и отмечалась воспалительная инфильтрация ее стромы. В исследовании И.Т. Щербакова (1999) при применении пробиотика бифидумбактерина у человека при острых кишечных инфекциях различной этиологии выявилась нормализация показателя толщины собственной пластинки слизистой оболочки толстой кишки, числа межэпителиальных лимфоцитов, уменьшалась выраженность воспалительной инфильтрации слизистой оболочки.
В печени мышей после коррекции дисбиоза пробиотиками энтероцином и колибактерином выявлялась умеренно выраженная гиалиново-капельная дистрофия гепатоцитов, преимущественно периферических отделов долек. При морфометрическом исследовании число внутридольковых лимфоцитов в группе мышей, получавших энтероцин, было достоверно ниже контрольных значений, а в группе, получавшей колибактерин, статистически значимо не изменялось. Показатель содержания неэпителиальных клеточных элементов по ходу печеночных балок по сравнению с группой мышей, получавших антибиотики, достоверно возрастал и не отличался от контроля (табл. 3).
В тимусе после коррекции нарушений состава микрофлоры энтероцином, выявлялось очаговое опустошение коркового слоя, а после применения колибактерина отмечалось его расширение. При морфометрическом исследовании тимуса после применения энтероцина показатель отношения коркового слоя к мозговому был достоверно ниже контрольных значений, и не отличался от группы мышей после курса антибиотиков. В группе мышей, получавшей колибактерин, этот показатель достигал контрольных значений (табл. 4).
В селезенке при гистологическом исследовании после применения пробиотика энтероцина преобладала белая пульпа, большая часть лимфоидных узелков была со светлыми центрами, зона ПАЛМ слабо выражена. После применения колибактерина, в селезенке также преобладала белая пульпа, в большинстве лимфоидных узелков определялись крупные зародышевые центры, зона ПАЛМ, также как и в группе, получавшей энтероцин, была выражена слабо. При морфометрическом исследовании после применения энтероцина объемная доля светлых центров и зоны ПАЛМ не отличалась от группы, получавшей антибиотики. После применения колибактерина увеличивался показатель объемной доли светлых центров лимфоидных узелков, показатель объемной доли зоны ПАЛМ достоверно не менялся по сравнению с мышами после курса антибиотиков (табл. 5).
Состав просветной микрофлоры и морфологические изменения тонкой, толстой кишки, печени и органов иммунной системы через 30 сут после курсового введения пробиотиков
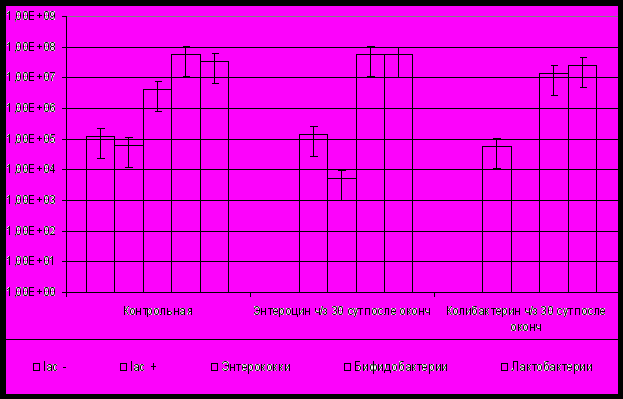
При изучении действия пробиотиков энтероцина и колибактерина через 30 сут после окончания коррекции первичного дисбиотического состояния в составе просветной микрофлоры мышей произошли следующие изменения: в группе мышей, получавших энтероцин, качественный и количественный состав микрофлоры нормализовался (рис. 3). Тогда как у мышей, получавших колибактерин, не обнаруживались характерные для нормофлоры представители рода Enterococcus. В обеих группах мышей, получавших энтероцин и колибактерин, наблюдалось замещение условнопатогенных неферментирующих энтеробактерий нормальными, ферментирующими эшерихиями, но в группе, получавшей энтероцин, количество последних было на порядок больше, чем в группе, получавшей колибактерин (рис. 3). Объяснением этому факту может служить то, что оба пробиотика обладают значительным антагонизмом по отношению к систематически близким энтеробактериям и способны эффективно вытеснять их из состава микробиоты. В то же время, штамм E. coli M 17, на основе которого создан колибактерин, в отличие от штамма E. coli EB 429, послужившего основой для разработки энтероцина, не обладает достаточной адгезией к эпителию кишечника мыши и постепенно элиминируется из желудочно-кишечного тракта подопытных животных. Следствием этого было более низкое содержание ферментирующих эшерихий в группе мышей, получавших колибактерин. Количество бифидобактерий и лактобактерий в группе, получавшей энтероцин, достигло контрольных значений, в группе, получавшей колибактерин, количество бифидо- и лактобактерий понизилось.
При гистологическом исследовании слизистой оболочки тонкой кишки на 30-е сут после курсового введения колибактерина и энтероцина, показатели объемной доли бокаловидных клеток нормализовались. Число межэпителиальных лимфоцитов после применения энтероцина соответствовало контрольным значениям, а после применения колибактерина этот показатель был меньше контрольных значений. Показатель числа нейтрофилов после коррекции дисбиоза энтероцином и колибактерином нормализовался (табл. 1). В слизистой оболочке толстой кишки реактивные изменения сохранялись – толщина слизистой оболочки была ниже контрольных значений, выраженность гиперплазии бокаловидных клеток значительно уменьшалась, однако не достигала контрольных значений, сохранялась слабо выраженная инфильтрация собственной пластинки слизистой оболочки лимфоцитами, гистиоцитами и единичными нейтрофилами (табл. 2).
*- различия статистически значимы по сравнению с контрольной группой
*
*
*
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
1-
2-
3-
4-
5-
Рис. 3. Количественный и качественный состав просветной микрофлоры мышей BALB/c через 30 сут после окончания курсового введения пробиотиков энтероцина и колибактерина
В печени при использовании обоих пробиотиков дистрофические изменения не выявлялись, морфологическая картина печени не отличалась от таковой у мышей контрольной группы. Тимус мышей, получавших энтероцин и колибактерин, имел нормальное строение и не отличался от такового в контрольной группе. В селезенке показатель объемной доли зоны ПАЛМ соответствовал контрольным значениям, а светлых центров лимфоидных узелков оставался выше контрольных значений (табл. 5).
Таким образом, пробиотические штаммы, несмотря на многочисленные благоприятные эффекты, не эквивалентны собственной индигенной микрофлоре и не способны размножаться в кишечнике. Одной из причин этого может быть бионесовместимость с резидентными бактериями хозяина (Глушанова Н.А., Блинов А.И., 2005). Даже наиболее эффективные пробиотики действуют только во время курса лечения и обнаруживаются в кале лишь в течение 3–7 сут после его окончания (Катт М.A., 2001). Поэтому, для достижения устойчивого терапевтического эффекта, во-первых, необходим длительный или даже постоянный прием пробиотиков, во-вторых, желательно, чтобы пробиотический препарат представлял собой штаммы нормобиоты, максимально совместимые с резидентными штаммами (Корниенко Е.А., 2007).
Курсовое введение канамицина и тетрациклина приводит к нарушению состава микрофлоры кишечника. При коррекции дисбиотического состояния пробиотиками энтероцином и колибактерином произошла нормализация микрофлоры, однако эффект пробиотика энтероцин выражен в большей степени, чем пробиотика колибактерин, о чем свидетельствует более высокое содержание ферментирующих эшерихий, нормализация количества энтерококков у мышей, получавших энтероцин, и отсутствие энтерококков у мышей, получавших колибактерин. Введение антибиотиков вызывает реактивные изменения тонкой и толстой кишки, характеризующиеся гиперплазией бокаловидных клеток, увеличением содержания межэпителиальных лимфоцитов и нейтрофилов, это коррелирует с данными Калмыковой А.И. и соавт, (2005). После коррекции первичного дисбиоза пробиотиками энтероцином и колибактерином сохраняются структурные изменения слизистой оболочки тонкой кишки в ответ на введение пробиотика. Выявленные структурно-функциональные изменения тимуса и селезенки после введения антибиотиков и пробиотиков являются неспецифической реакцией, развивающейся в ответ на их введение и с функциональной точки зрения указывают на активацию иммунной системы.
Через 30 сут после коррекции дисбиотического состояния пробиотиками энтероцин и колибактерин морфологическая картина в тонкой кишке, печени, тимусе и селезенке практически не отличались от контроля, но сохранялись реактивные морфологические изменения слизистой оболочки толстой кишки. Это, видимо, обусловлено тем, что основная масса бактерий находится именно в толстой кишке, поэтому восстановление ее микрофлоры под действием пробиотиков сочетается с длительно сохраняющимися реактивными морфологическими изменениями ее слизистой оболочки.
ВЫВОДЫ
- Курсовое введение канамицина и тетрациклина в терапевтических дозах (250 мг/кг) вызывает у самцов мышей линии Balb/с развитие первичного дисбиотического состояния, реактивных морфологических изменений слизистой оболочки тонкой и толстой кишки, печени и органов иммунной системы.
- Первичное дисбиотическое состояние, индуцированное у мышей Balb/с курсовым введением антибиотиков широкого спектра действия, характеризуется качественным и количественным нарушением состава микрофлоры с уменьшением числа неферментирующих энтеробактерий, исчезновением ферментирующих энтеробактерий и энтерококков, сохранением лакто- и бифидофлоры.
- При первичном дисбиозе реактивные изменения слизистой оболочки тонкой и толстой кишки характеризуются статистически значимым увеличением объемной доли бокаловидных клеток и абсолютного числа нейтрофилов. В толстой кишке, кроме того, определяются гиперплазия и лимфоидно-гистиоцитарная инфильтрация собственной пластинки слизистой оболочки, в тонкой кишке увеличивается показатель числа межэпителиальных лимфоцитов. В печени снижается абсолютное число неэпителиальных клеточных элементов и внутридольковых лимфоцитов.
- Развитие первичного дисбиоза сопровождается изменением морфофункционального состояния органов иммунной системы. В тимусе уменьшается объемная доля коркового слоя, в селезенке снижается объемная доля периартериолярных лимфоидных муфт и увеличивается доля светлых центров лимфоидных узелков.
- При коррекции первичного дисбиоза колибактерином и энтероцином микробиоценоз желудочно-кишечного тракта у мышей Balb/с частично восстанавливается. При применении индигенного пробиотика энтероцина наблюдается восстановление видового состава нормофлоры и количества одного из основных компонентов микробиома – бифидобактерий. При использовании препарата колибактерина среди видового состава нормофлоры не происходит восстановления группы энтерококков.
- После коррекции первичного дисбиотического состояния пробиотиками энтероцин и колибактерин выраженность реактивных морфологических изменений в тонкой и толстой кишке, в целом, уменьшается. В тонкой кишке показатель объемной доли бокаловидных клеток нормализуется, показатель числа нейтрофилов в строме слизистой оболочки снижается. Число межэпителиальных лимфоцитов при использовании пробиотика энтероцин статистически значимо увеличивается. В слизистой оболочке толстой кишки отмечается нормализация показателя толщины слизистой оболочки, снижение выраженности лимфоидно-гистиоцитарной инфильтрации стромы, а показатели объемной доли бокаловидных клеток и числа нейтрофилов остаются повышенными.
- После коррекции первичного дисбиотического состояния пробиотиком энтероцин объемная доля коркового слоя тимуса остается сниженной, а после применения колибактерина этот показатель нормализуется. После применения обоих пробиотиков по сравнению с контрольной группой мышей реактивные изменения в селезенке сохраняются: показатели объемной доли периартериолярных лимфоидных муфт остаются ниже контрольных значений, а светлых центров лимфоидных узелков – выше.
- Выявлены принципиальные отличия взаимодействия с микробиомом пробиотиков колибактерина и энтероцина в отдаленном периоде (30 сут) после их применения. Индигенный пробиотик энтероцин приводит к восстановлению качественного и количественного состава всех групп бактерий, за исключением ферментирующих эшерихий, количество которых превышает показатели контрольной группы. При использовании для коррекции дисбиоза колибактерина восстановления энтерококков не происходит, количество лакто- и бифидобактерий по сравнению с контролем достоверно снижается и дисбиотические изменения сохраняются
- По данным морфометрического исследования через 30 сут после коррекции дисбиоза обоими пробиотиками реактивные изменения сохраняются только в толстой кишке и селезенке. В толстой кишке сохраняется увеличение показателей объемной доли бокаловидных клеток и числа нейтрофилов в собственной пластинке слизистой оболочки. В селезенке сохраняется увеличение объемной доли светлых центров лимфоидных узелков.
Список работ, опубликованных по теме диссертации
- Овчарова А.Н., Алексанкин А.П., Тихонова Н.Б., Козловский Ю.Е, Серебряков С.Н. Сравнительная оценка эффективности действия пробиотиков Энтероцин и Колибактерин при экспериментальном дисбактериозе. //Материалы международной научно-практической конференции «Актуальные проблемы клеточного пушного звероводства России», Москва, 2007.- с.223-227.
- Овчарова А.Н. Морфологическая характеристика иммунной системы мышей BALB/с при нарушении состава микрофлоры и коррекции его пробиотиками «Энтероцин» и «Колибактерин» //Материалы научной конференции «Актуальные вопросы морфогенеза в норме и патологии, Москва, 2008. - с.118-122.
- Овчарова А.Н., Михайлова Л.П., Серебряков С.Н., Макарова О.В., Козловский Ю.Е., Матевосян К.Ш., Тихонова Н.Б. Морфологическая характеристика иммунной системы мышей Balb/c при нарушении состава микрофлоры и коррекции его пробиотиками «энтероцин» и «колибактерин» //Российский медико-биологический вестник им. академика И.П. Павлова, 2009. - №1 - с. 8-18
- Кактурский Л.В., Михайлова Л.П., Овчарова А.Н., Козловский Ю.Е., Серебряков С.Н., Тихонова Н.Б.. Морфологическая характеристика тонкой и толстой кишки мышей Balb/c при нарушении состава микрофлоры, индуцированном антибиотиками.// Морфологические ведомости, 2011. - №2. - с. 36-43
- Хомякова Т.И., Хомяков Ю.Н., Козловский Ю.Е., Макарова О.В., Овчарова А.Н., Михайлова Л.П. Морфологические изменения слизистой оболочки тонкой и толстой кишки при первичном дисбиозе и его коррекции пробиотиками //Материалы международной научной конференции по пробиотикам и пребиотикам, Словакия, 2011, с. 43.
Соискатель А.Н. Овчарова
