Экспериментальное обоснование применения нейропептидов в комплексной терапии острого гнойного холангита при механической желтухе 14. 01. 17 Хирургия 03. 03. 04 Клеточная биология, цитология, гистология
| Вид материала | Автореферат |
- Эндоскопические аспекты ранней диагностики и лечения больных с острым билиарным панкреатитом, 436.22kb.
- Закономерности дегенерации и адаптации сетчатки глаз при экспериментальных ретинопатиях,, 745.16kb.
- Цитологические особенности вторичных миелодисплазий при лимфомах 03. 00. 25 гистология,, 526.98kb.
- Морфофункциональная характеристика пульпы зуба и оценка иммунного статуса при кариесе,, 552.48kb.
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
- Лимфоидные органы и миокард в системе мать-плод при вибрации, воздействии кадмием, 640.36kb.
- Ультраструктурная и цитохимическая характеристика макрофагов, инфицированных рнк-содержащими, 636.4kb.
- Особенности морфо-функциональных изменений мышц при хронической артериальной недостаточности, 252.93kb.
- Обоснование применения пармелии в комплексной терапии экземы (клинико-экспериментальное, 349.46kb.
- Влияние биологически активных клеточных компонентов растений на структурные изменения, 324.85kb.
На правах рукописи
Чумаков Алексей Михайлович
ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ НЕЙРОПЕПТИДОВ В КОМПЛЕКСНОЙ ТЕРАПИИ ОСТРОГО ГНОЙНОГО ХОЛАНГИТА ПРИ МЕХАНИЧЕСКОЙ ЖЕЛТУХЕ
14.01.17 Хирургия
03.03.04 Клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
Диссертации на соискание учёной степени
кандидата медицинских наук
Оренбург - 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования
«Оренбургская государственная медицинская академия федерального агентства по здравоохранению и социальному развитию»
Научные руководители: Заслуженный врач РФ,
доктор медицинских наук,
профессор Третьяков Анатолий Андреевич
Заслуженный деятель науки РФ
Доктор биологических наук,
профессор Стадников Александр Абрамович
Официальные оппоненты: доктор медицинских наук,
профессор Абрамзон Олег Моисеевич
доктор медицинских наук,
профессор Корнеев Геннадий Иосифович
Ведущая организация: Челябинская государственная медицинская академия
Защита состоится «10»_марта 2010 г. в _10 часов на заседании диссертационного совета Д 208.066.02 при ГОУ ВПО «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» по адресу: 460000, г. Оренбург, ул. Советская, 6.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан «___»_________ 2010 г.
Учёный секретарь
диссертационного совета
доктор медицинских наук, профессор Сайфутдинов Р.И.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Высокая и прогрессивно нарастающая распространенность желчно -каменной болезни, поражающая от 2% до 15% населения различных регионов России, ставит на одно из первых мест это заболевание среди других болезней органов брюшной полости (В.И.Малярчук с соавт., 1999; С.Ю.Новиков, А.П.Уханов, 1999)
Весьма актуальной до настоящего времени остается проблема холангита в связи с неуклонным увеличением количества больных с холелитиазом и ростом числа осложнений этого заболевания (Э.И.Гальперин с соавт., 1988; М.И.Филимонов с соавт., 1994; А.С.Ермолов с соавт., 1995; А.А.Чумаков, 1994, 1996).
Чаще всего клиника холангита развивается на фоне механической желтухи, причиной которой в 62% случаев является холедохолитиаз, в 24,5% рубцовая стриктура внепеченочных желчных протоков и в 13,2% -стриктура большого дуоденального сосочка (А.А.Третьяков, 1998; А.И.Борисов, 2002; А.С.Ермолов с соавт., 2003).
Более половины больных желчно-каменной болезнью - лица пожилого и старческого возраста с атипично протекающей клиникой, часто осложняющейся механической желтухой и холангитом на фоне тяжелых сопутствующих заболеваний (Э.И.Гальперин с соавт., 1988; В.К.Гостищев с соавт., 1999). Клиническая картина у этой группы больных характеризуется бурным прогрессированием интоксикации и развитием полиорганной недостаточности. Несмотря на совершенствование методов ранней диагностики, техники оперативных вмешательств, широкое внедрение антибактериальных средств, активных методов детоксикации организма, летальность при механической желтухе, осложненной холангитом, все ещё высока и колеблется от 13 до 28,8% (Э.И.Гальперин, 1988; Bondarev et al, 1992; M.Shimoda et al, 1993; А.Е. Борисов с соавт., 1993).
Одной из причин отсутствия заметного улучшения результатов лечения гнойного холангита является увеличение доли затяжных и хронических форм, не поддающихся стандартной антибиотикотерапии из-за поливалентной устойчивости микроорганизмов к применяемым противомикробным препаратам (Э.И.Гальперин с соавт., 1996; Ю.И.Каргаполов с соавт., 1996; В.А.Журавлев с соавт., 2003; А.Е.Борисов с соавт., 2003).
Высокая толерантность микрофлоры желчных путей к антибиотикам широкого спектра действия диктует необходимость поиска новых препаратов, обладающих антимикробными свойствами, и более эффективных способов местного антибактериального воздействия.
В последние годы в схемы местной антибактериальной терапии при различных инфекционно-воспалительных процессах стали вводить окситоцин (П.П.Курлаев, 2001; В.Г.Гавриленко, 2003; А.Е. Климушкин, 2003; О.М.Абрамзон, 2004; В.Н. Барков, 2004; К.Г. Сивожелезов, 2005; Б.А.Стадников, 2005; Н.Н. Кочкина, 2008;).
Экспериментально - гистологическими исследованиями к настоящему времени обоснована целесообразность использования этого нейропептида в комплексном лечении гнойно-некротических процессов мягких тканей (А.А.Стадников, 2001, 2005, 2008, 2009). При этом показано, что положительный эффект от применения окситоцина связан не только со стимуляцией пролиферации эпителиоцитов, фибробластов и макрофагов, но и с антибиотическим воздействием данного пептида на прокариотические клетки.
В сочетании с антибиотиками окситоцин, снижая персистентный потенциал возбудителей, потенцирует антимикробный эффект антибиотиков, способствует более быстрой элиминации возбудителя из очага поражения (О.М.Абрамзон, 2004).
Вместе с тем, до настоящего времени нет сведений, касающихся обоснования клинического применения окситоцина в комплексном лечении холангитов доброкачественного генеза.
Всё изложенное явилось побудительным мотивом для проведения настоящего исследования.
Цель исследования
Целью настоящего исследования явилось морфофункциональное обоснование использования окситоцина для оптимизации репаративного процесса при экспериментальном гнойном холангите.
Задачи исследования
Для достижения этой цели были поставлены следующие задачи:
- Изучить эффективность применения комплекса «окситоцин+антибиотик» в лечении острого гнойного холангита по клиническим, бактериологическим и гистологическим показателям при сравнении его с другими методами лечения (традиционное лечение с использованием антибиотика для сочетанного местного и общего применения, традиционное лечение с использованием антибиотика для парентерального применения и антисептика - для местного).
- Установить особенности течения некробиотических и регенераторных процессов в инфицированных внутри- и внепечёночных желчных протоках и окружающих их тканях при тех же методах лечения.
- Сопоставить эффективность каждого метода лечения с исходными клиническими, бактериологическими и гистологическими показателями, и уточнить дифференцированные показания к использованию комплекса «окситоцин + антибиотик» для местного применения при лечебной коррекции гнойного холангита.
Научная новизна исследования
Впервые установлено, что окситоцин в условиях гнойного холангита создаёт оптимальные условия для реализации паренхиматозными и стромальными элементами печени и желчевыводящих путей своих адаптивных и компенсаторных возможностей, в том числе гистобластических и органотипических потенций.
Обоснованы и предложены гистологические (включая электронно-микроскопические) критерии оценки компенсаторно-приспособительных процессов в печени и внепечёночных желчных протоках при остром гнойном холангите в условиях сочетанного (местного и общего) применения комплекса «окситоцин + антибиотик».
Изучена структурно-функциональная реорганизация паренхиматозных и стромальных элементов печени при различных видах общего и местного лечения гнойного холангита.
Показан положительный эффект местного применения комплекса «окситоцин + антибиотик» на микробную экологию желчевыделительной системы при гнойном холангите и репаративные гистогенезы.
Научно-практическое значение
Разработанная оригинальная экспериментальная модель острого гнойного холангита может быть использована для решения актуальных вопросов хирургической гепатологии.
Теоретическое значение работы определяется тем, что полученные данные расширяют патогенетические представления об особенностях этиологии и патогенеза гнойного холангита и роли морфологических изменений в печени и желчеотводящих путях, их выраженности и обратимости в развитии заболевания, что существенно для клеточной биологии и цитологии гепатобилиарной системы.
Анализ микробиологических параметров протоковой желчи при различных методах лечения острого гнойного холангита и оценка таксономического спектра бактериальных патогенов с определением доминирующих видов микроорганизмов имеет существенное значение для клинической гепатологии.
Установлено, что использование окситоцина в условиях гнойного холангита обеспечивает уменьшение зон некроза, отграничение их от жизнеспособных тканей, стимулирует регенераторные процессы в печени и в желчных протоках, в конечном итоге приводит к снижению количества осложнений, предупреждает хронизацию процесса воспаления, что имеет важное значение для абдоминальной хирургии.
Положения выносимые на защиту
- Применение комплекса «окситоцин + антибиотик» эффективно при лечении экспериментального острого гнойного холангита, обеспечивая антимикробный и стимулирующий регенераторный процесс в инфицированных внутри- и внепечёночных желчных протоках и окружающих их тканях, в большей степени, чем традиционные методы лечения, оказывая эффективное отграничение гнойно-некротических очагов и стимулируя реализацию структурами органа своих гистобластических и регенераторных потенций.
2. Обоснованы и предложены новые ультраструктурные критерии оценки позитивного влияния окситоцина на репаративный гистогенез паренхиматозных и стромальных элементов печени, холедоха и холангиол при экспериментальном остром гнойном холангите.
Апробация работы и публикации.
Основные положения диссертации доложены и обсуждены на научно-практической конференции врачей Приволжско-Уральского военного округа “Актуальные вопросы военной и практической медицины” (Оренбург, 2005, 2006, 2007), на межобластной научно-практической конференции хирургов «Актуальные вопросы хирургии» (Бугуруслан, 2007), на конференции молодых учёных (Оренбург 2007), на XV международном конгрессе хирургов – гепатологов стран СНГ «Актуальные вопросы хирургической гастроэнтерологии» (Казань 2008), на Всероссийской научной конференции «Нейробиологические аспекты морфогенеза и регенерации» (Оренбург 2008). По теме диссертации опубликовано 13 научных работ, из них 6 по перечню ВАК РФ.
Объем и структура диссертации
Диссертация изложена на 145 страницах машинописного текста и состоит из введения, обзора литературы, материалов и методов, результатов собственных исследований, их обсуждения, выводов, практических рекомендаций и указателя литературы, включающего 226 источников, в том числе 191 работу отечественных и 35 иностранных авторов.
Работа иллюстрирована 27 микрофотографиями гистологических препаратов, электронограмм и 4 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Общая характеристика - работа носит экспериментальный характер. Объектом исследования явились 72 животных – беспородные белые крысы- самцы массой 280 – 300г.
Сведения о 6 сериях экспериментов представлены в табл. 1.
Таблица 1. Распределение подопытных животных по сериям опытов.
| № n/n | Наименование серии опытов | Кол-во Живот-ных | Сроки наблюдения | Летальность. (%) | |||
| 3 сут. | 5 сут. | 7 сут. | 10 сут. | | |||
| I | Модель механической желтухи без применения, каких либо лекарственных средств | 12 | 3 | 3 | 3 | 3 | 8,3+ 0,02 |
| II | Модель гнойного холангита без применения, каких либо лекарственных средств | 12 | 3 | 3 | 3 | 3 | 66,7+ 0,03 |
| III | ГХ+ цефоперабол внутримышечно 2 раза в сутки по 50 мг/кг. Местное лечение осуществлялось дренированием инфицированных желчных путей и промыванием их 1% раствором диоксидина | 12 | 3 | 3 | 3 | 3 | 33,3+ 0,01 |
| IV | ГХ+ антибиотик цефаперабол, который вводился внутримышечно 2 раза в сутки по 50 мг/кг и в d. choledochus (через дренаж) также 2 раза в этой же дозе | 12 | 3 | 3 | 3 | 3 | 42,6+ 0,04 |
| V | ГХ+ в просвет холедоха вводился раствор окситоцина в дозе 0,015 ЕД + антибиотик (цефоперабол). Так же животные получали антибиотик (цефоперабол) внутримышечно | 12 | 3 | 3 | 3 | 3 | 25+ 0,01 |
| VI | ГХ+ в просвет холедоха вводился раствор окситоцина в дозе 0,015 ЕД | 12 | 3 | 3 | 3 | 3 | 42,6+ 0,03 |
В первой серии опытов (12 животных), с соблюдением правил асептики и антисептики, крысам под эфирным наркозом производили верхнесрединную лапаротомию, выделяли общий желчный проток и создавали модель механической желтухи путем перевязки d.choledochus. Послеоперационная рана зашивалась наглухо.
Во 2-й серии опытов (12 животных) воспроизводилась модель острого гнойного холангита путем инфицирования билиарной системы на фоне механической желтухи введением в просвет общего желчного протока взвеси E.coli 196 с концентрацией 0,95х105 КОЕ в 1 мл (0,4 мл на 1 кг). Послеоперационная рана ушивалась однорядным непрерывным швом наглухо, через все слои. Лечение в данной группе не проводилось.
В 3-й серии опытов (12 животных) создавали модель гнойного холангита на фоне механической желтухи по вышеописанной методике. Спустя 1 сутки выполнялась релапаротомия, дренирование расширенного общего желчного протока. В качестве дренажа использовали подключичный катетер № 12, через который осуществлялась декомпрессия d.choledochus. Просвет трубки закрывался во время операции. Декомпрессию начинали со следующих суток. Лечение острого гнойного холангита проводилось традиционным способом. Животные получали антибиотик цефоперабол (производство фирмы АВОL med) внутримышечно 2 раза в сутки по 20 мг. Местное лечение осуществлялось дренированием инфицированных желчных путей и промыванием их 1% раствором диоксидина.
В 4-й серии опытов (12 животных) проводилось лечение антибиотиком цефапераболом, который инъецировали внутримышечно 2 раза в сутки по 50 мг/кг и в d. choledochus (через дренаж) также 2 раза в этой же дозе.
В 5-й серии опытов (12 животных) изучалось лечебное действие окситоцина ( производство фирмы «GEDEON RICHTER») и антибиотика. Животные получали антибиотик (цефоперабол) внутримышечно, а в просвет желчных протоков – окситоцин в дозе 0,25 ЕД + антибиотик (цефоперабол) (2 раза в сутки).
В 6-й серии опытов (12 животных) изучалось действие окситоцина. В этой серии дважды в сутки вводили окситоцин в дозе 0,25 ЕД внутримышечно и в просвет желчных протоков.
Сроки наблюдения животных всех групп – 3, 5, 7 и 10 суток.
Из опыта животные выводились передозировкой эфира. При выполнении исследований соблюдались «Правила проведения работ с использованием экспериментальных животных» согласно приказу МЗ СССР, № 755, от 12.08.1977 г.
Методики микробиологических исследований.
Оценка эффективности лечения острого гнойного холангита проведена по динамике клинико-лабораторных показателей, тяжести эндотоксикоза – по общему состоянию животных (слабость, отсутствие аппетита, гибель). Исследование состава микрофлоры инфицированных желчных путей проведено по общепринятой методике (Приказ МЗ СССР № 535 от 22.04.85) у всех животных перед началом лечения и через 3,5,7,10 суток. Видовая принадлежность микрофлоры определялась методом мазка с последующей его бактериоскопией и бактериологическим исследованием на средах (кровяной агар, мясопептонный агар, тиоглеколевая среда) согласно приказу МЗ СССР № 535 от 22.04.85. Для определения чувствительности флоры к антибиотикам использован метод бумажных дисков.
Методики морфологических исследований.
Материал (кусочки печени, поджелудочной железы, вне – и внутрипечёночные желчные протоки, гипоталамус, нейрогипофиз) брали через 3, 5, 7, 10 суток от начала эксперимента после эвтаназии.
Для светооптического изучения материал после фиксации в 10% растворе нейтрального формалина и обезвоживания спиртами заключался в парафин-целлоидин для получения гистологических срезов. Световая микроскопия осуществлялась бинокулярным микроскопом МБС-15. Гистологические срезы окрашивали гематоксилином Майера и эозином, пикрофуксином по Ван-Гизон, метиленовым зеленым и пиронином по Браше, перйодатом К и реактивом Шифф по Мак Манусу. Идентификацию нейросекрета проводили паральдегид – фуксином по Гомори-Габу в модификации Поленова А.Л. ( 1963 ).
Для электронно-микроскопических исследований материал фиксировался 2,5 % раствором глутарового альдегида на какодилатном буфере (pH=7,3) с последующей дополнительной фиксацией в 1% растворе четырехокиси осмия, обезвоживали в растворах ацетона с возрастающей концентрацией и заливался в смесь ЭПОН-812 и аралдита (Wikly, 1975). Полутонкие срезы (1 мкм) окрашивались метиленовым синим и основным фуксином по методике Sato T., Shamoto M. (1973). Ультратонкие срезы подвергались двойному контрастированию растворами уранилацетата и цитрата свинца (Reynolds, 1963). Срезы просмотрены в электронном микроскопе ЭМВ 100АК при увеличении от 4000 до 40000.
При иммунноцитохимическом исследовании произведена идентификация экспрессии про – и антиапоптотических генов Р 53 и Вcl 2 с использованием наборов моноклональных антител (реактивы фирмы «Дако» Дания) для определения дезинтеграции нуклеосомальных и хроматиновых структур.
Полученные количественные данные статистически обработаны с использованием непараметрических методов (критерий знаков, Вилкоксона - Манна-Уитни). Для установления связи использован корреляционный анализ. Компьютерная обработка проводилась с помощью пакета прикладных статистических программ EXCEL 7.0, Microsoft Excel 5.0 а.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При гистологическом исследовании в первой серии опытов на 3-5 сутки эксперимента обнаружено резкое расширение желчных капилляров и холангиол, с явлениями кариопикноза и десквамации эпителиоцитов, сопровождающееся мозаичным деструктивным повреждением гепатоцитов, островковыми некрозами паренхимы печени на значительном протяжении. К 7 и 10 суткам эксперимента отмечалось выраженное усугубление выше описанной морфологической картины. Сохранялись значительные участки некрозов паренхимы печени, замещающиеся соединительной тканью. При длительном нарушении оттока желчи отдельные гепатоциты теряли свойственное им трабекулярное строение и образовывали псевдожелезистые структуры.
Экспрессия синтеза проапоптотического белка р-53 в эпителии холангиол составила 0,5 + 0,01 % на 3-и-5-е сутки эксперимента. На 7-е-10-е сутки данный показатель составил 1,1 + 0,01 %, что свидетельствует о формировании апоптотической доминанты.
В зонах некроза печёночной паренхимы и отслойки эпителиальных клеток холангиол не отмечено пролиферативных разрастаний гепатоцитов и эпителия. Это свидетельствует о том, что в новообразованной соединительной ткани печени и по периферии желчевыводящих путей нарушены гистиотипические коррелятивные связи репаративного характера, усугубляющие течение холангита.
Во второй серии опытов на третьи сутки в печени регистрировались многочисленные гнойники, неограниченные пиогенными мембранами. В ряде случаев обнаружены поддиафрагмальные абсцессы. На пятые сутки на фоне нарушения цитоархитектоники печёночных балок и желчных капилляров, превалировали микроабсцессы. При этом гнойно – некротические процессы приобретали генерализованный характер, и в гистопрепаратах отмечались зоны сплошных некрозов печёночной паренхимы. В слизистой оболочке желчеотводящих путей преобладали дистрофические и некробиотические процессы. В их микроциркуляторном русле выявлялись стаз форменных элементов крови и тромбообразование (Рис. 1).
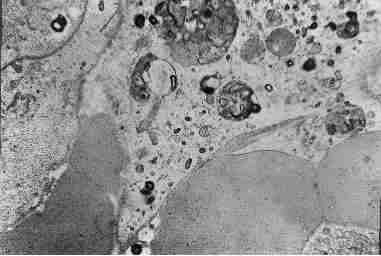
Рис.1. Стаз форменных элементов крови и тромбообразование в микроциркуляторном русле.
Наблюдались кариорексис и лизис эпителиоцитов холедоха. Погибшие пласты эпителия отторгались в просвет холангиол. Выявлены диссоциации гладких миоцитов, их некробиотические изменения, что происходило на фоне выраженного экссудативного воспаления. Часто некробиотические процессы достигали соединительнотканных структур собственной пластинки слизистой оболочки желчеотводящих путей. В некоторых участках холедоха слизистая оболочка была полностью разрушена. При этом эпителиоциты обнаруживались в виде отдельных фрагментов среди обильных масс детрита. В подслизистой основе холедоха определялись гиперемия сосудов, периваскулярный отёк, диффузная лейкоцитарная инфильтрация, разволокнение и дискомплексация фибриллярных компонентов соединительной ткани, а так же очаговый гистолиз. Отмечен дизрегенераторный характер воспаления в холедохе, без отчётливо выраженной фазы пролиферации. Это нашло своё подтверждение и в ходе иммуноцитохимических исследований, показавших возрастание численности холангиоцитов с признаками апоптоза во все сроки наблюдений.
Клинические проявления интоксикации во второй серии опытов были более выражены чем в первой серии эксперимента. Летальность составила 81 %. Морфологические нарушения в кровообращении проявлялись явлениями агрегации эритроцитов и образованием микротромбов. При длительном холестазе обнаруживалось избыточное разрастание соединительной ткани вокруг внутрипечёночных желчных протоков. При этом отмечались увеличение экспрессии проапоптотического белка р-53 и дистрофические изменения холангиоцитов к 7 суткам эксперимента в обеих сериях. Митотический индекс на 3–и сутки эксперимента ни в 1-ой, ни во 2 – ой серии эксперимента не определялся. На 7–е сутки в 1–ой серии он составил 0,8 + 0,01 %, во 2–й серии 1,4 + 0,13 %.
Встречаемый в первой серии опытов феномен образования псевдожелезистых структур, в условиях инфицирования, наблюдался значительно чаще из-за выраженности гипертензии в протоковой системе печени. Данный характер морфологических изменений наблюдался в 17,2+ 0,7% на 7-е сутки эксперимента и в 22,3+1,2% - на 10-е сутки.
Экспрессия синтеза проапоптотического белка р-53 в эпителии имела место в 1,7+0,04% - 2,1+0,02% на 3-и – 10-е сутки эксперимента (Табл. 2).
Таким образом, нарушение пассажа желчи в экспериментальных условиях закономерно протекает с выраженными изменениями внутрипеченочных желчных протоков и реактивными изменениями в кровообращении и соединительной ткани, с образованием псевдожелезистых структур в условиях инфицирования.
Таблица 2. Характеристика морфологических изменений эпителия ВЖП в экспериментальных условиях (%).
| Морфологические показатели | 3-5 суток | 7-10 суток | ||
| Без инфицирования | В условиях инфицирования | Без инфицирования | В условиях инфицирования | |
| Дистрофические изменения холангиоцитов | 34,1 ±1,8 | 48,6±2,1 | 39,8±1,1 | 52,6±2,1 |
| Митотический индекс | - | - | 0,8±0,01 | 1,4±0,13 |
| Псевдожелезистые структуры образованные гепатоцитами. | - | - | 9,1±0,6 | 17,2±0,7 |
| Экспрессия проапоптотического белка р 53 | 0,5±0,01 | 1,7±0,04 | 1,1±0,01 | 3,2±0,03 |
Новообразование соединительной ткани, представляющей собой скопления клеток фибробластического ряда, происходит во всех поврежденных участках холедоха и печени, с последующей дифференцировкой. Гипотетически данный факт развития восстановительных процессов в структурах печени и желчевыводящих протоках возможен и при остром гнойном холангите на фоне механической желтухи. Однако в данном опыте формирование малодифференцированных соединительнотканных элементов существенно заторможено, а процессы фибриллогенеза с возникновением рубцовых структур наступали на 5-е сутки. Это в свою очередь ограничивало развитие репаративного гистогенеза эпителия желчевыводящих протоков.
Полученные факты о стереотипных изменениях в структурах желчевыводящих путей свидетельствуют о нарастании гипоксии в условиях инфицирования. Следствием этих изменений является истощение материальных и прежде всего энергетических и пластических ресурсов гистоструктур.
При анализе структур печени и желчевыводящих протоков в условиях острого гнойного холангита после выполнения дренирующих холедох операций и проведения традиционного лечения (3-я серия) можно подчеркнуть следующие моменты. Наличие дренажа в общем желчном протоке не исключает выраженной дезорганизации паренхиматозных структур печени. Большая часть деформированных балок имеет расширенные желчные капилляры в виде кистозных полостей.
В данной серии опытов дистрофические изменения в гепатоцитах и эпителиоцитах наиболее ярко проявлялись через 3-е суток опыта. И они имели место вплоть до 10-х суток эксперимента.
Мы обнаружили гипертрофию большей части гепатоцитов в зонах некрозов печеночной паренхимы. Характерным было то, что гепатоциты усиливали синтез ДНК, а так же их репродуктивную активность. Тканевой трансформации в клетках эпителия желчевыводящих путей не отмечено. Однако, не взирая на все репаративно-компенсаторные изменения в печени и протоках, пролиферативных реакций эпителия холангиол и возникновения новых желчеотводящих протоков в моделируемых условиях не отмечено ни в одни сутки эксперимента.
Кроме всего установлено разрастание соединительной ткани, которая изолирует некротически измененные гепатоциты. В пограничных участках отмечается резкий полиморфизм гепатоцитов и особенно их ядер. Отмеченный факт разрастания соединительной ткани происходит без выраженной фазы вторичной цито- и органодифференцировки. Так же не было отмечено новообразования печеночных балок.
Исследуя объекты, изъятые из области гнойно-некротического поражения печени и внепеченочных желчных протоков экспериментальных животных, в комплексном лечении которых применялся окситоцин (5-я и 6-я серии), мы получили существенные морфологические отличия в характере течения гнойного холангита. Это прежде всего проявилось в уменьшении выраженности некробиотических изменений паренхиматозных и протоковых структур. На стадиях 3-х – 7-х суток опыта в 2,5-3 раза уменьшилось количество тромбированных и сладжированных сосудов микроциркуляторного русла. Одновременно усиливались регенераторные (митотические) процессы у эндотелиоцитов, фибробластов, периваскулярных клеток (Рис. 2).
Правомочность подобного суждения подтверждено полученными нами результатами, свидетельствующими о том, что через 3, и особенно 7 суток использования окситоцина происходит усиление васкулогенеза в демаркационных зонах, где интенсивно развивается малодифференцированная соединительная ткань с формированием новых

Рис. 2. Картина митоза фибробластов.
петель гемокапилляров. Она постепенно заполняет и отграничивает некротизированные участки печени. В тех местах (через 3-7 суток) можно было идентифицировать несколько переходящих друг в друга гистологических структур: лейкоцитарно-некротический; пролиферирующих микрососудов; функционально активных фибробластов и макрофагов; фиброзного содержащего значительное количество коллагеновых, ретикулярных и эластических волокон.
Следует заметить, что при использовании окситоцина понижается численность деструктивно изменённых полиморфноядерных лейкоцитов. С другой стороны, на их смену приходят гистиоцитарные и моноцитарные макрофаги, активно лизирующие бактерии и фрагменты повреждённых тканей.
Анализ гистопрепаратов и электроннограмм показал, что пограничные с участками некроза гепатоциты, эпителий выводных протоков сохранили свои гисто- и органобластические репаративные свойства. Об этом свидетельствует тот факт, что среди них регистрировались клетки дифференцированного статуса, имеющие крупные ядра с деконденсированным хроматином, с большим количеством свободных рибосом.
Следует отметить, что при использовании окситоцина гетероформизм фибробластов был более выражен. Эти клетки, как правило, имели крупные ядра с дисперсным хроматином, 1-2 ядрышка. Одновременно наблюдались явления гипертрофии ядрышек и возрастание количества гранул гликогена. Подобные изменения нами рассматриваются как важный адаптационный механизм. Ещё раз отметим, что в тех сериях, где окситоцин не применялся, реституции печёночных балок и холангиол не происходит, очевидно, из-за быстро формирующейся соединительной ткани с признаками рубцевания.
Эти наблюдения позволили нам сделать заключение о том, что введение окситоцина создаёт благоприятные условия не только для развития грануляционной соединительной ткани, но и для адекватной реакции важнейших элементов, организующих «поле воспаления» - макрофагов. Применение окситоцина обеспечило не только более быстрое и эффективное отграничение гнойно-некротических локусов, но и привело к значительной стимуляции пролиферации эпителиальных структур холангиол. Через 3 суток в новообразованной грануляционной ткани отмечены эпителиальные разрастания в виде тяжей, трубочек, островков. На стадии 7 суток в них происходят процессы вторичной функциональной цитодифференцировки.
Нами был так же проведён анализ микробиологических параметров протоковой желчи при остром гнойном холангите, вызванном кишечной палочкой, при различных методах лечения и в различные сроки послеоперационного периода.
Оценена динамика таксономического спектра бактериальных патогенов с определением приоритетных видов микроорганизмов. Следует отметить, что на 3-и сутки после инфицирования билиарной системы у животных всех групп в 93,4 + 2,9% случаев высевались энтеробактерии, в 5,3 + 2,6% - граммпозитивные кокки, представленные микроорганизмами родов Staphilococcus, Streptococcus и Enterococcus, в 1,9 % - прочие виды бактерий.
При анализе видовой структуры биликультур энтеробактерий было установлено, что лидирующее место занимали эшерихии, их доля составила 78,6 %, вторую позицию - клебсиеллы 6,7%, третью и четвёртую – цитробактеры 4,3% и энтеробактеры 3,4%, удельный вес представителей прочих родов энтеробактерий был значительно ниже и в совокупности составил 7 %.
В послеоперационном периоде происходила частая смена видового состава билиарной микрофлоры. Такие изменения наблюдались на 5-7 сутки и 10 сутки эксперимента у 71,0+ 8,3 и 83,3 + 9,0 % животных, а в половине исследований происходила смена видового состава билиарной флоры между указанными сроками.
Нельзя исключить, что выявленные модификации видового спектра билиарных энтеробактерий у экспериментальных животных после операции связаны в первую очередь с назначением антибактериальных препаратов широкого спектра действия, а так же с феноменом транслокации микроорганизмов из просвета кишечника.
В ходе лечения на 3-5 сутки отмечалась высокая частота бактериохолии у животных получавших антибактериальную терапию, доля положительных посевов у них составляла 96,7%, в группах, где применялся окситоцин и антибиотик, доля положительных результатов снизилась до 72,2 %. На фоне продолжения применения комплекса «окситоцин + антибиотик» на 7-10 сутки уровень бактериохолии составил 68,1 %, а в группах где применялись антибактериальные препараты – 92,1%.
Между анализируемыми группами наблюдались отличия по компонентно-видовому составу микрофлоры. В ходе лечения окситоцином доля монофлоры увеличилась и была выше, чем в группах получавших традиционное лечение: к 3-5 суткам она составила 64,6 % против 47,2 %, а к 7-10 суткам 74,3 % против 63,2 % соответственно. У животных получавших окситоцин отмечено также снижение микстфлоры с 17,8 % до 11,4 % к 5 суткам, в последующие сроки снижение продолжилось до 7,4 % к 10 суткам.
Степень обсеменённости протоковой желчи микрофлорой у животных получавших окситоцин к 5 суткам снизилось до lg 5,3 КОЕ/мл, в то время как в противоположных группах отмечено повышение этого показателя до lg 7,3 КОЕ/мл, который в этой группе не изменился к 7-10 суткам. В исследуемой группе данный показатель снизился до lg 4,7 КОЕ/мл.
Выводы
- Применение окситоцина в комплексном лечении острого гнойного холангита является этиологически и патогенетически обоснованным. Воспалительный процесс в печени и желчевыводящих путях протекает благоприятнее при использовании окситоцина, чем при лечении антибиотиками и антисептиками: снижается в 2 раза количество послеоперационных осложнений, уменьшается вероятность хронизации процесса воспаления, сокращаются сроки лечения.
- Местное применение комплекса « окситоцин + антибиотик » в сочетании с парентеральным применением антибиотика при лечении острого гнойного холангита оказывает выраженный антимикробный эффект, способствует снижению бактериальной обсеменённости желчевыводящих путей, обеспечивает оптимальные условия для купирования воспалительного процесса.
- Сравнительные гистологические и гистохимические исследования паренхиматозных и стромальных элементов печени при гнойном холангите позволяют выделить отличительные особенности действия окситоцина по сравнению с применением антибиотиков и антисептиков. Окситоцин повышает репродуктивную активность холангиоцитов и гепатоцитов и в целом стимулирует репаративный гистогенез.
- Особенности структурно-морфологических изменений в печени при экспериментальном гнойном холангите характеризуются нарастающей атрофией и дистрофией тканевых структур и эпителиоцитов, определяющим развитием рубцовой соединительной ткани, дистрофическими изменениями слизистой оболочки и формированием псевдополипов с лимфогистиоцитарной инфильтрацией стромальных элементов.
- Характерными иммунноцитохимическими признаками нарастающих деструктивных и некробиотических процессов в печени и желчевыводящих путях при остром гнойном холангите на фоне механической желтухи является соответствующее возрастание экспрессии проапоптотического белка в эпителии желчных протоков с формированием апоптотической доминанты.
- В своей совокупности полученные результаты обосновывают целесообразность клинических испытаний окситоцина для лечебной коррекции острого гнойного холангита.
Практические рекомендации
Полученные результаты могут быть использованы:
в экспериментальной медицине при изучении и поиске новых способов лечения острого гнойного холангита;
- в экспериментальной морфологии при изучении репаративных процессов печени;
- для обоснования и разработки эффективных способов стимуляции регенерации тканей печени млекопитающих, в том числе и человека;
- в учебном процессе на кафедрах гистологии и НИИ морфологического профиля, а также при написании соответствующих разделов учебных пособий.
Список научных работ, опубликованных по теме диссертации
- Чумаков А.М. Реактивные изменения внутрипечёночных желчных протоков в условиях экспериментального холестаза и инфицирования / А.А. Третьяков // Морфология.- 2008.- № 5.- С.98-99.
- Чумаков А.М. Модель гнойного холангита при механической желтухе / А.М. Чумаков// Вестник Оренбургского государственного университета.- Оренбург, 2008.- С. 158-160.
- Чумаков А.М. Экспериментальное обоснование применения окситоцина при лечении холангита / А.М. Чумаков, А.А. Стадников, А.А. Третьяков // Актуальные проблемы лечения больных с различной хирургической патологией: материалы VII межобластной научно-практической конференции хирургов.- Бугуруслан, 2008.- С. 121-122.
- Чумаков А.М. Современные аспекты антибактериальной терапии при гнойном холангите / А.М. Чумаков, А.А. Стадников, А.А. Третьяков // Актуальные проблемы лечения больных с различной хирургической патологией: материалы VII межобластной научно-практической конференции хирургов.- Бугуруслан, 2008.- С. 117-120.
- Чумаков А.М. Морфофункциональные и микробиологические аспекты целесообразности применения окситоцина в коррекции нарушений репаративной регенерации тканевых элементов желчевыводящих путей при остром гнойном холангите в эксперименте / А.М. Чумаков, А.А. Стадников, А.А. Третьяков // Морфологические ведомости.- Москва, 2009.- № 3.- С. 240-242.
- Чумаков А.М. Реактивность и пластичность тканевых элементов внепечёночных желчеотводящих путей при экспериментальном холангите эксперименте / А.М. Чумаков, А.А. Стадников, А.А. Третьяков // Научный вестник Ханты-Мансийского государственного медицинского института.- Ханты-Мансийск, 2006.- №2.- С. 109.
- Чумаков А.М. Особенности программированной гибели клеток (апоптоза) в процессах гистогенезов и цитодифференцировки желчевыводящих путей в условиях гнойного холангита при его лечении окситоцином / А.М. Чумаков, А.А. Стадников, А.А. Третьяков // Информационный архив.- Оренбург, 2007.- С. 69.
- Чумаков А.М. Создание экспериментальной модели гнойного холангита при механической желтухе / А.М. Чумаков, А.А. Третьяков, А.А. Стадников // Актуальные вопросы военной и практической медицины.- Оренбург, 2006.- С. 533-535.
- Чумаков А.М. Регенераторные возможности тканевых элементов желчеотводящих путей в условиях холангита при механической желтухе / А.М. Чумаков, А.А. Стадников, А.А. Третьяков // Актуальные вопросы военной и практической медицины.- Оренбург, 2006.- С. 561-563.
- Чумаков А.М. Коррекция морфофункциональных нарушений внепечёночных желчеотводящих путей с помощью окситоцина у крыс при экспериментальном инфицированном холангите / А.М. Чумаков, А.А. Третьяков // Морфология.- 2008.- № 3.- С.118.
- Чумаков А.М. Микробиологическая характеристика протоковой желчи при лечении гнойного холангита окситоцином в эксперименте / А.А. Третьяков, А.М. Чумаков // Анналы хирургической гепатологии.- Москва, 2008. - № 3.- С. 76.
- Чумаков А.М. Морфофункциональные обоснования возможности использования окситоцина для оптимизации репаративных процессов при экспериментальном холангите / Чумаков А.М., А.А. Стадников, А.А. Третьяков // Анналы хирургической гепатологии.- Москва, 2007. - № 3.- С. 122-123.
- Чумаков А.М. Применение окситоцина при экспериментальном холангите / А.А. Третьяков, А.А. Стадников, А.М. Чумаков // Анналы хирургической гепатологии.- Москва, 2009. - № 3.- С. 30-35.
