И. М. Губкина «утверждаю» Первый проректор профессор В. Н. Кошелев 2011 г. Рабочая программа
| Вид материала | Рабочая программа |
- И. М. Губкина Утверждаю: Первый проректор по учебной работе, профессор В. Н. Кошелев, 757.5kb.
- И. М. Губкина Утверждаю: Первый проректор по учебной работе, профессор В. Н. Кошелев, 214.46kb.
- И. М. Губкина Утверждаю: Первый проректор по учебной работе, профессор В. Н. Кошелев, 234.32kb.
- И. М. Губкина Утверждаю: Первый проректор по учебной работе, профессор В. Н. Кошелев, 141.31kb.
- И. М. Губкина Утверждаю: Первый проректор по учебной работе, профессор В. Н. Кошелев, 249.42kb.
- И. М. Губкина утверждаю: Первый проректор по стратегическому развитию ниу ргу нефти, 516.73kb.
- И. М. Губкина утверждаю: Первый проректор по стратегическому развитию ниу ргу нефти, 529.14kb.
- Николая Григорьевича Столетовых» (ВлГУ) Колледж инновационных технологий и предпринимательства, 271.43kb.
- Николая Григорьевича Столетовых» Кафедра химии утверждаю первый проректор В. Г. Прокошев, 219.64kb.
- И. М. Губкина «утверждаю» Проректор по учебной работе В. Г. Мартынов 2002 г. Рабочая, 102.03kb.
Текущий тест №3 Химический эквивалент
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Под каким номером указано значение молярной массы эквивалента элемента углерода в соединении CО2?
1. 6 2. 3 3. 8,4 4. 4,8 5. 12
2. Под каким номером указано число молекул оксида серы (IV), содержащееся в одном моль эквивалентов этого вещества в реакции:
2NaOH + SO2 = Na2SO3 + H2O?
1.
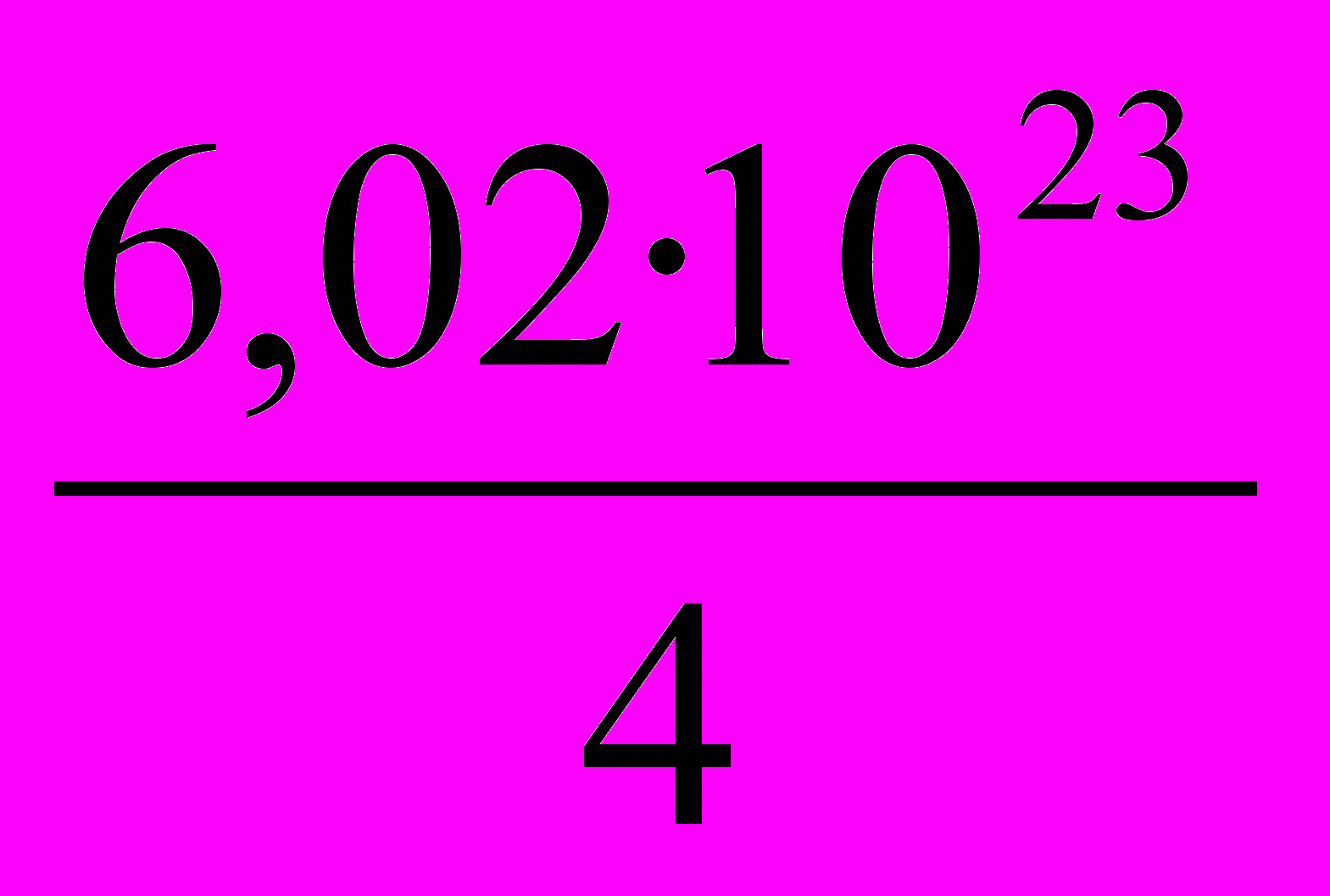 2.
2. 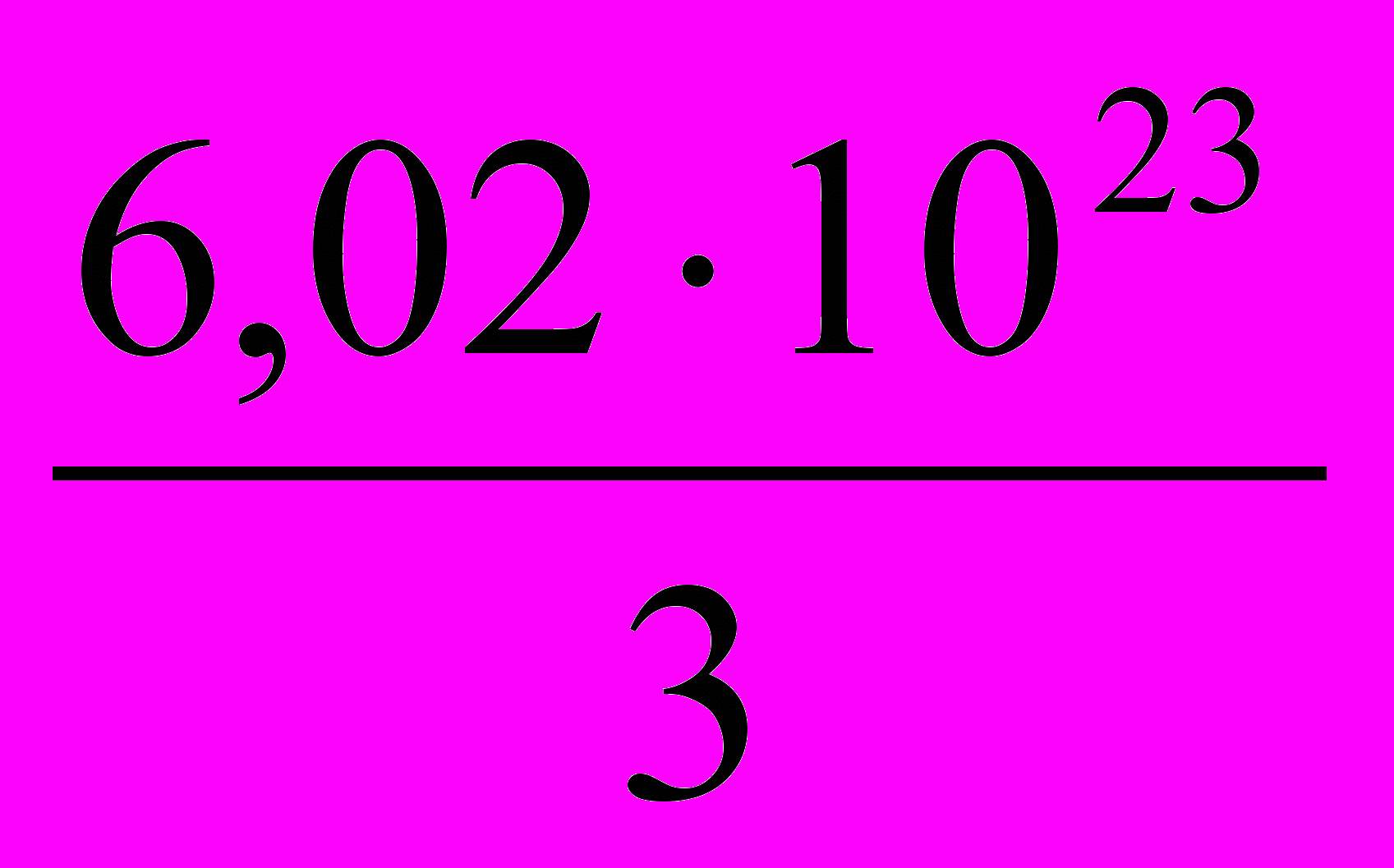 3.
3. 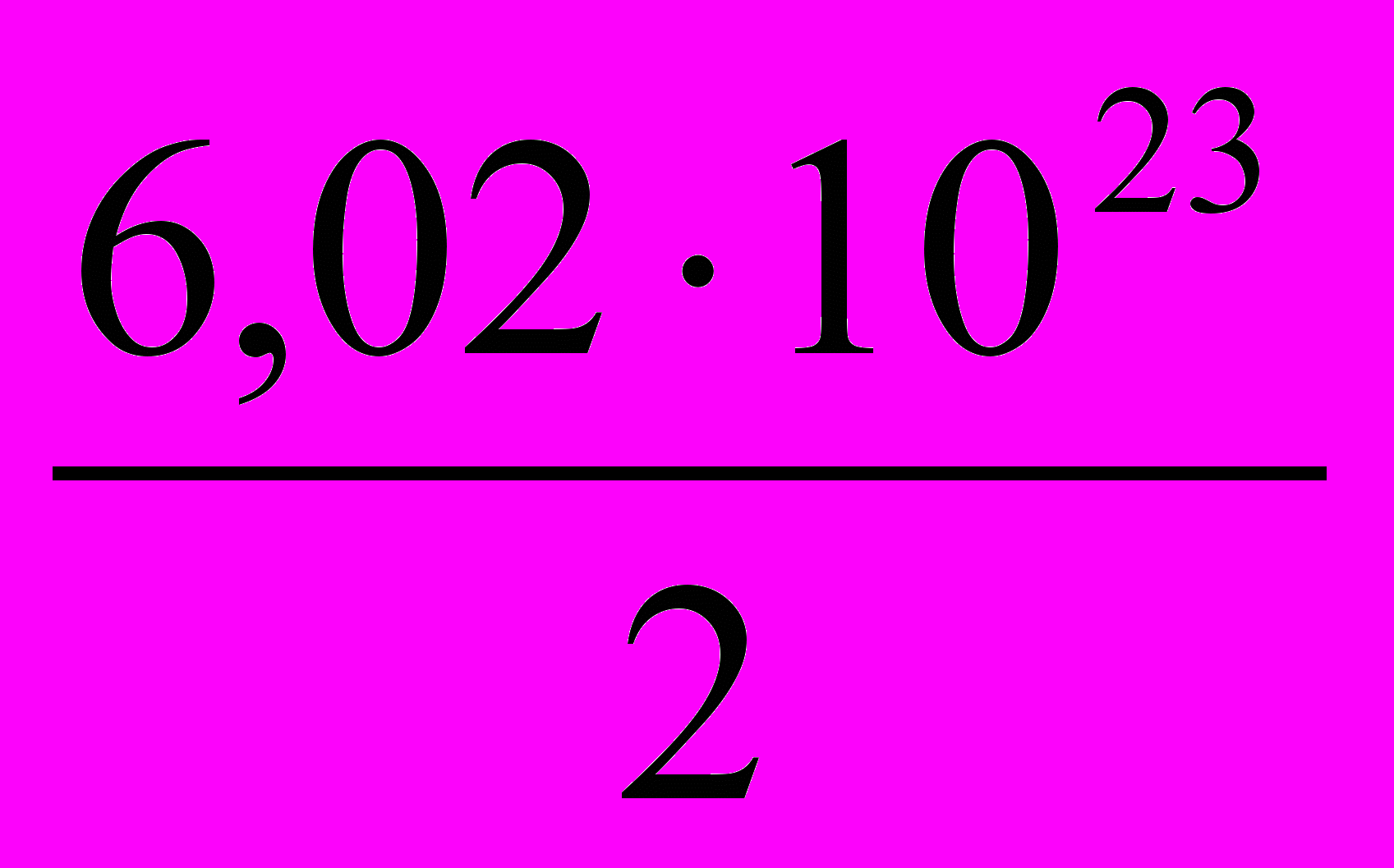 4.
4. 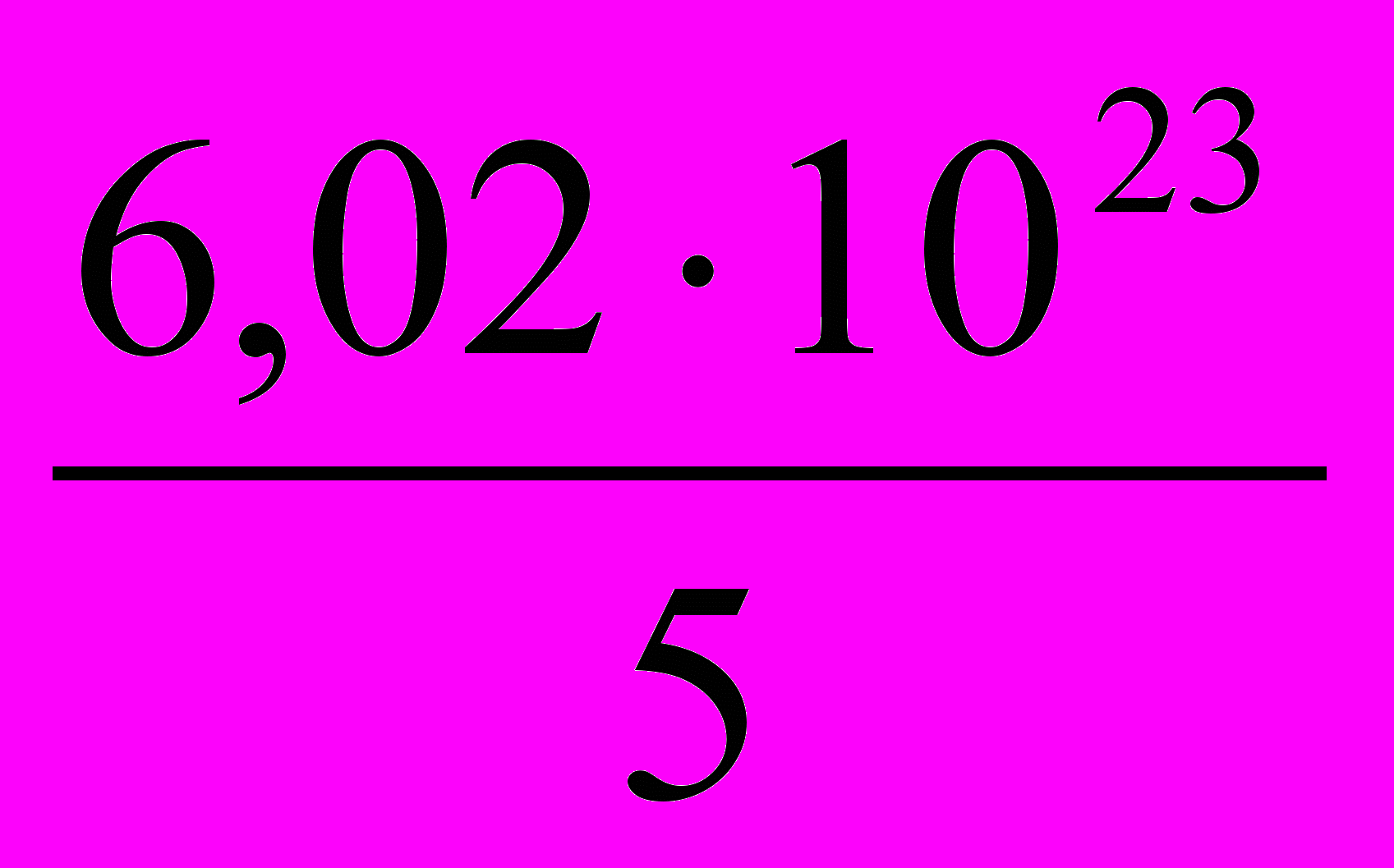 5. 6,02·1023
5. 6,02·10233. Под каким номером указано значение молярной массы эквивалента ортофосфорной кислоты в реакции:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O?
1. 2. M 3. 4. 5.
4. Под каким номером указано значение эквивалента сульфата натрия в реакции:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl?
1. 2. 3. 1 4. 5.
5. Под каким номером указано число молей эквивалентов серной кислоты в реакции полной нейтрализации, содержащееся в этом веществе массой 4,9 г?
1. 0,2 2. 1,5 3. 2 4. 1 5. 0,1
Текущий тест №4 Строение атома
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Под каким номером указано число энергетических уровней, на которых расположены электроны у атомов с порядковыми номерами 10, 72, 88?
1) 2, 8, 10 2) 2, 7, 10 3) 2, 6, 10 4) 2, 6, 7
2. Под каким номером указано максимальное число электронов на подуровне, характеризующемся орбитальным квантовым числом ℓ = 2?
1) 2ē 2) 6ē 3) 14ē 4) 12ē 5) 10ē
3. Под каким номером приведен химический знак элемента, которому отвечает следующее строение двух последних энергетических уровней:
… 3s23p63d54s2?
1) Zn 2) V 3) Mn 4) Ca 5) Br
4
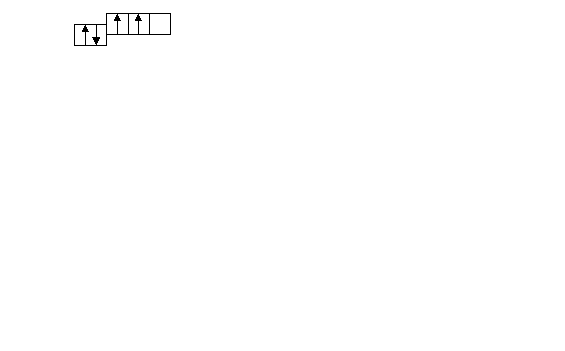 . Какому элементу отвечает следующая схема распределения электронов по подуровням внешнего квантового слоя?
. Какому элементу отвечает следующая схема распределения электронов по подуровням внешнего квантового слоя?1) Sb 2) Pb 3) Ga 4) Po 5) Ti
5. Под каким номером приведен химический знак галогена, максимальная валентность для которого не совпадает с номером группы?
1) F 2) Cl 3) Br 4) J 5) At
Текущий тест №5 Растворы
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Укажите номер или сумму условных номеров, под которыми расположены вещества, при смешивании умеренного количества которых с водой образуется дисперсная система, называемая суспензией:
1) негашеная известь (CaO) 2) нефть
4) порошок мела (CaCO3) 8) цемент
16) ацетон (CH3COCH3) 32) каустик (NaOH)
2. Чему равна молярная концентрация 10 нормального раствора серной кислоты?
- Чему равно значение объемной доли метана в смеси с азотом содержащей 224 л метана (н.у.) и 30 моль азота?
Текущий тест №6 Химическая термодинамика.
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. По какой формуле рассчитывается ΔGр в стандартных условиях для реакции:
2FeO +3/2 O2 → Fe2O3?
2. Термохимическое уравнение окисления меди: 2Cu(к) + O2(г) = 2CuO(к)
ΔH реак=-324 кДж Сколько кДж тепла выделится при окислении 32г меди?
3. Определите знак изменения энтропии в реакции:
2А(г) + В2(г) → 2А2В(ж) ∆Нор>0
Возможно ли протекание этой реакции при стандартных условиях?
Текущий тест №7 Химическая кинетика и химическое равновесие
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Как изменится скорость прямой реакции C(тв.)+CO2(газ)=2CO(газ) при увеличении давления в 2 раза? Укажите номер, под которым расположен правильный ответ.
1. не изменится 2. увеличится в 4 раза
3. уменьшится в 4 раза 4. увеличится в 2 раза
5. уменьшится в 2 раза
2. Две реакции при 00 протекают с одинаковой скоростью V1=V2, температурный коэффициент скорости первой реакции равен 5, второй – 7. Как будут относиться скорости реакции V1/V2, если реакции проводить при 500С? Укажите номер, под которым расположен правильный ответ.
1. 5 · (50/10) 2. 7/5 3. 5/7
4. 550/10 5. (5/7)50/10
3. В системе установилось равновесие:
H2+Cl2=2HCl ΔH= - 92,3 кДж/моль.
В какую сторону оно сместится при понижении температуры? Укажите номер, под которым расположен правильный ответ.
2. влево 3. вправо 4. не сместится
4. В системе установилось равновесие:
3Fe2O3(кр.)+H2 ↔ 2Fe3O4(кр.)+H20(газ)
В какую сторону сместится равновесие при повышении давления?
1. влево 2. не сместится 3. вправо
Текущий тест №8 Электролитическая диссоциация
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Укажите номер или сумму условных номеров, под которыми расположены неверные утверждения:
1) практически все растворимые соли являются сильными электролитами
2) степень диссоциации хлорида натрия в бензоле больше, чем в воде
4) электролитическая диссоциация происходит под действием электрического тока
8) чем выше растворимость вещества в воде, тем больше степень диссоциации этого вещества.
2. Чему равно число ионов, которые образуются при полной диссоциации молекулы хлорида железа (III)?
3. Укажите номер или сумму условных номеров, под которыми расположены формулы ионов, способных находиться совместно в значительных количествах:
1) Ba2+ и SO42- 2) OH- и H+ 4) Ag+ и S2- 8) NH4+ и Cl-
16) Cu2+ и NO3- 32) Al3+ и OH-
4. Чему равна сумма коэффициентов в полном ионно-молекулярном уравнении реакции между раствором сульфата цинка и избытком раствора гидроксида калия, приводящая к образованию тетрагидроксоцинката? Напишите уравнение реакции в молекулярном, полном и сокращенном ионно – молекулярном видах.
Текущий тест №9 Водородный показатель среды, гидролиз
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Под каким номером указана окраска, которую имеет индикатор лакмус в кислой среде?
1) синий 2) желтый 3) малиновый 4) бесцветный
5) фиолетовый 6) красный
2. Чему равно значение водородного показателя среды, если концентрация ионов водорода равна 10-5 моль/литр
3. Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, подвергающихся гидролизу:
1) K2S 2) Ba(NO3)2 4) CaCO3 8) Na2CO3
16) (NH4)2SiO3 32) BaSO4
4. Напишите в молекулярной и ионно – молекулярной формах уравнение реакции гидролиза Fe2(SO4)3
Текущий тест №10 Окислительно-восстановительные реакции
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Под каким номером приведено уравнение окислительно-восстановительной реакции?
1) CuSO4 + Zn = ZnSO4 + Cu
2) CaCO3 + CO2 + H2O = Ca(HCO3)2
3) SO3 + H2O = H2SO4
4) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
5) NaHCO3 + NaOH = Na2CO3 + H2O
2. Руководствуясь строением атомов, определите, под каким номером указана формула иона, который может быть только окислителем?
1) MnO42- 2) NO3- 3) Br - 4) S2- 5) NO2-
3. Под каким номером приведена формула вещества, являющегося наиболее сильным восстановителем, из числа приведенных ниже?
1) NO3- 2) Сu 3) Fe 4) Ca 5) S
4. Под каким номером указано количество вещества KMnO4 в молях, которое взаимодействует с 10 моль Na2SO3 в реакции, представленной следующей схемой:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O?
1) 4 2) 2 3) 5 4) 3 5) 1
5. Под каким номером приведена реакция диспропорционирования (самоокисления – самовосстановления)?
1) 2H2S + H2SO3 = 3S + 3H2O
2) 4KClO3 = KCl + 3KClO4
3) 2F2 + 2H2O = 4HF + O2
4) 2Au2O3 = 4Au + 3O2
5) 2KClO3 = 2KCl + 3O2
Рубежный тест №1 по темам «Основные понятия и законы химии. Важнейшие классы неорганических соединений. Строение атома. Химическая связь. Растворы.»
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Сколько молекул содержится в 10 мл водорода при н.у.?
2. Разложение бертолетовой соли выражается уравнением
KСlO3 = 2KCl + 3О2. Сколько литров кислорода выделится при разложении 8 моль бертолетовой соли?
3. Запишите химические формулы карбоната магния, нитрата алюминия, гидросульфида меди, сульфата дигидроксохрома (III), сернистой кислоты, гидроксида олова (II).
4. Какие из перечисленных оксидов взаимодействуют с водой: оксид натрия, оксид фосфора(V), оксид азота(I), оксид меди? Если взаимодействие возможно, запишите уравнения реакции.
5. Гидроксид олова Sn(OH)2 амфотерен. Какими реакциями Вы это можете доказать?
6. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: гидросульфат натрия сульфат натрия хлорид натрия.
7. Для атомов 16S, 20Ca и 42Mo
а) приведите электронные формулы атомов этих элементов;
б) приведите краткие электронно-графические формулы атомов этих элементов. Схематично покажите возможность перехода атомов элементов в возбужденное состояние, соответствующее максимальной валентности;
в) приведите краткие электронно-графические формулы атомов этих элементов в возбужденном состоянии, соответствующем максимальной валентности и укажите его максимальную валентность;
г) приведите краткую электронно-графическую формулу для иона Ge+4.
8. Определите типы связей между атомами в молекулах HCl, Br2, KNO2
HCl BrBr KON=O
9. Определите тип гибридизации электронных облаков атома серы в молекуле SO3, геометрическую форму и полярность данной молекулы.
10. Определите тип межмолекулярного взаимодействия между молекулами водорода и хлороводорода.
11. Плотность 10% раствора сульфата марганца равна 1,102 г/мл. Рассчитайте его молярность и нормальность.
12. Имеется раствор гидроксида калия объемом 500 мл. На титрование 10 мл этого раствора было израсходовано 9,2 мл раствора соляной кислоты с молярной концентрацией эквивалента 0,1 моль/л. Определить массу КOH в исходном растворе.
Рубежный тест №2 по теме «Химическая термодинамика и кинетика. Окислительно-восстановительные процессы»
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
1. Реакция протекает практически до конца, если в водном растворе реагируют
1 моль хлорида кальция + 2 моль нитрата натрия
1 моль хлорида железа (III) + 3 моль гидроксида натрия
1 моль сульфата бария + 2 моль хлороводородной кислоты
1 моль сульфата калия + 2 моль хлороводорода
Объясните, почему Вы выбрали этот ответ (или эти ответы).
2. Рассчитайте молярность и моляльность 10% раствора хлорида кальция (=1,083г/мл)
3. Какова энтальпия образования аммиака, если на разложение 2 моль NH3 затрачивается 92 кДж?
4. Рассчитайте, возможна ли при 300оС реакция
Fe2O3 + C → 2Fe + 3CO S0(Fe) = 27 Дж / К. моль
5. Исходя из знака ∆Gреакции SnO2 + Sn = 2 SnO ∆Go298 >0.
Сделайте вывод о том, какая степень окисленности более характерна для олова. Почему?
6. Рассчитайте, во сколько раз следует увеличить СВ2 в системе
2А2(г) + В2(г)→ 2А2В, чтобы при уменьшении СА2 в 4 раза, скорость реакции не изменилась?
7. На сколько градусов надо повысить температуру, чтобы при температурном коэффициенте, равном 3, скорость реакции увеличилась в 81 раз? Ответ обоснуйте.
8. Напишите выражения Кравн. для реакций
TiO2 + 2C ↔ Ti + 2CO H0р > O
2H2 + O2 ↔ 2H2O(г) H0р < O
Укажите, куда сместится равновесие при:
а) уменьшении давления б) нагревании
9. Какую реакцию среды имеют водные растворы карбоната натрия, хлорида железа (III), нитрата калия? Ответ подтвердите уравнениями гидролиза этих солей. Рассчитайте рН 10-2 М раствора хлорида аммония.
10. Выпадет ли осадок при сливании равных объемом 10-4 М раствора нитрата серебра и 10-4 М раствора хлорида калия? Ответ обоснуйте.
11. Составьте схему электронного баланса и укажите, какое количество вещества сероводорода взаимодействуют с шестью моль перманганата калия в реакции:
KMnO4+ H2S + H2SO4 S + MnSO4 + K2SO4 + H2O
12. Чему равно значение молярной массы металла, который в гальваническом элементе, составленном из стандартного медного и стандартного ртутного электродов, является анодом?
Перечень примерных экзаменационных вопросов
по итогам освоения дисциплины
(ОК 1, ОК-6, ОК- 7, ОК-8, ОК-9, ОК-11, ОК-12, ОК-13)
Основные законы и понятия химии.
- Важнейшие классы неорганических соединений.
- Электронная оболочка атома. Атомная орбиталь. Характеристика электрона в атоме. Квантовые числа.
- Многоэлектронные атомы. Порядок заполнения электронами энергетических уровней, подуровней, орбиталей. Принцип Паули. Принцип наименьшей энергии (правила Клечковского). Правило Гунда.
- Структура Периодической системы Д.И.Менделеева с точки зрения современной теории строения атома. Период. Группа. Главная и побочная подгруппы. s-, p-, d-, f-электронные семейства элементов. Валентные электроны.
- Зависимость свойств атома элемента (орбитальный радиус, энергия ионизации, сродство к электрону, электроотрицательность) от строения электронной оболочки.
- Ковалентная связь. Основные положения метода валентных связей. Свойство ковалентной связи – насыщаемость. Валентность элемента. Возбужденное состояние атома элементов.
- Ковалентная связь. Свойство ковалентной связи – направленность. σ- и π-связи. Одинарные и кратные связи. sp-, sp2-, sp3-гибридизация атомных орбиталей. Правило определения геометрической формы молекулы.
- Ковалентная связь. Свойства ковалентной связи. Дипольный момент. Полярность молекул.
- Ионная связь. Степень ионности. Зависимость между ионностью связи и положением элемента в периодической системе элементов Д.И.Менделеева. Свойства ионной связи.
- Металлическая связь. Свойства металлической связи.
- Жидкое состояние вещества (жидкости). Силы Ван-дер-Ваальса. Водородная связь. Взаимосвязь типа межмолекулярной связи и полярности молекул с температурой кипения жидкости.
- Твердое состояние вещества (твердые тела). Кристаллическое состояние. Классификация кристаллов. Аморфное состояние.
- Энтальпия системы. Стандартные условия. Энтальпия образования вещества. Энтальпия реакции. Эндотермические и экзотермические реакции.
- Энтропия системы. Изменение энтропии при химических реакциях. Второй закон термодинамики.
- Энергия Гиббса системы. Направленность химических процессов. Энергия Гиббса образования вещества. Расчет энергии Гиббса реакции в стандартных условиях и температурах отличных от стандартных.
- Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс. Константа скорости. Кинетические уравнения гомогенных и гетерогенных реакций.
- Зависимость скорости реакции от температуры. Температурный коэффициент. Уравнение Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- Необратимые и обратимые процессы. Химическое равновесие. Константа равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- Жидкие растворы. Энтальпия растворения. Сольваты (гидраты). Кристаллогидраты. Кристаллизационная вода.
- Растворы. Методы выражения количественного состава растворов. Доля. Молярная, нормальная и массовая концентрации. Моляльность.
- Растворы неэлектролитов. Общие свойства растворов неэлектролитов. Давление насыщенного пара растворителя над раствором. Температура кипения и температура замерзания растворов. Закон Рауля. Эбуллиоскопическая и криоскопическая постоянные растворов.
- Растворы электролитов. Диссоциация. Механизмы диссоциации соединений с ионной и полярной ковалентной связью. Диэлектрическая проницаемость.
- Сильные и слабые электролиты. Степень диссоциации. Константа диссоциации. Диссоциация кислот, оснований и солей.
- Электролитическая диссоциация воды. Ионное произведение воды. Нейтральная, кислая и основная среды. Водородный показатель (pH). Индикаторы.
- Обратимые и необратимые реакции в растворах. Ионные уравнения. Случаи необратимости реакций в растворах. Реакции ионного обмена.
- Гидролиз солей. Степень гидролиза, константа гидролиза, факторы, влияющие на полноту протекания процесса.
- Произведение растворимости. Условия выпадения и растворения осадка.
- Окислительно-восстановительные реакции (ОВР). Понятие о степени окисления элементов. Окисление. Восстановление. Восстановитель. Окислитель.
- Составление уравнений окислительно-восстановительных реакций электронно-ионным методом. Типы ОВР.
- Взаимосвязь окислительно-восстановительных свойств элементов с положением элемента в Периодической системе элементов Д.И. Менделеева.
- Механизм возникновения электродного потенциала на границе металл-электролит. Влияние различных факторов на величину электродного потенциала. Уравнение Нернста. Измерение электродного потенциала. Ряд стандартных электродных потенциалов.
- Химические источники электрической энергии. Гальванический элемент. Аккумулятор. Устройство и принцип работы гальванического элемента. Электрохимическая схема гальванического элемента. Э.Д.С. гальванического элемента. Химические и концентрационные гальванические элементы.
- Электролиз расплавов. Электролиз водных растворов электролитов с инертным и активным анодом.
- Понятие о коррозии металлов и способах антикоррозионной защиты.
- Важнейшие классы органических соединений. Углеводороды. Кислородсодержащие органические соединения.
- Реакции полимеризации и поликонденсации. Наиболее распространенные полимеры. Природные, искусственные и синтетические полимерные материалы.
- Качественные реакции на катионы и анионы.
7. УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ
а) основная литература
1. Глинка Н.Л. Общая химия.: Учеб. для студентов нехимических спец. вузов – М.: Интеграл-пресс, 2010. – 728 с.
2. Коровин Н.В. Общая химия: Учеб. для технических направлений и спец. вузов. – М.: Высшая школа, 2009. – 557 с.: ил.
3. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов. / Под ред. Рабиновича В.А. и Рубиной Х.М.. При участии Алексеевой Т.Е., Платуновой Н.Б., Рабиновича В.А., Рубиной Х.М., Хрипуновой Т.Е.. – М.: Интеграл-пресс, 2007. – 240 с.
4. Рыбальченко В.С. Лабораторный практикум по общей химии. РГУ нефти и газа им. И.М. Губкина, 2006 г.
б) дополнительная литература
1. Рыбальченко В.С., Болдырева О.Г. Техника лабораторных работ. Методы разделения и очистки веществ. Учебное пособие к лабораторному практикуму по общей химии. РГУ нефти и газа им. И.М. Губкина, 2007 г.
2. Рыбальченко В.С., Болдырева О.Г. Важнейшие классы неорганических соединений. Учебное пособие к лабораторному практикуму по общей химии. РГУ нефти и газа им. И.М. Губкина, 2007 г.
8. МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ
Специализированные лаборатории по общей и неорганической химии должны иметь площади, соответствующие правилам техники безопасности и средствами индивидуальной защиты, укомплектованы необходимым лабораторным оборудованием и реактивами для проведения работ, предусмотренных учебным планом; дополнительно снабжены интерактивными досками комплексом мультимедийного оборудования для проведения лабораторных и практических занятий на современном уровне. В качестве вспомогательных лабораторных помещений необходимо наличие препараторской и склада для хранения часто используемых в лабораторном практикуме реактивов.
Лекционные аудитории должны быть оборудованы для демонстрации эксперимента (иметь препараторскую, тягу, газифицированы) и также снабжены интерактивной доской и мультимедийным комплексом.
При реализации программы по дисциплине «Общая химия» используются следующие образовательные технологии:
- мультимедийный курс лекций (с использованием ПК и мультимедиа проектора);
- лабораторные работы и практические занятия проводятся в специализированных лабораториях, снабженных необходимым оборудованием и химической посудой; для активизации процесса освоения приемов лабораторного эксперимента студенты кооперируются в группы по 2-3 человека, что позволяет коллективно обсуждать его результаты и формулировать выводы;
- самостоятельная работа студентов включает решение задач расчетного характера, подготовку и завершение оформления лабораторных работ, подготовку к контрольным мероприятиям, посещение консультаций, изучение основного и дополнительного материала по учебникам и пособиям, работу на компьютере и в библиотеке, экзамену и т.п.
Программа составлена в соответствии в соответствии с требованиями Федерального образовательного стандарта высшего профессионального образования для подготовки бакалавров по направлению 151000 «Технологические машины и оборудование», с учетом рекомендаций ПрООП ВПО по данному направлению.
Автор:
проф. Рыбальченко В.С.
Заведующий кафедрой:
чл.-корр. РАН, д.х.н., проф. Дедов А.Г.
Программа одобрена на заседании УМК факультета инженерной механики РГУ нефти и газа им. И.М. Губкина от_______________года, протокол №__________.
Председатель учебно-методической комиссии
факультета__________________________________
Начальник УМУ______________________________Макаров А.Д
