Бактерии-деструкторы ароматических углеводородов и их хлорпроизводных: разнообразие, особенности метаболизма, функциональная геномика 03. 02. 03 Микробиология
| Вид материала | Автореферат диссертации |
СодержаниеHalomonas taeanensis Thalassospira permensis 4.2. Двухкомпонентная бактериальная ассоциация, осуществляющая полную деструкцию 2,4’-дихлорбифенила Arthrobacter, Janibacter |
- Рабочей программы учебной дисциплины (модуля) микробиология, 48.16kb.
- Твердофазная люминесценция полициклических ароматических углеводородов в условиях адсорбционного, 262.95kb.
- Задание егэ по теме «Углеводороды» а задания, 45.66kb.
- «Взаимосвязь предельных, непредельных и ароматических углеводородов», 11.54kb.
- Свистунова наталья Юрьевна биологические особенности лекарственных и ароматических, 416.08kb.
- Вопросы для подготовки к зачету по дисциплине: «Эксплуатационные материалы», 51.34kb.
- Оценка фотодинамического воздействия in vitro на бактерии из микробоценозов ротовой, 331.98kb.
- Функциональная и рецепторная характеристика белков суперсемейства иммуноглобулинов, 1127.13kb.
- Бактерии рода enterococcus в озере байкал: Распределение, видовой состав, механизм, 275.08kb.
- Ароматические углеводороды. Бензол представитель аренов. Строение молекулы и физические, 54.51kb.
Примечание. «+» - рост (колонии размером 1-3 мм); «» – слабый рост (колонии размером менее 1 мм); «» - отсутствие роста бактерий.
*Рост фиксировался по образованию биопленки на агаризованной среде. При росте на полноценной среде в присутствии 240 г/л и 290 г/л NaCl присутствовали только колонии штамма Chromohalobacter sp. SMB17.
Галотолерантные штаммы Arthrobacter sp. SMВ11 и Arthrobacter sp. SMВ145 филогенетически близки (99.7% сходства нуклеотидных последовательностей гена 16S рРНК) к A. сrystallopoietes (см. раздел 1.1). Штаммы росли на нафталине, салицилате и ацетате (интермедиаты деструкции нафталина), а также бензойной и пара-гидроксибензойной кислотах.
Грамположительный штамм SMB14 (=ВКМ Ас-2280Т =LMG 22207) на основании результатов изучения генотипических, хемотаксономических и морфо-физиологических характеристик был валидно описан как новый вид Brevibacterium permense. Штамм рос на бензойной, парагидроксибензойной кислотах и ацетате как единственном источнике углерода и энергии, а также на полноценной среде Раймонда без NaCl в среде культивирования и при концентрации соли до 120 г/л (табл. 6).
Штамм SMB17 - умеренно галофильная бактерия семейства Halomonadaceae, растет на средах при 30–290 г/л NaCl и не растет в отсутствии соли (табл. 6). Сравнительный анализ нуклеотидной последовательности гена 16S рРНК (около 1470 п.н.) показал, что штамм входит в филогенетический кластер, включающий представителей рода Chromohalobacter, и наиболее близок (более 99% сходства 16S рРНК генов) к C. canadensis ATCC 43984Т, C. beijerinckii ATCC 19372Т и C. japonicus CECT 7219T. Штамм растет на бензойной, парагидроксибензойной кислотах и ацетате.
Ассоциация бактерий SMB3. Изучение влияния солености среды на рост консорциума SMB3 в минеральной среде Раймонда с нафталином в качестве единственного источника углерода и энергии показало, что максимальные значения оптической плотности культуры наблюдаются при 30 г/л NaCl и в отсутствие соли. Увеличение концентрации хлорида натрия в среде культивирования до 90 г/л приводило к снижению показателей ростовых характеристик. При более высоких концентрациях соли увеличения оптической плотности не зафиксировано (рис. 19). Из исследуемой ассоциации выделено семь штаммов бактерий (табл. 7), отличающиеся между собой и от выделенных ранее из района солеразработок бактерий по фенотипическим и генотипическим характеристикам (REP-, BOX-ПЦР и ARDRA).
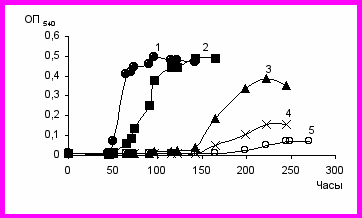
Рис. 19. Рост ассоциации SMB3 в минеральной среде Раймонда с нафталином при разных концентрациях NaCl (г/л). 1 – без соли, 2 – 30, 3 – 60, 4 – 75, 5 90.
В состав ассоциации входят Rhodococcus sp. SMB37 и Rhodococcus sp. SMB38 - деструкторы нафталина (см. раздел 1.2.), а также штаммы, не деградирующие данное соединение (бактерии-спутники) (табл. 7), характеристики которых приводятся ниже.
Штамм Halomonas sp. SMB31, согласно филогенетическому анализу (16S рРНК), наиболее близок к Halomonas taeanensis (уровень сходства 99.8%) и характеризуется фенотипическими признаками, свойственными роду.
Таблица 7. Рост бактерий из ассоциации SMB3 на полноценной и минеральной (с нафталином) средах в присутствии разных концентраций NaCl (г/л)
| Штамм | полноценная среда * | минеральная среда с нафталином** | |||||||
| 0 | 30 | 80 | 100 | 170 | 300 | 0 | 75 | 90 | |
| Halomonas sp. SMB31 | – | +++ | +++ | +++ | ++ | + | – | – | – |
| Arthrobacter sp. SMB32 | +++ | +++ | +++ | + | – | – | – | – | – |
| Microbacterium sp. SMB33 | +++ | +++ | +++ | ++ | – | – | – | – | – |
| Thalassospira permensis SMB34 | +++ | +++ | +++ | – | – | – | – | – | – |
| Salinicola socius SMB35 | + | +++ | +++ | +++ | ++ | + | – | – | – |
| Rhodococcus sp. SMB37 | +++ | +++ | +++ | + | – | – | +++ | + | – |
| Rhodococcus sp. SMB38 | +++ | +++ | +++ | + | – | – | +++ | +++ | + |
Примечание. * – рост на полноценной агаризованной среде Раймонда, ** – рост в жидкой минеральной среде Раймонда с нафталином, «–» – нет роста, «+» – «+++» – активность роста.
Штамм SMB35 образует периферическую ветвь в филогенетическом кластере, включающем роды Halomonas, Cobetia и Chromohalobacter. Уровни сходства 16S рРНК гена штамма SMB35 и видов рода Halomonas - в пределах 90.6% - 95.1%. Наиболее высокие величины сходства (95.0-95.1%) обнаружены с тремя видами рода Halomonas – H. pacifica, H. taeanensis и H. ventosae. Штамм SMB35 отличается также от видов Halomonas sensu stricto и близкородственных видов Halomonas, а также от представителей других родов семейства Наlomonadaceae по фенотипическим характеристикам (подвижность и характер расположения жгутиков, диапазон концентраций NaCl, при которых возможен рост, способность гидролизовать крахмал, желатину, твин 80, мочевину). На основании вышеперечисленных характеристик, а также отличий по содержанию Г+Ц-пар в ДНК, штамм SMB35 (=ВКМ В 2397Т =DSM 19940Т) валидно описан в качестве нового рода и вида Salinicola socius в семействе Halomonadaceae.
Штамм SMB34 (сем. Rhodospirillaceae) является аэробом, хемоорганотрофом, клетки - изогнутые палочки, подвижные (один полярный жгутик). Оксидазо- и каталазоположительные. Штамм растет как в отсутствии NaCl, так и при высокой солености среды культивирования (до 80 г/л соли). Филогенетический анализ (16S рРНК) показал, что штамм группируется с представителями рода Thalassospira и имеет наиболее высокий уровень сходства гена 16S рРНК (99.5%) с T. xiamenensis M-5T. Уровень сходства с типовым штаммом типового вида рода Thalassospira (T. lucentensis QMT2T) - 96.6%. Состав жирных кислот SMB34 и референтных штаммов оказался близким, преобладали C18:1ω7, C16:0 , C18:0, C16:1ω7c, C17:0 cyclo. Однако у штамма SMB34 дополнительно выявлены iso-C15:0 и anteiso-C15:0, не обнаруженные у близкородственных видов. Уровень ДНК-ДНК сходства между штаммом SMB34 и типовыми штаммами (T. xiamenensis M-5T , T. tepidiphila 1-1BT и T. profundimaris WPO211T) не превышает 50%. Основываясь на перечисленных выше данных, штамм SMB34 (=ВКМ B 2527T =NBRC 106175T) отнесен к новому виду «Thalassospira permensis».
Штаммы SMB32 и SMB33 на основании филогенетического анализа и ряда фенотипических признаков на данном этапе исследований определены как Arthrobacter sp. (группа «A. nicotianae») и Microbacterium sp., соответственно. Штаммы являются компонентами нафталинметаболизирующего консорциума SMB3, способны использовать в качестве единственного источника углерода и энергии интермедиаты деструкции нафталина – салицилат и гентизат.
Галотолерантные штаммы Rhodococcus sp. SMB37, Rhodococcus sp. SMB38, Arthrobacter sp. SMB32 и Microbacterium sp. SMB33 способны к росту на полноценной среде Раймонда без и в присутствии NaCl до 100 г/л , а «Thalassospira permensis» SMB34 растет при концентрации соли до 80 г/л в среде культивирования (табл. 7). Умереннно галофильные, согласно классификации Кашнера (Кашнер, 1981; Ventosa et al., 1998), штаммы SMB31 и SMB35 (сем. Halomonadaceae) растут на полноценной среде Раймонда при 30 - 300 г/л NaCl; оптимальный рост – при 30-100 г/л NaCl в среде культивирования.
Штаммы Halomonas sp. SMB31 и Salinicola socius SMB35 при росте в минеральной среде Раймонда с глюкозой в качестве субстрата в условиях высокой осмолярности среды (50, 100 г/л NaCl) внутриклеточно накапливали эктоин и глутамат. В клетках S. socius при росте в присутствии 100 г/л NaCl был дополнительно обнаружен гидроксиэктоин. Полученные результаты о качественном составе осмопротекторов представителей семейства Halomonadaceae согласуются с литературными данными (Calderon et al., 2004; Vargas et al., 2006).
4.1.2. Протокооперация в нафталинметаболизирующем консорциуме бактерий SMB3
Поскольку бактерии-спутники консорциума SMB3 способны расти на интермедиатах катаболизма нафталина (салицилате, гентизате, ацетате), было проведено исследование влияния промежуточных метаболитов деструкции нафталина на структуру консорциума, используя метод ДГГЭ и подсчет КОЕ. Установлено, что культивирование консорциума на ацетате, салицилате и гентизате приводит к элиминации ряда бактерий, в то время как при инкубировании с нафталином в качестве единственного источника углерода и энергии состав стабильно сохраняется. Наблюдаемое уменьшение биоразнообразия консорциума SMB3 при смене источника углерода и энергии (нафталина на промежуточные продукты его метаболизма) можно объяснить сокращением звеньев трофической цепи, что ведет к конкуренции между бактериальными популяциями, трансформирующими одинаковый субстрат. Полученные результаты доказывают, что в ассоциации присутствуют сформированные трофические связи, в которых каждый член сообщества занимает определенную экологическую нишу.
Изучены кинетические параметры роста модельных смешанных культур на нафталине в условиях высокой солености среды. В экспериментах были использованы родококки - деструкторы нафталина SMB37 и SMB38, умеренно галофильный штамм Halomonas sp. SMB31 в следующих вариантах: штаммы SMB37 и SMB31 (I); штаммы SMB38 и SMB31 (II); штаммы SMB37, SMB38 и SMB31 (III). Контроль качественного состава смешанных культур бактерий осуществляли методом ДГГЭ. Результаты электрофореза подтверждают данные, полученные на основе макроморфологических свойств бактерий (подсчет КОЕ).
Показано, что умеренно галофильная бактерия Halomonas sp. SMB31 сохраняется в составе смешанных культур при культивировании на нафталине и, более того, способна к эффективному росту (рис. 20 А,Б). При совместном культивировании штаммов-деструкторов с умеренно галофильной культурой Halomonas sp. SMB31 значительно сокращается lag-период и увеличивается удельная скорость роста Rhodococcus sp. SMB38, а также увеличивается количество клеток Rhodococcus sp. SMB37 (рис. 20 В).
I вариант II вариант
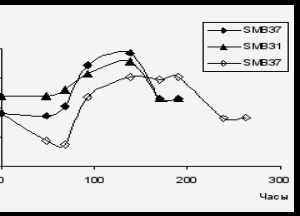
III вариант
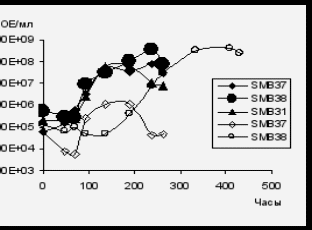
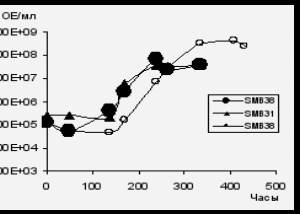
Рис. 20. Рост модельных ассоциаций и индивидуальных штаммов-деструкторов в среде Раймонда на нафталине в присутствии 70 г/л NaCl. Не заштрихованные маркеры – индивидуальные бактерии, заштрихованные маркеры – штаммы в составе ассоциаций.
Результаты модельных экспериментов, демонстрирующие наличие взаимовыгодных отношений между деструкторами и бактериями-спутниками в искусственно созданных ассоциациях, могут быть спроецированы как на отношения организмов в полученных нами путем селекции консорциумах (SMB1, SMB3), так и на отношения в микробиоценозах природных и техногенных экосистем. По всей вероятности, описанные выше взаимодействия между бактериями в условиях высокой осмолярности среды связаны с обменом осмопротекторными соединениями между членами микробных сообществ (консорциумов). Способность синтезировать осмолиты была нами выявлена у умеренно галофильных бактерий сем. Наlomonadaceae (см. раздел 4.1.1.) и галотолерантных бактерий из ассоциаций SMB1, SMB3 (см. раздел 1.5.).
4.2. Двухкомпонентная бактериальная ассоциация, осуществляющая полную деструкцию 2,4’-дихлорбифенила
Штамм-деструктор хлорбифенилов Microbacterium sp. B51 не осуществляет полную утилизацию 2,4’диХБ, а разлагает его до 4ХБК (см. раздел 2.1, табл. 4). Для дополнения полного пути разложения 2,4’диХБ, утилизации хлорбензоата (рис. 21), был использован штамм-деструктор 4ХБК Arthrobacter sp. Н5 (см. раздел 3). При совместном культивировании штаммов Microbacterium sp. В51 и Arthrobacter sp. Н5 полная деструкция 2,4’диХБ и 4ХБК осуществляется за 58 часов. О минерализации 2,4’диХБ данной двухкомпонентной культурой свидетельствует и накопление в культуральной жидкости свободных ионов хлора: к 82 часам их количество составило 100% от теоретически возможного.
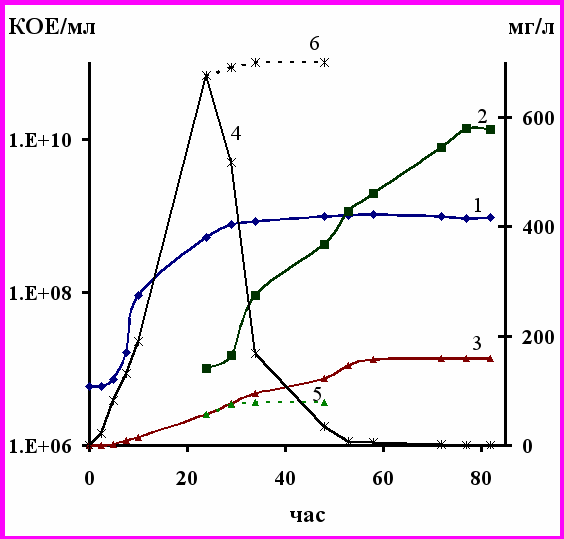
Рис. 21. Деструкция 2,4’-дихлорбифенила двухкомпонентной бактериальной ассоциацией: 1 – рост Microbacterium sp. B51; 2 – рост Arthrobacter sp. H5; 3 - Cl-; 4 - 4ХБК; 5 - Cl- (без внесения Arthrobacter sp. H5); 6 - 4ХБК (без внесения Arthrobacter sp. H5). Стрелкой указан момент внесения штамма Н5.
Деструкция 2,4’диХБ сопровождалась интенсивным ростом бактерий, о чем свидетельствует увеличение КОЕ штамма В51 в два раза, а штамма Н5 – в три раза. На основании полученных результатов можно сказать, что созданная нами двухкомпонентная ассоциация осуществляет деструкцию 2,4’диХБ эффективнее, чем описанные ранее смешанные культуры (Fava et al., 1994, 1996; Potrawfke et al., 1998). Одним из важных моментов, влияющих на активность деградации токсикантов, являются особенности взаимодействия бактерий в ассоциации (Davey, O’Toole, 2000; Christensen et al., 2002). Анализ параметров роста штаммов В51 и Н5 при совместном культивировании на 2,4’диХБ выявил отсутствие антагонистического действия штаммов друг на друга.
Таким образом, на примере изучения экспериментально созданной ассоциации штаммов Microbacterium sp. В51 и Arthrobacter sp. Н5 показана возможность создания комбинаций бактерий-деструкторов, которые могли бы служить основой при создании биопрепаратов, использующихся для ремедиации объектов окружающей среды от устойчивых токсичных поллютантов – полихлорированных бифенилов.
Заключение
Применение микроорганизмов для очистки окружающей среды от токсичных, устойчивых к разложению поллютантов в настоящее время приобретает все большие масштабы. Бактерии рассматриваются как перспективные объекты для создания новых экотехнологий и являются предметом всесторонних исследований. Эффективность методов биоремедиации определяется как способностью используемых организмов к полной деградации целевых токсикантов или их разложения до менее токсичных интермедиатов (утилизируемых основной массой участников микробиоценозов), так и активностью создаваемых биопрепаратов (технологий) в широком диапазоне физико-химических условий. В результате скрининга более 500 штаммов-деструкторов полициклических ароматических углеводородов и полихлорированных бифенилов, были выявлены и детально охарактеризованы бактерии различных эволюционных групп, способные разлагать токсиканты в широком диапазоне температур (от +4 до 40ºС), солености (до 80-90 г/л NaCl) и рН среды (от 5 до 9). В их числе протеобактерии (Pseudomonas, Alcaligenes, Flavobacterium), актинобактерии (Arthrobacter, Brevibacterium, Cellulomonas, Microbacterium, Rhodococcus, Dietzia, Janibacter, Kocuria, Streptomyces), спорообразующие бактерии семейства Bacillaceae (Bacillus, Paenibacillus).
При исследовании галотолерантных нафталинметаболизирующих бактериальных консорциумов, выделенных из техногеннозасоленных почв, было продемонстрировано наличие протокооперативных отношений между их компонентами (бактериями-деструкторами ПАУ и бактериями-спутниками). Показано положительное влияние умеренно галофильных бактерий семейства Halomonadaceae (постоянных членов данных консорциумов), синтезирующих осмопротекторные соединения, на процесс разложения ПАУ в условиях повышения солености среды. Полученные результаты, несомненно, внесут существенный вклад в стратегии усовершенствования методов биоремедиации засоленных экосистем.
В результате изучения бактерий-деструкторов бифенила/ПХБ были впервые обнаружены грамположительные бактерии, осуществляющие полное разложение моно(ди)хлорбифенилов: Microbacterium sp. В51 - орто-моно(ди)ХБ; Rhodococcus ruber Р25 (=ИЭГМ 896) – (орто)пара-моноХБ и 2,4’диХБ, характеризующиеся уникальными особенностями утилизации индивидуальных хлорбифенилов и их смесей - как в минеральных средах, так и в модельных почвенных системах. Штаммы могут применяться для восстановления почв, водоемов и деструкции промышленных смесей, содержащих хлорбифенилы (Патент РФ №2262531). Было также показано, что полное разложение 2,4’-дихлорбифенила эффективно осуществляется двухкомпонентным модельным консорциумом, включающим Microbacterium sp. В51 (осуществляет деструкцию 2,4’-дихлорбифенила до 4 хлорбензойной кислоты) и Arthrobacter sp. H5 (деструктор 4-хлорбензоата). Использование ассоциаций микроорганизмов, содержащих дополняющие друг друга метаболические пути разложения какого-либо субстрата, является одной из стратегий детоксикации сложных органических поллютантов и лежит в основе создании современных биопрепаратов.
Клонирование fcb- и ohb-генов, контролирующих пара-дегалогенирование 4ХБК и орто-дегалогенирование 2-/2,4ХБК, соответственно, и конструирование рекомбинантных путей полной деградации хлорбензоатов в клетках P. putida определило новые подходы к созданию штаммов микроорганизмов, способных к эффективной деструкции и/или детоксикации различных ксенобиотиков-поллютантов. На основе этих генов был создан ряд генетически модифицированных штаммов, осуществляющих эффективную утилизацию орто /пара-хлорбифенилов и коммерческих смесей ПХБ.
У активных бактерий-деструкторов ПАУ и бифенила/ПХБ родов Arthrobacter, Janibacter, Rhodococcus и Pseudomonas были изучены ключевые гены начального этапа разложения этих соединений. Нуклеотидные последовательности этих функциональных генов (har, bph) включены в международные базы данных GenBank/EMBL/DDBJ. Показано, что у актинобактерий har, bph гены характеризуются большим полиморфизмом по сравнению с аналогичными функциональными генами протеобактерий рода Pseudomonas. Накопление информации о структуре генов/оперонов, определяющих ключевые моменты метаболизма токсичных соединений, имеет важное значение для развития системной биологии с целью применения ее достижений в биодеградации (Trigo et al., 2009). Подходы системной биологии, учитывающие в максимальной степени результаты экологических исследований и информацию в сфере геномики, метагеномики, протеомики и метаболомики, являются наиболее перспективными как для понимания молекулярных механизмов биодеградации трудноразлагаемых поллютантов в условиях микробиоценозов, так и для создания биопрепаратов (биотехнологий), активных в определенных биологических и физико-химических условиях, оптимизации протекания биодеградативных процессов.
Проведенные исследования выявили значительный пласт не исследованного ранее микробного разнообразия. На основании филогенетической обособленности и фенотипических отличий от ближайших таксонов, обнаружены организмы нового рода и новых видов бактерий, в их числе, характеризующиеся биодеградативными свойствами. Ряд из них (Salinicola socius, Brevibacterium permense, Brevibacterium antiquum и Brevibacterium аurantiacum) валидно описаны в соответствии с международными правилами, описания других («Rhodococcus naphthalenivorans» sp. nov., «Thalassospira permensis» sp. nov.) представлены в настоящее работе. Важным результатом таксономического направления исследований явилось упорядочение таксономической структуры рода Brevibacterium и доказательство наличия среди оранжево-пигментированных организмов нескольких видов внутри этого рода. Обоснование создания нового рода Salinicola для штамма SMB35 из нафталинметаболизирующего консорциума явилось важным этапом в развитии системы классификации филогенетически гетерогенного рода Halomonas и семейства Halomonadaceae в целом. В настоящее время в род Salinicola реклассифицированы некоторые ранее описанные виды родов Halomonas и Chromohalobacter (de la Haba et al., 2009).
