Бактерии-деструкторы ароматических углеводородов и их хлорпроизводных: разнообразие, особенности метаболизма, функциональная геномика 03. 02. 03 Микробиология
| Вид материала | Автореферат диссертации |
- Рабочей программы учебной дисциплины (модуля) микробиология, 48.16kb.
- Твердофазная люминесценция полициклических ароматических углеводородов в условиях адсорбционного, 262.95kb.
- Задание егэ по теме «Углеводороды» а задания, 45.66kb.
- «Взаимосвязь предельных, непредельных и ароматических углеводородов», 11.54kb.
- Свистунова наталья Юрьевна биологические особенности лекарственных и ароматических, 416.08kb.
- Вопросы для подготовки к зачету по дисциплине: «Эксплуатационные материалы», 51.34kb.
- Оценка фотодинамического воздействия in vitro на бактерии из микробоценозов ротовой, 331.98kb.
- Функциональная и рецепторная характеристика белков суперсемейства иммуноглобулинов, 1127.13kb.
- Бактерии рода enterococcus в озере байкал: Распределение, видовой состав, механизм, 275.08kb.
- Ароматические углеводороды. Бензол представитель аренов. Строение молекулы и физические, 54.51kb.
Примечание. «++» - рост; «+» - слабый рост; «» - нет роста.
донорный штамм; реципиентный штамм.
Было установлено, что реципиентный штамм P. putida BS394 способен к слабому росту на среде, содержащей 40 г/л NaCl, но не растет при 60 г/л NaCl, тогда как у трансконъюгантных штаммов был отмечен хороший рост при содержании 60 г/л соли на полноценной среде и при 40 г/л на среде с нафталином в качестве субстрата. В то же время, природный галотолерантный штамм SN11 более устойчив к повышению концентрации NaCl, чем рекомбинантные бактерии (табл. 2). Таким образом, можно предположить, что в плазмидах исследуемых бактерий-деструкторов присутствуют не только гены, участвующие в деградации ПАУ, но и генетические элементы, детерминирующие способность бактерий к росту при повышенной солености среды.
Кроме того, у галотолерантных штаммов Arthrobacter sp. SMВ11 и SMB145, выращенных при повышенной солености среды (50-100 г/л NaCl), были обнаружены низкомолекулярные эндо-метаболиты: эктоин, глутамат, бетаин и трегалоза. Известно, что такие соединения относят к осмопротекторам и они обнаружены у многих галофильных и галотолерантных бактерий. Накопление в клетках организмов осмопротекторов является одним из основных механизмов адаптации микроорганизмов к высокой осмолярности среды (Ventosa et al., 1998; Grant, 2004; Lentzen, Schwarz, 2006). Также нами было показано, что штаммы рода Rhodococcus, выращенные в минеральной среде в присутствии 50 и 80 г/л NaCl с глюкозой в качестве субстрата, накапливали эктоин, гидроксиэктоин и глутамат (табл. 3). Такое сочетание осмолитов в клетках родококков обнаружено впервые.
Таблица 3. Содержание осмопротекторов у деструкторов рода Rhodococcus
| Штамм | Концентрация NaCl, (г/л)* | Содержание осмопротекторов, % от сухого веса биомассы | ||
| Эктоин | Глутамат | Гидроксиэктоин | ||
| SMB37 | 50 | 0.6 | 0.4 | 0.7 |
| SMB37 | 80 | 0.3 | – | 0.35 |
| SMB38 | 50 | 0.6 | 1.4 | 1.4 |
| SMB38 | 80 | 1.2 | 0.6 | 2.0 |
Примечание. * вес/объем в среде культивирования, «–» – вещество не обнаружено.
1.6. Бактериальные гены, контролирующие начальные этапы деструкции нафталина
Первым этапом аэробной деградации нафталина у бактерий является гидроксилирование субстрата до соответствующего cis-дигидродиола, реакция осуществляется мультикомпонентными ферментными системами – диоксигеназами (Larkin, 1999; Gibson, Parales, 2000). Нафталин диоксигеназы (НДО), кодируемые генами nah (штаммы рода Pseudomonas) и nar (штаммы рода Rhodococcus), существенно различаются между собой структурно, сохраняя при этом основные каталитические свойства (Kulakov, 2000). Разнообразие генов, кодирующих α- и β субъединицы НДО, в исследуемых штаммах изучали путем амплификации участка генов nah и nar с последующим гидролизом полученных ампликонов эндонуклеазами рестрикции MseI и HaeIII. ПЦР-анализ с использованием праймеров, разработанных Ferrero с соавторами (Ferrero et al., 2002), показал наличие гена nahAc, кодирующего α-субъединицу НДО, в исследуемых бактериях рода Pseudomonas. Анализ нуклеотидных последовательностей амплифицированного участка nahAc-гена штаммов SN11, DN13, G51 выявил высокую гомологию (99.6-100%) с таковыми референтных штаммов P. putida NCIB9816, NCIB9816-4 и BS202. На рисунке 6 представлена дендрограмма, отображающая сходство нуклеотидных последовательностей, гомологичных гену nahAc, исследуемых и известных штаммов-деструкторов.
Для исследования генов, кодирующих НДО, грамположительных бактерий, нами были сконструированы праймеры, при создании которых были использованы известные нуклеотидные последовательности nar-генов, кодирующих α- и β субъединицы НДО, деструкторов нафталина рода Rhodococcus. С ДНК-матриц родококков были получены ампликоны ожидаемой длины (1936 п. н.) (рис. 7).
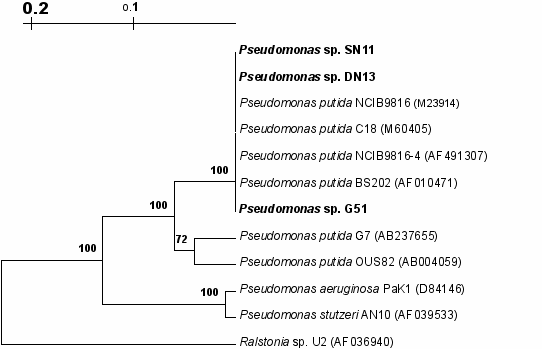

Рис. 6. Дендрограмма, отображающая сходство нуклеотидных последовательностей, гомологичных гену nahAc .
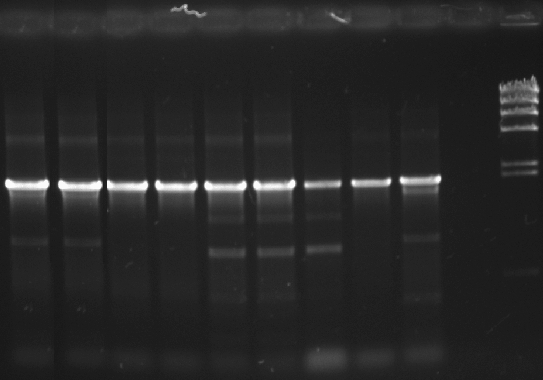
1 2 3 4 5 6 7 8 9 10 11
Рис. 7. Электрофореграмма продуктов амплификации генов narAaAb штаммов-деструкторов рода Rhodococcus: 1 – G10, 2 – P25*, 3 – DB11, 4 – SMB38, 5 – SMB37, 6 – B2-1, 7 – B1-4, 8 – B13, 9 – B14, 10 - отрицательный контроль, 11 – маркер λ HindIII. *Штамм Rhodococcus ruber P25 подробно описывается в разделе 2.2.
В то же время, применение сконструированных праймеров с препаратами ДНК деструкторов нафталина родов Arthrobacter и Bacillus не дало положительных результатов, что свидетельствует о высокой специфичности сконструированных олигонуклеотидов, а также о различии генетических систем деструкции нафталина у разных таксонов грамположительных бактерий.
Анализ нуклеотидных последовательностей ампликонов штаммов В13, В2-1, DB11, SMB38, выделенных из засоленных почв, показал принадлежность исследуемых фрагментов ДНК к семейству nar-генов, и выявил высокую гомологию (98.5-100%) с таковыми известных штаммов-деструкторов полиароматических соединений рода Rhodococcus. На дендрограммах четко прослеживается закономерность выделения взятых в анализ фрагментов narAa-генов и narAb-генов в два кластера (рис. 8). Степень сходства нуклеотидных последовательностей была выше 98% для narAa- и narAb-генов внутри каждого кластера и не превышала 92% для narAa-генов и 90% для narAb-генов между кластерами. На основании проведенного анализа можно предположить наличие двух ветвей эволюции narАаAb-генов у бактерий рода Rhodococcus. Показано, что nar-гены этих штаммов входят в разные группы одного подкластера (рис. 8) с гомологией нуклеотидных последовательностей внутри группы 100%, а между ними - 99%.
А
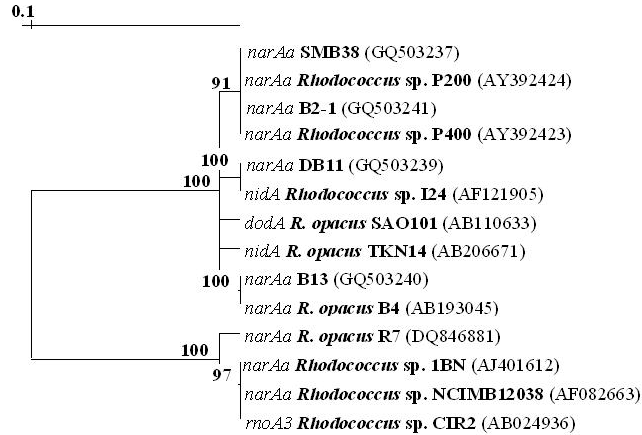
Б
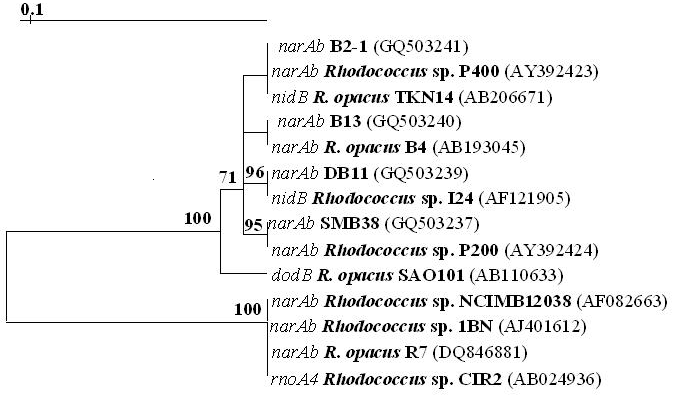
Рис. 8. Дендрограммы, отображающие сходство нуклеотидных последовательностей, гомологичных генам narAa (А) и narAb (Б).
Полученные данные свидетельствуют о разнообразии генетических систем деструкции нафталина бактерий рода Rhodococcus, выделенных из района разработок Верхнекамского месторождения солей.
- Бактерии-деструкторы бифенила/полихлорированных бифенилов
2.1. Характеристика бактерий-деструкторов
Методом накопительного культивирования на бифениле из техногеннозагрязненных почв, грунтов и донных отложений выделено 280 штаммов-деструкторов бифенила, из них детально охарактеризовано 42 штамма. На основании филогенетического анализа и фенотипических характеристик штаммы отнесены к родам: Arthrobacter, Alcaligenes, Cellulomonas, Comamonas, Flavimonas, Flavobacterium, Microbacterium, Pseudomonas, Rhodococcus, Janibacter, Xanthomonas.
Большинство изолированных бактерий росли в диапазоне температур 8-40˚С и рН среды 6-9. У ряда бактерий-деструкторов выявлена способность к росту на полноценной и минеральной (с бифенилом в качестве субстрата) средах в присутствии повышенного содержания NaCl. Так, штаммы Alcaligenes sp. Р39, Pseudomonas sp. B2 и Pseudomonas sp. B106, R. ruber Р25 активно росли на бифениле при содержании 60 г/л соли в среде культивирования и в полноценной среде при 100-120 г/л NaCl.
Более половины изученных деструкторов бифенила способны к росту на нафталине, толуоле, бензоле и феноле, пять штаммов могут осуществлять деструкцию фенантрена. Среди исследованных штаммов выявлены бактерии, которые осуществляли деструкцию хлорированных соединений (2ХБК, 4ХБК, 2,4 Д). Особо следует отметить штаммы R. ruber Р25, Microbacterium sp. B51, Pseudomonas spр. G1, G12 и B106, которые обладают наиболее широкой субстратной специфичностью по отношению к моно(поли)ароматическим соединениям и их хлорпроизводным.
Все исследованные штаммы осуществляли разложение монохлорированного бифенила: при инкубации клеток бактерий с 4моноХБ (500 M) наблюдалось накопление 4ХБК (от 75 M до 230 M, в зависимости от штамма, за 1 час). Для изучения особенностей разложения орто- и пара-ХБ изолированными бактериями в качестве модельного соединения нами выбран 2,4’диХБ, хлорированный по обоим бифенильным кольцам. Все бактерии проявляли активность по отношению к 2,4’диХБ, однако эффективность и характер окислительных способностей штаммов различался. На основании анализа продуктов биодеструкции 2,4’диХБ выделены три группы штаммов, обладающие различными путями деградации данного соединения (табл. 4). У большинства штаммов (группы I и II) при деструкции 2,4'диХБ происходило накопление продукта мета-расщепления дихлорбифенила - 3,8-Cl ГОФДК (max=397 нм), что указывает на 2,3 диоксигенирование пара-хлорированного кольца 2,4'диХБ (Seeger et al., 1995; Seah et al., 2000). Кроме того, все исследованные штаммы группы II накапливали разные количества 4ХБК, что в свою очередь говорит о более глубокой трансформации 2,4'диХБ по пути предпочтительного 2,3-диоксигенирования орто хлорированного кольца. У штамма Р25 наблюдалось существенное уменьшение количества продуктов разложения 2,4'диХБ (3,8-Cl ГОФДК и ХБК), что указывает на эффективную утилизацию не только 2,4'диХБ, но и 4ХБК.
Таблица 4. Разложение 2,4’дихлорбифенила бактериями-деструкторами
| Штамм | ГОФДК, ОП (λ397) | ХБК | |||
| 3 часа | 24 часа | Положе-ние хлора | Концентрация ,%* | ||
| 3 часа | 24 часа | ||||
| I группа (осуществляют окисление пара-хлорированного кольца) | |||||
| Alcaligenes sp. P39 | 0 | 1.36 0.03 | - | 0 | 0 |
| Flavimonas sp. S214 | 3.1 ± 0.11 | 3.05 ± 0.04 | - | 0 | 0 |
| Flavobacterium sp. P38 | 0 | 1.12 0.01 | - | 0 | 0 |
| Pseudomonas sp. B106 | 3.5 ± 0.03 | 2.44 ± 0.02 | - | 0 | 0 |
| Pseudomonas sp. G1 | 3.7 ± 0.08 | 3.48 ± 0.03 | - | 0 | 0 |
| Pseudomonas sp. G11 | 3.1 ± 0.09 | 2.91 ± 0.07 | - | 0 | 0 |
| Pseudomonas sp. G13 | 3.2 ± 0.01 | 3.78 ± 0.05 | - | 0 | 0 |
| Pseudomonas sp. P24 | 4.2 ± 0.3 | 4.48 ± 0.03 | - | 0 | 0 |
| Pseudomonas sp. S1 | 0 | 1.6 ± 0.08 | - | 0 | 0 |
| Pseudomonas sp. S2 | 0 | 2.3 ± 0.04 | - | 0 | 0 |
| Pseudomonas sp. S9 | 0 | 0.6 ± 0.04 | - | 0 | 0 |
| Pseudomonas sp. S13 | 0 | 0.7 ± 0.06 | - | 0 | 0 |
| Pseudomonas sp. S15 | 0 | 1.1 ± 0.04 | - | 0 | 0 |
| Pseudomonas sp. S210 | 1.1 ± 0.04 | 1.72 ± 0.07 | - | 0 | 0 |
| Pseudomonas sp. S212 | 3.0 ± 0.06 | 2.94 ± 0.02 | - | 0 | 0 |
| Rhodococcus sp. P1 | 0 | 0.5 ± 0.04 | - | 0 | 0 |
| Rhodococcus sp. P19 | 0 | 0.1 ± 0.03 | 2 | 0 | 3.0 |
| Janibacter sp. P9 | 3.6 ± 0.02 | 2.7 ± 0.01 | - | 0 | 0 |
| Xanthomonas sp P8 | 1.7 ± 0.04 | 4.1 ± 0.08 | - | 0 | 0 |
| II группа (осуществляют окисление орто- и пара-хлорированных колец) | |||||
| Arthrobacter sp. P29 | 2.1 ± 0.07 | 1.79 ± 0.02 | 4 | 28.4 | 46.7 |
| Arthrobacter sp. B107 | 1.8 ± 0.03 | 2.01 ± 0.03 | 4 | 30.3 | 43.1 |
| Cellulomonas sp. P27 | 0.8 ± 0.04 | 0.84 ± 0.03 | 4 | 67.0 | 97.0 |
| Cellulomonas sp. P28 | 0.6 ± 0.07 | 0.64 ± 0.03 | 4 | 70.0 | 66.0 |
| Flavobacterium sp. G14 | 3.3 ± 0.09 | 3.40 ± 0.04 | 4 | 0 | 7.0 |
| Microbacterium sp. P26 | 1.1 ± 0.05 | 3.240.01 | 4 | 38.7 | 68.7 |
| Pseudomonas sp. B2 | 4.0 ± 0.06 | 3.96 ± 0.02 | 4 | 5.4 | 10.0 |
| Pseudomonas sp. B7 | 2.7 ± 0.03 | 1.60 ± 0.01 | 4 | 9.3 | 14.0 |
| Pseudomonas sp. B8 | 1.6 ± 0.06 | 1.69 ± 0.02 | 4 | 48.0 | 64.0 |
| Pseudomonas sp. P22 | 0.7 ± 0.05 | 0.87 ± 0.05 | 4 | 72.0 | 74.0 |
| Pseudomonas sp. P23 | 0.3 ± 0.08 | 0.36 ± 0.01 | 4 | 70.6 | 84.0 |
| Rhodococcus sp. G10 | 2.9 ± 0.01 | 2.69 ± 0.05 | 4 | 10.0 | 13.0 |
| Rhodococcus sp. P2kr | 3.1 ± 0.05 | 3.8 ± 0.04 | 4 | 2.0 | 12.0 |
| Rhodococcus sp. P12 | 0 | 0 | 4 | 0 | 6.0 |
| | | | 2 | 3.6 | 3.0 |
| Rhodococcus sp. P13 | 0.2 ± 0.09 | 0.4 ± 0.04 | 4 | 1.4 | 2.2 |
| | | | 2 | 3.0 | 4.0 |
| Rhodococcus sp. P20 | 0.2 ± 0.07 | 0.5 ± 0.04 | 4 | 0 | 2.0 |
| | | | 2 | 3.0 | 4.6 |
| Rhodococcus sp. P25** | 1.2 ± 0.02 | 0.52 ± 0.07 | 4 | 67.0 | 29.0 |
| Rhodococcus sp. SN31 | 0.8 ± 0.04 | 1.22 ± 0.04 | 4 | 3.7 | 9.0 |
| III группа (осуществляют окисление орто-хлорированного кольца) | |||||
| Comamonas sp. S211 | 0 | 0 | 4 | 16.4 | 18.6 |
| Microbacterium sp. B51 | 0 | 0 | 4 | 88.0 | 92.7 |
| Pseudomonas sp. G12 | 0 | 0 | 4 | 84.0 | 85.5 |
| Rhodococcus sp. DB11 | 0 | 0 | 4 | 9.5 | 33.0 |
Примечание: * - % от теоретически возможного, ** - к 5 часам инкубации штамма Р25 с 2,4’диХБ было отмечено: ГОФДК – ОП397=1.1, 4ХБК – 73.8%.
Штаммы III группы - Rhodococcus sp. DB11 и Comamonas sp. S211 в присутствии 2,4'диХБ аккумулировали около 33 и 18.6% 4ХБК, соответственно, а штаммы Pseudomonas sp. G12 и Microbacterium sp. B51 - около 90% этого продукта, накопления продуктов мета-расщепления 2,4'диХБ не было зафиксировано (табл. 4). Таким образом, можно предположить, что эти штаммы атакуют только орто-хлорированное кольцо молекулы 2,4'диХБ.
2.2. Биодеградативные особенности штаммов R. ruber Р25 и Microbacterium sp. В51
Штамм R. ruber Р25 (=ИЭГМ 896) является активным деструктором орто-, пара-замещенных хлорированных бифенилов. При деструкции 2моноХБ в среде наблюдалось накопление 8-Cl ГОФДК (λmax=395 нм) и 2ХБК, а при деструкции 4моноХБ – 10-Cl ГОФДК (λmax=434 нм) и 4ХБК. В процессе деградации 4моноХБ к 24 часам было отмечено снижение содержания 4ХБК в среде с 66% до 41%. При культивировании штамма Р25 с 2,2’диХБ не была обнаружена ГОФДК, но в среде аккумулировались свободные ионы хлора и 2ХБК (около 14% от теоретически возможного, за 24 часа). При разложении 4,4’диХБ было отмечено накопление в среде 3,10-диCl ГОФДК (λmax=434 нм) и увеличение концентрации 4ХБК в течение первых 24 часов до 68% с последующим снижением в 5.5 раза. Установлено, что при деструкции 2,4’диХБ штамм R. ruber Р25 предпочтительнее окислял орто-хлорированное кольцо молекулы хлорбифенила (табл. 4), при деструкции 2,4,2’триХБ – ди(орто-пара)-хлорированное кольцо, а при разложении 2,4,4’триХБ – моно(пара)-хлорированное кольцо. Изучена способность штамма R. ruber Р25 использовать в качестве единственного источника углерода и энергии 2-, 4моноХБ и 2,4’диХБ (рис. 9). Кроме того, штамм эффективно утилизировал образующиеся в процессе разложения 2ХБК и 4ХБК (рис. 10).
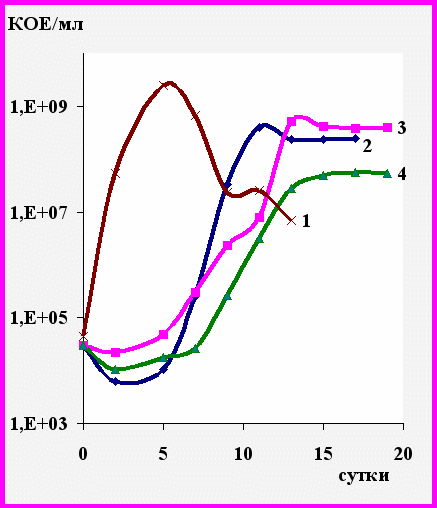
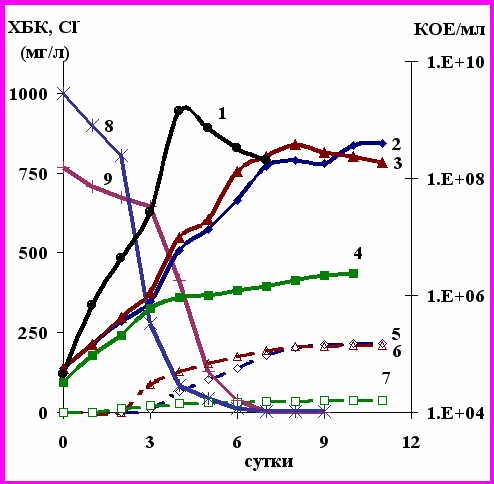
Рис. 9. Динамика роста R. ruber Р25 на бифениле (1) и его хлорированных производных: 2 - 2 моноХБ, 3 - 4-моноХБ, 4 - 2,4'диХБ.
Рис. 10. Рост R. ruber Р25 на бензойной кислоте (1) и ее хлорпроизводных: КОЕ при росте на 2ХБК (2), 4ХБК (3), 2,4ХБК (4); Clˉ при росте на 2ХБК (5), 4ХБК (6), 2,4ХБК (7); концентрация ХБК при росте на 2ХБК (8) и 4ХБК (9).
R. ruber Р25 содержит три плазмиды, размером ~110 т.п.н. (рР25-1), ~90 т.п.н. (рР25-2) и ~80 т.п.н. (рР25 3) (рис. 11А). Для доказательства плазмидной локализации генов, ответственных за разложение бифенила, нафталина и ХБК, проведены эксперименты по элиминации плазмид. При скрининге клонов, утративших способность к росту на одном или нескольких субстратах, обнаружено отсутствие одной или нескольких плазмид (рис. 11Б). Клоны с фенотипом бифˉнафˉ2ХБКˉ4ХБКˉ характеризовались отсутствием плазмид, у клонов с фенотипом бифˉнаф+2ХБКˉ4ХБКˉ было зафиксировано наличие плазмиды рР25-3 (~80 т.п.н.), а у клонов, утративших способность к росту только на ХБК, отсутствовала плазмида рР25-1 (~110 т.п.н.). Таким образом, нами сделано предположение о плазмидной локализации генетических детерминант, контролирующих деградацию бифенила, нафталина и ХБК у штамма R. ruber Р25.
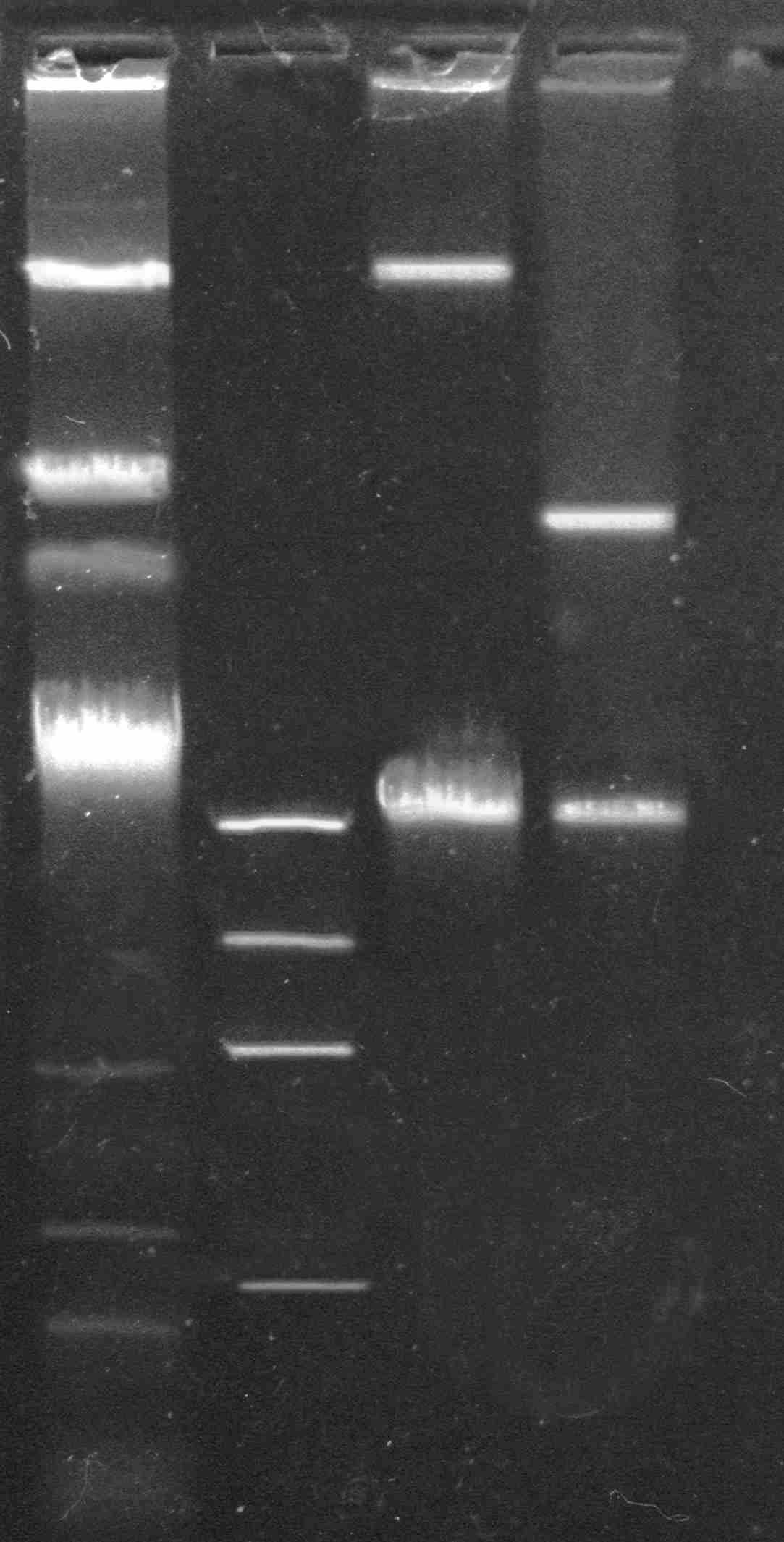
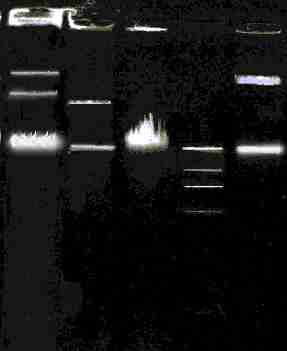
1 2 3 4 1 2 3 4 5
А Б
Рис. 11А. Электрофореграмма плазмидных ДНК: 1 – рР25-(1-3); 2 λ HindIII; 3 pBS1501 (110 т.п.н.); 4 NAH7 (83 т.п.н.).
Рис. 11Б. Скрининг клонов R. ruber Р25 с различным фенотипом на наличие плазмидной ДНК: 1 биф+наф+ХБКˉ (рР25-2, рР25-3); 2 бифˉнаф+ХБКˉ (рР25-3); 3 –бифˉнафˉХБКˉ (элиминант); 4 – λ-HindIII; 5 NAH7 (83 т.п.н.).
Результаты изучения деструкции моно(ди)хлорбифенилов штаммом Microbacterium sp. В51 приведены в таблицах 4 и 5.
Таблица 5. Деструкция хлорбифенилов штаммом Microbacterium sp. В51
| ПХБ | Концен-трация ПХБ (мг/л) | Время инкубации (час) | Концен-трация Cl- (мг/л) | Хлорбензойная кислота | ГОФДК | |||
| Поло-жение хлора | Концентрация | λmax (нм) | ОП | |||||
| мг/л | %* | |||||||
| 2ХБ | 94.25 | 0 | н.о. | 2 | - | - | 395 | - |
| | | 5 | | | 56.600.02 | 72.3 | | - |
| | | 24 | | | 11.820.01 | 15.1 | | <0.1 |
| 4ХБ | 94.25 | 0 | н.о. | 4 | - | - | 434 | - |
| | | 5 | | | 31.110.08 | 39.7 | | <0.1 |
| | | 24 | | | 28.310.05 | 36.0 | | <0.1 |
| 2,2’ХБ | 22.3 | 0 | - | 2 | - | - | - | - |
| | | 5 | 3.80.05 | | 14.130.03 | 90.3 | | - |
| | | 24 | 6.30.08 | | 1.650.02 | 10.6 | | - |
| 4,4’ХБ | 22.3 | 0 | - | 4 | - | - | 432 | 0 |
| | | 5 | - | | 3.590.01 | 23.0 | | 0.360.05 |
| | | 24 | - | | 12.690.06 | 81.1 | | 0.950.02 |
