Бактерии-деструкторы ароматических углеводородов и их хлорпроизводных: разнообразие, особенности метаболизма, функциональная геномика 03. 02. 03 Микробиология
| Вид материала | Автореферат диссертации |
- Рабочей программы учебной дисциплины (модуля) микробиология, 48.16kb.
- Твердофазная люминесценция полициклических ароматических углеводородов в условиях адсорбционного, 262.95kb.
- Задание егэ по теме «Углеводороды» а задания, 45.66kb.
- «Взаимосвязь предельных, непредельных и ароматических углеводородов», 11.54kb.
- Свистунова наталья Юрьевна биологические особенности лекарственных и ароматических, 416.08kb.
- Вопросы для подготовки к зачету по дисциплине: «Эксплуатационные материалы», 51.34kb.
- Оценка фотодинамического воздействия in vitro на бактерии из микробоценозов ротовой, 331.98kb.
- Функциональная и рецепторная характеристика белков суперсемейства иммуноглобулинов, 1127.13kb.
- Бактерии рода enterococcus в озере байкал: Распределение, видовой состав, механизм, 275.08kb.
- Ароматические углеводороды. Бензол представитель аренов. Строение молекулы и физические, 54.51kb.
Примечание: «н.о.» – не определяли, « - » - не зафиксировано, * - % от теоретически возможного.
Штамм Microbacterium sp. В51 осуществлял практически 100% деструкцию диХБ (2,2’-, 2,4’- и 4,4’диХБ). Аккумуляция в среде 2ХБК и 4ХБК при деструкции 2,2’- и 2,4’диХБ, соответственно, свидетельствовала о предпочтительной атаке штаммом орто-хлорированного кольца этих соединений (табл. 4, 5). Microbacterium sp. В51 утилизировал 2ХБК, продукт разложения 2моноХБ и 2,2’диХБ, и трансформировал 4,4’диХБ через стадию образования 3,10 диCl ГОФДК до 4ХБК (табл. 5). Полученные данные позволяют предположить, что штамм В51 способен окислять орто- и пара-хлорированные кольца молекул ПХБ. Таким образом, Microbacterium sp. В51 по своим деградативным свойствам близок к известному штамму-деструктору ПХБ Burkholderia sp. LB400 (Seeger et al., 1995, 1999; Seah et al., 2000), но, в отличие от штамма LB400, способен деградировать 4,4’диХБ и осуществлять полную утилизацию 2моноХБ и 2,2’диХБ.
Было также установлено, что штамм В51 способен активно разлагать 2моноХБ в условиях модельной почвенной системы. Анализ динамики изменения концентрации 2моноХБ показал, что основное снижение количества субстрата (до 98%) происходило в течение первых 24 часов инкубирования. Увеличение количества жизнеспособных клеток штамма в течение эксперимента на три порядка по сравнению с контролем свидетельствовало об использовании 2моноХБ в качестве ростового субстрата.
2.3. Разнообразие генов, кодирующих α-субъединицы ферментов подсемейства бифенил/толуол диоксигеназ, исследуемых бактерий-деструкторов
Проведен скрининг 24 штаммов-деструкторов бифенила, на наличие в их геноме нуклеотидных последовательностей, кодирующих α-субъединицы ферментов подсемейства бифенил/толуол диоксигеназ (Gibson, Parales, 2000). Амплифицируемые участки ДНК соответствуют правой части генов α субъединиц терминальных оксигеназ, включающей каталитический центр (Zielinski et al., 2002). С ДНК четырнадцати штаммов был получен ПЦР-продукт ожидаемого размера, около 500 п.н. В то же время с ДНК ряда деструкторов бифенила/ПХБ, в том числе активных штаммов R. ruber Р25 и Microbacterium sp. В51, отсутствовала специфичная амплификация. Несмотря на сформировавшуюся в процессе эволюции специализацию ферментов по отношению к конкретным субстратам, наблюдается перекрывание спектров окисляемых соединений даже для диоксигеназ, относящихся к разным подсемействам (Barriault, Sylvestre, 1999; Raschke et al., 2001). С другой стороны, известны бактерии родов Sphingomonas, Bacillus, Rhodococcus, осуществляющие деструкцию бифенила с помощью бифенил 2,3-диоксигеназ, существенно отличающихся от ферментов подсемейства бифенил/толуол диоксигеназ и сходных с фенантрен и нафталин диоксигеназами бактерий-деструкторов ПАУ (Romine et al., 1999; Mukerjee-Dhar et al., 2005; Taguchi et al., 2007; Yang et al., 2007). Полученные данные свидетельствуют об отличии ключевых ферментов деструкции бифенила исследованных нами активных бактерий от ферментов подсемейства бифенил/толуол диоксигеназ.
По результатам гидролиза ампликонов эндонуклеазами рестрикции HhaI и HaeIII бактерии рода Pseudomonas были выделены в отдельную группу, бактерии порядка Actinomycetales можно подразделить на три группы (рис. 12). К первой группе относятся Rhodococcus sp. P1, P12, P13, P20, утилизирующие бифенил/ХБ, нафталин, бензол, толуол. Штамм Rhodococcus sp. G10 (вторая группа) осуществляет трансформацию бифенила/ХБ и растет на бензоле и толуоле. В третью группу вошли штаммы Arthrobacter sp. Р24а, Cellulomonas sp. Р28, Janibacter sp. P27a и P9, способные к слабому росту на бифениле.

(А)
(Б)
Рис. 12. Электрофореграммы рестрикционных фрагментов, полученных при обработке ампликонов эндонуклеазами HhaI (A) и HaeIII (Б):
Rhodococcus sp. (штаммы: 3 – P1, 4 – P12, 5 – P13, 6 – P20, 7 – G10), Janibacter sp. (штаммы: 8 – P9, 9 – P27a), 12 – Arthrobacter sp. P24a, 13 – Cellulomonas sp. P28, Pseudomonas sp. (штаммы: 14 – S9, 15 – S13, 16 – S210, 17 – S211, 18 – S212);
2, 19 – Rhodococcus sp. P20 (ампликон, не обработанный эндонуклеазой); 1, 10, 20 – маркер молекулярных масс 100–1000 п.н. («Силекс», Россия); 11 – маркер молекулярных масс pUC19 ДНК/ MspI («Силекс», Россия).
Анализируемые участки генов бактерий рода Rhodococcus существенно отличались от гомологичных генов бактерий рода Pseudomonas (рис. 13). Участки ДНК штаммов Rhodococcus sp. P1, P12 и P13 были на 98-99% сходны с генами, кодирующими α-субъединицы бифенил 2,3-диоксигеназ, известного деструктора ПХБ Rhodococcus sp. RHA1 и разлагающего бифенил R. opacus BIE-20. Амплифицированный фрагмент ДНК Rhodococcus sp. G10 на 98% сходен с геном α-субъединицы гидроксилирующей диоксигеназы деструктора толуола Arthrobacter sp. 3YC3. У бактерий родов Janibacter и Arthrobacter обнаружены уникальные нуклеотидные последовательности, отличающиеся от генов, кодирующих большие субъединицы известных гидроксилирующих диоксигеназ как грамположительных, так и грамотрицательных бактерий (рис. 13).
Полученные данные свидетельствуют о разнообразии генетических систем, контролирующих ключевые процессы деструкции ароматических углеводородов, бактерий-деструкторов бифенила из техногеннозагрязненных почв Прикамья.
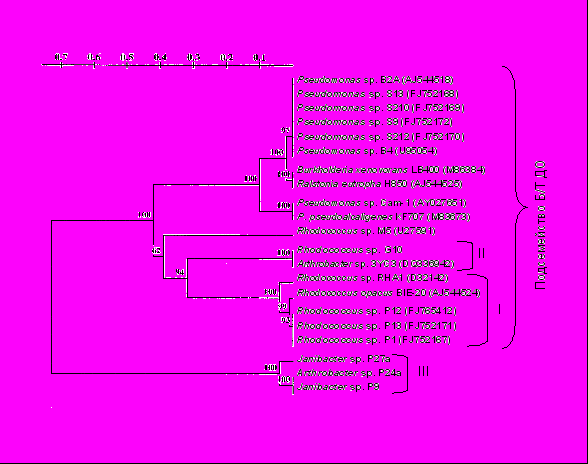
Рис. 13. Дендрограмма, отображающая сходство нуклеотидных последовательностей, гомологичных исследуемым участкам генов α-cубъединиц подсемейства бифенил/толуол диоксигеназ.
3. Природные и генетически-модифицированные бактерии-деструкторы хлорбензойных кислот
Более 20 бактерий-деструкторов хлорбензойных кислот (2-, 3-, 4- и 2,4ХБК) были выделены из почв и грунтов, загрязненных отходами производства галогенсодержащих соединений (г. Пермь). Подробно нами были исследованы шесть штаммов-деструкторов 4ХБК, которые на основании филогенетических и фенотипических особенностей были идентифицированы как Arthrobacter sp. H4, H5, Micrococcus sp. G120, G126, Pseudomonas sp. G107, H2.
3.1. Генетические системы, контролирующие дехлорирование 4ХБК, бактерий рода Arthrobacter
Данные ДНК-типирования двух исследованных артробактерий, штаммов H4 и H5, показали их идентичность. Наибольший уровень сходства (99%) ген 16S pРНК штамма Н4 имеет с типовым штаммом A. globiformis M23411T. Штаммы Arthrobacter sp. H4 и Н5 эффективно растут на 4ХБК, используя данное соединение в качестве единственного источника углерода и энергии, способны к росту на высоких концентрациях хлорбензоата - до 3 г/л. Параметры роста артробактерий сопоставимы с таковыми хорошо изученного штамма-деструктора 4ХБК A. globiformis КЗТ1 (Зайцев, Карасевич, 1981). Анализ метаболитов при культивировании штаммов H4 и Н5 на 4ХБК показал наличие в среде инкубирования интермедиатов – 4ГОБК, ПКК и ионов хлора. На основании полученных результатов и анализа литературных данных было сделано предположение, что штаммы H4, Н5, как и штамм КЗТ1, осуществляет дегалогенирование 4ХБК до расщепления ароматического кольца (Зайцев, Карасевич, 1981). Описан механизм первичной атаки на молекулу 4ХБК - гидролитическое дегалогенирование (Elsner et al., 1991). Эту реакцию катализирует трехкомпонентная 4ХБК-дегалогеназа, включающая 4-хлорбензоат-KoA-лигазу (FcbA), 4-хлорбензоил-KoA-дегалогеназу (FcbB) и 4-гидроксибензоат:КоА-тиоэстеразу (FcbC).
Ранее нами было показано, что у штамма A. globiformis КЗТ1 реакция дегалогенирования 4ХБК контролируется генами, расположенными в плазмиде размером ~110 т.п.н. Гены, ответственные за дальнейший метаболизм пара-гидроксибензойной кислоты, находятся в хромосоме (Zaitzev et al., 1991). У Arthrobacter sp. H4 и Н5, выделенных из техногенных почв (г. Пермь), плазмидные ДНК не были обнаружены. Можно предположить, что генетические детерминанты, контролирующие весь путь разложения 4ХБК, у этих штаммов располагаются в хромосоме.
Клонирование и изучение fcb-генов A. globiformis КЗТ1. В клетках E. coli JM109 на мультикопийном векторе pUC19 была сконструирована клонотека Sau3A-фрагментов тотальной ДНК (обогащенной плазмидной ДНК) штамма A. globiformis КЗТ1. При анализе Арr-клонов E.coli JM109 обнаружен рекомбинантный штамм, содержащий плазмиду pCA311, которая придавала клеткам E. coli способность к дехлорированию 4ХБК. Анализ с использованием метода ТСХ показал, что 4ГОБК является единственным продуктом конверсии 4ХБК клетками E. coli. Таким образом, в составе pCA311 были клонированы fcb гены, кодирующие 4-хлорбензоат-4-гидроксилазу (дегалогеназу). На основе рестрикционного анализа плазмиды pCA311 и ее делеционных производных, а также анализа полипептидов, синтезированных в мини-клетках E. coli на матрицах полученных рекомбинантных плазмид была построена физическая карта клонированного фрагмента ДНК (7612 т.п.н.), определена последовательность расположения генов, кодирующих полипептиды с Mr=57, 31 и 17 кДа. Показано, что все 3 гена fcbA1(А), fcbA2(В), fcbA3(С) требуются для сохранения 4ХБК+ фенотипа. В дальнейшем, данные о наличии трех структурных генов, определяющих дегалогеназную активность, были подтверждены и дополнены, когда была определена и проанализирована нуклеотидная последовательность ДНК, клонированная в составе плазмиды pCA311 (номер в GenBank AF304300). Основываясь на результатах анализа нуклеотидных последовательностей и литературных данных (Babbitt et al.,1992; Schmitz et al.,1992), было сделано заключение, что проклонированные нами гены fcb объединены в структурный оперон с тремя открытыми трансляционными рамками, кодирующими полипептиды в следующем порядке: 4ХБК-КоА-лигаза, 4ХБК-КоА-дегалогеназа и 4ХБК-КоА-тиоэстераза.
3.2. fcb-Гены бактерий-деструкторов 4ХБК из техногеннозагрязненных почв (г. Пермь)
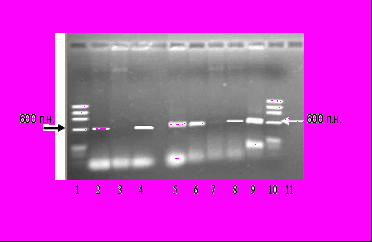
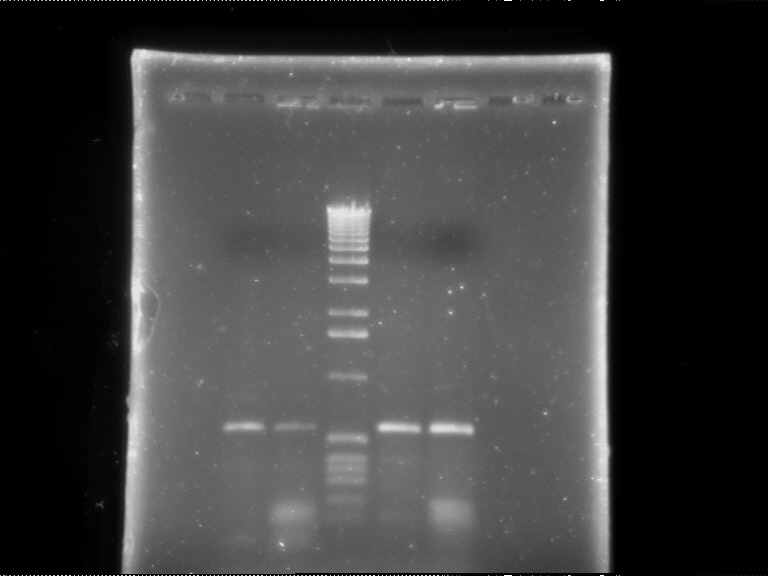
На основе нуклеотидных последовательностей fcb-генов штаммов A. globiformis КЗТ1 (GenBank AF304300) и Arthrobacter sp. SU (GenBank M93187) были разработаны праймеры, при использовании которых возможна амплификация участков ДНК, содержащих гены fcbA и fcbB (Rodrigues et al., 2001). Методом ПЦР нами были исследованы выделенные бактерии-деструкторы 4ХБК на наличие в геноме fcb-генов. С ДНК штаммов Arthrobacter sp. H4, H5, Micrococcus sp. G120 были получены ПЦР-продукты ожидаемого размера – 589 п.н. (fcbA) и 598 п.н. (fcbB) (рис. 14А). Полученные результаты позволяют сделать предположение о наличии у этих штаммов генов, контролирующих дегалогенирование 4ХБК. fcb-Гены были также обнаружены у штамма R. ruber Р25 (рис. 14Б), деструктора ХБ/4ХБК (см. раздел 2.2.).
 500 п.н
500 п.н1 2 3 4 5
А Б
Рис. 14. Электрофореграммы продуктов амплификации fcb-генов штаммов-деструкторов 4ХБК: (А) Arthrobacter sp. H4 (2 – fcbA, 6 – fcbB), Micrococcus sp. G126 (3 – fcbA, 7 – fcbB), Micrococcus sp. G120 (4 – fcbA, 8 – fcbB), Arthrobacter sp. Н5 (5 – fcbA, 9 – fcbB), 1, 10 – маркер молекулярных масс IX («Sigma», Германия), 11 – отрицательный контроль; (Б) A. globiformis КЗТ1 (1 – fcbA, 4 – fcbB), R. ruber Р25 (2 – fcbA, 5 – fcbB), 3 маркер молекулярных масс 1000 п.н. («Силекс», Россия).
Анализ нуклеотидных последовательностей генов fcbA и fcbB штамма Arthrobacter sp. H4 показал 100% сходство с гомологичными последовательностями большинства бактерий рода Arthrobacter. Уровень сходства участка гена fcbA штамма R. ruber P25 с генами, кодирующими 4 хлоробензоат КоА-лигазу, бактерий A. globiformis КЗТ1, A. ramosus FG1, Arthrobacter sp. SU, Arthrobacter sp. TM1 составил 98 99%; с гомологичным геном Arthrobacter sp. FHP1 – 95%. Обнаружено 98-99% сходство участка гена fcbB штамма R. ruber P25 с гомологичными нуклеотидными последовательностями бактерий рода Arthrobacter. В литературе не описано фактов присутствия fcb-генов у природных бактерий рода Rhodococcus. Следует отметить, что штамм R. ruber P25, способный полностью разлагать 4ХБ/4ХБК, и деструкторы 4ХБК рода Arthrobacter (штаммы H4, H5), выделены из одних и тех же почв, загрязненных отходами производства галогенированных соединений (г. Пермь). Известно, что гены, контролирующие деструкцию 4ХБК, могут входить в состав плазмид и транспозонов (Zaitsev et al., 1991; Peel, Wyndham, 1999), кроме того, fcb-гены бактерий рода Arthrobacter успешно экспрессируются в клетках бактерий рода Rhodococcus (Rodrigues et al., 2006). Таким образом, не исключена возможность горизонтального переноса кластера генов fcb между бактериями почвенной экосистемы, находящейся под высоким селективным давлением галогенсодержащих поллютантов.
3.3. ohb-Гены, контролирующие окислительное дегалогенирование орто-замещенных хлорбензоатов, Pseudomonas aeruginosa 142
Другим механизмом первичной атаки хлорбензойных кислот является окислительное дегалогенирование, описанное для ряда бактерий-деструкторов 2ХБК, 2,4диХБК и 2,5диХБК рода Pseudomonas, в том числе P. aeruginosa 142 (рис. 15). В нашей работе были клонированы и охарактеризованы ohb-гены, контролирующие отщепление галогена из орто-положения до расщепления ароматического кольца, штамма деструктора 2ХБК и 2,4диХБК P. aeruginosa 142 (Романов и др., 1993). На основе вектора широкого круга хозяев pSP329 в клетках E. coli DH5αF’ была создана клонотека генов тотальной ДНК P. aeruginosa 142, среди 3700 клонов которой обнаружены 2 клона, осуществляющие превращение 2ХБК в катехол и 2,4диХБК – в 4-хлоркатехол. На основании полученных результатов был сделан вывод, что в рекомбинантных плазмидах pOD33 и pOD22, содержащихся в этих клонах, присутствуют ohb-гены орто-галобензоат 1,2 диоксигеназы (ОГБД) (рис. 15).
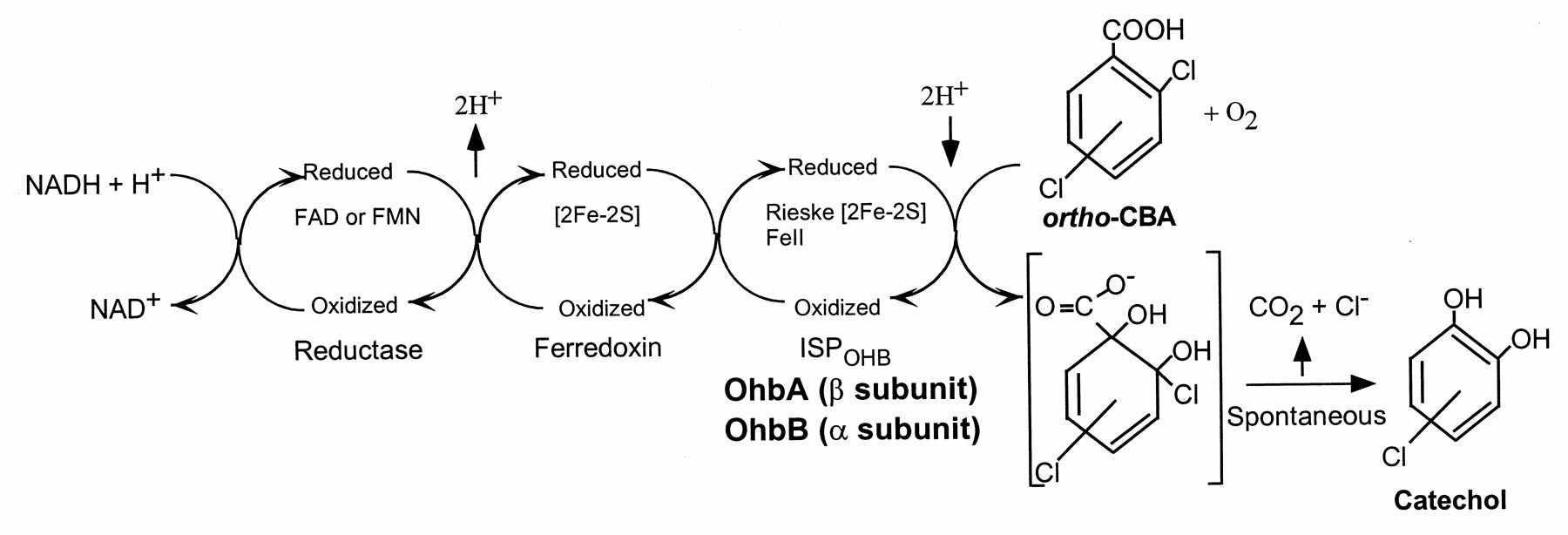
Рис. 15. Молекулярный механизм окислительного орто-дегалогенирования хлорбензоатов, описанный для P. aeruginosa 142 (Romanov and Hausinger, 1994).
Плазмида pOD33, содержащая вставку ДНК около 6 т.п.н. и стабильно поддерживающаяся в клетках E. coli, была использована для дальнейших исследований. Путем субклонирования плазмиды pOD33 с применением экзонуклеазы Bal31 была получена плазмида pE43 с размером вставки ДНК 3.7 т.п.н., проявляющая наибольший уровень экспрессии ohb-генов в клетках E. coli, которая была трансформирована в клетки P. putida mt-2 (штамм PB2440) (Bagdasarian et al., 1981). Рекомбинантный штамм P. putida PB2440(pE43) приобрел новые свойства: рос на 2ХБК как единственном источнике углерода и энергии при концентрации субстрата до 2 мМ. В опытах с отмытыми клетками была показана способность штамма окислять дихлорированные субстраты - 2,4диХБК, 2,5диХБК и 2,6диХБК.
Определена нуклеотидная последовательность вставки ДНК плазмиды pOD33 размером 6052 п.н. (GenBank AF121970). Обнаружены 6 открытых рамок считывания, в том числе генов ohbB, ohbA, кодирующих большую и малую субъединицы терминальной диоксигеназы, соответственно (рис. 16). Кроме того, обнаружен регуляторный ген ohbR, транслируемый им белок относится к регуляторным белкам IclR-типа (Donald et al., 1996). Интересен факт, что орто-галобензоат 1,2-диоксигеназная активность проявлялась в отсутствие генов, кодирующих ферредоксин и редуктазу, предполагается, что терминальная оксигеназа ОГБД использует электрон-транспортную систему, синтезируемую различными бактериями-хозяевами. Терминальная оксигеназа, кодируемая генами ohbB и ohbA, образует отдельный филогенетический кластер, который включает ароматические оксигеназы нетипичной структурно-функциональной организации и отличающиеся от других членов семейства ароматических диоксигеназ (Gibson, Parales, 2000).
В составе клонированной вставки была обнаружена открытая рамка считывания ORF5 (ohbC); функция транслируемого полипептида массой 48969 Да неизвестна (рис. 17). ohb–Гены фланкированы IS1396-подобными инсерционными последовательностями, в состав транспозона входили гены tnpA и top, кодирующие транспозазу А и топоизомеразу I/III, соответственно. Кроме того, было обнаружено, что весь «ohb-регион» ограничен инвертированными повторами размером 14 п.н. в позициях (56 – 69) и (5984 – 5997) (GenBank AF121970).
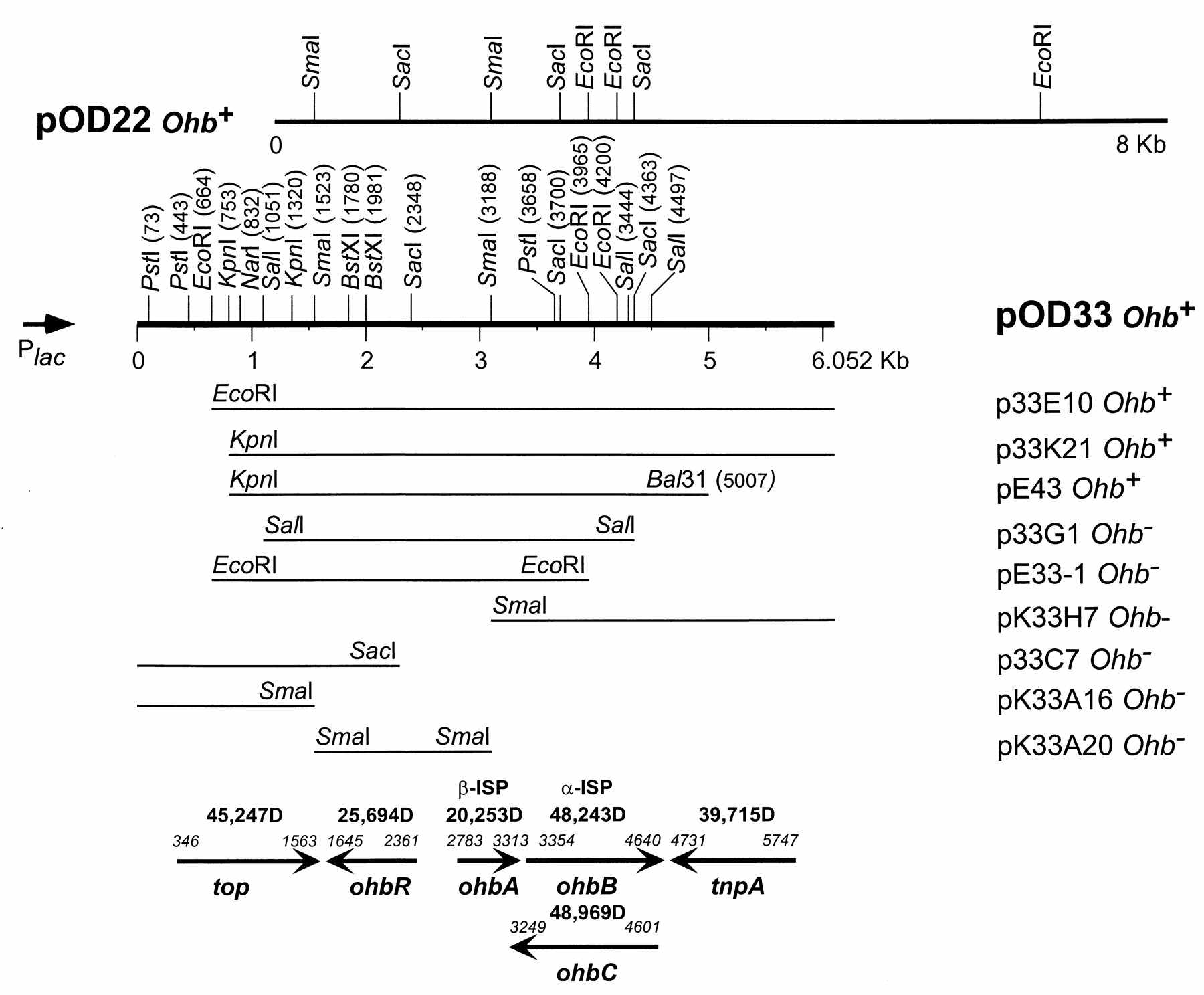
Рис. 16. Физическая карта и организация ohb-локусов в составе рекомбинантных плазмид pOD22 и pOD33. Плазмиды pK33A16, pK33H7 и pK33A20 были cконструированы на основе вектора BlueScript; для других вариантов использовали вектор pSP329. Фенотипы указаны справа от названия плазмид. Локализация и ориентация ORF1 (top), ORF2 (ohbR), ORF3 (ohbA), ORF4 (ohbB), ORF5 (ohbC), ORF6 (tnpA) показана в нижней части рисунка, там же указаны молекулярные массы соответствующих полипептидов.
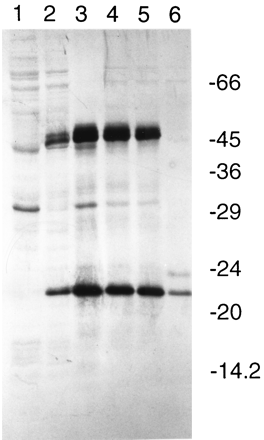
Рис. 17. Авторадиограмма [35S]метионин-меченных полипептидов, синтезируемых в миниклетках E. coli
 925, содержащих рекомбинантные плазмиды. Дорожки: 1, pSP329; 2, pOD33; 3, p33K21; 4, pOD22; 5, pE43; 6, pE33-1. Стандарты молекулярных масс (SDS-7; «Sigma»): бычий сывороточный альбумин (66.2 kDa), овальбумин (45 kDa), глицеральдегид-3-фосфатдегидрогеназа (36 kDa), карбоангидраза (29 kDa), трипсиноген (24 kDa), ингибитор трипсина (20.1 kDa), and
925, содержащих рекомбинантные плазмиды. Дорожки: 1, pSP329; 2, pOD33; 3, p33K21; 4, pOD22; 5, pE43; 6, pE33-1. Стандарты молекулярных масс (SDS-7; «Sigma»): бычий сывороточный альбумин (66.2 kDa), овальбумин (45 kDa), глицеральдегид-3-фосфатдегидрогеназа (36 kDa), карбоангидраза (29 kDa), трипсиноген (24 kDa), ингибитор трипсина (20.1 kDa), and  -лактальбумин (14.2 kDa).
-лактальбумин (14.2 kDa). 3.4. Конструирование метаболических путей деструкции хлорароматических соединений в клетках бактерий
3.4.1. Клонирование и экспрессия fcb-генов в составе рекомбинантной плазмиды в клетках P. putida
На основе вектора с широким кругом бактерий-хозяев pRK415 (Keen,1988) нами была сконструирована рекомбинантная плазмида pPC3, содержащая fcb-гены. Из клеток рекомбинантного штамма E. coli JM109(pPC3) плазмида была мобилизована в клетки штамма P. putida KЗ6R (Rifr), способного к полному окислению пара-гидроксибензойной кислоты (ПГБК), но не 4ХБК (Карасевич, Зайцев, 1984). Эксперименты по выращиванию в Cl--cвободной среде в присутствии возрастающих концентраций 4ХБК показали, что за 48 часов роста рекомбинантный штамм P. putida KЗ6R(pPC3) полностью дехлорирует 3.5 г/л субстрата в сравнении с 1.5 г/л в случае родительского штамма KЗT1. Таким образом, внесение fcb-генов в штамм, утилизирующий ПГБК, привело к образованию гибридного пути деградации 4ХБК путем вертикального наращивания предсуществовавшего пути.
Путем пересевов рекомбинантного штамма P. putida КЗ6R(pPC3) на среды с постепенно повышающимися концентрациями 4ХБК (от 1 до 10 г/л) были получены варианты, характеризующиеся суперэкспрессией fcb-генов. Наиболее эффективное фенотипическое выражение функции дехлорирования наблюдалось у штамма KЗ6R(pPC3-10), адаптированного к росту на 10 г/л 4ХБК, который полностью минерализовал до 6 г/л 4ХБК при росте в минеральной среде. Все штаммы, адаптированные к высоким концентрациям 4ХБК, характеризовались более высокой степенью стабильности поддержания плазмиды в клетках по сравнению с исходным штаммом КЗ6R(pPC3). Рестрикционный анализ плазмид из всех адаптированных вариантов штамма КЗ6R(pPC3) выявил во всех случаях наличие делеции размером 3 т.п.н. в векторной части плазмиды pPC3. Основываясь на этом факте, можно предположить, что повышение стабильности плазмид в клетках адаптированных штаммов связано со структурными изменениями исходной рекомбинантной плазмиды pPC3.
3.4.2. Конструирование рекомбинантного штамма, содержащего fcb гены в хромосоме P. putida
Реальный путь достижения генетической стабильности - интеграция желаемого гена в хромосому реципиента. С этой целью нами были проведены эксперименты по конструированию штамма, содержащего fcb-гены в хромосоме P. putida KЗ6R. На основе вектора pDK8, содержащего модифицированный транспозон Tn5-K2GA(Tcr), была сконструирована плазмида pCDK4, содержащая fcb-гены, которая была мобилизована в клетки P. putida KЗ6R. При селекции трансконьюгантов на среде, содержащей тетрациклин и 4ХБК в качестве единственного источника углерода и энергии, был получен рекомбинантный штамм KЗ6R::Tn5-K2GA[Tcr fcbA1,A2,A3], характеризовавшийся высокой стабильностью признака 4ХБК+. Сравнительный анализ эффективности деградации 4ХБК полученного штамма и плазмидных вариантов штамма КЗ-6R показал, что за 20 суток штамм полностью утилизирует до 4 г/л 4ХБК. Эта величина сравнима с таковой для штамма KЗ6R(pPC3), но много ниже для адаптированных вариантов последнего.
Таким образом, введение генов дехлорирования в хромосому, с одной стороны, приводило к стабилизации проявления функции. С другой стороны, плазмидные варианты штамма P. putida КЗ6R обладали более высокой эффективностью дехлорирования 4ХБК, так как в хромосоме fcb-гены находились в единственной копии.
3.4.3. Штаммы-деструкторы ПХБ, сконструированные при использовании fcb- и ohb-генов
Описано большое количество бактерий-деструкторов, осуществляющих разложение различных конгенеров ПХБ, и наиболее изученными из них являются штаммы Burkholderia xenovorans LB400 и Rhodococcus sp. RHA1 (Chain et al., 2006; McLeod et al., 2006). Однако подавляющее большинство деструкторов ПХБ, в том числе и вышеперечисленные, в процессе разложения этих токсикантов аккумулируют хлорбензоаты. Для создания рекомбинантного пути полной утилизации орто- и пара-ХБ были использованы ohb и fcb гены (рис. 18), контролирующие орто- и пара-дегалогенирование хлорбензоатов (см. разделы 3.1. и 3.3.).
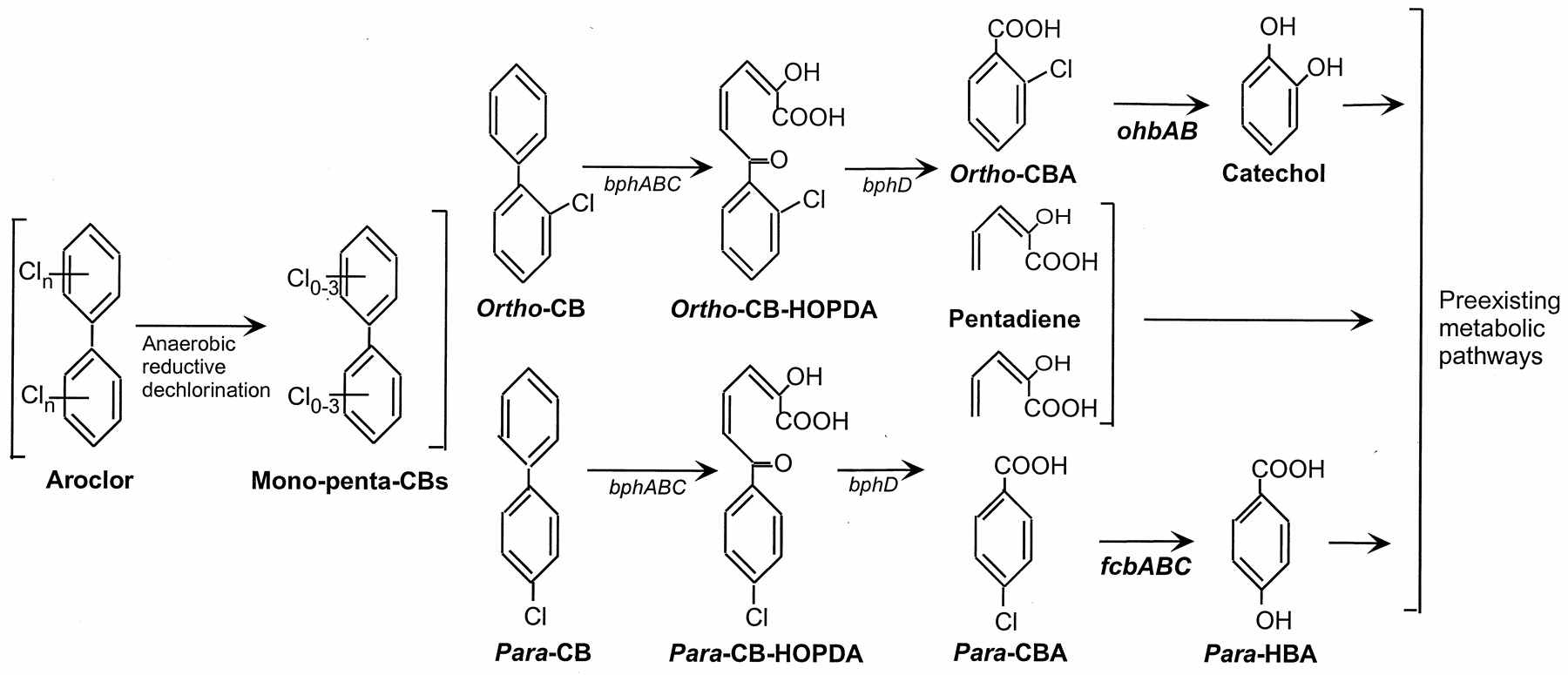
Рис. 18. Рекомбинантные пути деградации 2ХБК (вверху) и 4ХБК (внизу), конструированные путем наращивания предсуществовавших путей окисления (хлор)бифенилов, орто-гидроксибензоата, катехола и пентадиена с использованием дегалогеназных генов ohbAB и fcbABC. Показано анаэробное дехлорирование Арохлора, в результате которого аккумулируются, в основном, орто- и пара-замещенные ХБ (слева) и метаболизм 2ХБ и 4ХБ через орто-ХБ-ГОФДК и пара-ХБ-ГОФДК, соответственно, которые трансформируются в ХБК и пентадиен (цит. по Hrywna et al., 1999).
Первоначально были проведены эксперименты по созданию модифицированных путей полной утилизации моноХБ путем добавления генов дегалогенирования ohb и fcb в составе рекомбинантных плазмид в штамм-деструктор хлорбифенилов Comamonas testosteroni VP44 (Мальцева et al., 1999). Рекомбинантные штаммы C. testosteroni VP44, содержащие ohb и fcb гены приобретали способность расти на 2ХБК, 2моноХБ и 4ХБК, 4моноХБ, соответственно, при концентрации 10 мМ каждого из субстратов (Hrywna et al., 1999). Аналогичные эксперименты были проведены с использованием штамма Rhodococcus sp. RHA1 в качестве реципиента генов fcb (плазмиды pRHD34): сконструированный штамм приобретал способность к росту на 4ХБК и 4моноХБ (Rodrigues et al., 2001).
Рекомбинантные штаммы B. xenovorans LB400 (pRO41, ohb) и Rhodococcus sp. RHA1 (pRHD34, fcb) были исследованы в модельных почвенных экспериментах при деструкции коммерческой смеси ПХБ «Aroclor 1242». После 30 дней инкубирования количество ПХБ-конгенеров сократилось на 57%, при этом рекомбинантные бактерии стабильно сохранялись в загрязненной ПХБ почве в течение всего эксперимента (Rodrigues et al., 2006).
Таким образом, использование клонированных генов раннего дегалогенирования при создании бактерий с новыми метаболическими характеристиками, существенными при разложении хлорароматических ксенобиотиков, имеет фундаментальное и практическое значение.
4. Природные и модельные ассоциации бактерий, перспективные для использования в биотехнологиях очистки окружающей среды
- Нафталинметаболизирующие ассоциации бактерий, выделенные из техногеннозасоленных почв
Из почв района солеразработок методом накопительного культивирования получены две ассоциации бактерий, способные расти на нафталине в присутствии повышенной солености среды: ассоциация SMB1 – до 80 г/л NaCl, ассоциация SMB3 – до 90 г/л NaCl.
4.1.1. Характеристика нафталинметаболизирующих ассоциаций
Ассоциация бактерий SMВ1. При росте ассоциации SMВ1 на агаризованной минеральной среде в парах нафталина наблюдалось формирование биопленки на агаре при содержании хлорида натрия до 140 г/л (табл. 6). В то же время, рост ассоциации в жидкой минеральной среде на нафталине как единственном источнике углерода и энергии был зафиксирован при содержании соли не более 80 г/л. Наибольшие показатели роста сообщества были установлены в отсутствие NaCl в среде культивирования (ОП540=0.66 о.е.), в присутствии 50, 70 и 80 г/л NaCl оптическая плотность культуры уменьшалась и достигала 0.25, 0.19 и 0.11 о.е., соответственно.
Таблица 6. Рост ассоциации SMB1 и индивидуальных штаммов на агаризованной среде в присутствии разных концентраций NaCl (г/л)
Штамм | Рост на минеральной среде с нафталином | Рост на полноценной среде | ||||||||||
| 0 | 30 | 70 | 100 | 140 | 0 | 30 | 60 | 120 | 180 | 240 | 290 | |
| Arthrobacter sp. SMB11 | + | + | + | | | + | + | + | | | | |
| Arthrobacter sp. SMB145 | + | + | + | | | + | + | + | + | | | |
| Brevibacterium permense SMB14 | | | | | | + | + | + | + | | | |
| Chromohalobacter sp. SMB17 | | | | | | | + | + | + | + | | |
| Ассоциация SMB1* | + | + | + | + | + | + | + | + | + | + | | |
