№41. 2 «Формирование специализированного химического класса, обеспечивающего профессиональную ориентацию учащихся средней школы в области прикладной биотехнологии и производства здоровых продуктов питания»
| Вид материала | Документы |
- Программа элективного курса «биотехнологии… биотехнологии спасут человечество?!» для, 188.79kb.
- «Проблемы организации спортивного питания в подготовке спортсменов высокой квалификации», 59.67kb.
- Реферат по курсу: «Биология и экология» На тему: «Санитарно-гигиеническое состояние, 170.88kb.
- Программа обучения, воспитания, профессиональной ориентации и профессиональной начальной, 70.25kb.
- Экспериментальная программа обучения, воспитания, профессиональной ориентации и профессиональной, 80.11kb.
- Практикум содержит работы по основам производства самых разнообразных продуктов питания., 1041.29kb.
- Доклада, 47.9kb.
- Извлечения из европейского законодательства в области биотехнологии, 537.61kb.
- Тематика курсовых работ по дисциплине «Организации производства и обслуживания на предприятиях, 34.63kb.
- Использование полисахаридной добавки в технологии взбивных молочных десертов, 635.69kb.
1 2
Коричный альдегид — 3-фенилпропеналь, β-фенилакролеин, cinnamic aldehyde, cinnamaldehyde, органическое вещество из группы фенилпропаноидов, существует в виде транс- и цис-изомеров, причем в природе встречается только в транс-форме.
Коричный альдегид был выделен из коричного эфирного масла в 1834 Ж. Б. Дюма и Э. М. Пелиго (англ.) и синтезирован в лаборатории Л. Кьоцца в 1856.
 |
В промышленности его получают конденсацией бензальдегида с ацетальдегидом при катализе водным раствором щёлочи. Коричный альдегид применяетсяв качестве пищевых эссенций, отдушек для мыла; а также для получения коричного спирта.
Бензойный альдегид (бензальдегид) C6H5CHO — простейший альдегид ароматического ряда бесцветная жидкость с характерным запахом горького миндаля. В пищевой промышленности применяется как ароматизатор (искусственное миндальное масло, миндальная эссенция).
 |
Ядра косточек горького миндаля содержат гликозид амигдалин. В немного меньшем количестве он присутствует в косточках абрикос, персиков, вишни, черешни и др. косточковых. Определить, что имеющиеся у вас косточки содержат амигдалин, можно по запаху напоминающему запах бензальдегида/синильной кислоты.
Способ получения:
- C6H5CH(CN)O-C12H21O10 (гликозид амигдалин) + ферментативный гидролиз (ферменты уже содержатся в самих косточках) = C6H5CHO + HCN + сахар.Далее растворимыми солями железа осаждается нерастворимый в воде гексацианоферрат железа и бензальдегид отгоняется с водяным паром.
Диацетил (2,3-бутандион, диметилглиоксаль) - простейший представитель дикетонов с формулой С4H6O2.
 |
Диацетил - желто-зелёная жидкость, имеет сильный, жирный запах сливочного масла и сметаны, но практически безвкусен.
Синтетический диацетил используется для создания некоторых ароматизаторов для пищевой промышленности при формировании запаха масла в производстве маргарина и других жировых пищевых продуктов. Хорошо маскирует синтетические добавки.
Содержится в коровьем жире, некоторых эфирных маслах, обжаренном кофе, цикории, продуктах гидролиза древесины, пиролиза табака.
Встречается в дистилляционных водах после отгонки эфирных масел кипариса, казацкого можжевельника, корня ветиверы и ириса, западно-индийского сандалового дерева, хмеля, тмина, корня ангелики.
В соке винограда встречается в количествах 0,1— 0,5 мг/дм3, в винах — 0,5—5 мг/дм3. Образуется при окислении ацетоина во время брожения спиртового, яблочно-молочного, а также в процессе различных обработок вин. Количество диацетила находится в прямой зависимости от исходной концентрации сахара в сусле. Участвует в создании аромата вин: некоторым винам придает приятный запах лесного ореха или слегка прогорклого масла. Белые столовые вина, содержащие диацетил выше 1 мг/дм3, приобретают тона окисленности. Пороговая концентрация 0,7—0,8 мг/дм3.
В некоторых видах пива (English Pale ales), присутствие диацетила приемлемо или желательно в низких или иногда в средних концентрациях.
Цитра́ль (3,7-диметил-2,6-октадиеналь) — монотерпеновый ациклический альдегид, существует в виде двух изомеров: E-изомера гераниаля и Z-изомера нераля. Цитраль, присутствующий в природных эфирных маслах представляет собой смесь изомеров с преобладанием гераниаля.
 |
Цитраль— бесцветная или светло-жёлтая вязкая жидкость с сильным запахом лимона. Цитраль используют как ароматизатор в пищевой промышленности.
Цитраль содержится в эфирном масле лимонного сорго (лемонграссовом масле, до 85 %), масле кубебы (до 75 %), лимонном, эвкалиптовом и некоторых других эфирных маслах.
Цитраль выделяют из эфирных масел (наиболее удобный способ— обработкой сульфитом или бисульфитом натрия с образованием и дальнейшим выделением кристаллического бисульфитного производного); получают окислением кориандрового масла; взаимодействием геранилхлорида с уротропином (реакцией Соммле) и др.
Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов с химической формулой CH3-CHO.
 |
В пищевой промышленности используется для получения уксусной кислоты.
Это один из наиболее важных альдегидов, широко встречающийся в природе и производящийся в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями, как результат их метаболизма.
Запах копченой консервированной говядины связан могут придавать такие ароматизаторы, из класса альдегидов как 2-метилпропаналя и 2-метилбутаналя
Лекция № 5 Карбоновые кислоты и жиры как компоненты в функциональных продуктах питания
Карбо́новые кисло́ты— класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
 |
Карбоновые кислоты, применяемые в пищевой промышленности в качестве консервирующих средств и для придания продуктам и блюдам приятного кисловатого вкуса. Например, лимонную кислоту, молочную кислоту, уксную кислоту, яблочную кислоту, сорбиновую кислоту используют при изготовлении кондитерских изделий, безалкогольных напитков, пищевых концентратов (желе, кисели), варенья, компотов, соусов и др.
Муравьиная кислота (систематическое наименование: метановая кислота) — первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Формула: HCOOH
В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях пчел и муравьев. Муравьиная кислота впервые была выделена в 1671 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв.
Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные муравьиной кислотой, дольше сохраняются.
У́ксусная кислота (эта́новая кислота)— органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксус является продуктом брожения вина и известен человеку с незапамятных времен.
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов на самом деле являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреа Либавиусом (нем.Andreas Libavius) и французским химиком Пьером Августом Адэ (фр.Pierre Auguste Adet).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины.
При биохимическом производство уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта.
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
СН3СН2ОН + О2 → СН3СООН + Н2О
Пропио́новая кислота́ (пропановая кислота, метилуксусная кислота, консервант E280)— бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos»— первый, «pion»— жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот
Пропионовая кислота препятствует росту плесени и некоторых бактерий. Поэтому большая часть производимой пропионовой кислоты используется как консервант в продуктах, потребляемых человеком, и в продуктах для животных. В продуктах для животных применяется непосредственно пропионовая кислота, либо её аммониевая соль (пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебе и в других хлебобулочных изделиях, пропионовая кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
Ма́сляная кислота́ (бута́новая кислота́) С3Н7СООН — бесцветная жидкость с запахом прогорклого масла. Соли и эфиры масляной кислоты называются бутиратами.
Масляная кислота и её эфиры содержатся в коровьем масле и нефти. Эфиры масляной кислоты применяют как душистые вещества, эмульгаторы. Возбудителями маслянокислого брожения являются анаэробные бактерии рода Клостридиум: Clostridium paserianum (вид назван в честь Луи Пастера, обнаружившего этот вид бактерий), Clostridium butyricum, Clostridium butilicum.
Валериа́новая кислота́ (пента́новая кислота́) С4Н9COOH — одноосновная предельная карбоновая кислота, бесцветная жидкость с неприятым запахом. Соли и эфиры валериановой кислоты называют валератами.
Валериановая кислота имеет 4 изомера:
- н-пентановая кислота СН3-СН2-СН2-СН2-COOH
- 3-метилбутановая кислота СН3-CH(СН3)-СН2-СООН
- 2-метилбутановая кислота СН3-СН2-CH(СН3)-СООН
- 2,2-диметилпропановая кислота СН3-С(СН3)2-СООН
В пищевой промышленности используют изоамиловый эфир изовалериановой кислоты (яблочная эссенция), также используется этиловый и пентиловый эфир валерьяновой кислоты.
Мало́новая кислота (пропандиовая кислота) НООССН2СООН – двухосновная предельная карбоновая кислота.
 |
Используют малоновую кислоту в синтезе непредельных кислот, флавонов, аминокислот, витаминов B1 и B6.
Адипи́новая кислота (гександиовая кислота) НООС(СН2)4СООН – двухосновная предельная карбоновая кислота.
 |
Адипиновая кислота - пищевая добавка E355 для придания кислого вкуса (в частности, в производстве безалкогольных напитков).
Обладает всеми химическими свойствами, характерными для карбоновых кислот. Образует соли, большинство из которых растворимо в воде. Легко этерифицируется в моно- и диэфиры. С гликолями образует полиэфиры. Соли адипиновой кислоты - адипинаты. При взаимодействии с NH3 и аминами даёт аммонийные соли, при дегидратации превращающиеся в адипамиды. С диаминами образует полиамиды, с NH3 в присутствии катализатора при 300-400°C - адиподинитрил.
Лимо́нная кислота́ (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) — кристаллическое вещество белого цвета, температура плавления 153°C, хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Слабая трёхосновная кислота. Соли и эфиры лимонной кислоты называются цитратами.
 |
Лимонная кислота, являясь главным промежуточным продуктом метаболического цикла трикарбоновых кислот, играет важную роль в системе биохимических реакций клеточного дыхания множества организмов.
Вещество чрезвычайно распространено в природе: содержится в ягодах, плодах цитрусовых, хвое, стеблях махорки, особенно много её в китайском лимоннике и недозрелых лимонах.
Впервые лимонная кислота была выделена в 1784 году из сока недозрелых лимонов шведским аптекарем Карлом Шееле.
Лимонную кислоту раньше получали из сока лимона и биомассы махорки. В настоящее время основной путь промышленного производства — биосинтез из сахара или сахаристых веществ (меласса) промышленными штаммами плесневого гриба Aspergillus niger.
Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция), широко используется как вкусовая добавка, регулятор кислотности и консервант в пищевой промышленности (пищевые добавки E330—Е333), для производства напитков, сухих шипучих напитков.
При приёме внутрь в небольших дозах (например, при употреблении цитрусовых) активирует цикл Кребса, что способствует ускорению метаболизма. При похмелье рассматривается токсикологами как мера химической дезинтоксикации.
Яблочная кислота (оксиянтарная кислота, гидроксибутандиовая кислота) НООС-СН(ОН)-СН2-СООН — двухосновная оксикарбоновая кислота.
 |
Бесцветные гигроскопичные кристаллы, отлично растворимые в воде и этиловом спирте. Температура плавления 100°C. Впервые выделена шведским химиком Карлом Вильгельмом Шееле (Carl Wilhelm Scheele) в 1785 году из незрелых яблок. Соли и анионы яблочной кислоты — малаты.
Яблочная кислота содержится в незрелых яблоках, винограде, рябине, барбарисе, малине и др. Растения махорки и табака содержат её в виде солей никотина.
Малат является промежуточным продуктом цикла трикарбоновых кислот и глиоксилатного цикла. В цикле Кребса L-яблочная кислота образуется путём гидратации фумаровой кислоты и далее окисляется коферментом НАД+ в щавелевоуксусную кислоту.
Применяется как пищевая добавка ( Е296) природного происхождения при изготовлении фруктовых вод и кондитерских изделий. Также применяется в медицине.
Ви́нная кислота́ (диоксиянтарная кислота, 2,3-дигидроксибутандиовая кислота) НООС-СН(ОН)-СН(ОН)-СООН — двухосновная оксикислота.
 |
Винная кислота — распространённое природное соединение. В значительном количестве она содержится в кислом соке многих фруктов, например, в виноградном соке. Винная кислота впервые была выделена в 1869 году в виде кислой калийной соли. Соли винной кислоты— тартраты.
Применяется в пищевой промышленности (пищевая добавка Е334)
Молочная кислота — α-оксипропионовая (2-гидроксипропановая) кислота. Так же известна как «Cal».
 |
- tпл 25-26 °C оптически активная + или — форма.
- tпл 18 °C рацемическая форма.
Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем молоке, при брожении вина и пива.
Была открыта шведским химиком Карлом Шееле в 1780 году. В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты.
В пищевой промышленности используется как консервант, пищевая добавка E270.
Получают молочную кислоту молочнокислым брожением глюкозы (реакция ферментативна):
C6H12O6 → 2CH3CH(OH)COOH + 21,8·104 Дж
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром», глюкоза является главным источником углеводов в нашем организме.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) имеет повышенный уровень.
Чтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна — она с лёгкостью сама проходит через клеточные мембраны
Пальмитиновая кислота (Гексадекановая кислота) CH3(CH2)14COOH – наиболее распространенная в природе одноосновная насыщенная карбоновая кислота (жирная кислота).
 |
Пальмитиновая кислота входит в состав глицеридов большинства животных жиров и растительных масел (например, пальмовое масло содержит 39—47%, коровье — 25%, соевое — 6,5%, свиное сало — 30%), а также в состав некоторых восков, например в спермацете кашалота 90% цетилового эфира, а в пчелином воске 30% миристилового эфира пальмитиновой кислоты. В животных организмах пальмитиновая кислота — конечный продукт синтеза жирных кислот из ацетил-КоА.
Соли и эфиры пальмитиновой кислоты называются пальмитатами
Метилпальмитат — для получения гексадеканола, пальмитиновой кислоты и её производных, а также как ароматизирующее вещество для пищевых продуктов.
Линоленовая кислота — одноосновная карбоновая кислота с тремя изолированными двойными связями, CH3(CH2CH=CH)3(CH2)7COOH
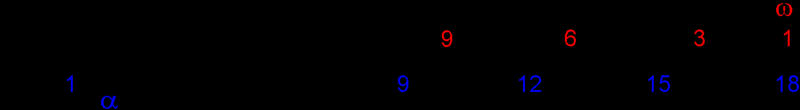 |
Бесцветная маслообразная жидкость; tkип 184 °C (532 н/м², или 4 мм рт. ст.), плотность 0,905 г/см³ (20°C).
Линоленовая кислота относится к так называемым незаменимым жирным кислотам В виде триглицерида она содержится во многих растительных маслах, например, в льняном (до 30 %), перилловом (до 55 %), конопляном, соевом и др.
Линолевая кислота — одноосновная карбоновая кислота с двумя изолированными двойными связями CH3(CH2)3-(CH2CH=CH)2(CH2)7COOH.
 |
Формула линолевой кислоты С18Н32О2 была установлена в 1889 г. профессором А.Н.Реформатским.
Линолевая кислота — светло-жёлтая маслянистая жидкость, нерастворимая в воде, но хорошо растворимая во многих органических растворителях. Tпл −11 °C, tkип 182 °C (532 н/м², или 4 мм рт. ст.), плотность 0,903 г/см³ (20 °C). Содержание в растительных маслах и животных жирах (%): кокосового масла 1,5—2,6; касторового 2,0—3,0; кориандрового 7,0—7,5; горчичного 14,5—20,0; льняного 15,0—30,0; хлопкового 40,0—45,0; кукурузного 43,5—46,9; подсолнечного масла 46,0—60,0; соевого 52,0—65,0; конопляного 56,0—65,0; макового 58,0—65,0 %; говяжьего жира 2,0—5,0; бараньего 3,0—4,0; свиного 3,0—8,0. В натуральных жирах линолевая кислота находится в виде геометрического цис-изомера. Она имеет неразветвлённую цепь углеродных атомов и две изолированные двойные связи, одна из которых расположена между 9-м и 10-м, а вторая между 12-м и 13-м углеродными атомами (9,12-уноктадиеновая кислота). По положению двойной связи эта кислота относится к семейству кислот ω-6. Имея такое строение, линолевая кислота окисляется кислородом воздуха легче, чем олеиновая.
Линолевая кислота вместе с линоленовой кислотой относится к так называемым незаменимым жирным кислотам, необходимым для нормальной жизнедеятельности; в организм человека и животных эти кислоты поступают с пищей, главным образом в виде сложных липидов — триглицеридов и фосфатидов . В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многих растительных масел и животных жиров, например соевого, хлопкового, подсолнечного, льняного, конопляного масел, китового жира.
Жиры, или триглицериды— природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов.
 |  |
| Триглицериды. Выделен остов глицерина, чёрным на белом фоне — часть молекулы жирных кислот (на рисунке— это радикалы пальмитиновой кислоты). | Структура триглицеридов Радикалы R1, R2 и R3 жирных кислот могут быть различны |
В живых организмах выполняют структурную, энергетическую и др. функции.
Наряду с углеводами и белками, жиры — один из главных компонентов клеток животных, растений и микроорганизмов.
Жидкие жиры растительного происхождения обычно называют маслами.
Природные жиры содержат в своём составе три кислотных радикала, имеющих неразветвлённую структуру и, как правило, чётное число атомов углерода (содержание «нечетных» кислотных радикалов в жирах обычно менее 0,1 %).
Жиры гидрофобны, практически нерастворимы в воде, хорошо растворимы в органических растворителях и частично растворимы в этаноле (5-10%).
Природные жиры содержат следующие жирные кислоты:
Насыщенные:
- стеариновая (C17H35COOH)
- маргариновая (C16H33COOH)
- пальмитиновая (C15H31COOH)
Ненасыщенные:
- пальмитолеиновая (C15H29COOH, 1 двойная связь)
- олеиновая (C17H33COOH, 1 двойная связь)
- линолевая (C17H31COOH, 2 двойные связи)
- линоленовая (C17H29COOH, 3 двойные связи)
- арахидоновая (C19H31COOH, 4 двойные связи, реже встречается)
Чаще всего в животных жирах встречаются стеариновая и пальмитиновая кислоты, ненасыщенные жирные кислоты представлены в основном олеиновой, линолевой и линоленовой кислотами. Физико-химические и химические свойства жиров в значительной мере определяются соотношением входящих в их состав насыщенных и ненасыщенных жирных кислот.
В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50 %. Насыщенные жиры расщепляются в организме на 25-30%, а ненасыщенные жиры расщепляются полностью. Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии Химические исследования тел животного происхождения. Шеврёль прожил исключительно плодотворную и долгую жизнь: он родился в 1786, за три года до штурма Бастилии, а умер почти через 103 года, простудившись при осмотре работ по постройке Эйфелевой башни. На торжества, посвященные столетию Шеврёля, собрались более двух тысяч ученых со всей Европы; на банкете почтенный профессор лихо отплясывал с самой молодой участницей – восемнадцатилетней Жизель Тифено.
Действуя водными растворами кислот и щелочей на различные жиры, он получил в результате реакции гидролиза (омыления) открытый еще Шееле глицерин и не известные ранее химические соединения – различные жирные кислоты, многим из которых он и дал названия. А «сладкое масло» Шееле Шеврёль назвал глицерином (греч. glykeros – сладкий). Как установил Шееле, жиры по своему составу аналогичны уже тогда известным сложным эфирам, которые при гидролизе превращаются в спирты и кислоты.
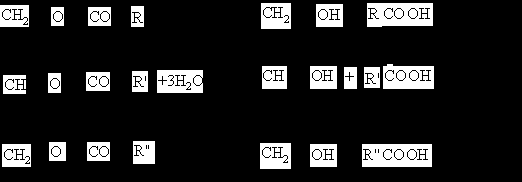
Именно из триглицеридов состоят в основном масла и жиры.
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир. В 1859 его соотечественник Шарль Вюрц (1817–1884), используя реакцию, названную его именем, синтезировал жиры, нагревая трибромпропан с «серебряными мылами»
Если все три гидроксильные группы присоединили остатки карбоновых кислот, образуются триглицериды; при гидролизе они распадаются на глицерин и свободные кислоты:
Аналогично были получены моно- и диглицериды. Таким образом, можно получить «синтетические жиры» с любым числом атомов углерода в цепях жирных кислот. Конечно, намного проще и дешевле получать жиры из природных источников, но Бертло и Вюрц вовсе не собирались заменять природный жир синтетическим. Проведенный ими так называемый «встречный синтез» однозначно доказывал состав природных жиров.
Любое вещество, даже самое необходимое, может вызывать токсические эффекты. Действие вещества определяется дозой.
На лекциях присутствовали учащиеся школ г. Москвы: №№ 906, 958, 622, колледжа ПК №39 и школ Московской области: №17 г. Коломны, № 12 г. Люберцы.
Список использованных источников
- Петров А.А. Органическая химия: учебник / А.А. Петров, Х.В. Бальян, А.Т. Трощенко. – СПб.: Иван Федоров, 2002. – 622 с.
- Ким А.М. Органическая химия: учебник / А.М. Ким – Новосибирск: Сибирское университетское изд-во, 2001. – 814 с.
- Янковский С.А. Словарь терминов и определений по органической химии: учебное пособие / С.А. Янковский, В.А. Панкратов, Г.Х. Кудрякова – М.: МГУПБ, 2009. – 220 с.
- Лабораторные работы по органической химии (под ред. Гинзбурга О.Ф. и Петрова А.А.). – М.: Высшая школа, 1982. – 270 с.
- Травень В.Ф. Органическая химия: учебник / В.Ф. Травень. – М.: Академкнига, 2004. – Т. 1,2. – 1309 с.
- Шабаров Ю.С. Органическая химия: учебник / Ю.С. Шабаров. - М.: Химия, 2000. – 848 с.
- Несмеянов А.Н. Начала органической химии: учебник / А.Н. Несмеянов, Н.А. Несмеянов. - М.: 1974. – Т. 1,2. – 1488 с.
