Автореферат диссертации на соискание ученой степени
| Вид материала | Автореферат диссертации |
| ИЛ-1+ЛПС, пг/мл ИЛ-4+ЛПС, пг/мл ИЛ-8+ЛПС, пг/мл ИЛ-10+ЛПС, пг/мл St. aureus Pr. vulgaris |
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 298.92kb.
- Автореферат диссертации на соискание ученой степени, 500.38kb.
Примечание: * – достоверные различия с контролем при уровне значимости р0,01, ** – достоверные различия средних исследуемых показателей ЛПС- и ФГА-индуцированной продукции цитокинов при уровне значимости р0,001.
Эти закономерности свидетельствуют, с одной стороны, о полноценности интегративных механизмов эндогенной системы цитокинов и способности к саморегуляции, а с другой стороны, о высоком активационном потенциале клеток здоровых детей к синтезу и секреции цитокинов.
Патогенетическая неоднородность или стадийность заболевания сочетается с неодинаковыми реакциями в цитокиновой сети, и по-разному от них зависят. Это подтверждается результатами исследования спонтанной и митоген-индуцированной продукции цитокинов ИЛ-1, ИЛ10, ИЛ-8, ИЛ-4 и ИНФ-α у детей с травматической болезнью в различные стадии процесса (табл. 2). Уже в дебюте травматической болезни резко увеличивалась спонтанная продукция как про-, так и противовоспалительных цитокинов, с максимальной концентрацией ИЛ-8. При этом спонтанная продукция ИЛ-1 в остром периоде травмы превосходила таковую у здоровых детей почти в 7 раз, в то же время продукция амбивалентного цитокина ИЛ-10 возрастала – в 15 раз. Нестимулированная выработка ИЛ-8 достоверно увеличивалась в остром периоде травматической болезни по сравнению с нормой в 4,5 раз, в то время
Таблица 2.
Показатели продукции цитокинов in vitro клетками периферической крови здоровых детей и пациентов с травматической болезнью
| Показатели продукции цитокинов | Статисти- ческие показатели | Уровень продукции цитокина, пг/мл | ||
| Здоровые дети (n=15) | Острый период (n=15) | Период развер- нутой клиники (n=15) | ||
| ИЛ-1 спонт., пг/мл | M±m | 57,1±8,2 | 393,13±10,58* | 185,67±7,45*# |
| ИЛ-1+ЛПС, пг/мл ИС, усл. ед | M±m | 1380,8±23,54 24,18±2,8 | 612,38±8,51* 1,56±0,02* | 554,33±6,56*# 2,98±0,03*# |
| ИЛ-1+ФГА, пг/мл ИС, усл. ед | M±m | 226,8±5,61 3,97±0,1 | 514,13±9,09* 1,31±0,15* | 569,33±6,98*# 3,06±0,08*# |
| ИЛ-4 спонт., пг/мл | M±m | 15,5±1,9 | 50,25±3,03* | 25,33±1,84*# |
| ИЛ-4+ЛПС, пг/мл ИС, усл. ед | M±m | 39,4±2,45 2,54±0,13 | 31,13±1,92* 0,62±0,03* | 14,39±1,33*# 0,57±0,004* |
| ИЛ-4+ФГА, пг/мл ИС, усл. ед | M±m | 22,78±1,45 1,47±0,15 | 51,13±3,42* 1,02±0,08* | 48,00±3,0* 1,89±0,02*# |
| ИЛ-8 спонт., пг/мл | M±m | 337,0±10,1 | 1503,25±19,35* | 867,33±11,36*# |
| ИЛ-8+ЛПС, пг/мл ИС, усл. ед | M±m | 2143,78±38,2 6,36±0,2 | 1845,58±14,38* 1,23±0,04* | 1909,0±20,93*# 2,2±0,01*# |
| ИЛ-8+ФГА, пг/мл ИС, усл. ед | M±m | 1013,45±27,62 3,01±0,01 | 1846,25±18,13* 1,23±0,1* | 1607,67±18,43*# 1,85±0,006*# |
| ИЛ-10 спонт., пг/мл | M±m | 4,98±0,51 | 76,25±4,36* | 33,67±3,84*# |
| ИЛ-10+ЛПС, пг/мл ИС, усл. ед | M±m | 197,48±37,92 39,65±1,4 | 42,63±5,80* 0,55±0,03* | 63,0±9,43* 1,87±0,01*# |
| ИЛ-10+ФГА, пг/мл ИС, усл. ед | M±m | 43,12±4,23 8,66±0,56 | 280,88±24,47* 3,68±0,2* | 144,67±18,64*# 4,3±0,003*# |
| ИНФ-α спонт., пг/мл | M±m | 53,1±2,56 | 21,05±1,75* | 16,45±0,57*# |
| ИНФ-α+ЛПС, пг/мл ИС, усл. ед | M±m | 1393,38±25,15 26,24±1,9 | 15,86±0,39* 0,75±0,01* | 16,17±0,41* 0,98±0,001*# |
| ИНФ-α+ФГА, пг/мл ИС, усл. ед | M±m | 3957,92±59,4 73,54±2,9 | 22,24±2,03* 1,06±0,05* | 16,08±0,3*# 0,98±0,002* |
Примечание: * – достоверные различия с нормой при уровне значимости р0,02, # – достоверные различия с острым периодом при уровне значимости р0,05.
как синтез ИЛ-4, который подавляет продукцию хемокина (Ковальчук Л.В., Сайгитов Р.Т., 2000; Фрейдлин И.С. с соавт., 2002), возрастал только в 3 раза, одновременно с этим концентрация ИЛ-8 превосходила концентрацию ИЛ-4 почти в 30 раз.
В период развернутой клиники клетки периферической крови травмированных детей (табл. 2) продолжали активно секретировать весь исследуемый спектр цитокинов даже в режиме спонтанного культивирования. Наиболее высокий уровень продукции демонстрировал ИЛ-10 и оппозитный острофазозый цитокин – ИЛ-1. Выработка ИЛ-8 в 2,6 раза была выше, чем показатели у здоровых детей, а ИЛ-4 лишь в 1,6 раза. Несмотря на относительно высокие параметры базальной продукции тестируемых медиаторов в данный период травматической болезни, нами отмечена относительная стабилизация повышенного уровня цитокинов, проявляющаяся в снижении секреции исследуемых цитокинов в среднем в 2 раза по сравнению с острым периодом, что возможно связано с активацией механизмов ауто- и паракринной регуляции секреции цитокинов (Козлов В.А., 2002).
Об относительности стабилизации и патогенетической незавершенности травматического процесса свидетельствуют и показатели соотношения оппозитных цитокинов (рис. 1). Если соотношение уровня ИЛ-1/ИЛ-10 на фоне их активной продукции не меняется, то соотношение продукции ИЛ-8 к
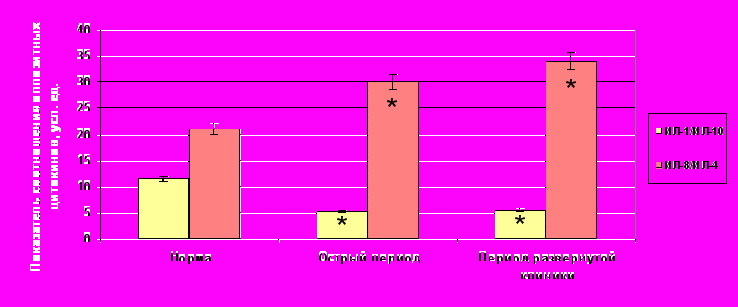 Примечание: * – достоверные различия с нормой при уровне значимости р0,05
Примечание: * – достоверные различия с нормой при уровне значимости р0,05Рисунок 1. Динамика соотношения оппозитных цитокинов в норме и при травматической болезни.
ИЛ-4 прогрессивно растет, что еще больше усугубляет цитокиновый дисбаланс в период развернутой клиники уже развившийся в более раннем посттравматическом периоде. При этом нарушения цитокиновой сети касаются преимущественно ее хемокинового звена, а именно снижение продукции ИЛ-4, как регулятора (ингибитора) избыточной продукции хемокинов, на фоне активной секреции ИЛ-8.
Уровень ИНФ- в раннем посттравматическом периоде достоверно уменьшался почти в 2,5 раза в сравнении с нормой и продолжал прогрессивно падать в период развернутой клинической картины болезни.
Особенности функционирования цитокиновой сети, как в норме, так и при патологических состояниях наиболее ярко проявляются в условиях активации иммунокомпетентных клеток. Нами установлено, что в раннем посттравматическом периоде ЛПС инициировал разнонаправленные эффекты цитокин-продуктивной активности клеток периферической крови. Эндотоксин и ФГА лишь умеренно стимулировали продукцию ИЛ-1. Индекс стимуляции (ИС) был в 15 раз ниже для ЛПС и в 3 раза – для ФГА. Динамика секреции ИЛ-10 в присутствии бактериального митогена была противоположной. Клетки периферической крови травмированных детей отвечали на ЛПС не усилением продукции ИЛ-10, а наоборот, ее угнетением, при этом индекс стимуляции был более чем в 70 раз ниже, чем у здоровых детей. ФГА, напротив, вызывал стимуляцию продукции ИЛ-10. В период развернутой клиники бактериальный митоген реализовывал свой стимулирующий эффект в большей степени, увеличивая секрецию ИЛ-1 в 3 раза и ИЛ-10 в 1,8 раза, что может свидетельствовать о частичном восстановлении регуляторного потенциала цитокиновой системы.
Уровни секреции оппозитных цитокинов ИЛ-1 и ИЛ-10, как и уровни ИЛ-8 и ИЛ-4, продуцируемых ex vivo, в ответ на стимуляцию эндотоксином и ФГА отличались и в раннем посттравматическом, и в более позднем, периодах болезни. Их профиль не имел такого феноменологического сходства, как у здоровых детей и характеризовался асинхронностью ответа на индуктор.
Таким образом, патологическая активация фагоцитов и других иммуноцитов, проявляющаяся, в частности, в повышенной продукции острофазовых цитокинов – ИЛ-1, ИЛ-8, наиболее выраженной в ранний период посттравматической деструкции, направлена скорее на эффекторное обеспечение повреждающих, нежели репарирующих механизмов иммунного ответа. По нашему мнению, именно высокие уровни продукции цитокинов, в частности, ИЛ-8 определяют развитие мобилизационной блокады фагоцитов, подвижных продуцентов и носителей регуляторов воспаления. Поскольку эти клетки приходят в очаг воспаления или повреждения главным образом из других мест и являются необходимыми элементами процесса, то наряду с вопросами о природе медиаторов, их секреции и механизмах активации, возникает вопрос о том, как изменяется и регулируется их миграционная активность?
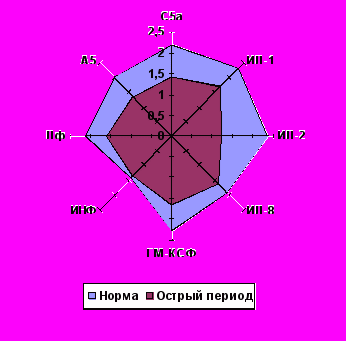
Локомоторная функция Нф и Мн исследовалась у 235 детей с переломами костей скелета. Контрольную группу составил 41 здоровый ребенок. В качестве хемоаттрактантов нами были использованы известные регуляторы иммунного воспаления (ИЛ-1, ИЛ-2, ИЛ-8, ГМ-КСФ, смесь ИНФ-α2(с)α2(d), лейкинферон (естественный цитокиновый комплекс), А5-пептидосодержащее вещество, выделенное из супернатантов активированных нейтрофилов). Контролем служил стандартный хемоаттрактант – С5а-фрагмент комплемента.
Установлено, что изучаемые регуляторы иммунного воспаления обладают выраженными хемокинетикотропными свойствами как по отношению к нейтрофилам, так и к моноцитам здоровых детей (рис. 2).
После травмы происходит снижение целенаправленного движения нейтрофилов и моноцитов ко всем изучаемым хемоаттрактантам (рис. 2). Такая «функциональная рефрактерность» к хемоаттрактантам развивается после контакта с раздражителем и носит системный характер, не связанный с локализацией очага воспаления. В её основе лежит сокращение числа рецепторов, доступных для взаимодействия с новыми порциями лиганда. Негативный эффект потенцируется, если за связыванием следует эндоцитоз, ведущий к структурной изоляции рецептора (Маянский А.Н., Пикуза О.И., 1993).
 Индекс хемотаксиса нейтрофилов, усл. ед. Индекс хемотаксиса нейтрофилов, усл. ед. | 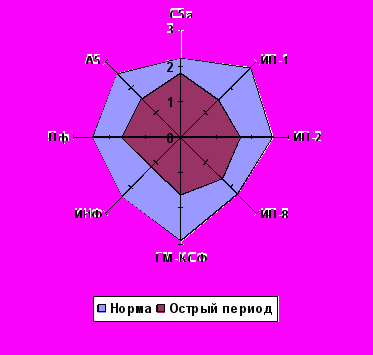 Индекс хемотаксис моноцитов, усл. ед. Индекс хемотаксис моноцитов, усл. ед. |
Рисунок 2. Хемотаксис фагоцитов периферической крови здоровых детей (n=41) и пациентов с ТБ (n=109) в острый период к биологически активным веществам различной природы.
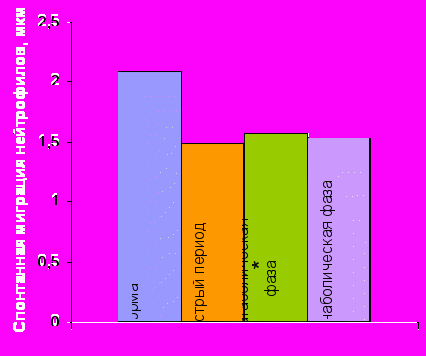 Спонтанная миграция нейтрофилов | 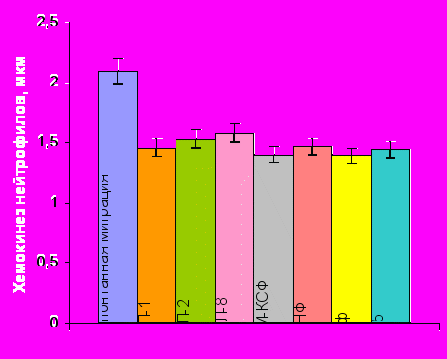 Хемокинез нейтрофилов Хемокинез нейтрофилов |
Примечание * – достоверность различий с нормой при р0,01.
Рисунок 3. Спонтанная миграция и хемокинез нейтрофилов периферической крови здоровых детей (n=41) и пациентов с ТБ (n=211) под действием биологически активных веществ различной природы.
Сравнение результатов исследования влияния регуляторов цитокиновой сети на хемокинетическую функцию фагоцитов здоровых и травмированных детей, показало, что характер изменений хемокинеза Нф и Мн, наблюдаемый после травмы и у здоровых детей, индуцируемых исследуемымицитокинами, почти полностью совпадает (рис. 3). По сути дела при непосредственном воздействии данными веществами на фагоциты здоровых детей in vitro мы фактически моделировали состояние этих клеток, схожее с тем, которое развивается после тканевой деструкции.
Далее предстояло выяснить, насколько изменения локомоторной функции Нф и Мн у детей с травматической болезнью играют отрицательную роль в плане развития гнойно-воспалительных осложнении. Для этого нами были обследованы 27 детей, у которых в посттравматическом периоде развились гнойно-воспалительные осложнения.
Осложненное течение травматической болезни характеризовалось еще более выраженным угнетением целенаправленной подвижности фагоцитов уже в остром периоде. Почти ко всем изучаемым регуляторным факторам отмечалось снижение направленной миграции как Нф, так и Мн. При этом Нф становились наиболее рефрактерны к ИЛ-1 и еще менее чувствительны к ИЛ-8 и ГМ-КСФ. Повышением чувствительности Нф отвечали только на смесь ИНФ α2(с)α2(d).
Таким образом, развитие гнойно-воспалительных осложнений у травмированных детей сопровождается еще более выраженным угнетением как хемокинетической, так и хемотаксической функции фагоцитов. Запоздалая миграция фагоцитов в очаг тканевой деструкции не позволяет данным клеткам эффективно реализовать элиминационный потенциал, а также участвовать в процессах репаративной регенерации костной ткани.
Далее необходимо было выяснить, как изменяется соотношение процессов формирования и резорбции костной ткани в условиях мобилизационной блокады нейтрофилов и моноцитов.
Индикаторами костного метаболизма являются маркеры костного ремоделирования – продукты костного матрикса и клеток кости.
Нами были исследованы три маркера метаболизма костной ткани кальцитонин (специфический гормональный ингибитор паратгормона), остеокальцин (костный глутаминовый белок – BGP – биохимический маркер формирования кости, характеризующий функцию остеобластов) и С-телопептиды коллагена I типа (CrossLaps) (маркер костной резорбции, характеризующий функцию остеокластов).
Содержание сывороточного кальцитонина у здоровых детей, составило 2,13±0,03 пг/мл. В раннем посттравматическом периоде отмечалась лишь тенденция к его повышению в сыворотке (3,06±0,18 пг/мл) в пределах возрастной нормы (рис. 4). В катаболическую фазу второго периода нами было зафиксировано достоверное повышение сывороточной концентрации кальцитонина более чем в 35 раз в сравнении со здоровыми детьми.
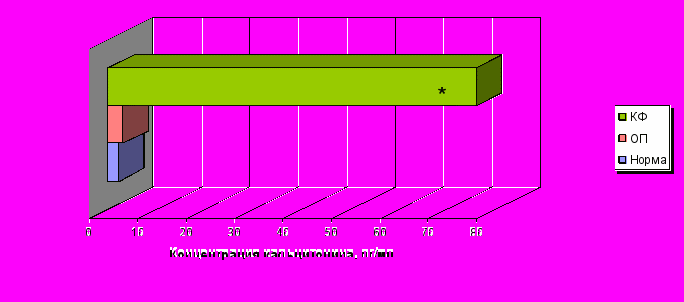 Примечание * – достоверность различий с нормой при р0,001.
Примечание * – достоверность различий с нормой при р0,001.Рисунок 4. Уровень кальцитонина в сыворотке крови здоровых детей (n=15) и пациентов с травматической болезнью в острый период (n=15) и катаболическую фазу (n=15) периода развернутой клинической картины.
У здоровых детей содержание остеокальцина составило 95,97±4,87 пг/мл, а С-телопептидов коллагена I типа (CrossLaps) – 0,59±0,01 нг/мл (рис. 5). При травматическом повреждении костной ткани в острый период уровень остеокальцина колебался в пределах возрастной нормы. В то время как концентрация маркера остеогенной деструкции достоверно увеличивалась почти в 2,5 раза, что свидетельствует об усилении в первые часы после травмы только резорбтивных процессов.
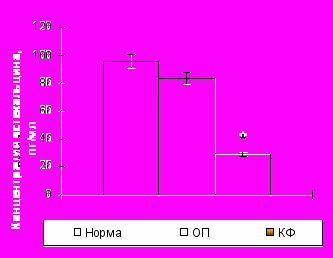 Уровень остекальцина | 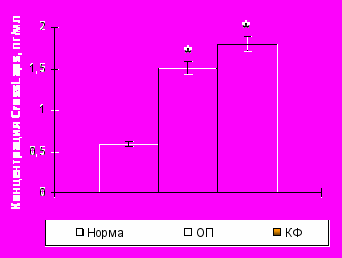 Уровень CrossLaps Уровень CrossLaps |
Примечание * – достоверность различий с нормой при р0,01.
Рисунок 5. Уровни остеокальцина и С-телопептидов коллагена I типа (CrossLaps) в сыворотке крови здоровых детей (n=15) и пациентов с травматической болезнью в острый период (n=15) и катаболическую фазу (n=15) периода развернутой клинической картины.
Концентрация остеокальцина сыворотки крови в катаболическую фазу снижалась как по отношению к норме более чем в 3 раза и в сравнении с острым периодом – на 60%. Концентрация же маркера остеогенной резорбции продолжала увеличиваться и в катаболическую стадию процесса.
Итак, механическое повреждение костной ткани уже в первые часы после травмы индуцирует резорбтивные процессы, приводя к дисбалансу остеогенеза и резорбции, интенсивность которой коррелирует со степенью нарушения локомоторной активности фагоцитов.
Учитывая, что риск перехода «физиологического» воспаления в инфекционный процесс во многом будет зависеть от функционального кинетического резерва фагоцитов важно было установить насколько эти клетки способны в условиях посттравматического воспаления отвечать на дополнительную хемотаксическую нагрузку бактериями и их дериватами.
С этой целью мы исследовали локомоторную функцию Нф у 134 детей с неосложненной и у 27 пациентов с осложненной механической травмой скелета. Контрольную группу составил 41 здоровый ребенок. В качестве хемоаттрактантов использовали вещества как бактериального, так и небактериального происхождения. Живые суточные бактериальные культуры Staphylococcus aureus, Escherichia coli, Proteus vulgaris, Pseudomonas aeruginosa, а также супернатанты нейтрофилов, полученные после инкубации с данными микроорганизмами (САН).
Изучаемые суточные культуры живых бактерий обладали выраженной хемотаксической активностью. Индекс хемотаксиса нейтрофилов здоровых детей к бактериям достоверно превышал уровень их спонтанного радиального движения. Аналогичные изменения хемотаксиса нейтрофилов здоровых детей нами зарегистрированы и к САН (рис. 6).
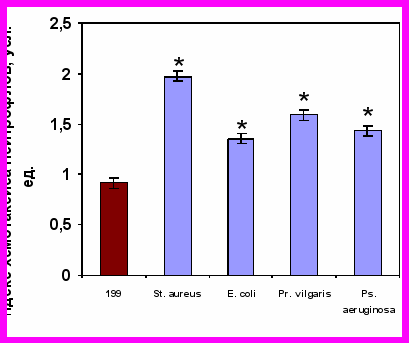 Хемотаксис нейтрофилов к живым суточным культурам бактерий | 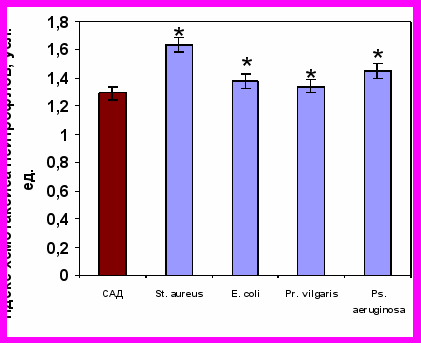 Хемотаксис нейтрофилов к супернатантам нейтрофилов доноров, активированных живыми бактериями |
Примечание * – достоверность различий с контролем при р0,01.
Рисунок 6. Хемотаксиса нейтрофилов здоровых детей (n=41) к живым суточным культурам бактерий и к супернатантам нейтрофилов доноров, полученных после инкубации с различными видами живых суточных культур бактерий.
После часовой инкубации нейтрофилов с живыми бактериями они утрачивали двигательную активность к бактериям того вида, которые они фагоцитировали, но при этом сохраняли способность целенаправленного движения в сторону других микроорганизмов (рис. 7). Напротив, САН, полученные при активации бактериями, вызывали выраженный положительный хемотаксис интактных нейтрофилов.
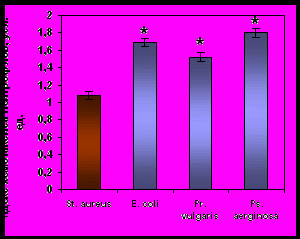 Хемотаксис нейтрофилов здоровых детей, инкубированных со St. aureus | 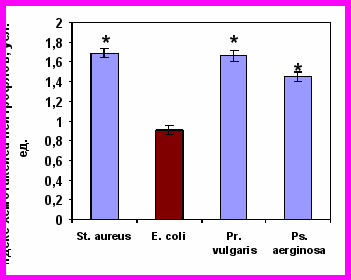 Хемотаксис нейтрофилов здоровых детей, инкубированных со E. coli |
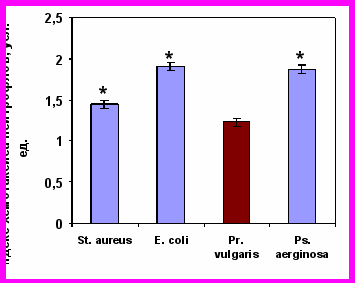 Хемотаксис нейтрофилов здоровых детей, инкубированных с Pr. vulgaris | 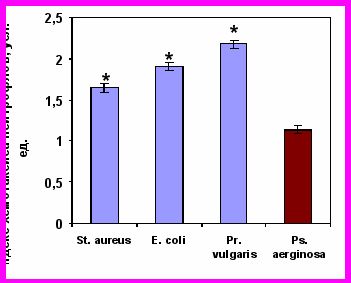 Хемотаксис нейтрофилов здоровых детей, инкубированных с Ps. aeruginosa |
Примечание * – достоверность различий с контролем при р0,01.
Рисунок 7. Индекс хемотаксиса нейтрофилов периферической крови здоровых детей (n=41), инкубированных с различными видами бактерий, к живым суточным культурам бактерий.
Наблюдаемые нами эффекты действия секреторных продуктов нейтрофилов на хемотаксическую реакцию донорских клеток, свидетельствуют с одной стороны, о том, что «запредельная бактериальная инвитровая нагрузка» приводит к блокаде рецепторов и развитию двигательного «паралича» именно к конкретному возбудителю – бактерии, а с другой – к секреции продуктов с кинетикотропной активностью именно к тому «микробу-контактеру».
В процессе фагоцитоза бактерий происходит изменение хемотаксической активности нейтрофилов не только здоровых детей, но и пациентов с травматической болезнью, в том числе при развитии гнойно-воспалительных осложнений. При этом характер хемотаксической реакции клеток и к живым бактериям, и к САН, полученным при стимуляции бактериями, является однотипным.
САН с кинетикотропным действием являются элементом саногенеза в патогенезе травматической болезни. Они, усиливая избирательно локомоторную функцию фагоцитов в отношении этиологического фактора, вызвавшего гнойно-воспалительный процесс, эффективно противостоят антифагоцитарному эффекту бактерий. Именно поэтому, течение травматической болезни, как правило, благоприятное (по нашим данным в 88,08% случаев). Тем не менее, у части пациентов (12% случаев) гнойно-воспалительные осложнения все же развиваются. Одной из вероятных причин, по нашим данным, является подавление способности фагоцитов к продукции как неспецифических (цитокины), так и специфических (секреторные продукты нейтрофилов) регуляторов воспаления под действием дополнительных индукторов (бактерий и их дериватов). Неспособность фагоцитов отвечать на дополнительную стимуляцию, в особенности, бактериальную, связана с тем, что гиперпродукция цитокинов, гормонов и других индукторов воспаления, уже в раннем посттравматическом периоде приводит к острейшему энергетическому и пластическому дефициту. При этом многократно угнетается способность клеток секретировать необходимые в данных условиях и в данной ситуации факторы, эффективно регулирующие функциональную активность участников воспалительной реакции, потенцируя дефекты цитокиновой сети, которые сказываются на эффективности противомикробной защиты организма.
Коррекция таких дефектов, очевидно, может способствовать повышению эффективности профилактических и лечебных мер.
Традиционно в лечении хирургических инфекций основную ставку, помимо вскрытия и дренирования гнойного очага, делают на антимикробную терапию, в частности на антибиотики. Антибактериальные препараты (АБП), при явном приоритете этиотропной направленности своего действия, согласно полученных нами данных также влияют на продукцию цитокинов.
Исследуя влияние амоксиклава, гентамицина, линкомицина и цефотаксима в соответствующих концентрациях (0,15 мг/мл, 0,05 мг/мл, 0,1 мг/мл и 0,5 мг/мл) на продукцию цитокинов клетками периферической крови у детей в острый период травматической болезни, нами установлено их неоднозначные эффекты.
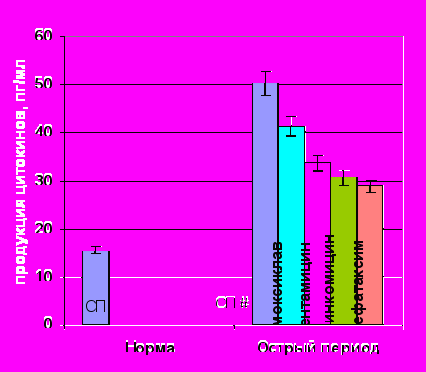
На фоне гиперпродукции ИЛ-1 амоксиклав, гентамицин и линкомицин индуцировали дальнейший рост спонтанной выработки ИЛ-1 (рис. 8). Наиболее выраженную стимуляцию продукции данного цитокина вызывал гентамицин. Аналогичные результаты были получены при оценке влияния анти-
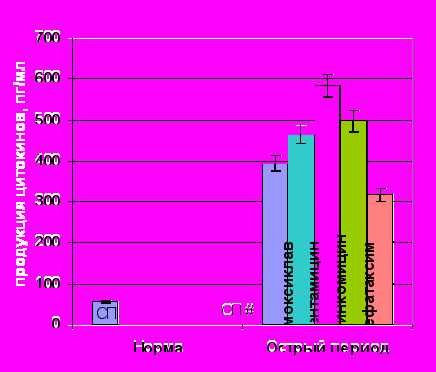 Спонтанная продукция ИЛ-1 под влиянием АБ | 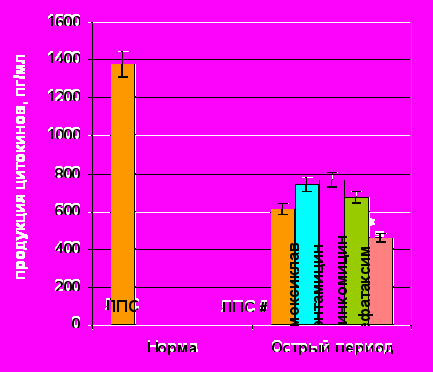 ЛПС-продукция ИЛ-1 под влиянием АБ |
Примечание: # – достоверные различия с нормой при уровне значимости р<0,001, * – достоверные различия с продукцией без АБП при уровне значимости р<0,01.
Рисунок 8. Показатели спонтанной и ЛПС-стимулированной продукции ИЛ-1 клетками периферической крови здоровых (n=15) и травмированных детей (n=15) под действием антибактериальных препаратов.
биотиков и на ЛПС-стимулированную продукцию ИЛ-1. Добавление амоксиклава, гентамицина и линкомицина к культуре клеток достоверно увеличивало ЛПС-секрецию ИЛ-1. Исключение составил цефотаксим, под действием которого снижалась как спонтанная, так и ЛПС-стимулированная продукция ИЛ-1.
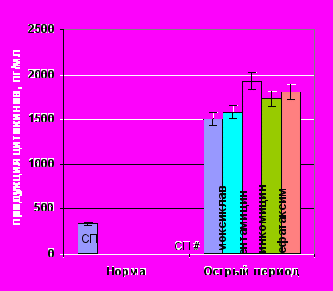
 Спонтанная продукция ИЛ-10 под влиянием АБ | 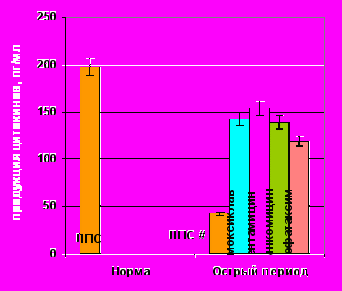 ЛПС-продукция ИЛ-10 под влиянием АБ |
Примечание: # – достоверные различия с нормой при уровне значимости р<0,01, * – достоверные различия с продукцией без АБП при уровне значимости р<0,05.
Рисунок. 9. Показатели спонтанной и ЛПС-стимулированной продукции ИЛ-10 клетками периферической крови здоровых (n=15) и травмированных детей (n=15) под действием антибактериальных препаратов.
Все антибиотики на фоне гиперпродукции ИЛ-10 в большей или меньшей степени стимулировали его спонтанную секрецию (рис. 9). Максимум стимуляции инициировал цефотаксим. ЛПС-стимулированная секреция ИЛ-10 под действием всех АБП также достоверно увеличивалась.
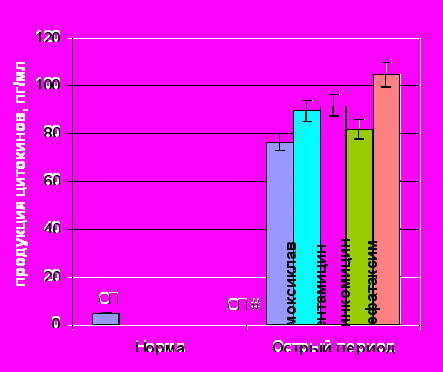
Уровень спонтанной и ЛПС-продукции ИЛ-8 под влиянием практически всех изучаемых антибиотиков не изменялся (рис. 10). Исключение составили гентамицин и линкомицин. Первый, из них, достоверно стимулировал спонтанный синтез цитокина, а второй – угнетал его ЛПС-продукцию. Подобная толерантность клеток к действию антибиотиков в отношении секреции ИЛ-8, на наш взгляд, обусловлена достаточно высоким уровнем его базальной и ЛПС-стимулированной продукции, уже в раннем посттравматическом периоде, что свидетельствует о «хемокиновой» гиперактивации in vivo.
 Спонтанная продукция ИЛ-8 под влиянием АБ | 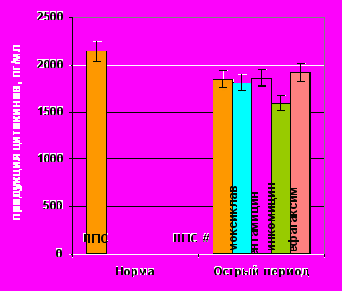 ЛПС-продукция ИЛ-8 под влиянием АБ ЛПС-продукция ИЛ-8 под влиянием АБ |
Примечание: # – достоверные различия с нормой при уровне значимости р<0,001, * – достоверные различия с продукцией без АБП при уровне значимости р<0,05.
Рисунок 10. Показатели спонтанной и ЛПС-стимулированной продукции ИЛ-8 клетками периферической крови здоровых (n=15) и травмированных детей (n=15) под действием антибактериальных препаратов.
 Спонтанная продукция ИЛ-4 под влиянием АБ | 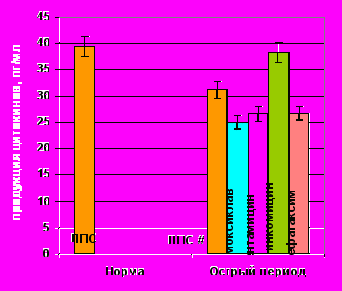 ЛПС-продукция ИЛ-4 под влиянием АБ ЛПС-продукция ИЛ-4 под влиянием АБ |
